- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тема 5. Реальные газы. Жидкости. Твердые тела презентация
Содержание
- 1. Тема 5. Реальные газы. Жидкости. Твердые тела
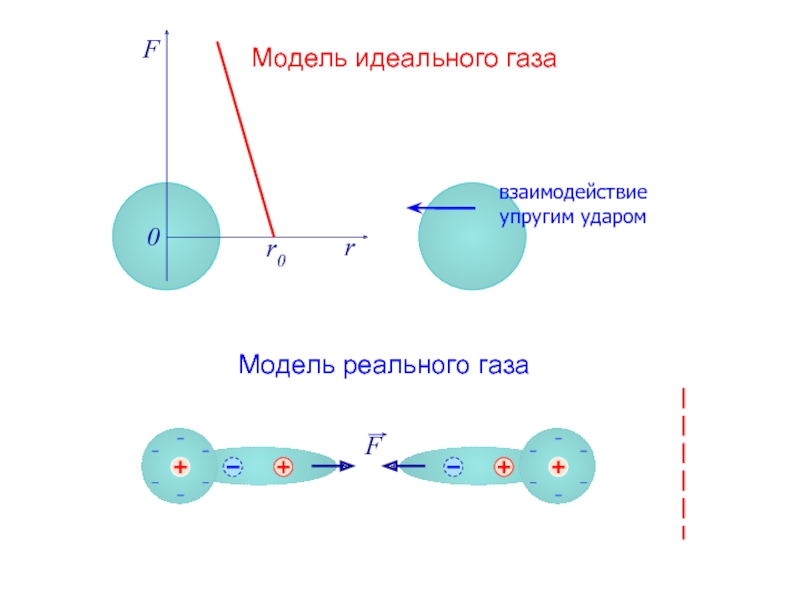
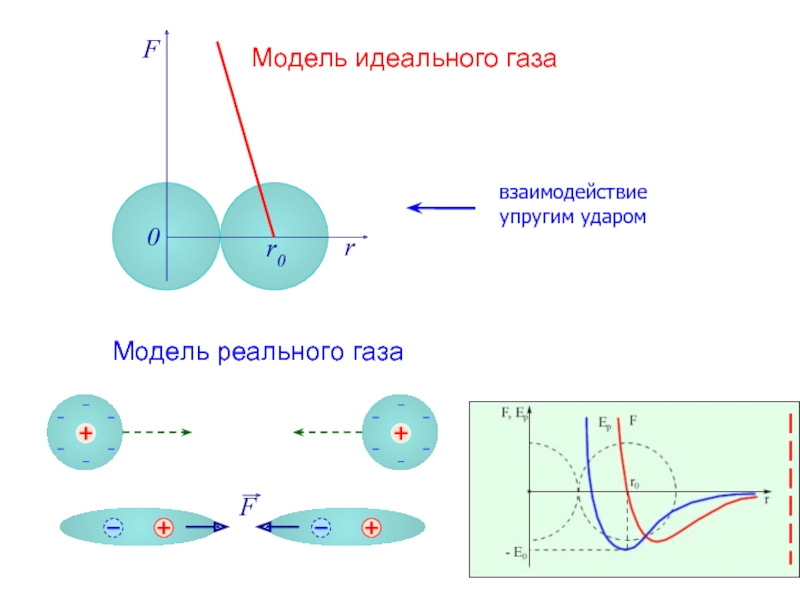
- 2. F r r0 0 Модель идеального газа Модель реального газа взаимодействие упругим ударом
- 3. F r r0 0 Модель идеального газа Модель реального газа взаимодействие упругим ударом
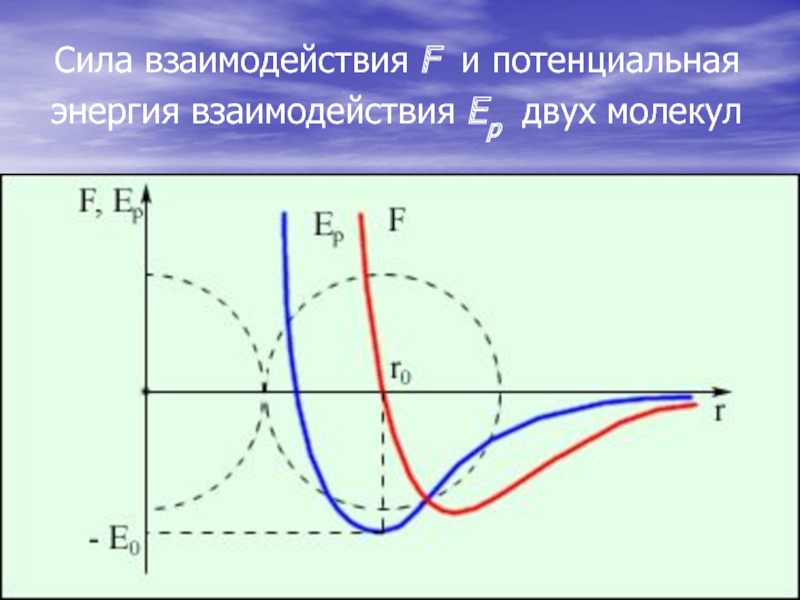
- 4. Сила взаимодействия F и потенциальная энергия взаимодействия Eр двух молекул
- 5. Модель Ван-дер-Ваальса Уравнение Ван-дер-Ваальса Ван-дер-Ваальс (van
- 6. Тема 5. Реальные газы. Жидкости. Твердые тела §5.2. Конденсация реального газа. Изотермы Ван-дер-Ваальса
- 7. изотермы
- 8. Водяной пар (1) и вода (2). Молекулы воды увеличены примерно в 5·107 раз.
- 9. Ткр
- 10. p V
- 11. Тема 5. Реальные газы. Жидкости . Твердые
- 13. Тема 5. Реальные газы. Жидкости . Твердые тела §5.4. Область двухфазных состояний. Уравнение Клапейрона-Клаузиуса
- 14. Определение: теплота, идущая на изменение фазового состояния
- 15. p V V1 V2 p p-dp δQ=0
- 16. - уравнение Клапейрона - Клаузиуса - зависимость давления насыщенного пара от температуры
- 17. Тема 5. Реальные газы. Жидкости . Твердые
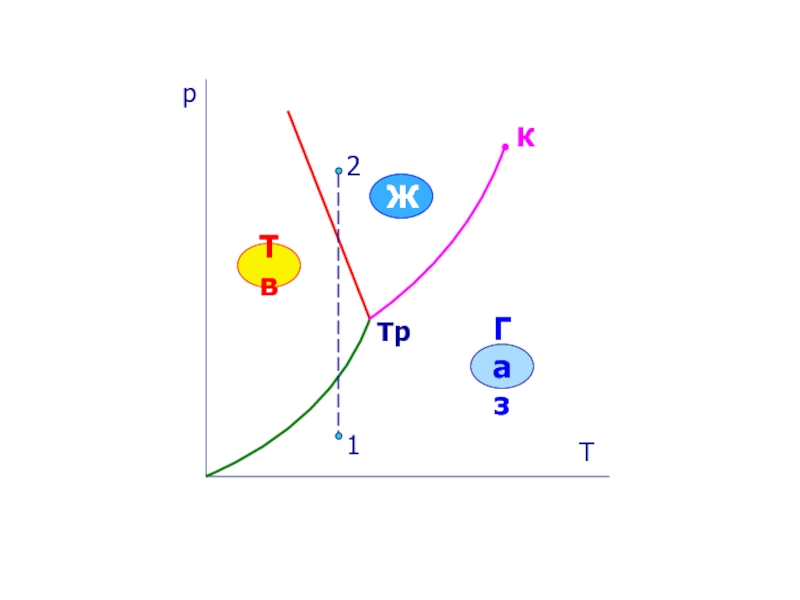
- 18. Диаграмма состояния Тв Ж Газ V=const
- 19. р Т К Тр Тв Ж Газ
- 20. Тема 5. Реальные газы. Жидкости . Твердые тела §5.6. Дырочная модель жидкости
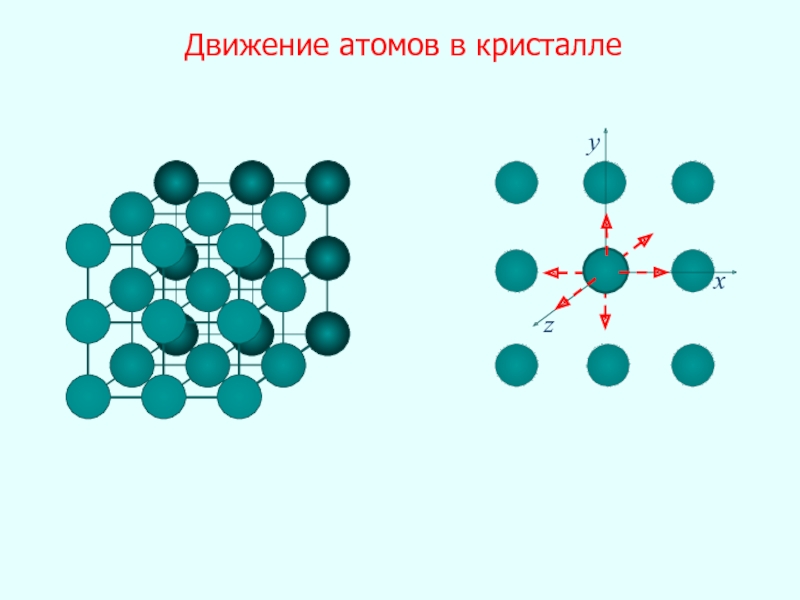
- 21. В кристаллах – дальний порядок В жидкостях
- 23. Тема 5. Реальные газы. Жидкости . Твердые
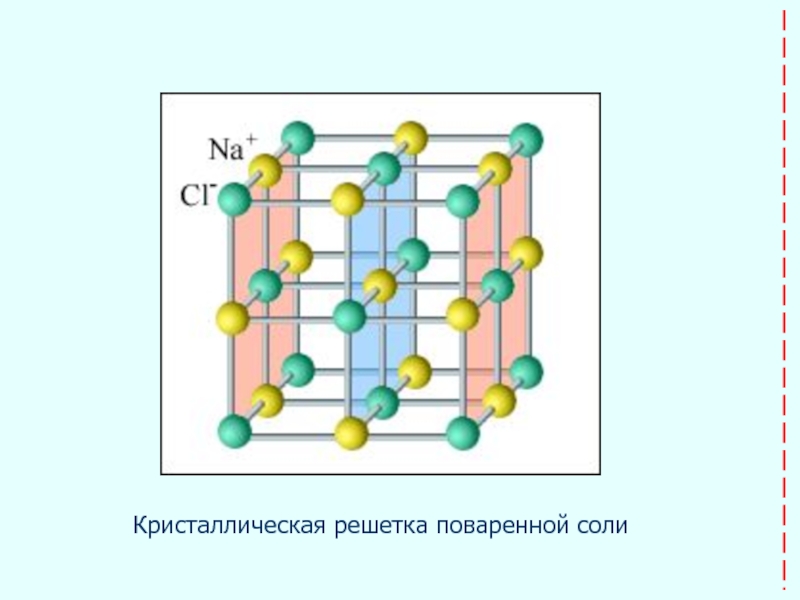
- 24. Кристаллическая решетка поваренной соли
- 25. Простые кристаллические решетки: 1 – простая
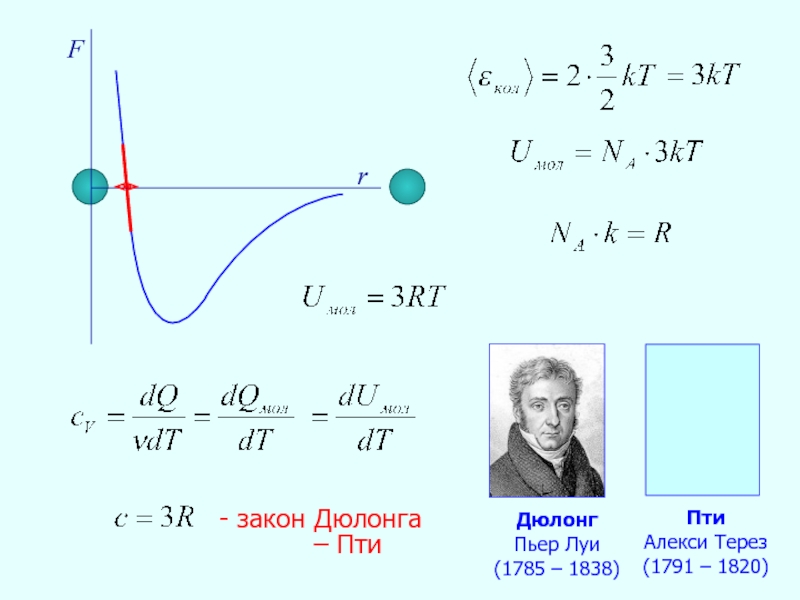
- 28. F r -
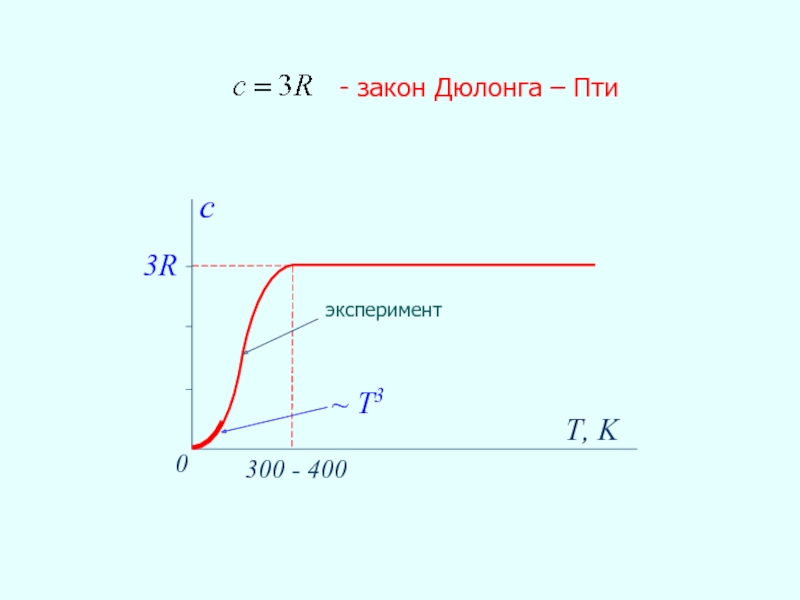
- 29. 3R T, K 0 300 - 400
- 30. Конец темы
Слайд 1Тема 5. Реальные газы. Жидкости. Твердые тела
§5.1. Модель реального газа. Уравнение
Слайд 5Модель Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса
Ван-дер-Ваальс
(van der Waals) Ян
(1837 – 1923)
Модель идеального
Слайд 6Тема 5. Реальные газы. Жидкости. Твердые тела
§5.2. Конденсация реального газа. Изотермы
Слайд 9
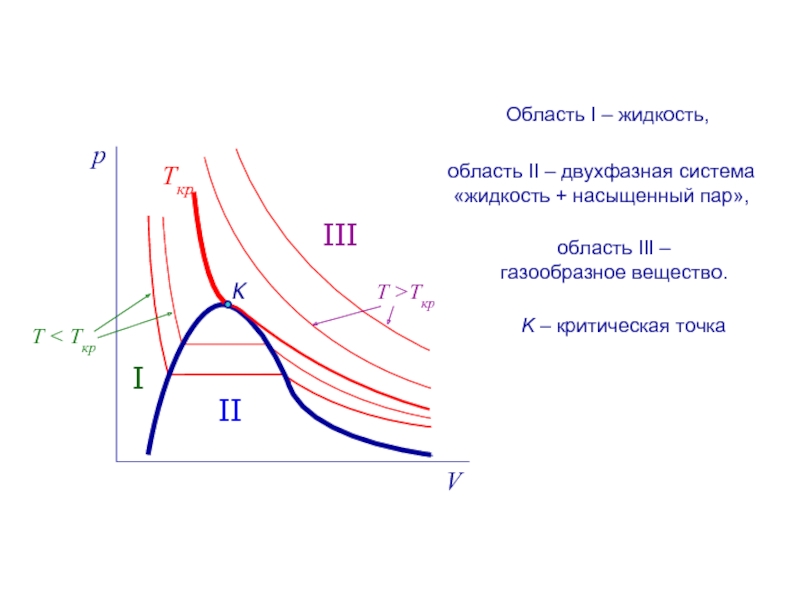
Ткр
K
I
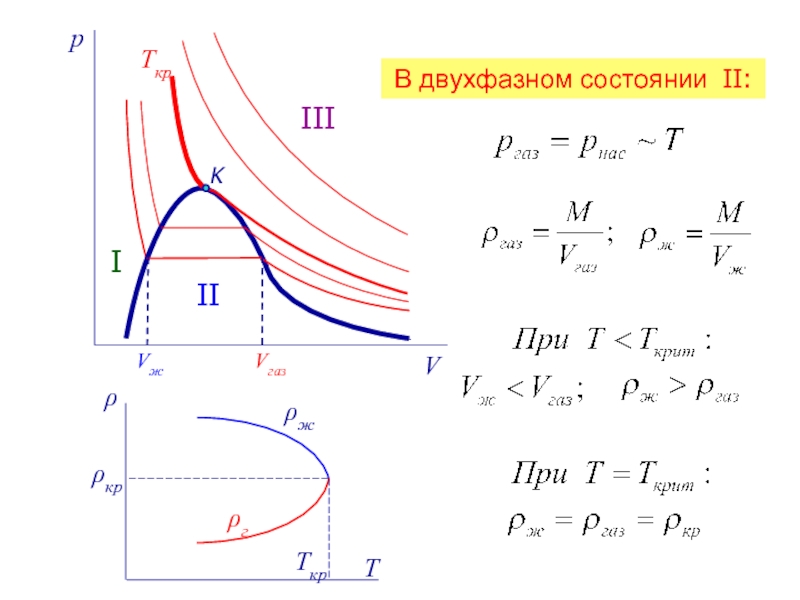
II
III
область II – двухфазная система «жидкость + насыщенный пар»,
Область I
область III – газообразное вещество.
K – критическая точка
Слайд 11Тема 5. Реальные газы. Жидкости . Твердые тела
§5.3. Область двухфазных состояний.
Слайд 13Тема 5. Реальные газы. Жидкости . Твердые тела
§5.4. Область двухфазных состояний.
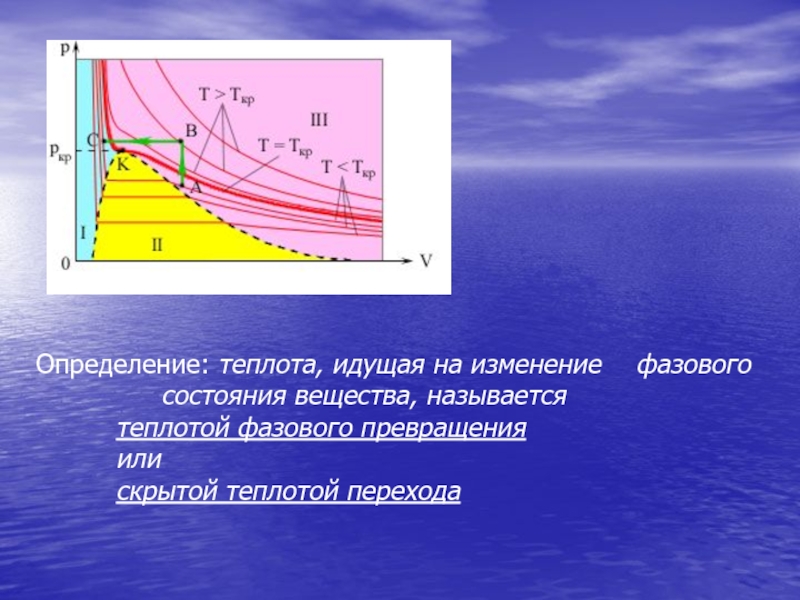
Слайд 14Определение: теплота, идущая на изменение фазового состояния вещества, называется
теплотой фазового
или
скрытой теплотой перехода
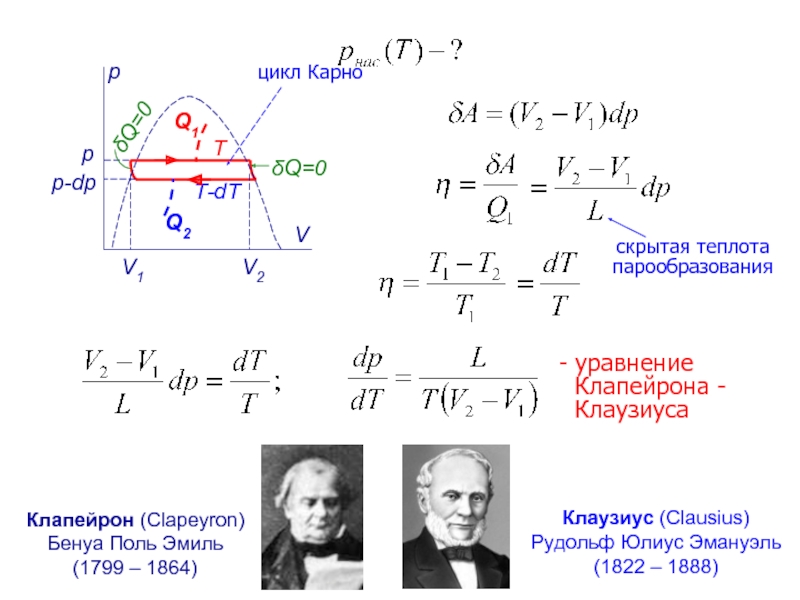
Слайд 15p
V
V1
V2
p
p-dp
δQ=0
δQ=0
T
T-dT
Q2
Q1
- уравнение Клапейрона - Клаузиуса
Клаузиус (Clausius)
Рудольф Юлиус Эмануэль
(1822 –
Клапейрон (Clapeyron)
Бенуа Поль Эмиль
(1799 – 1864)
Слайд 22
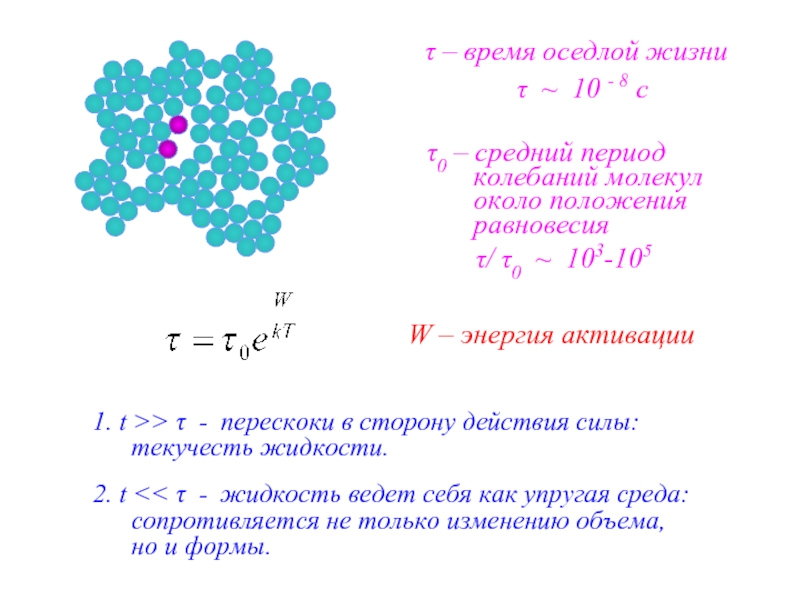
τ – время оседлой жизни
τ0 – средний период колебаний молекул около
W – энергия активации
τ/ τ0 ~ 103-105
τ ~ 10 - 8 c
1. t >> τ - перескоки в сторону действия силы: текучесть жидкости.
2. t << τ - жидкость ведет себя как упругая среда: сопротивляется не только изменению объема, но и формы.
Слайд 23Тема 5. Реальные газы. Жидкости . Твердые тела
§5.7. Кристаллы.
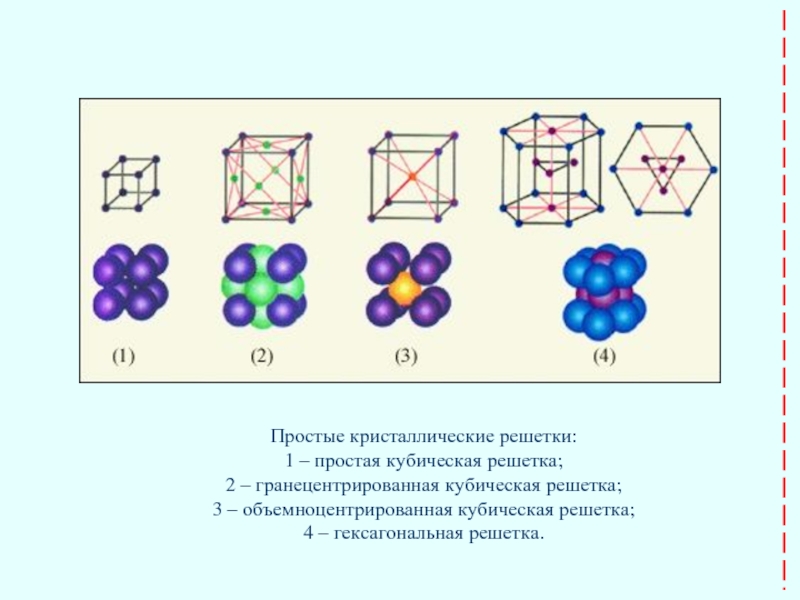
Слайд 25Простые кристаллические решетки:
1 – простая кубическая решетка;
2 – гранецентрированная
3 – объемноцентрированная кубическая решетка;
4 – гексагональная решетка.