- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Перекисное окисление липидов. Характеристика, продукты, биологическая и патофизиологическая роль презентация
Содержание
- 1. Перекисное окисление липидов. Характеристика, продукты, биологическая и патофизиологическая роль
- 3. Академик Н.Н.Семёнов Сирил Норман Хиншелвуд В 1956 г.
- 4. Тарусов Б.Н. Владимиров Ю.А. Автор гипотезы о
- 5. Эмануэль Н.М. Тарусов Б.Н. Выдвинули идею о
- 6. Общее уравнение свободнорадикального ПОЛ имеет следующий вид:
- 7. Важнейшие особенности ПОЛ: 1. О2 - зависимый
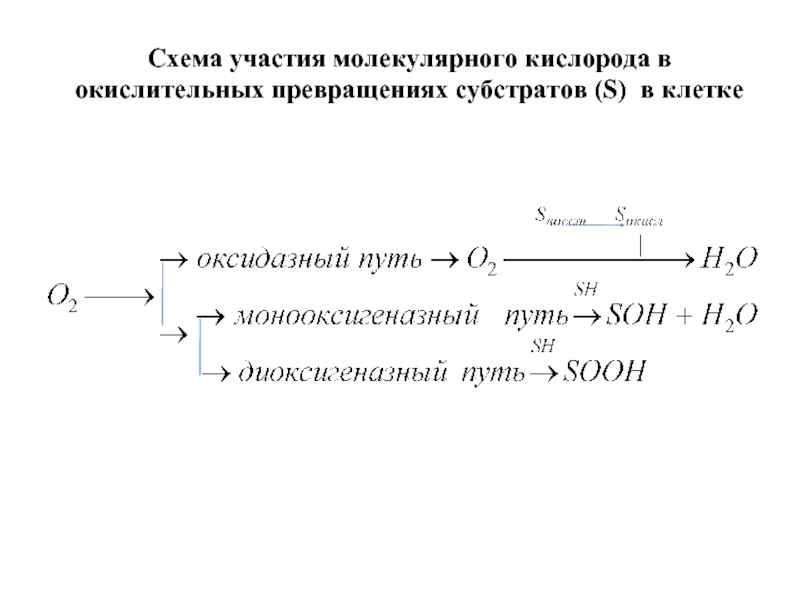
- 8. Схема участия молекулярного кислорода в окислительных превращениях субстратов (S) в клетке
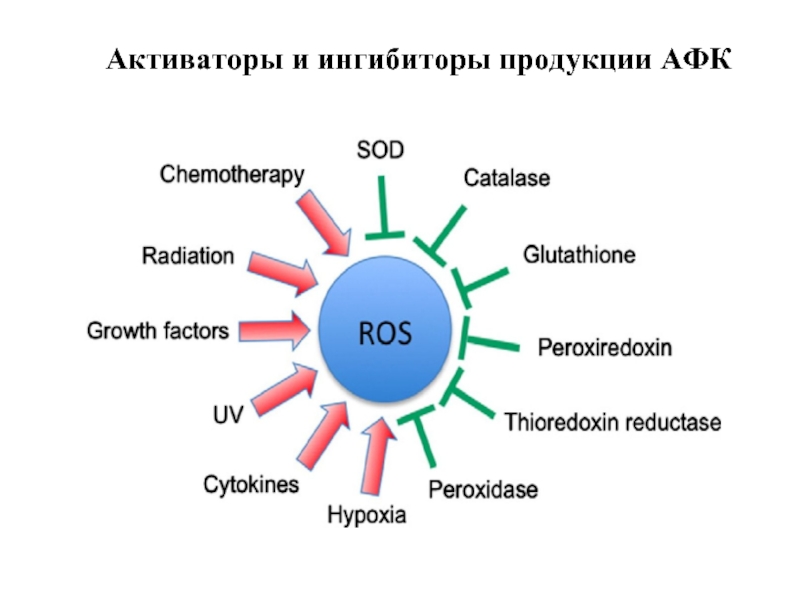
- 9. Активаторы и ингибиторы продукции АФК
- 11. Основными "фабриками" по производству свободных радикалов в
- 12. В физиологических условиях более 95% молекулярного кислорода
- 13. Свободные радикалы — это высокоактивные молекулы
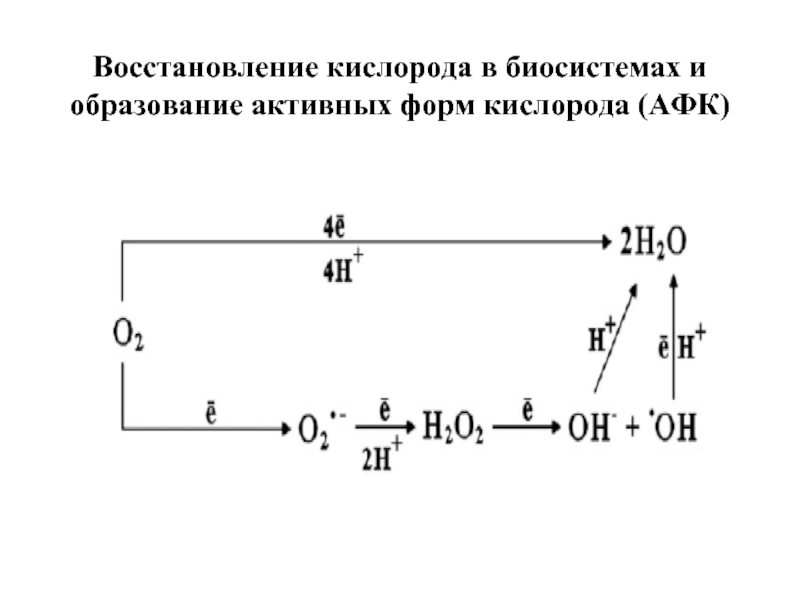
- 14. Восстановление кислорода в биосистемах и образование активных форм кислорода (АФК)
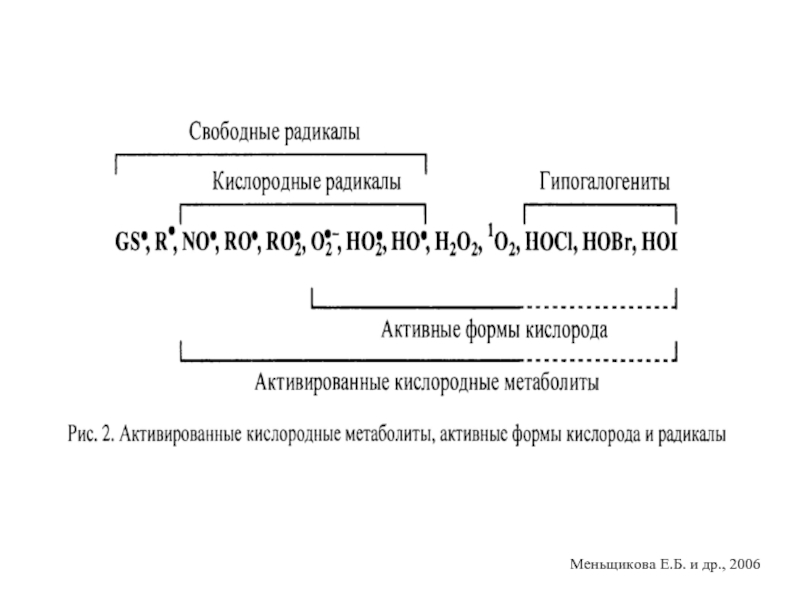
- 15. Активированные кислородные метаболиты (АКМ) - высокореакционные, преимущественно
- 16. Меньщикова Е.Б. и др., 2006
- 17. Владимиров Ю.А., 2000
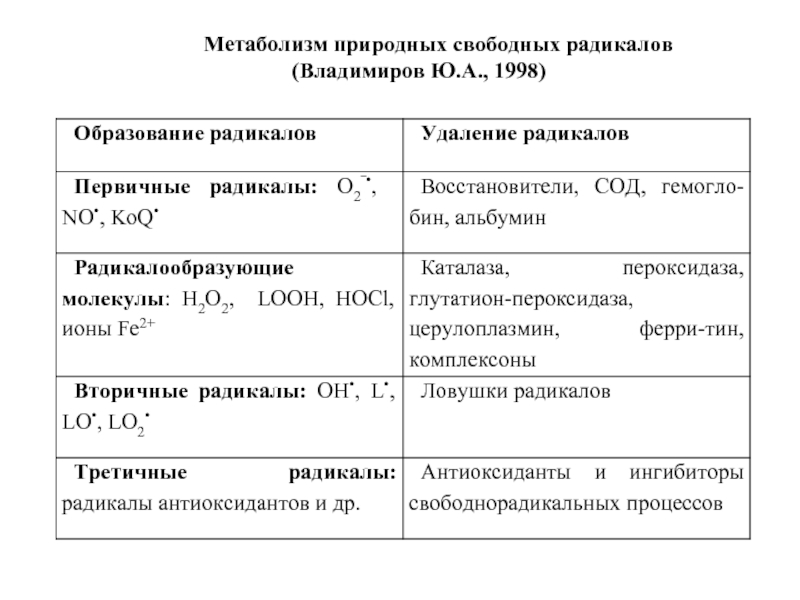
- 18. Метаболизм природных свободных радикалов (Владимиров Ю.А., 1998)
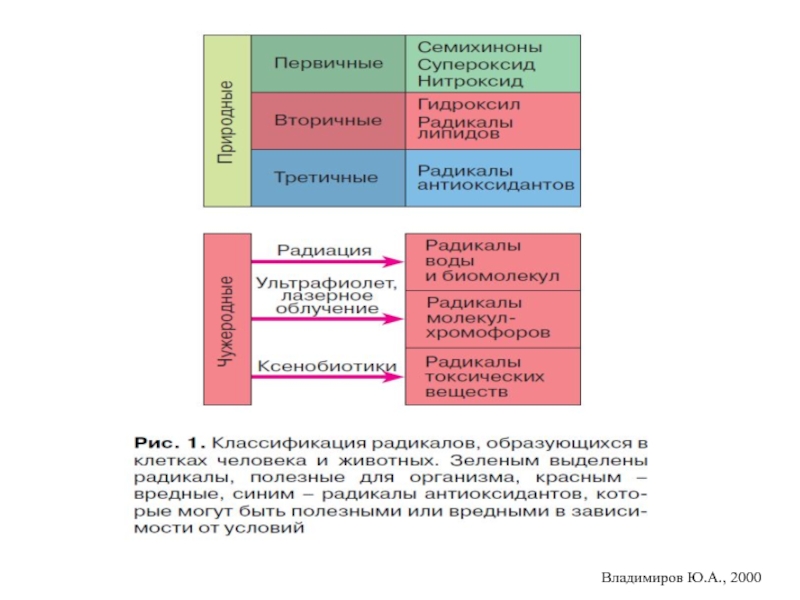
- 19. Свободные радикалы разделяют на первичные, вторичные
- 20. Классификация АКМ 1. Активные формы кислорода
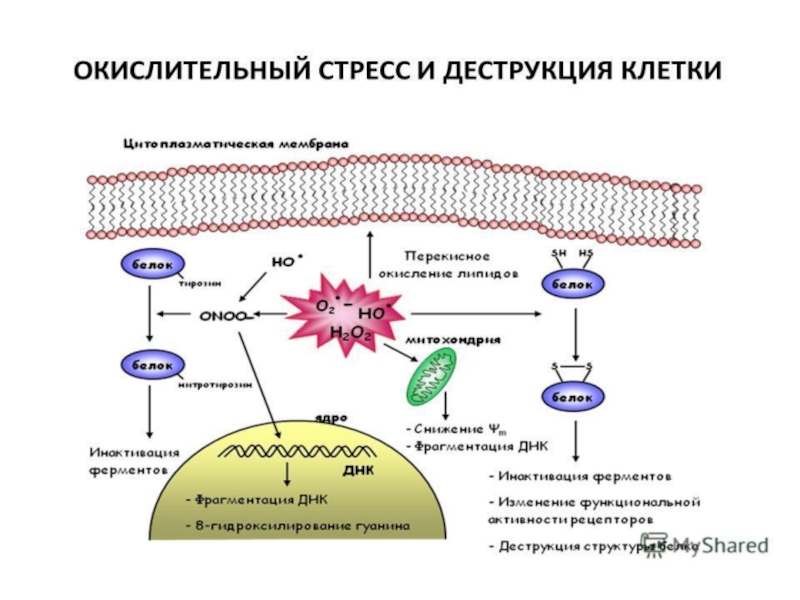
- 21. Окислительный стресс (ОС) - состояние сдвига динамического
- 22. Различные уровни АФК индуцируют различные клеточные процессы:
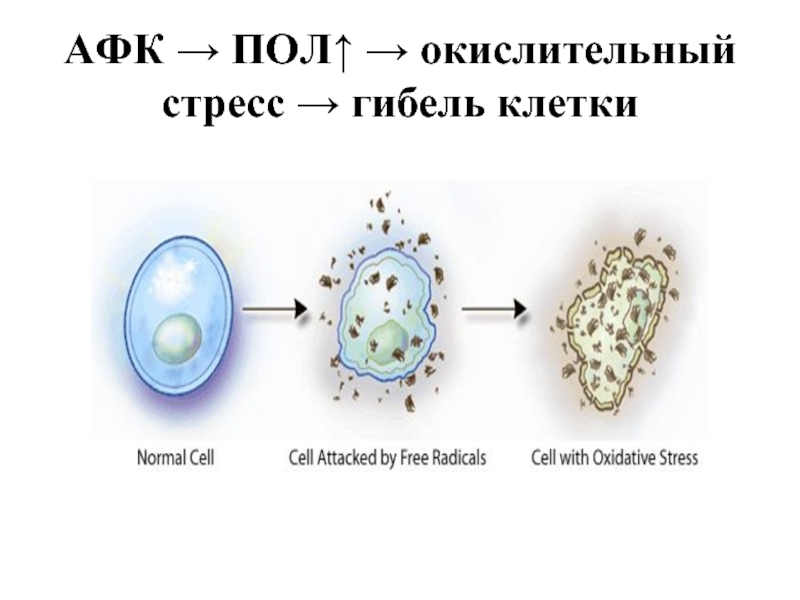
- 23. АФК → ПОЛ↑ → окислительный стресс → гибель клетки
- 26. Источники супероксидного анион-радикала (О2●▬) в клетке
- 27. Ксантиноксидоредуктаза – источник супероксида и перекиси водорода
- 28. Схема катаболизма пуринов, катализируемого ксантиноксидоредуктазой. Ксантиноксидаза – источник супероксида и перекиси водорода
- 30. ЭТЦ митохондрий – источник АФК. Два лика
- 31. Продукция супероксида и перекиси водорода в митохондриях
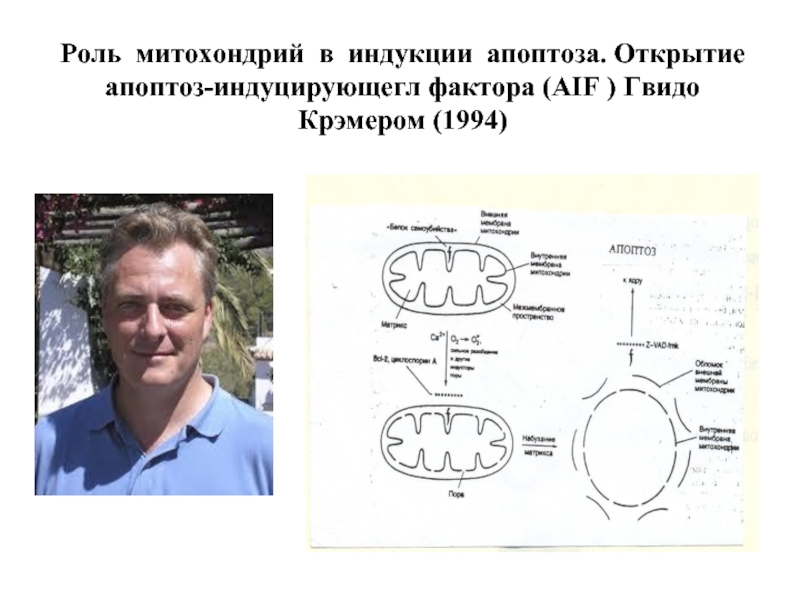
- 32. Роль митохондрий в индукции апоптоза. Открытие апоптоз-индуцирующегл фактора (AIF ) Гвидо Крэмером (1994)
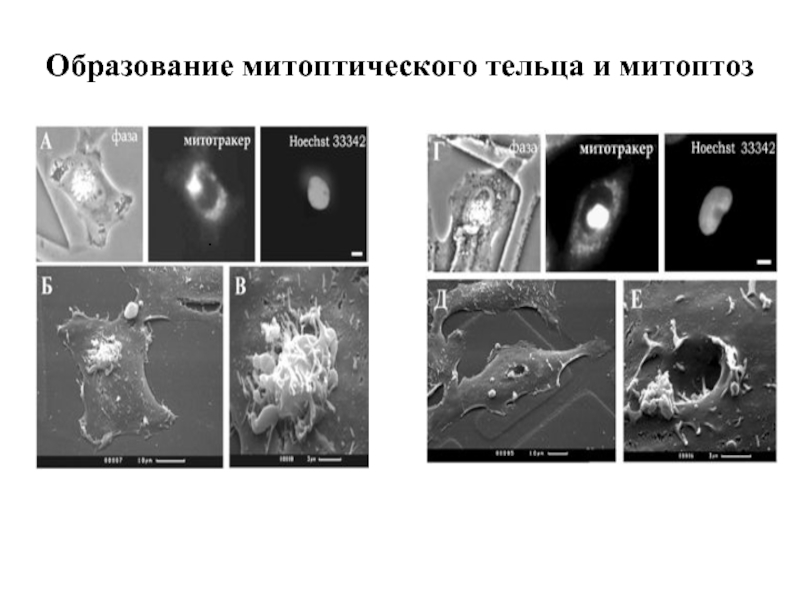
- 33. Образование митоптического тельца и митоптоз .
- 34. Конформационные болезни (КБ) – это заболевания, связанные
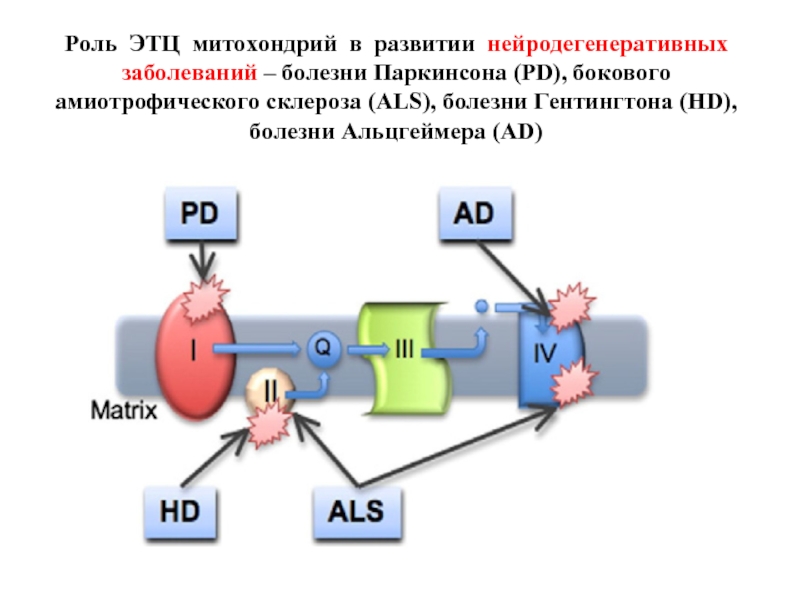
- 35. Роль ЭТЦ митохондрий в развитии нейродегенеративных заболеваний
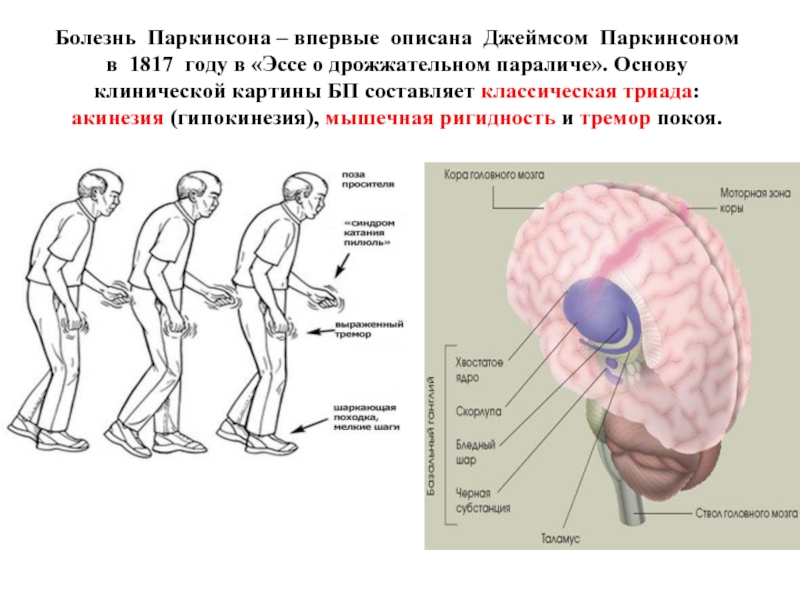
- 36. Болезнь Паркинсона – впервые описана Джеймсом Паркинсоном
- 38. Нарушение метаболизма при болезни Паркинсона (Крыжановский
- 40. Механизмы болезни Альцгеймера Наиболее признанной гипотезой развития
- 41. Болезнь Альцгеймера (сенильная деменция) — нейродегенеративное заболевание, впервые описанное в 1906
- 42. Боковой амиотрофический склероз (болезнь Лу Герига, болезнь
- 43. Генри Луи Гериг, прозванный за
- 44. Митохондриально-направленная терапия нейродегенеративных заболеваний
- 45. Структура и механизм действия митохондриально-направленного антиоксиданта SkQ1С сохданного в МГУ
- 46. ЭТЦ микросом – источник АФК Образование О2‾•
- 47. НАДФН-оксидаза фагоцитов – источник АФК Образование супероксида и гидропероксида НАДФН-оксидазой фагоцитов
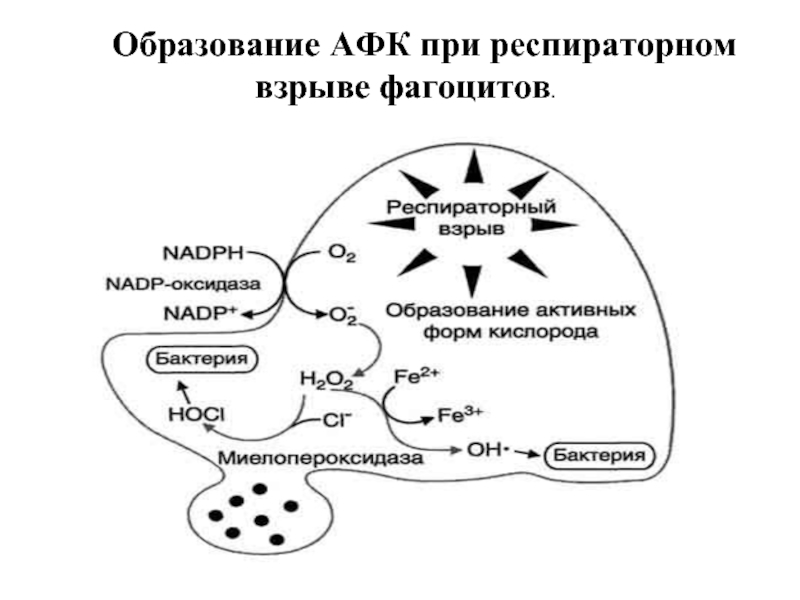
- 48. Образование АФК при респираторном взрыве фагоцитов.
- 49. Структура НАДФН-оксидазы. Состоит из 6 гетерогенных
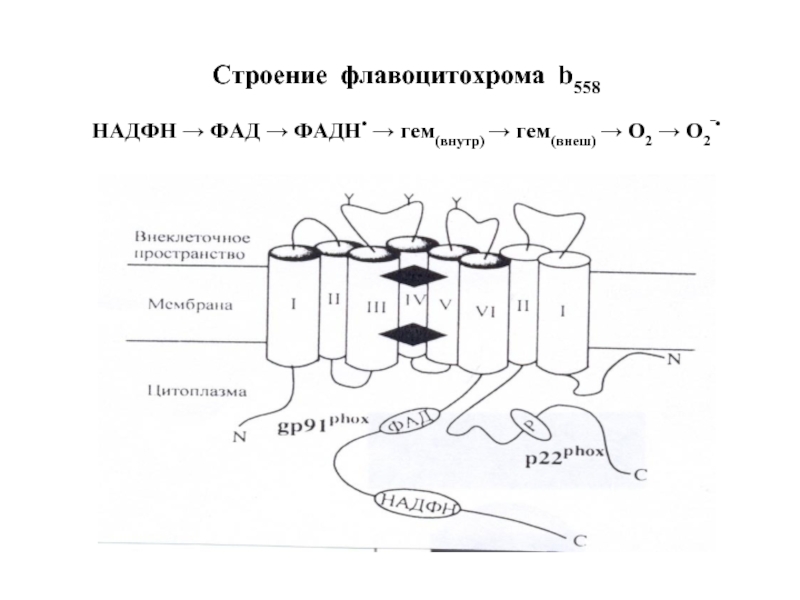
- 50. Строение флавоцитохрома b558 НАДФН → ФАД
- 51. Роль НАДФН-оксидазы в патогенезе заболеваний. Хронический
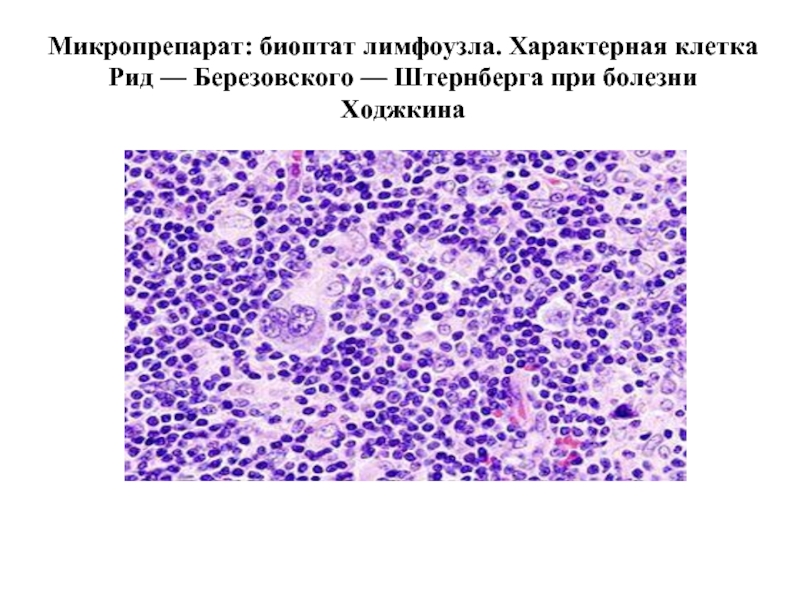
- 52. Микропрепарат: биоптат лимфоузла. Характерная клетка Рид — Березовского — Штернберга при болезни Ходжкина
- 53. Супероксиддисмутазы (СОД) – суперсемейство ферментов, относящихся к
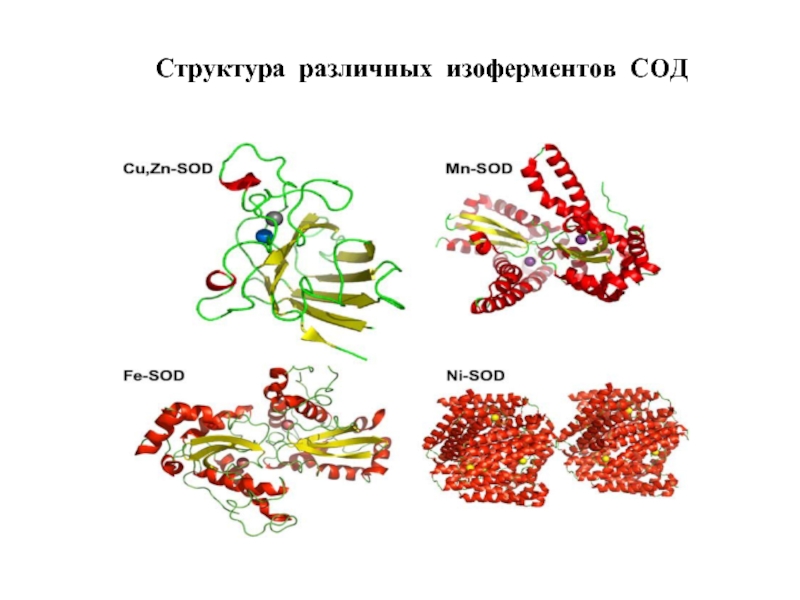
- 54. Структура различных изоферментов СОД
- 55. Источники перекиси водорода в клетке: НАДФН-оксидаза Электрон-транспортная
- 56. Элиминация перекиси водорода в клетке осуществляется ферментативным
- 57. Индукция ПОЛ 1.Самый эффективный индуктор ПОЛ –
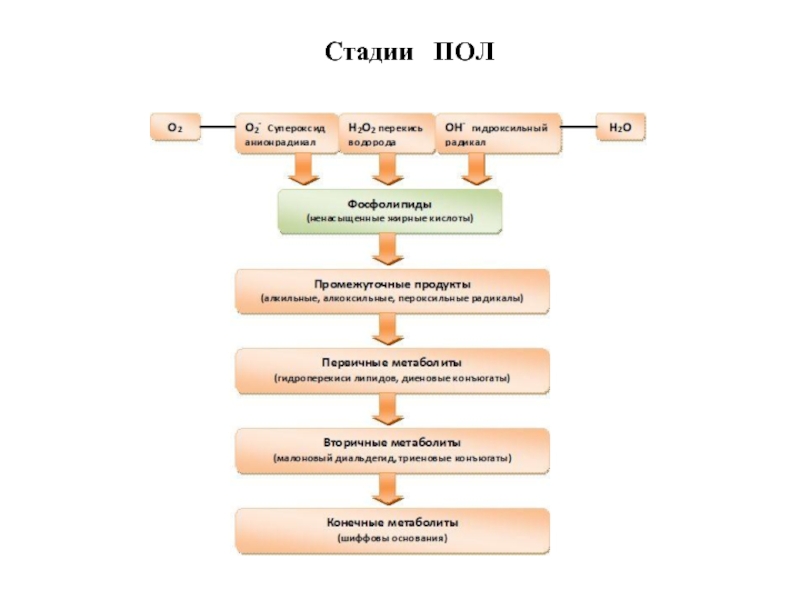
- 58. Стадии ПОЛ
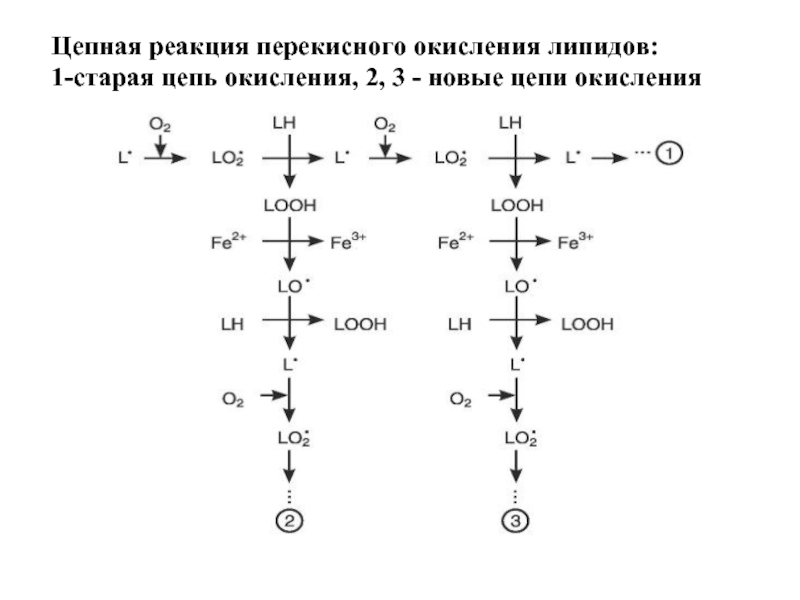
- 59. Цепная реакция перекисного окисления липидов: 1-старая цепь окисления, 2, 3 - новые цепи окисления
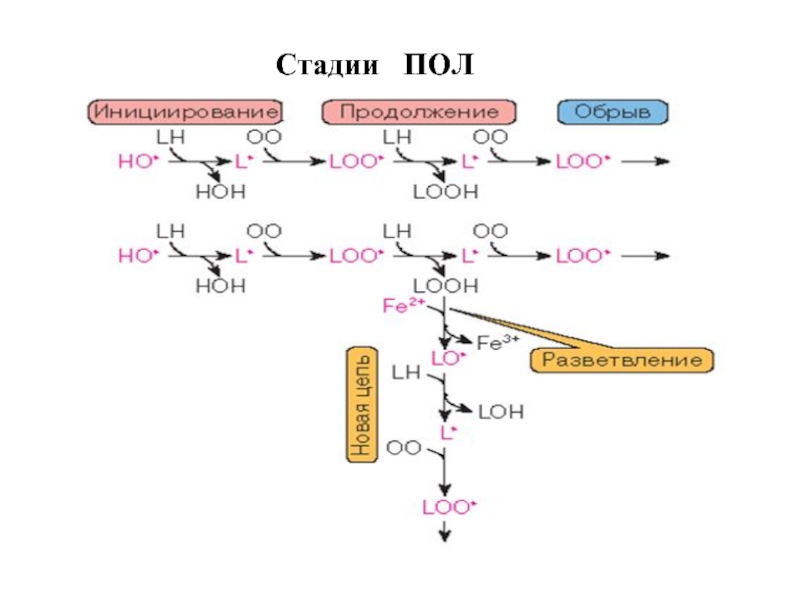
- 60. Стадии ПОЛ
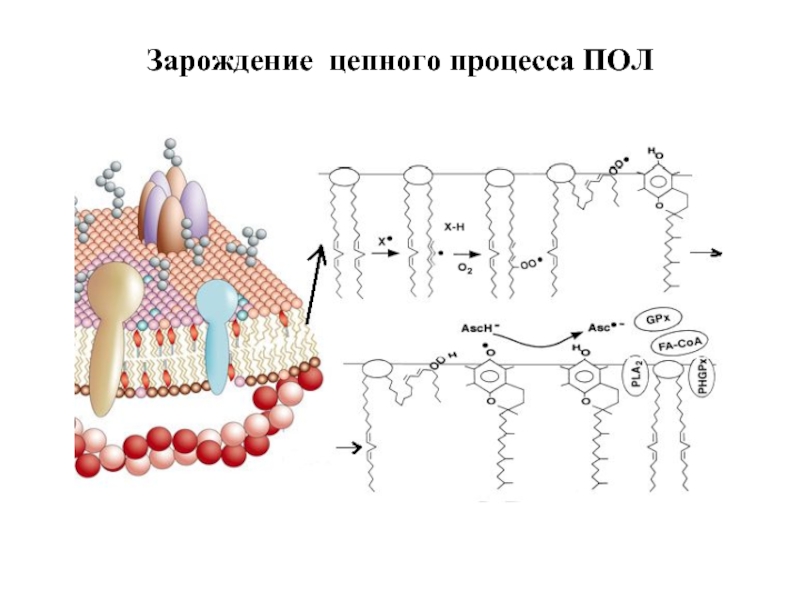
- 61. Зарождение цепного процесса ПОЛ
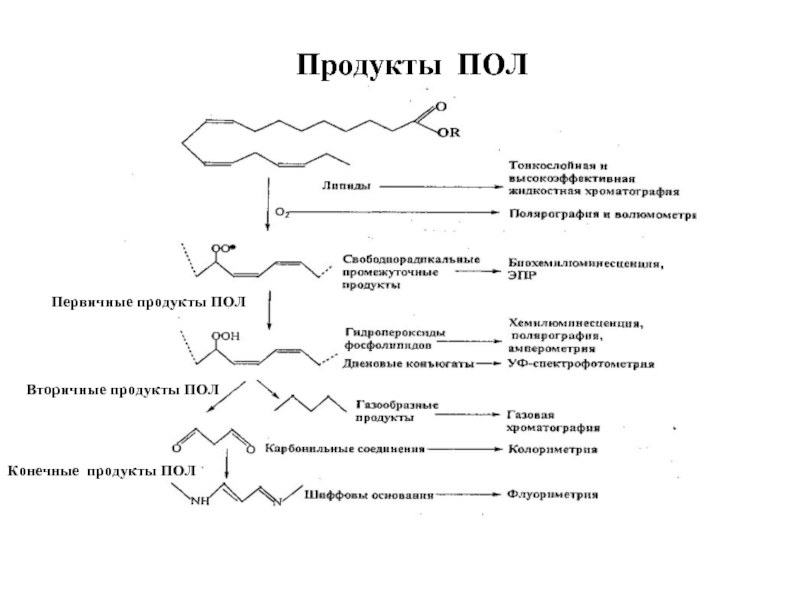
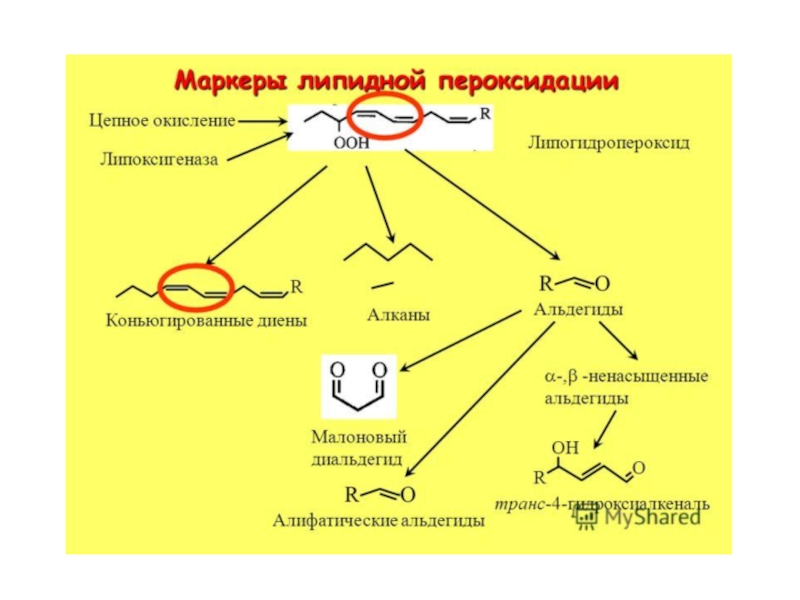
- 62. Продукты ПОЛ Первичные продукты ПОЛ Вторичные продукты ПОЛ Конечные продукты ПОЛ
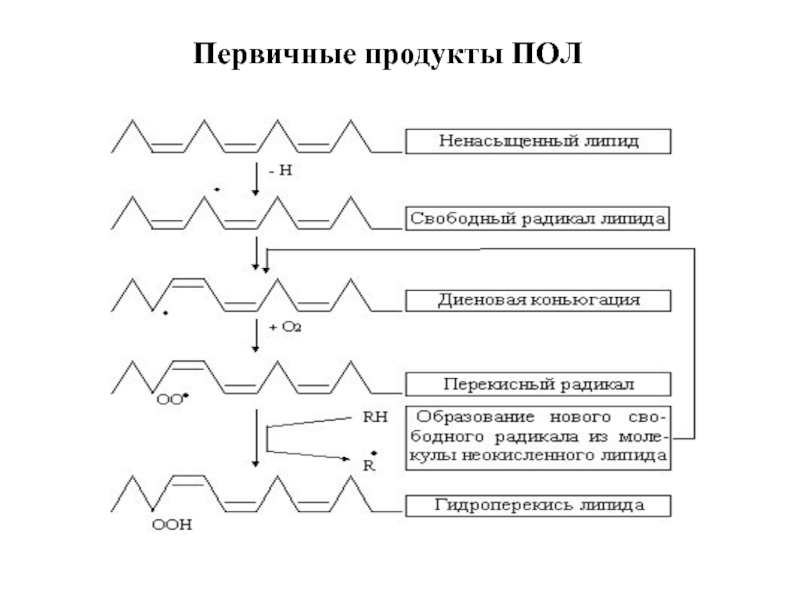
- 64. Первичные продукты ПОЛ
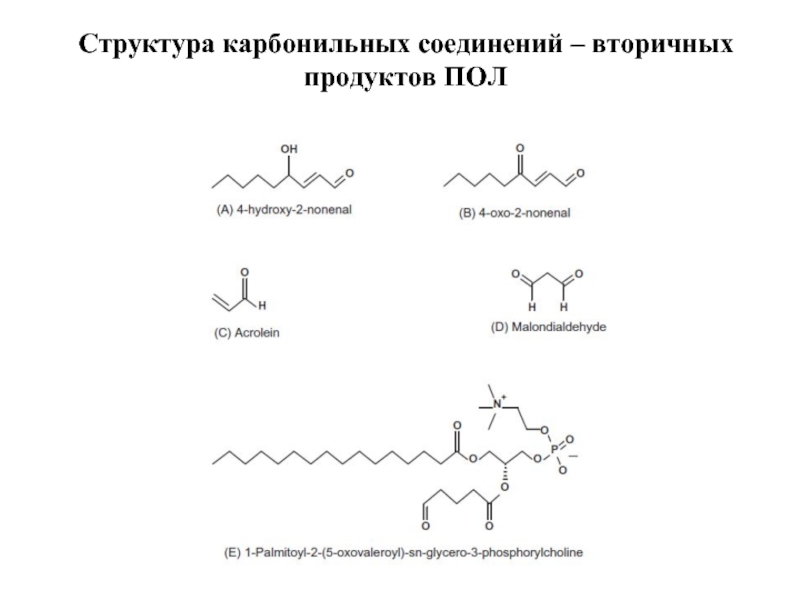
- 65. Структура карбонильных соединений – вторичных продуктов ПОЛ
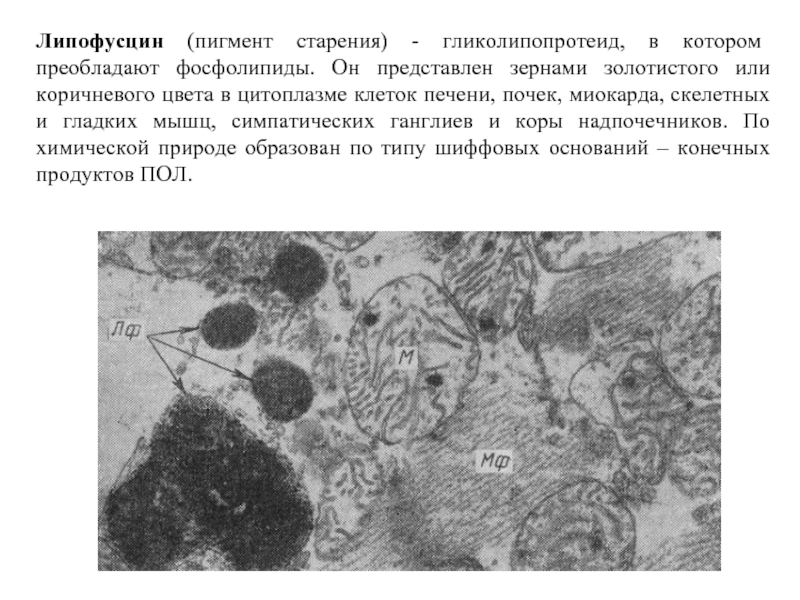
- 66. Липофусцин (пигмент старения) - гликолипопротеид, в котором
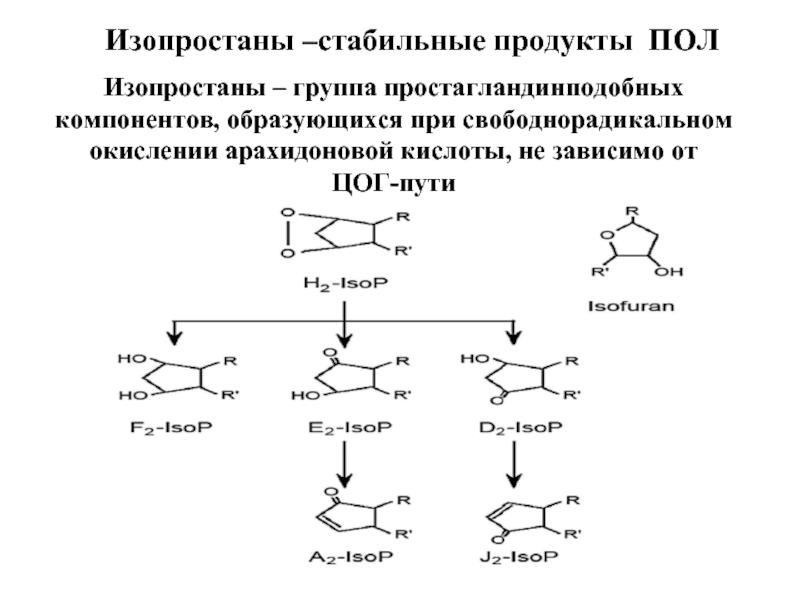
- 67. Изопростаны –стабильные продукты ПОЛ Изопростаны – группа
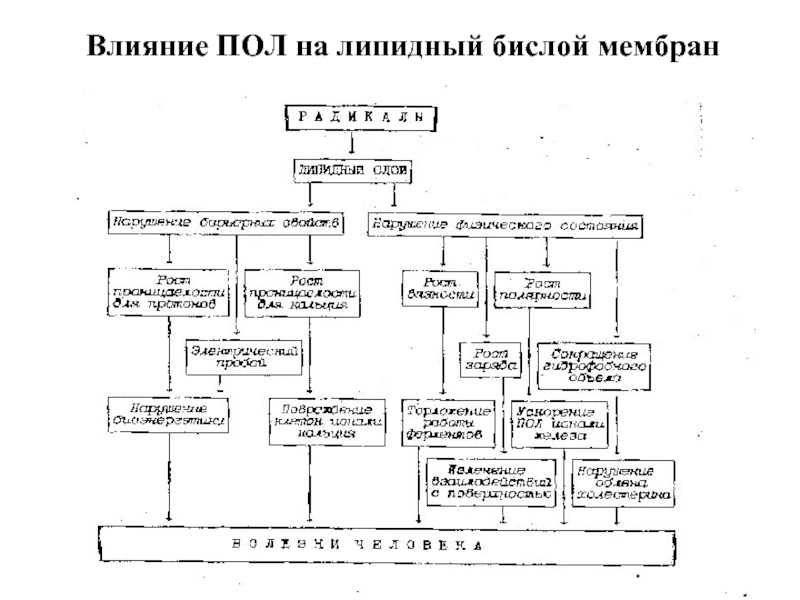
- 68. Влияние ПОЛ на липидный бислой мембран
- 69. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 70. Окислительное повреждение ДНК Виды повреждений ДНК:
- 72. Живые клетки имеют систему защиты от
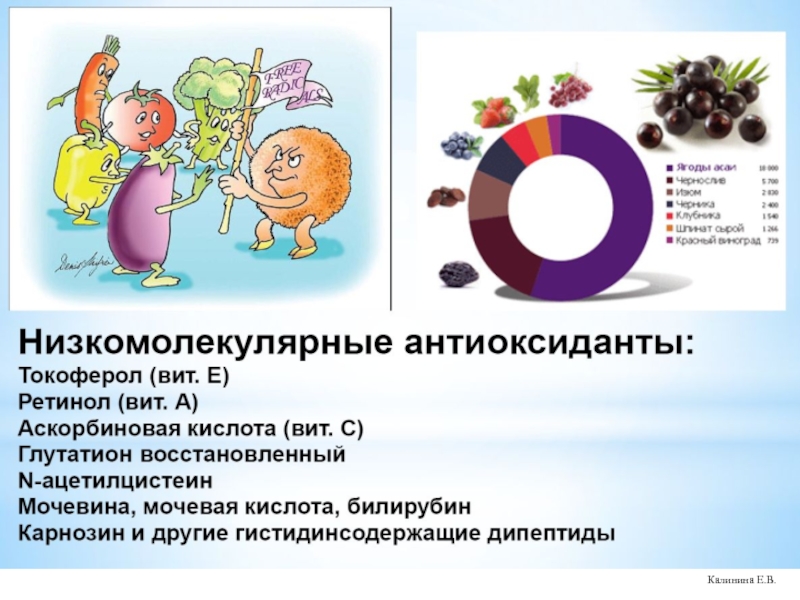
- 74. Калинина Е.В.
- 75. Калинина Е.В.
- 76. Калинина Е.В.
- 77. Калинина Е.В.
- 78. Калинина Е.В.
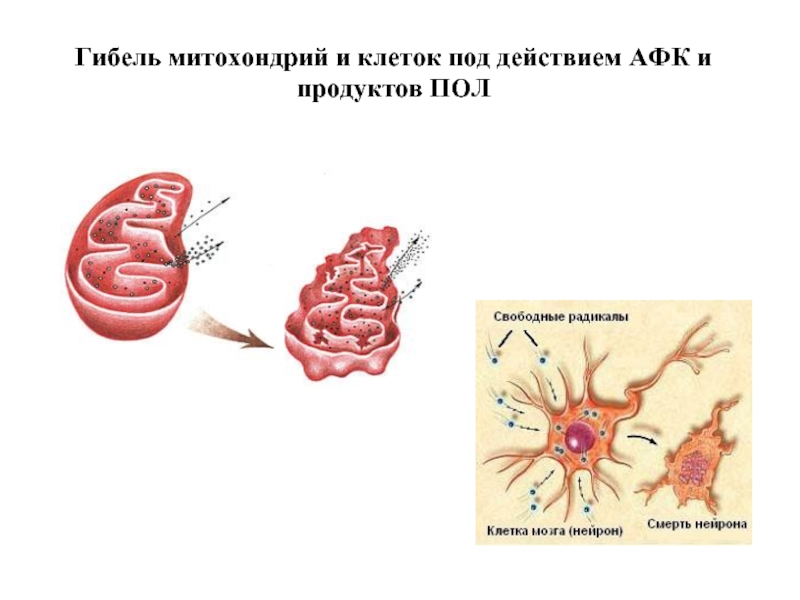
- 79. Гибель митохондрий и клеток под действием АФК и продуктов ПОЛ
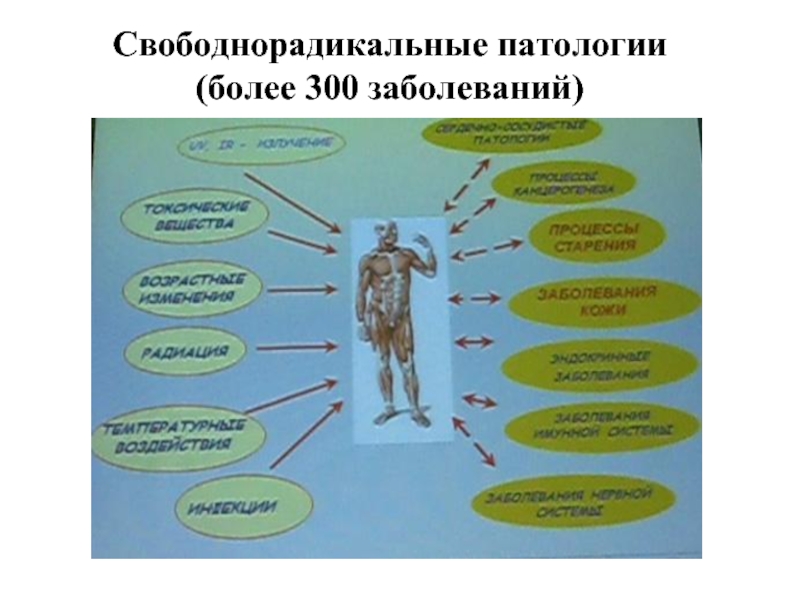
- 80. Свободнорадикальные патологии (более 300 заболеваний)
Слайд 1Перекисное окисление липидов
Характеристика, продукты, биологическая и патофизиологическая роль
Слайд 2 Перекисное окисление липидов –
Свободнорадикальные реакции ПОЛ постоянно протекают во всех организмах– от микроорганизмов до животных и человека.
Роль ПОЛ:
обновление мембранных липидов
поддержание структурного гомеостаза
биосинтез биологически активных соединений (простагландинов, тромбоксанов, лейкотриенов)
функционирование мембранных ферментов
- экспрессия генов
деление клеток
регуляция апоптоза
Чрезмерная активация ПОЛ приводит к развитию патологических процессов (окислительный стресс).
Слайд 3Академик Н.Н.Семёнов
Сирил Норман Хиншелвуд
В 1956 г. Н.Н.Семёнов совместно с С.Хиншелвудом получили Нобелевскую премию
Слайд 4Тарусов Б.Н.
Владимиров Ю.А.
Автор гипотезы о ведущей роли свободнорадикальных реакций ПОЛ в
Бурлакова Е.Б.
Слайд 5Эмануэль Н.М.
Тарусов Б.Н.
Выдвинули идею о роли ПОЛ в происхождении и патогенезе
Слайд 6Общее уравнение свободнорадикального ПОЛ имеет следующий вид:
(L• + LO•) +
L•, LO• - липидные радикалы
LH - полиненасыщенная жирная кислота (ПНЖК)
LOOH – гидроперекись липида
Слайд 7Важнейшие особенности ПОЛ:
1. О2 - зависимый процесс. О2 необходим для образования
2. скорость процесса зависит не только от концентрации исходных и конечных веществ, но и от содержания промежуточных соединений – липидных радикалов;
3. большая зависимость ПОЛ от температуры среды
(Q10 > 5);
4. скорость ПОЛ сильно зависит от степени ненасыщенности липидов;
5. ПОЛ инициируется путем отрыва атома водорода от атома углерода в α-положении, т.е. соседнего с двойной связью;
6. по типу утилизации кислорода ПОЛ относится к диоксигеназному пути окисления.
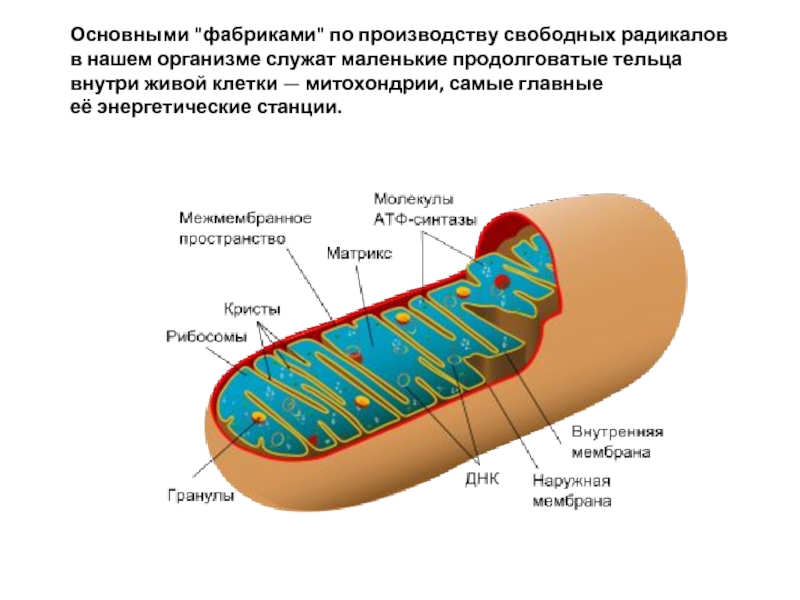
Слайд 11Основными "фабриками" по производству свободных радикалов в нашем организме служат маленькие
Слайд 12В физиологических условиях более 95% молекулярного кислорода вовлекается в процесс окислительного
Однако молекула кислорода способна к неполному восстановлению, что приводит к возникновению чрезвычайно реакционно-способных кислородных радикалов.
Слайд 13
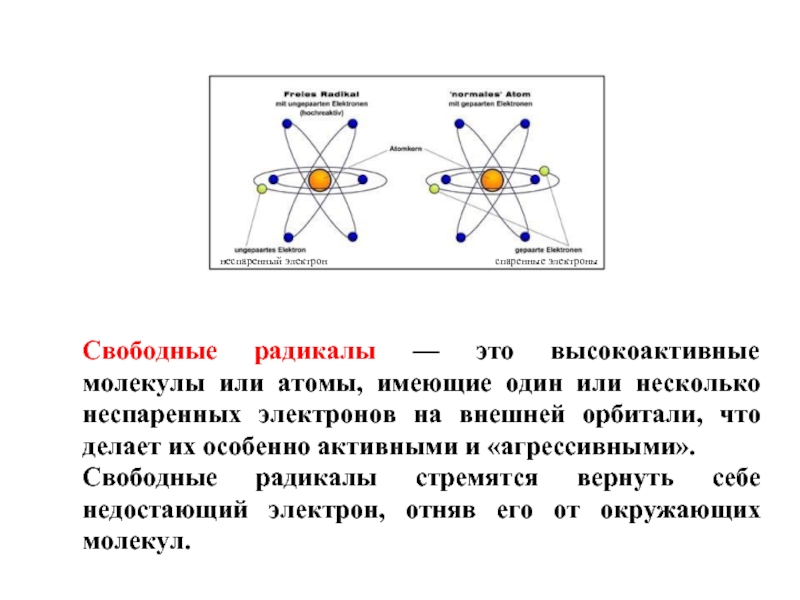
Свободные радикалы — это высокоактивные молекулы или атомы, имеющие один или
Свободные радикалы стремятся вернуть себе недостающий электрон, отняв его от окружающих молекул.
неспаренный электрон
спаренные электроны
Слайд 15Активированные кислородные метаболиты (АКМ) - высокореакционные, преимущественно радикальные кислородные соединения, образующиеся
Обнаружено от 300 до 800 различных органических радикалов: радикалы липидов, белков, низкомолекулярных пептидов, нуклеиновых кислот, фенолов, неорганических молекул
Слайд 19
Свободные радикалы разделяют на первичные, вторичные и третичные (Владимиров Ю.А.).
Первичные
Вторичные радикалы, в отличие от первичных, не выполняют физиологически полезных функций.
Напротив, они оказывают разрушительное действие на клеточные структуры, стремясь отнять электроны у «полноценных» молекул, вследствие чего «пострадавшая» молекула сама становится свободным радикалом (третичным), но чаще всего слабым, не способным к разрушающему действию.
Слайд 20Классификация АКМ
1. Активные формы кислорода (АФК) – продукты одно, двух- и
электронного восстановления молекулярного кислорода (О2•‾, НО2•, Н2О2, ОН•) или
изменения спина одного из электронов внешней орбитали (1О2).
2. Гипогалогениты - активные формы галогенов (АФГ) - (HOCl, HOBr, HOI, HOSCN) – продукты ферментативной реакции перекиси водорода и галогенов, которая катализируется миелопероксидазой, эозинпероксидазой, лактопероксидазой. Маркеры воспаления.
3. Оксид азота NO• и его метаболиты - активные формы азота (АФА) - (NO2•, NO+, NO‾,ONOO‾, S-нитрозотиолы). Физиологические функции NO•: регуляция тонуса сосудов (эндотелиальный фактор расслабления), медиатор нового типа, бактерицидное и противораковое действие.
4. Липидные радикалы (L•, LO•, LO2•) - образуются при протекании ПОЛ, при высоких концентрациях - цитотоксическое действие, при стационарных концентрациях - регуляторы биологических процессов.
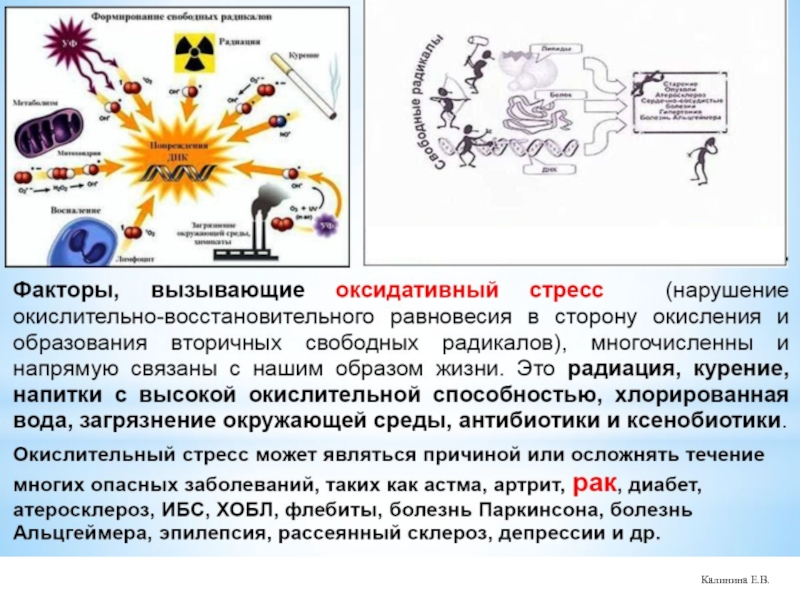
Слайд 21Окислительный стресс (ОС) - состояние сдвига динамического равновесия в системе прооксиданты↔антиоксиданты
В механизмах ОС выделяют:
собственно ОС (АФК↑);
нитрозильный стресс (АФА↑);
галогенирующий стресс (АФГ↑)
карбонильный стресс (АКС – альдегиды, кетоны ↑)
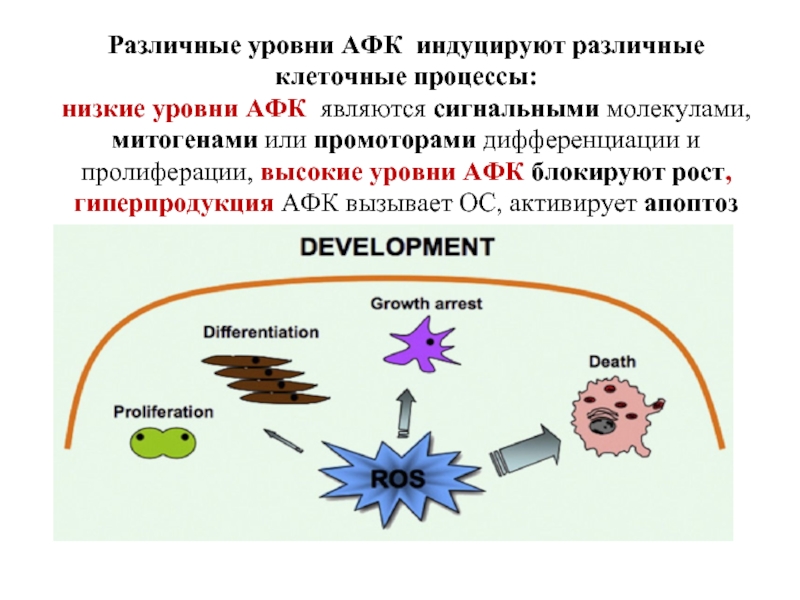
Слайд 22Различные уровни АФК индуцируют различные клеточные процессы:
низкие уровни АФК являются сигнальными
Слайд 26Источники супероксидного анион-радикала (О2●▬)
в клетке
1. Аутоокисление органических соединений (например, гемоглобина).
2.
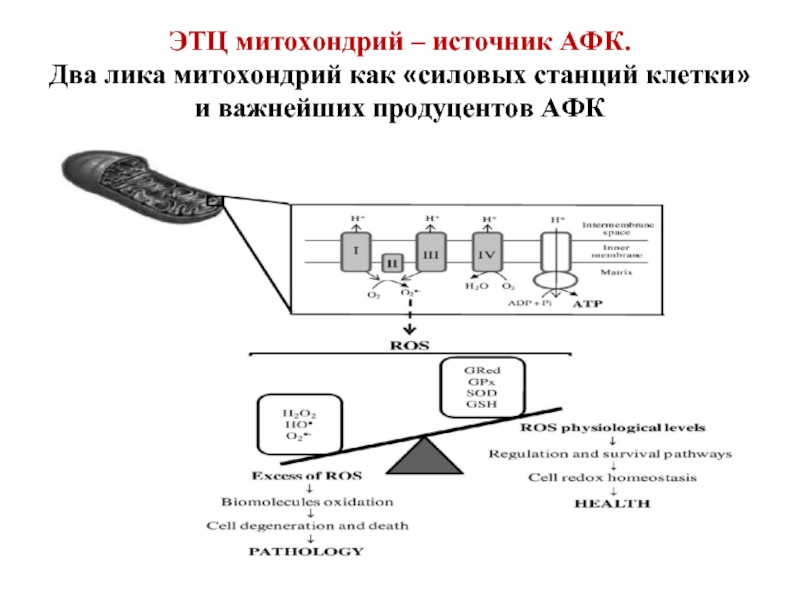
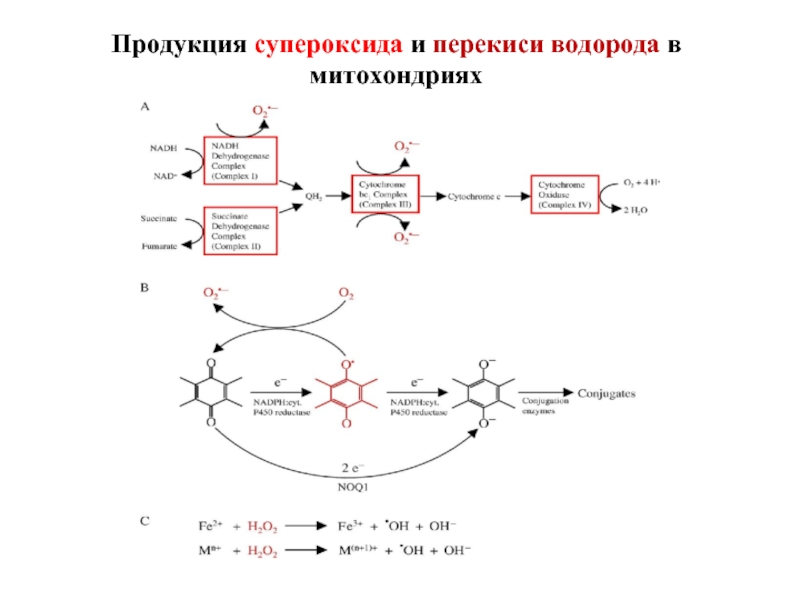
3. ЭТЦ митохондрий (5-6% АФК).
4.ЭТЦ микросом (75% АФК)
5. НАДФН-оксидаза
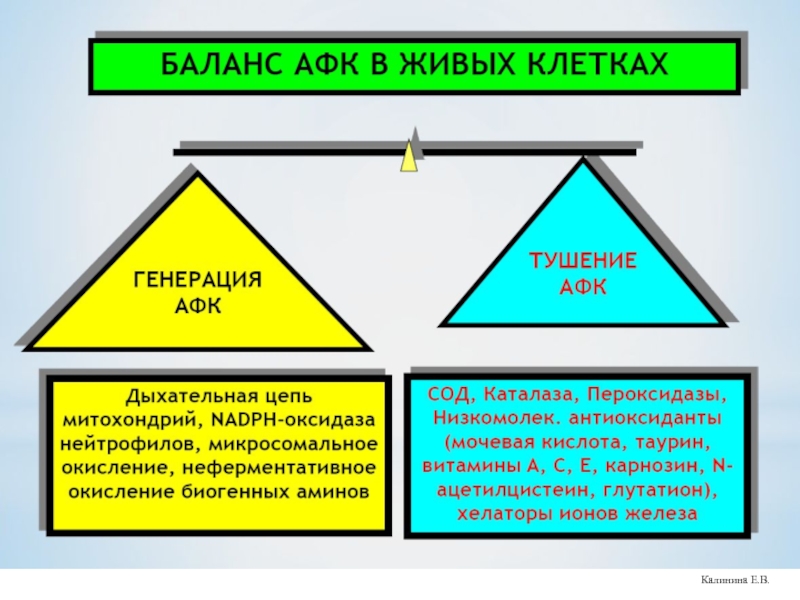
Пути удаления О2●▬ в клетке
1. Супероксиддисмутазы
2.Низкомолекулярные антиоксиданты - α-токоферол, аскорбат, мочевая кислота и др.
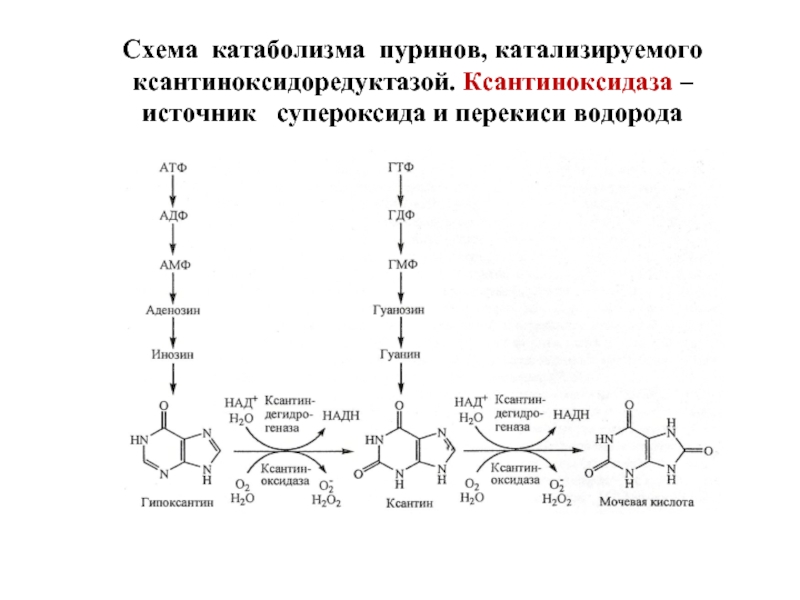
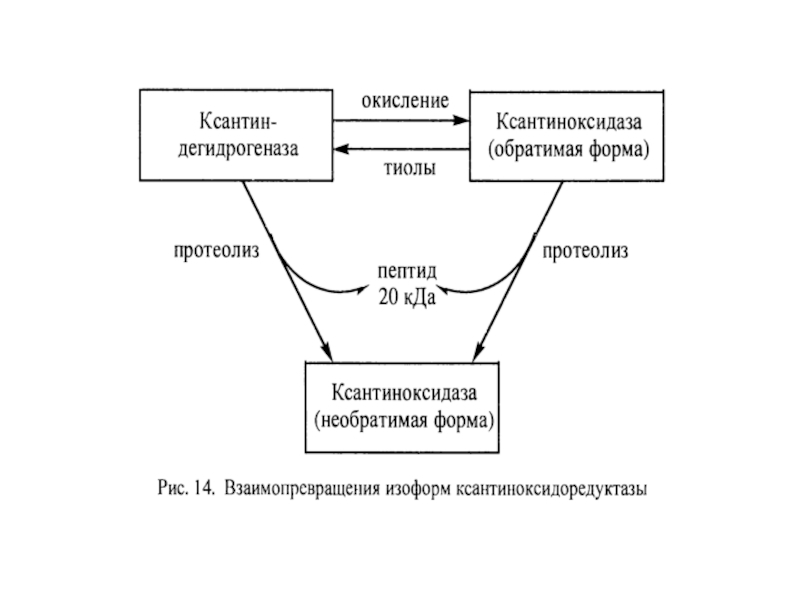
Слайд 27Ксантиноксидоредуктаза – источник супероксида и перекиси водорода в клетке
Ксантиноксидоредуктаза представлена
КД ↔ КО – это группа из двух близких по структуре Mo6+ и Fe2+-содержащих ферментов, локализованы в большинстве органов, обладают широкой субстратной специфичностью. Они окисляют пурины (через гипоксантин и ксантин до мочевой кислоты), пиримидины, адреналин, дегидрируют НАДН, НАДФН.
Слайд 28Схема катаболизма пуринов, катализируемого ксантиноксидоредуктазой. Ксантиноксидаза – источник супероксида и
Слайд 30ЭТЦ митохондрий – источник АФК. Два лика митохондрий как «силовых станций клетки»
Слайд 32Роль митохондрий в индукции апоптоза. Открытие апоптоз-индуцирующегл фактора (AIF ) Гвидо
Слайд 34Конформационные болезни (КБ) – это заболевания, связанные с нарушнием механизмов нативной
При всех этих заболеваниях наблюдается митохондриальная дисфункция, приводящая к повышенной продукции АФК, которые способствуют нарушению нормального фолдинга белков и накоплению молекул с аномальной конформацией.
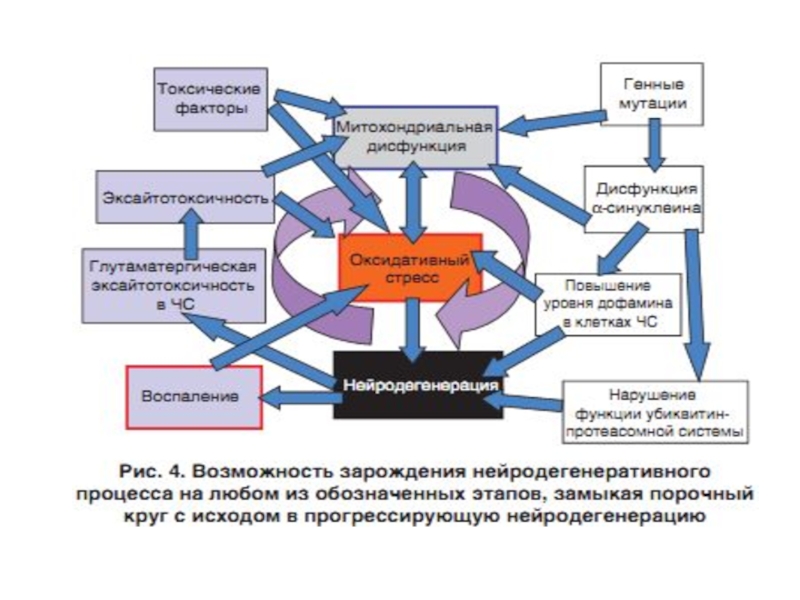
Слайд 35Роль ЭТЦ митохондрий в развитии нейродегенеративных заболеваний – болезни Паркинсона (PD),
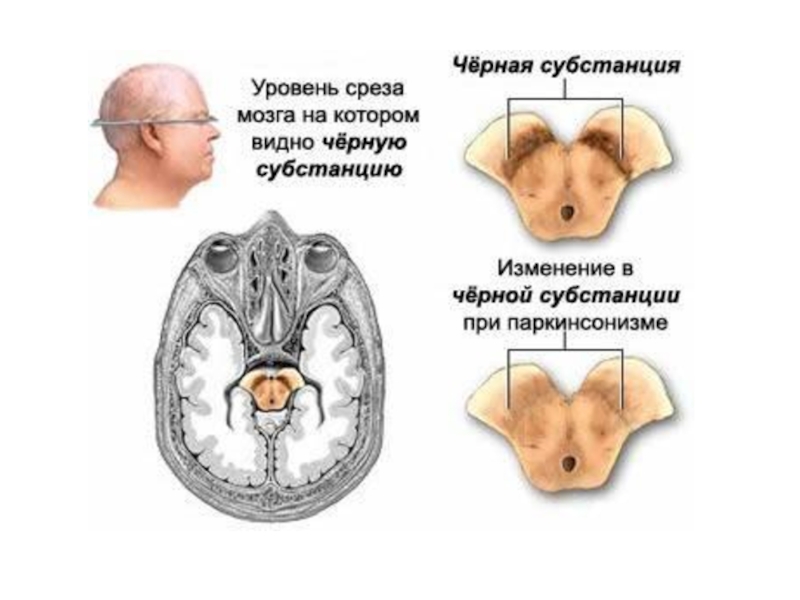
Слайд 36Болезнь Паркинсона – впервые описана Джеймсом Паркинсоном в 1817 году в
Слайд 38Нарушение метаболизма при болезни Паркинсона
(Крыжановский и др., 2000):
1. митохондриальная дисфункция
2. энергетический дефицит нейрона;
3. усиление ПОЛ с образованием токсичных продуктов;
4. Са-перегрузка нейронов, гибель клетки;
5. мутации в гене α-синуклеина → изменение структуры белка α-синуклеина → его накопление в нейроне → агрегация белка с образованием телец Леви. В настоящее время α-синуклеин - ключевой молекулярный маркер БП.
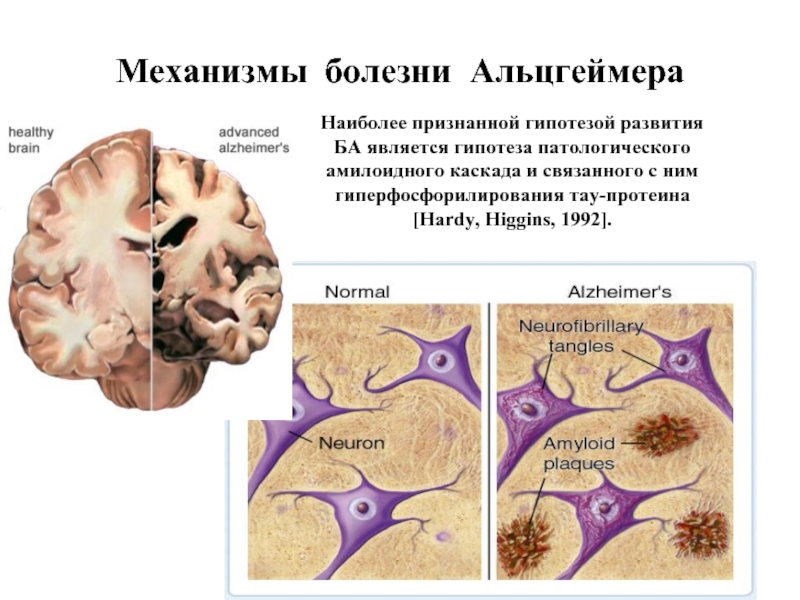
Слайд 40Механизмы болезни Альцгеймера
Наиболее признанной гипотезой развития БА является гипотеза патологического амилоидного
Слайд 41Болезнь Альцгеймера (сенильная деменция) — нейродегенеративное заболевание, впервые описанное в 1906 году немецким психиатром Алоисом Альцгеймером. Как
Общемировая заболеваемость на 2006 г. оценивалась в 26,6 млн. человек, а к 2050 году число больных может вырасти вчетверо.
Патоморфологические и биохимические механизмы БА связаны с:
- митохондриальной дисфункцией (нарушение IV ФК ЭТЦ);
- накоплением β-амилоидного пептида и образованием внеклеточных амилоидных бляшек;
- гиперфосфорилованием тау-белка, ассоциированного с микротрубочками, и образованием внутриклеточных нейрофибриллярных клубочков. Гибель нейронов.
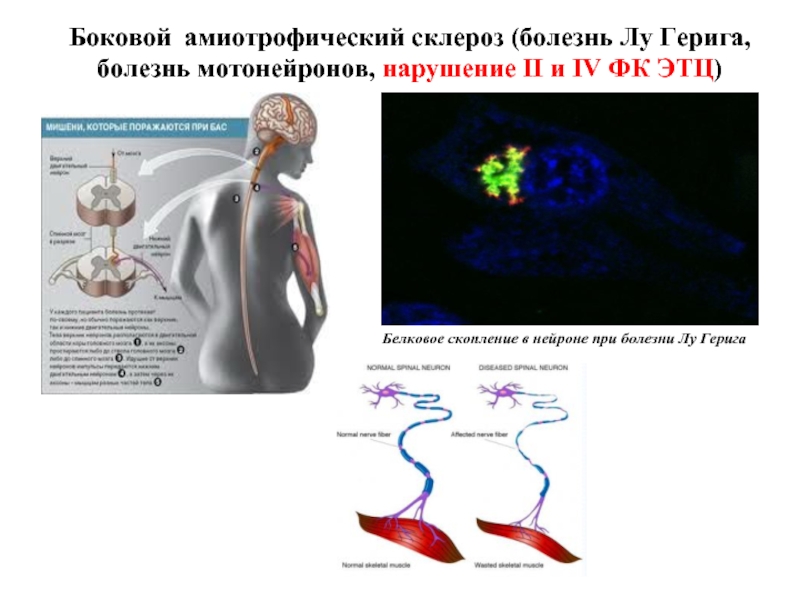
Слайд 42Боковой амиотрофический склероз (болезнь Лу Герига, болезнь мотонейронов, нарушение II и
Белковое скопление в нейроне при болезни Лу Герига
Слайд 43
Генри Луи Гериг, прозванный за выносливость «Железный конь» — выдающийся бейсболист.
Эксперт по черным дырам, Хокинг – один из самых выдающихся астрофизиков. Его достижения еще более значимы потому, что ученый страдает дегенеративным генетическим заболеванием, которое диагностировали, когда Стивену был 21 год; тогда будущему ученому врачи обещали всего несколько лет. Но Хокинг не только прожил более полувека, но и сделал множество фундаментальных открытий в области теоретической астрофизики.
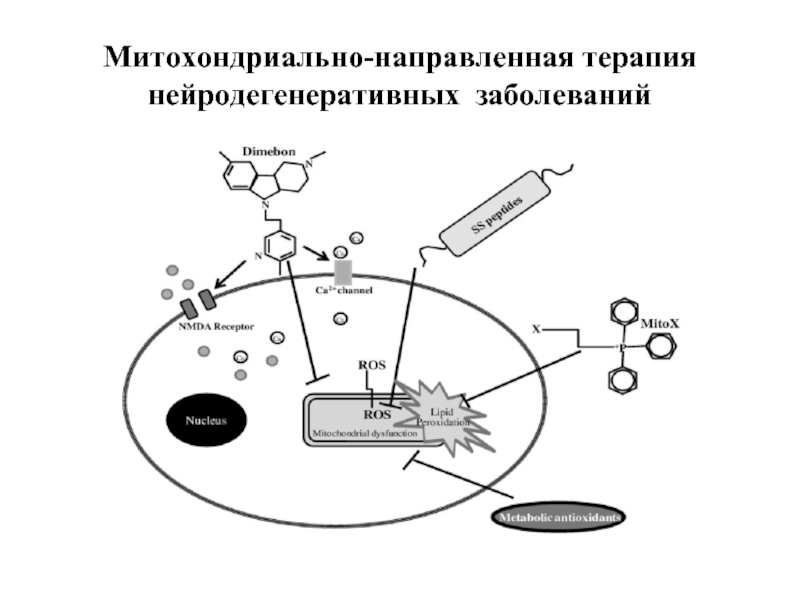
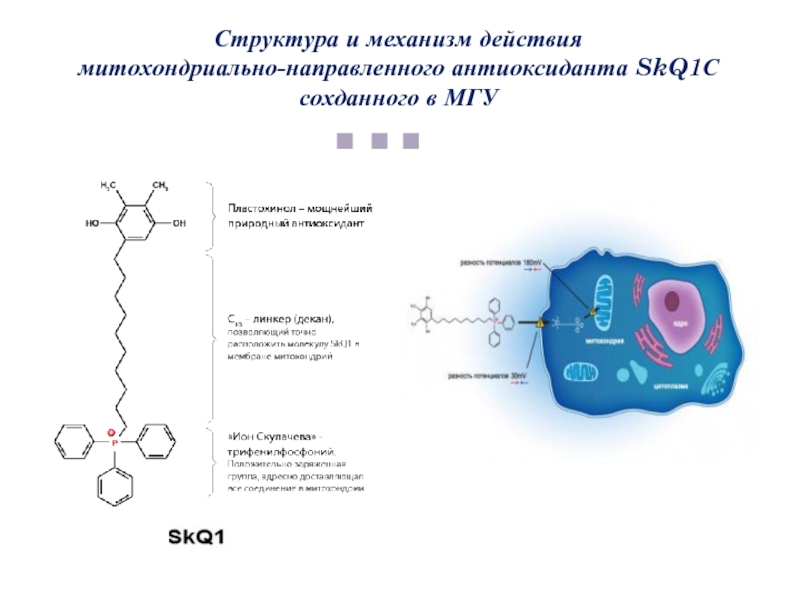
Слайд 45Структура и механизм действия
митохондриально-направленного антиоксиданта SkQ1С сохданного в МГУ
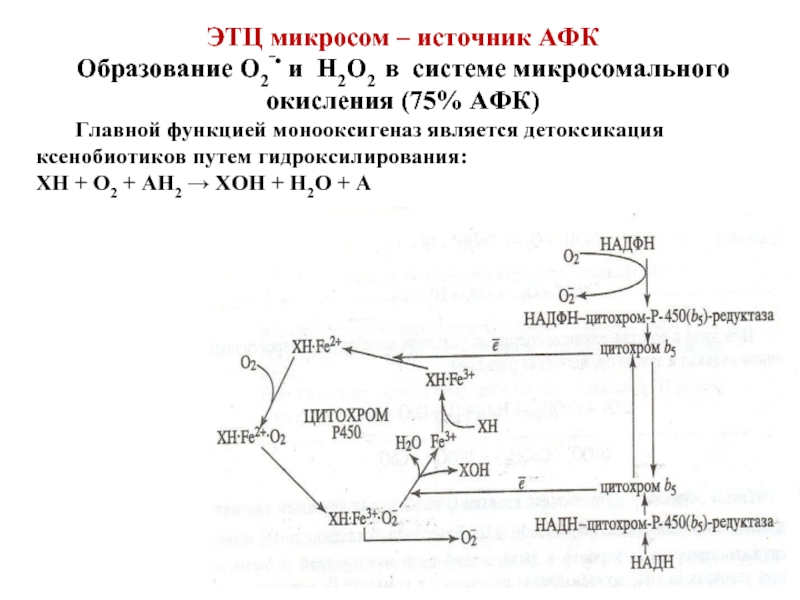
Слайд 46ЭТЦ микросом – источник АФК
Образование О2‾• и Н2О2 в системе микросомального
Главной функцией монооксигеназ является детоксикация ксенобиотиков путем гидроксилирования:
ХН + О2 + АН2 → ХОН + Н2О + А
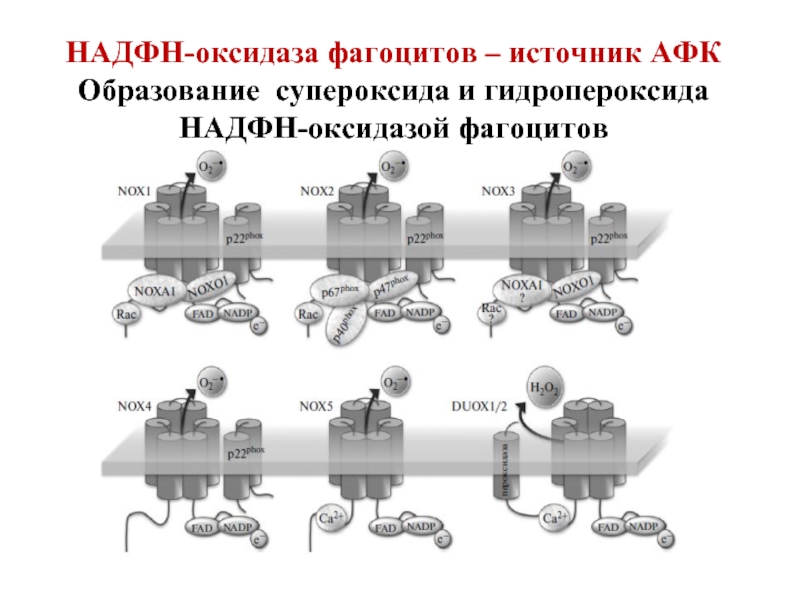
Слайд 47НАДФН-оксидаза фагоцитов – источник АФК
Образование супероксида и гидропероксида НАДФН-оксидазой фагоцитов
Слайд 49Структура НАДФН-оксидазы.
Состоит из 6 гетерогенных субъединиц: 2 мембрано-связанных (gp 91, p
2) Важнейший компонент НАДФН-оксидазы – цитохром b558 состоит из гликопротеина - β-субъединицы (gp91) и α-субъединицы (р22). β-субъединица (gp91) содержит 6 трансмембранных α-спиралей на N-конце и участки гликозилирования. С-конец имеет сайты связывания ФАД и НАДФН, в состав цит b558 входит 2 гема
Слайд 51Роль НАДФН-оксидазы в патогенезе заболеваний.
Хронический гранулематоз («детский фатальный хронический гранулематоз»; 1:200-250
Лимфогранулематоз (болезнь Ходжкина, злокачествен-ная гранулема) – злокачественное заболевание лимфоидной ткани, характерным признаком которого является наличие гигантских клеток Березовского-Штернберга и ингибирование НАДФН-оксидазы.
Слайд 52Микропрепарат: биоптат лимфоузла. Характерная клетка Рид — Березовского — Штернберга при
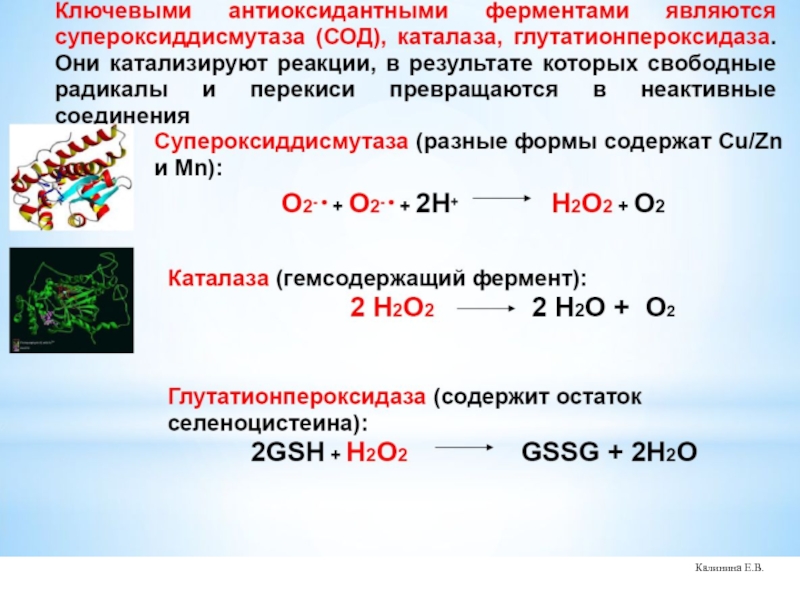
Слайд 53Супероксиддисмутазы (СОД) – суперсемейство ферментов, относящихся к классу оксидоредуктаз и катализирующих
О2‾• + О2‾• → Н2О2 + 3О2
СОД присутствуют у всех аэробных организмов.
СОД (эритрокупреин) была открыта Мак-Кордом и Фридовичем в 1969 г.
СОД классифицируют по строению активного центра и структурной организации молекулы.
Выделяют 3 семейства СОД:
- Cu,Zn-СОД (эукариоты, хлоропласты растений, бактерии)
- Fe-СОД, Mn-СОД (прокариоты, митохондрии эукариот, хлоропласты)
- Ni-СОД (Streptomyces, цианобактерии)
Супероксиддисмутазы
Слайд 55Источники перекиси водорода в клетке:
НАДФН-оксидаза
Электрон-транспортная цепь митохондрий
Электрон-транспортная цепь микросом
Ксантиноксидоредуктаза (КОР)
Супероксиддисмутаза
Каталаза
Глутатионпероксидаза
Пероксиредоксины
Слайд 56Элиминация перекиси водорода в клетке осуществляется ферментативным путем:
1.Каталаза – гемсодержащий внутриклеточный
2Н2О2 → 2Н2О + О2
2. Глутатионпероксидаза – конститутивное семейство ферментов, которые способны восстанавливать органические и неорганические гидропероксиды до гидроксисоединений или других восстановленных эквивалентов. Имеются селеновые и неселеновые ГПО. Селеновые ГПО содержат в активном центре селеноцистеин, который вовлекается в каталитический цикл.
2GSH + H2O2 → GSSG + 2 H2O
3. Пероксиредоксины – цитозольные белки, обладающие перксидазной активностью, которые имеют фиксированные цистеиновые остатки на концах молекул, восстанавливают Н2О2
Слайд 57Индукция ПОЛ
1.Самый эффективный индуктор ПОЛ – гидроксильный радикал ОН•, который образуется
Н2О2 + Fe2+ → OH• + OH▬ + Fe3+
HOCl + Fe2+ → OH• + Cl▬ + Fe3+
NO• + O2•▬ → ONOO▬ → ONOOH → OH• + NO2•
2. Fe2+ активирует ПОЛ через реакцию разветвления цепи, а также реакции Фентона и Осипова.
LOOH + Fe2+ → LO• + OH▬ + Fe3+
Слайд 59Цепная реакция перекисного окисления липидов:
1-старая цепь окисления, 2, 3 -
Слайд 66Липофусцин (пигмент старения) - гликолипопротеид, в котором преобладают фосфолипиды. Он представлен
Слайд 67Изопростаны –стабильные продукты ПОЛ
Изопростаны – группа простагландинподобных компонентов, образующихся при свободнорадикальном
ЦОГ-пути
Слайд 69ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
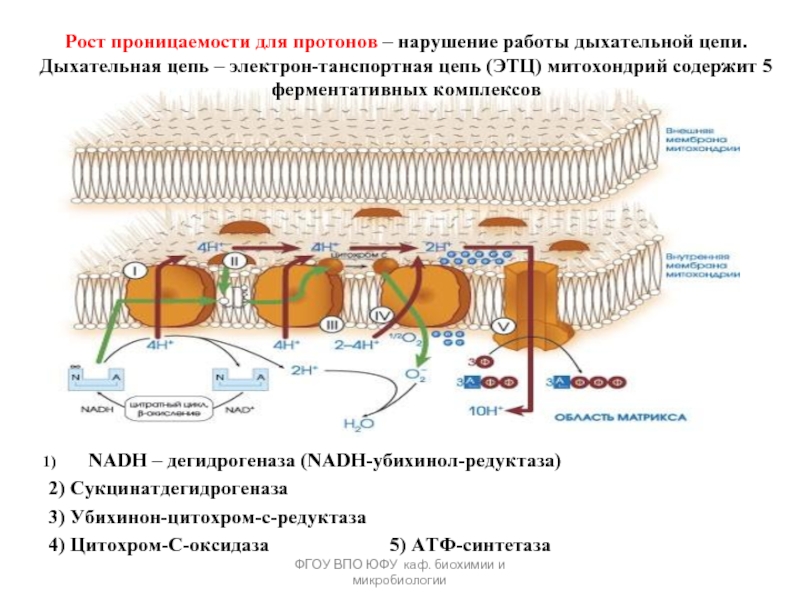
Рост проницаемости для протонов –
NADH – дегидрогеназа (NADH-убихинол-редуктаза)
2) Сукцинатдегидрогеназа
3) Убихинон-цитохром-с-редуктаза
4) Цитохром-С-оксидаза 5) АТФ-синтетаза
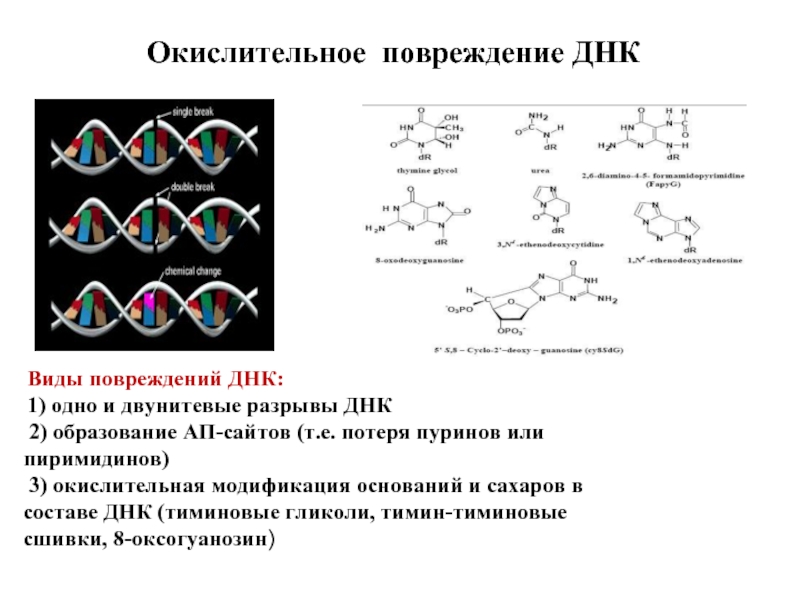
Слайд 70Окислительное повреждение ДНК
Виды повреждений ДНК:
1) одно и двунитевые разрывы
2) образование АП-сайтов (т.е. потеря пуринов или пиримидинов)
3) окислительная модификация оснований и сахаров в составе ДНК (тиминовые гликоли, тимин-тиминовые сшивки, 8-оксогуанозин)
Слайд 72
Живые клетки имеют систему защиты от повышенной продукции свободных радикалов -
Антиоксиданты «ловят» радикалы, отдавая им свои электроны, таким образом, обезвреживая их. При этом структура антиоксидантов остается стабильной.