- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Полярография и измерение рН презентация
Содержание
- 1. Полярография и измерение рН
- 2. Полярография один из важнейших электрохимических методов анализа
- 3. Возникновение метода Метод предложен Ярославом Гейровским в 1922 году,
- 4. Принцип метода Протекание электрического тока в водном
- 5. Количество прореагировавшего вещества определяется законом Фарадея, то
- 6. Почему ртуть? Выбор ртутного электрода в первых
- 7. Применение метода Полярография широко используется в металлургии, геологии, органической химии, медицине,
- 8. Измерение рН рН – мера активности ионов водорода в растворе
- 9. Датский химик Серенсен был первым, кто
- 10. Измерение рН Главным инструментом измерения рН является
- 11. Отбор проб
- 12. Ячейка безжидкостного соединения и рНметр фирмы «Орион»
- 13. принцип действия Действие pH-метра основано на измерении
- 14. Во многих жидких химических процессах очень важным
- 15. Области применений pH (активность ионов H+ в
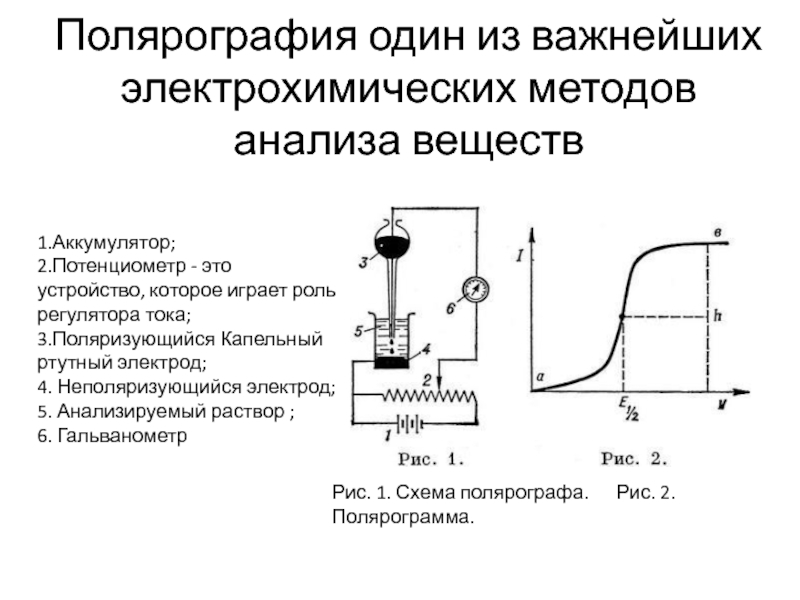
Слайд 2Полярография один из важнейших электрохимических методов анализа веществ
Рис. 1. Схема
1.Аккумулятор;
2.Потенциометр - это устройство, которое играет роль регулятора тока;
3.Поляризующийся Капельный ртутный электрод;
4. Неполяризующийся электрод;
5. Анализируемый раствор ;
6. Гальванометр
Слайд 3Возникновение метода
Метод предложен Ярославом Гейровским в 1922 году, когда он изучал влияние напряжения, приложенного
Слайд 4Принцип метода
Протекание электрического тока в водном растворе связано с движением ионов,
Слайд 5Количество прореагировавшего вещества определяется законом Фарадея, то есть пропорционально прошедшему через
Где М — масса прореагировавшего вещества, Мэкв — эквивалентная масса прореагировавшего вещества, Q — прошедший через электрод заряд, z- количество электронов, участвующих в превращении одной молекулы или одного иона, F- число Фарадея, задающее коэффициент пропорциональности. Число Фарадея равно 96485 кулон/моль и представляет собою число Авогадро, умноженное на заряд электрона.
Слайд 6Почему ртуть?
Выбор ртутного электрода в первых вариантах полярографии не случаен.
На
Слайд 7Применение метода
Полярография широко используется в металлургии, геологии, органической химии, медицине, в электрохимии для определения: ряда ионов (кадмий, цинк, свинец и
Слайд 8Измерение рН
рН – мера активности ионов водорода в растворе , количественно выражающая его кислотность.
рН – это отрицательный десятичный логарифм активности иона водорода
Общепринятой шкалой рН является шкала “общей концентрации ионов водорода” (рНт ), которая определятся тождеством:
Слайд 9
Датский химик Серенсен был первым, кто ввел термин рН в научный
История