- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Карбоновые кислоты и их функциональные производные презентация
Содержание
- 1. Карбоновые кислоты и их функциональные производные
- 2. Актуальность Карбоновые кислоты и их функциональные производные
- 3. Их взаимопревращаемость используется химиками-органиками для получения новых
- 4. Актуальность Поэтому знание электронного строения функциональных
- 5. Цель лекции На основе электронного строения функциональных
- 6. План Реакционные центры карбоновых кислот
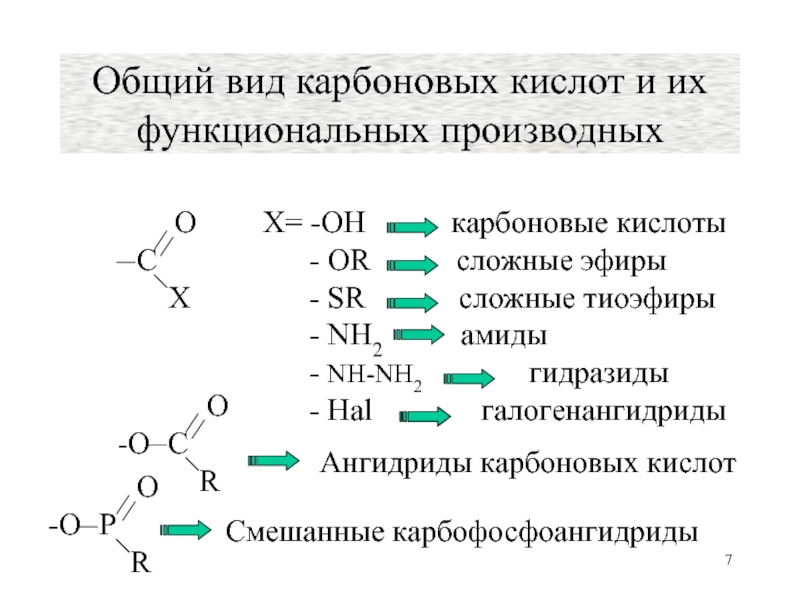
- 7. Общий вид карбоновых кислот и их функциональных производных
- 8. Реакционные центры Любая группа Х (кроме
- 9. Кислотность карбоновых кислот В карбоновых кислотах
- 10. Электроноакцепторные заместители усиливают кислотность карбоновых кислот, т.к.
- 11. Реакции SN. Общий механизм Nu –
- 12. Условия протекания реакции Наличие хорошей уходящей группы
- 13. Величина эффективного положительного заряда карбонильной группы
- 14. Увеличение δ+ на карбонильном атоме углерода С О О δ+ – +I, +M
- 15. Активация электрофильного центра Для усиления электрофильного центра
- 16. Реакция образования сложных эфиров Схема: #
- 17. Механизм реакции: Реакция образования сложных эфиров H+
- 18. Гидролиз сложных эфиров Кислотный (ацидолиз) Щелочной (щелочолиз) Ферментативный Схема щелочного гидролиза:
- 19. Механизм щелочолиза: Гидролиз сложных эфиров Na O-H
- 20. Значение гидролиза В организме по принципу кислотного
- 21. Конец лекции Благодарю за внимание Ответим на контрольный вопрос
Слайд 2Актуальность
Карбоновые кислоты и их функциональные производные (сложные эфиры и тиоэфиры, амиды,
Работа функциональных групп этих классов лежит в основе различных процессов жизнедеятельности.
Слайд 3Их взаимопревращаемость используется химиками-органиками для получения новых соединений.
Функциональные группы карбоновых кислот,
Актуальность
Слайд 4Актуальность
Поэтому знание электронного строения функциональных групп вышеуказанных классов органических соединений
Слайд 5Цель лекции
На основе электронного строения функциональных групп типа
где Х = -ОН,
Слайд 6План
Реакционные центры карбоновых кислот
и их функциональных производных …...10 мин
Сравнительная кислотность карбоновых кислот………………………20 мин
Реакции нуклеофильного замещения SN у тригонального атома углерода. Механизм в общем виде и схема процесса………… 25 мин
Реакции этерификаии и гидролиза. Условия протекания………………………………35 мин
Слайд 8Реакционные центры
Любая группа Х (кроме Cl и оксикарбонильной)
является электронодонором для оксогруппы
Слайд 9
Кислотность карбоновых кислот
В карбоновых кислотах существует ещё один важный центр –
О←Н
δ+
С работой этого центра связаны
реакции образования солей при взаимодействии кислот со щелочами или основными оксидами
R-COOH / RCOO–
Слайд 10Электроноакцепторные заместители усиливают кислотность карбоновых кислот, т.к. стабилизируют сопряженный анион.
Электронодоноры дестабилизируют
Кислотность карбоновых кислот
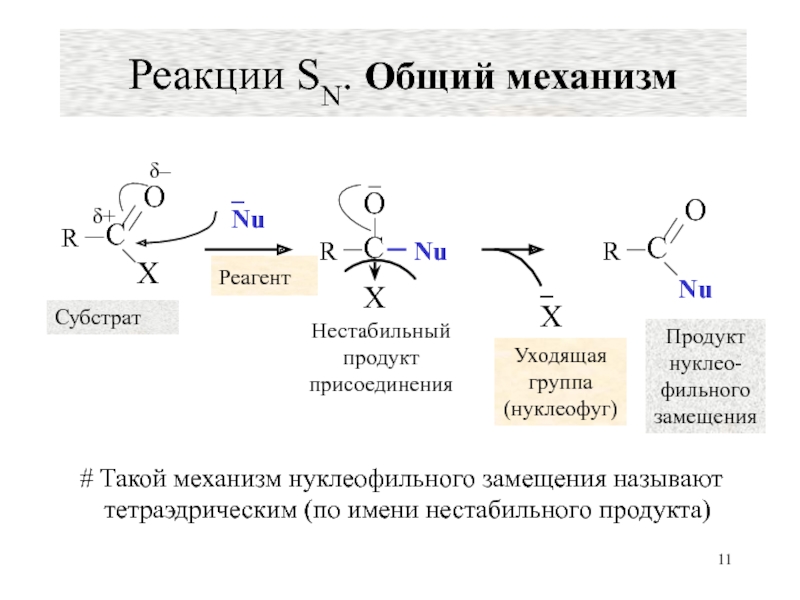
Слайд 11Реакции SN. Общий механизм
Nu
–
Субстрат
Реагент
Нестабильный
продукт присоединения
Уходящая группа
(нуклеофуг)
Продукт
нуклео-
фильного замещения
#
Слайд 12Условия протекания реакции
Наличие хорошей уходящей группы
Наличие сильного нуклеофильного реагента или
сильного электрофильного
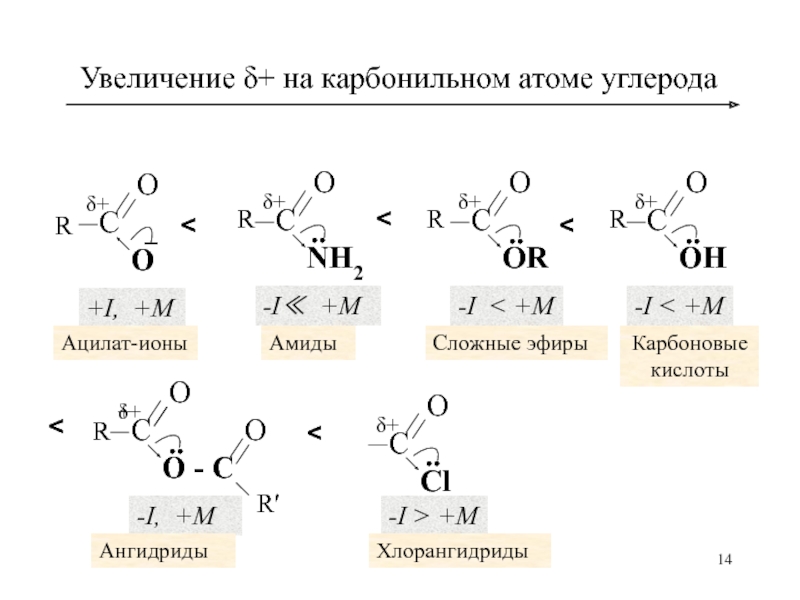
Слайд 13Величина эффективного положительного заряда карбонильной группы
Зависит от соотношения –I и +М-эффектов
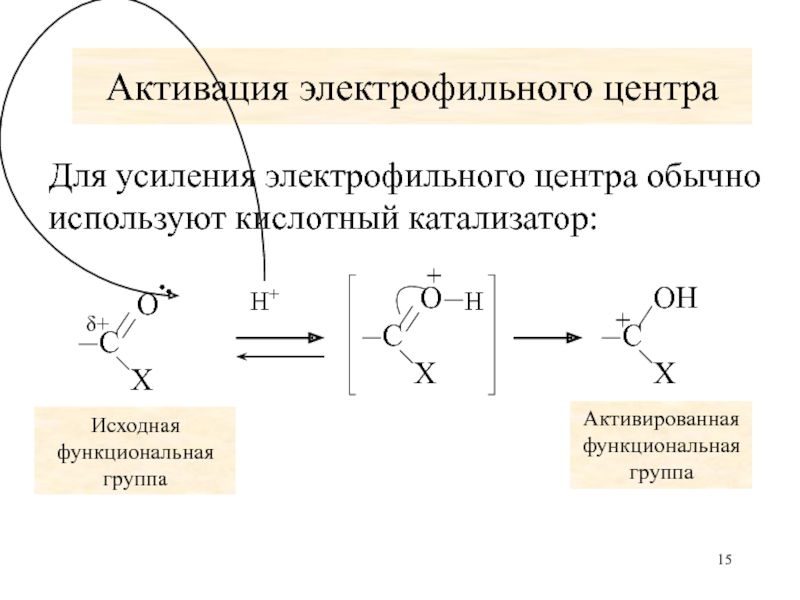
Слайд 15Активация электрофильного центра
Для усиления электрофильного центра обычно используют кислотный катализатор:
Исходная функциональная
Активированная функциональная группа
Слайд 16Реакция образования сложных эфиров
Схема:
# Эта реакция называется реакцией этерификации
# Карбоноые кислоты, однако, являются плохими ацилирующими агентами. Для ацилирования спиртов лучше брать ангидриды или галогенангидриды.
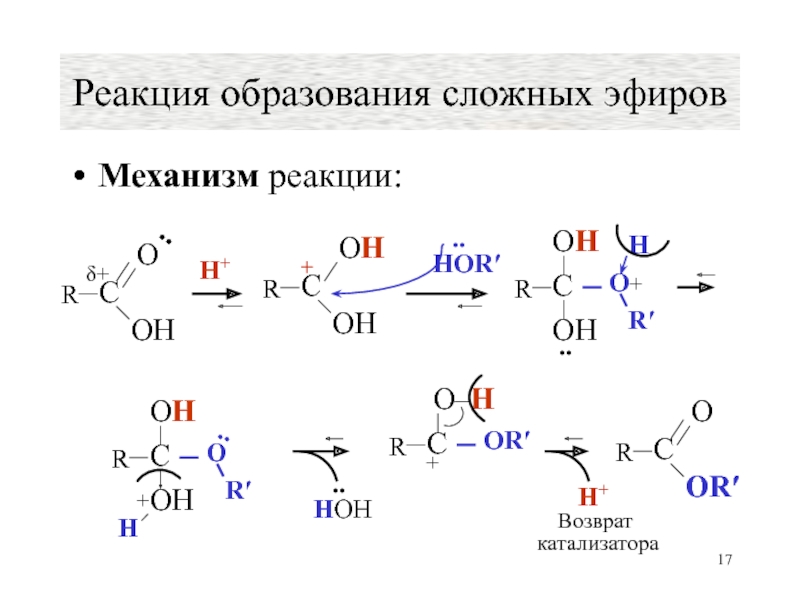
Слайд 17Механизм реакции:
Реакция образования сложных эфиров
H+
HOR′
..
HOH
..
С
О–H
R
OR′
+
Возврат
катализатора
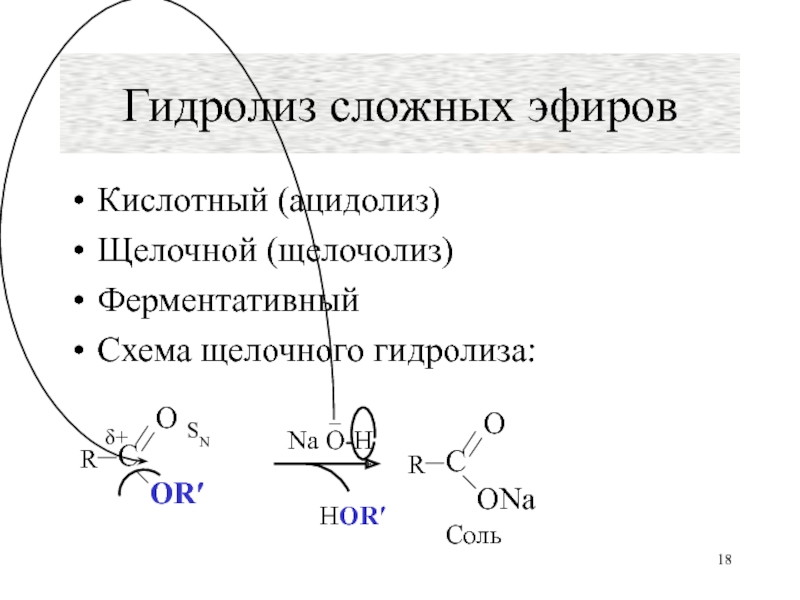
Слайд 18Гидролиз сложных эфиров
Кислотный (ацидолиз)
Щелочной (щелочолиз)
Ферментативный
Схема щелочного гидролиза:
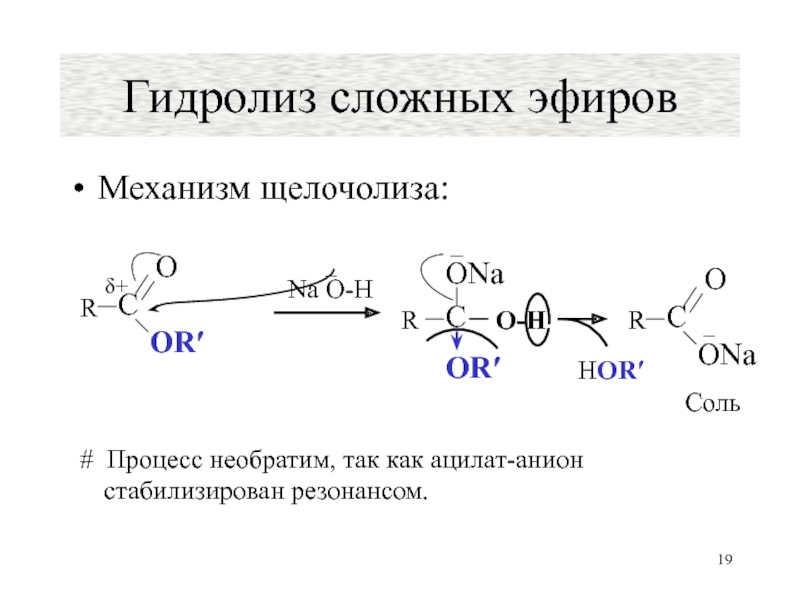
Слайд 19Механизм щелочолиза:
Гидролиз сложных эфиров
Na O-H
–
δ+
HOR′
С
О
ONa
R
Соль
С
ОNa
ОR′
О-Н
R
–
# Процесс необратим,
Слайд 20Значение гидролиза
В организме по принципу кислотного гидролиза расщепляются жиры и сложные
Но роль кислотных катализаторов здесь выполняют ферменты.