- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация неорганических веществ презентация
Содержание
- 1. Классификация неорганических веществ
- 2. Классификация веществ Вещества Чистые вещества
- 3. Химические элементы Металлы Цинк Натрий Неметаллы Азот Сера
- 4. Химические соединения Неорганические Серная кислота Гидроксид натрия Органические Метан Бензол
- 5. Неорганические вещества Простые состоят из атомов
- 6. Классификация простых веществ Все простые вещества на
- 7. Свойства простых веществ
- 8. Свойства простых веществ
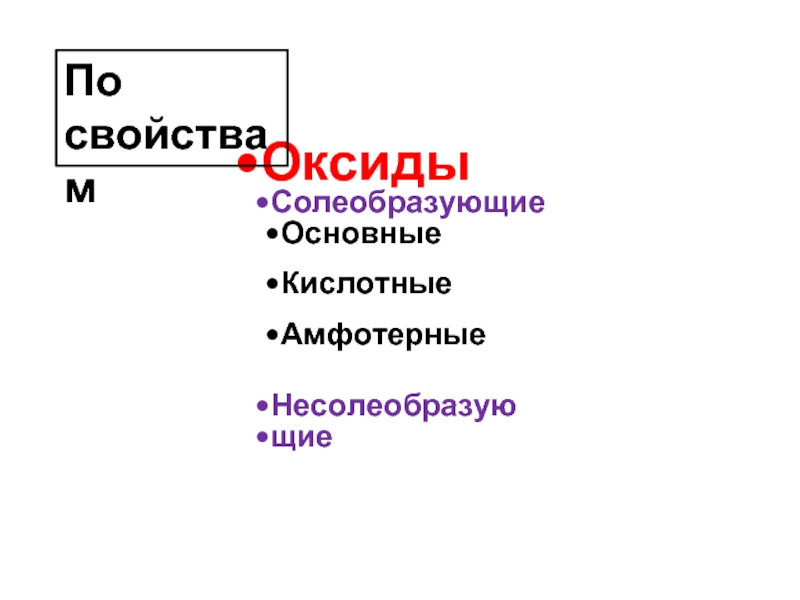
- 10. Сложные неорганические вещества Соли Основания Оксиды Кислоты
- 11. Оксиды - ЭмOn Это сложные
- 12. Оксиды Образованы металлами CaO, PbO
- 13. Оксиды Солеобразующие Основные Кислотные Амфотерные Несолеобразую щие По свойствам
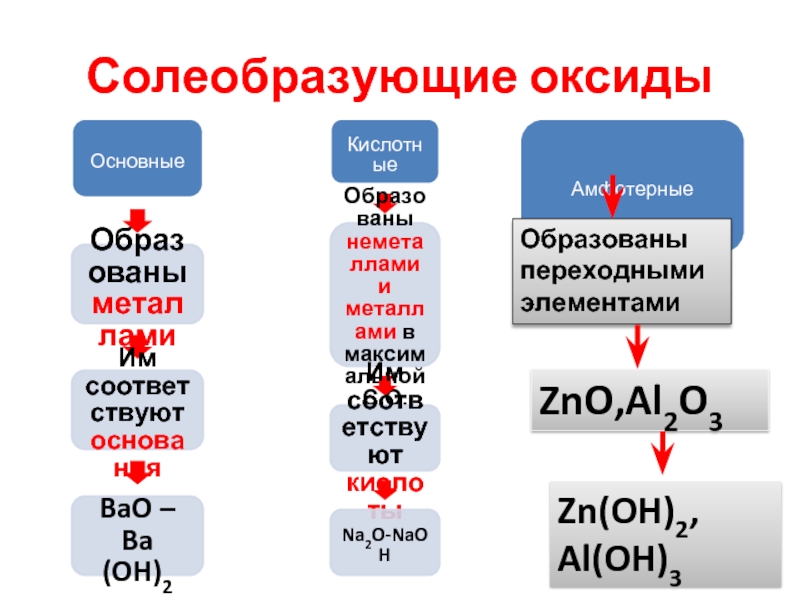
- 14. Солеобразующие оксиды Основные Образованы металлами
- 15. Несколько степеней окисления В названии оксида обязательно
- 16. Несолеобразующие оксиды (безразличные) СО – оксид углерода
- 17. Химическая связь и кристаллические решетки у оксидов
- 18. Демонстрация коллекций минералов и горных пород Кварц
- 19. В состав воздуха входят (оксиды): Оксид углерода
- 20. Применение оксидов H2O – важнейший минерал Земли
- 21. Основания- М+у(ОН)у где у – число
- 22. Классификация оснований по растворимости в воде Основания
- 23. Химическая связь и кристаллические решетки у оснований
- 24. Амфотерные основания- это сложные вещества, которые проявляют
- 25. Применение оснований NaOH- гидроксид натрия, «едкий натр»;
- 26. Применение оснований Al(OH)3- гидроксид алюминия, медицина –
- 27. Кислоты- НхАс где Ас – кислотный
- 28. По наличию кислорода в молекуле Кислоты
- 29. По количеству атомов водорода в молекуле
- 30. Химическая связь и кристаллические решетки у кислот
- 31. Использование кислот H2SO4 – серная кислота; производство
- 32. Использование кислот Н3РО4 – фосфорная кислота; производство
- 33. Соли это сложные вещества, состоящие из
- 34. Соли Средние Двойные Комплексные
- 35. Средние соли это продукты полного замещения атомов
- 36. Кислые соли это продукты неполного замещения атомов
- 37. Основные соли это продукты неполного замещения гидроксогрупп
- 38. Двойные и комплексные соли отличаются
- 39. Координационная теория А.Вернера Комплексные (координационные) соединения построены
- 40. Координационная теория А.Вернера Общее число лигандов, непосредственно
- 41. Координационная теория А.Вернера Наиболее характерны: Кч=2
- 42. Строение тетрагидроксоцинката натрия
- 43. Классификация комплексных солей Комплексные соли Катионные комплексы Анионные комплексы Нейтральные комплексы
- 44. Катионные комплексы [Cu(NH3)4]2+SO42- cульфат-тетраммин меди
- 45. Анионные комплексы Na2+[Zn(OH)4]2- тетрагидроксоцинкат натрия ион- комплексообразователь называем по латыни с суффиксом «ат»
- 46. Нейтральные комплексы Ион-комплексообразователь называем по-русски в именительном падеже: [Fe(CO)5] пента-карбонил-железо
- 47. Значение комплексных соединений в природе Огромное:
- 48. Химическая связь и кристаллические решетки у солей
- 49. Значение солей В повседневной жизни соли имеют
- 50. Значение солей минеральные удобрения: азотные NH4NO3- нитрат
Слайд 2
Классификация веществ
Вещества
Чистые вещества
Химические элементы
Химические соединения
Смеси веществ
Слайд 5Неорганические вещества
Простые
состоят из атомов одного химического элемента – Na, O2,N2,S.
металлы, неметаллы,
Сложные
состоят из атомов разных элементов, химически связанных друг с другом - NaOH
Слайд 6Классификация простых веществ
Все простые вещества на основании строения атомов, вида химической
Слайд 11
Оксиды - ЭмOn
Это сложные вещества, состоящие из двух химических элементов, один
Слайд 14Солеобразующие оксиды
Основные
Образованы металлами
Им соответствуют основания
BaO – Ba (OH)2
Кислотные
Образованы неметаллами и металлами
Им соответствуют кислоты
Na2O-NaOH
Амфотерные
Образованы переходными элементами
ZnO,Al2O3
Zn(OH)2,
Al(OH)3
Слайд 15Несколько степеней окисления
В названии оксида обязательно указывается С.О., если образующий элемент
+4-2
SO2 – оксид серы (IV)
+6-2
SO3 – оксид серы (VI)
Слайд 16Несолеобразующие оксиды
(безразличные)
СО – оксид углерода (II)
NO - оксид азота (II)
N2O -
Слайд 17Химическая связь и кристаллические решетки у оксидов
Оксиды, образованные:
металлами, имеют ионную
переходными металлами- ковалентную полярную ,
Кристаллические решетки могут быть ионными и атомными: BaO - ионная К.Р. Al2O3 – атомная К.Р. Минералы: корунд, сапфир, рубин.
3) неметаллами, имеют, ковалентную полярную связь, молекулярные (СО2, «сухой лед»), атомные (SiO2,(кварц, горный хрусталь, агат и т.д.)) К.Р.
Слайд 18Демонстрация коллекций минералов и горных пород
Кварц (SiO2)
Корунд (Al2O3)
Асбест (СаО . 3МgО
Тальк (3 MgO . 4SiO2.H2O)
Глина белая, красная; в состав входят оксиды: Al2O3. nH2O – белая; ,боксит Fe2O3 входит в состав красной глины.
Руды железа: Fe2O3 – красный железняк, Fe3O4 – магнитный железняк.
Слайд 19В состав воздуха входят (оксиды):
Оксид углерода (IV) - СО2
Вода - H2O
Вредные
Слайд 20Применение оксидов
H2O – важнейший минерал Земли участвует в круговороте веществ.
SiO2 -
Fe2O3, Fe3O4 – руды для производства чугуна и стали.
СО2 – углекислый газ, круговорот веществ в природе, фотосинтез.
Слайд 21Основания- М+у(ОН)у
где у – число гидроксогрупп, равное степени окисления металла
Основания- это сложные вещества, состоящие из атомов металла и одной или несколько гидроксогрупп (-ОН)
Слайд 22Классификация оснований по растворимости в воде
Основания
Хорошо растворимые в воде (щелочи)
KOH,
NaOH
Малорастворимые
Ca(OH)2,
Sr(OH)2
Нерастворимые в воде
Cu(OH)2,
Al(OH)3
Слайд 23Химическая связь и кристаллические решетки у оснований
Основания имеют ионную связь между
Кристаллическая решетка – ионная, твердая.
Слайд 24Амфотерные основания- это сложные вещества, которые проявляют и свойства кислот, и
нерастворимы в воде, им соответствуют амфотерные оксиды со С.О. +2, +3, +4
ZnO - Zn(OH)2 ↔ Н2ZnО2
Al2O3 - Al(OH)3 ↔ Н3AlО3
GeO2 – Ge(OH)4 ↔ Н4GeO4
Для них возможны ковалентные полярные связи и молекулярные кристаллические решетки.
Слайд 25Применение оснований
NaOH- гидроксид натрия, «едкий натр»; очистка нефтепродуктов, отбеливание бумаги, производство
Ca(OH)2 – гидроксид кальция, каменная известь; в смеси с песком- известковый раствор, побелка; производство сахарозы.
NH3.H2O (NH4OH)- гидрат аммиака (гидроксид аммония), нашатырный спирт – медицина, аммиачная вода- жидкое азотное удобрение.
Слайд 26Применение оснований
Al(OH)3- гидроксид алюминия, медицина – алмагель, препарат, обладающий обволакивающим адсорбирующим
AlCl3+3 NH4OH= Al(OH)3↓+3NH4Cl – получение в лаборатории
Fe(OH)3- гидроксид железа (III)- компонент желтого пигмента красок и эмалей, поглотительная масса для очистки природного газа; катализатор в органическом синтезе.
Слайд 27Кислоты- НхАс
где Ас – кислотный остаток (от англ. - acid-кислота),
Кислоты- это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Слайд 29По количеству атомов водорода в молекуле
Кислоты
Одноосновные
HCl, HNO3
Трёхосновные
Н3РО4
Двухосновные
H2S, H2SO4
Слайд 30Химическая связь и кристаллические решетки у кислот
Химическая связь между атомами в
Строение веществ – молекулярное.
Слайд 31Использование кислот
H2SO4 – серная кислота; производство минеральных удобрений, солей бескислородных кислот;
HNO3- азотная кислота; производство азотных удобрений, лекарственных препаратов; органический синтез; окислитель ракетного топлива.
Слайд 32Использование кислот
Н3РО4 – фосфорная кислота; производство удобрений;
HCl – соляная кислота; травление
Слайд 33Соли
это сложные вещества, состоящие из катионов металла ( иона аммония)
Слайд 35Средние соли
это продукты полного замещения атомов водорода в молекуле кислоты атомами
Н3РО4 → Na3PO4 Ba(OH)2- BaCl2
(NH4)3PO4
Слайд 36Кислые соли
это продукты неполного замещения атомов водорода в молекулах многоосновных кислот
Н3РО4 → NaH2PO4
Na2HPO4
Слайд 37Основные соли
это продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Fe(OH)3
Fe(OH)2Cl
Слайд 38Двойные и комплексные соли
отличаются друг от друга характером диссоциации
Двойные соли диссоциируют в одну ступень на катионы металлов и анионы кислотных остатков.
KAl(SO4)2↔K+ +Al3+ + 2 SO42-
Комплексные соли при диссоциации образуют сложные комплексные ионы, которые устойчивы в водных растворах.
[Cu(NH3)4]SO4↔ [Cu(NH3)4]2+ + SO4 2-
Слайд 39Координационная теория А.Вернера
Комплексные (координационные) соединения построены так: в центре находится атом
Лигандами могут быть анионы кислот, некоторые молекулы небольшого размера (H2O, NH3, CO)имеющие атомы с неподелёнными электронными парами.
Слайд 40Координационная теория А.Вернера
Общее число лигандов, непосредственно связанных с центральным атомом, называется
Ион- комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения, которую записывают в квадратные скобки.
Число лиганд соответствуют координационному числу иона-комплексообразователя.
[Cu(NH3)4]SO4
Слайд 41Координационная теория А.Вернера
Наиболее характерны:
Кч=2 (Cu+, Ag+, Au+)
Кч=4 (Cu2+, Au3+,Zn2+,Pb2+,Pt2+,Al3+)
Кч=6
Заряд внутренней сферы равен сумме зарядов иона- комплексообразователя и лиганд.
Ионы, не вошедшие во внутреннюю сферу, образуют внешнюю сферу.
Слайд 42Строение тетрагидроксоцинката натрия
внешняя сфера
Na2 [Zn(OH)4]
комплексообразователь лиганды
координационное число=4
Уравнение диссоциации:
Na2 [Zn(OH)4] →2Na++ [Zn(OH)4]2-
Слайд 43Классификация комплексных солей
Комплексные соли
Катионные комплексы
Анионные комплексы
Нейтральные комплексы
Слайд 44
Катионные комплексы
[Cu(NH3)4]2+SO42-
cульфат-тетраммин меди (II)
название составляется, начиная с аниона молекулы; ион-комплексообразователя назван
Слайд 45
Анионные комплексы
Na2+[Zn(OH)4]2-
тетрагидроксоцинкат натрия
ион- комплексообразователь называем по латыни с суффиксом «ат»
Слайд 46Нейтральные комплексы
Ион-комплексообразователь называем по-русски в именительном падеже:
[Fe(CO)5]
пента-карбонил-железо
Слайд 47Значение комплексных соединений в природе
Огромное: Хлорофилл- комплексное
соединение, ионом-комплексообразователем
является магний; хлорофилл
Гемоглобин- комплексное соединение, ионом
комплексообразователем является железо.
Гемоглобин отвечает за газообмен в клетке: снабжает
клетку кислородом и удаляет углекислый газ.
Витамин-В12 –комплексное соединение кобальта.
От комплексных соединений в живых организмах
зависит обмен веществ.
Слайд 48Химическая связь и кристаллические решетки у солей
В солях присутствует
Слайд 49Значение солей
В повседневной жизни соли имеют
огромное значение: в быту NaHCO3 -
гидрокарбонат
CaCO3 - карбонат кальция, мел, известняк,
мрамор;
стеарат Na,K –твердое и жидкое мыло;
KMnO4 - дезинфицирующее средство;
Слайд 50Значение солей
минеральные удобрения: азотные NH4NO3- нитрат аммония, калийные KCl – хлорид
В промышленности: соли катализаторы AlCl3, FeBr3.
Биологическое значение: соли NaCl, KCl, Na2HPO4,NaHPO4,NaHCO3,CaF2,Ca3(PO4)2.
Малахит (CuOH)2CO3- минерал.








































![Катионные комплексы [Cu(NH3)4]2+SO42-cульфат-тетраммин меди (II)название составляется, начиная с аниона молекулы; ион-комплексообразователя назван по-русски в](/img/tmb/3/242779/eab538e99b16fd06d3cfab5cb68f672d-800x.jpg)
![Анионные комплексы Na2+[Zn(OH)4]2-тетрагидроксоцинкат натрияион- комплексообразователь называем по латыни с суффиксом «ат»](/img/tmb/3/242779/3000ec723c975c2f670008228080c151-800x.jpg)
![Нейтральные комплексыИон-комплексообразователь называем по-русски в именительном падеже: [Fe(CO)5] пента-карбонил-железо](/img/tmb/3/242779/e1b338063830fd6623e8f8e514dadc95-800x.jpg)









