- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Разминка: определите вид химической связи HNO 3 Cl 2 KHSO 4 H2O H2O NaOH CaO Cu. презентация
Содержание
- 2. Разминка: определите вид химической связи HNO3 Cl2 KHSO4 H2O NaOH CaO Cu
- 3. NH3 +
- 4. Исследовательский урок химии
- 5. Цели урока: повторить виды химической связи сформировать
- 6. Решите задачу Молярная масса
- 8. Проблема 1 -Что
- 9. Лабораторный опыт 1). Внесите кристаллы исследуемого
- 10. Проблема 2 -Как может
- 11. N H3
- 13. А. Вернер Л.А.Чугаев
- 14. «Только с появлением теории Вернера
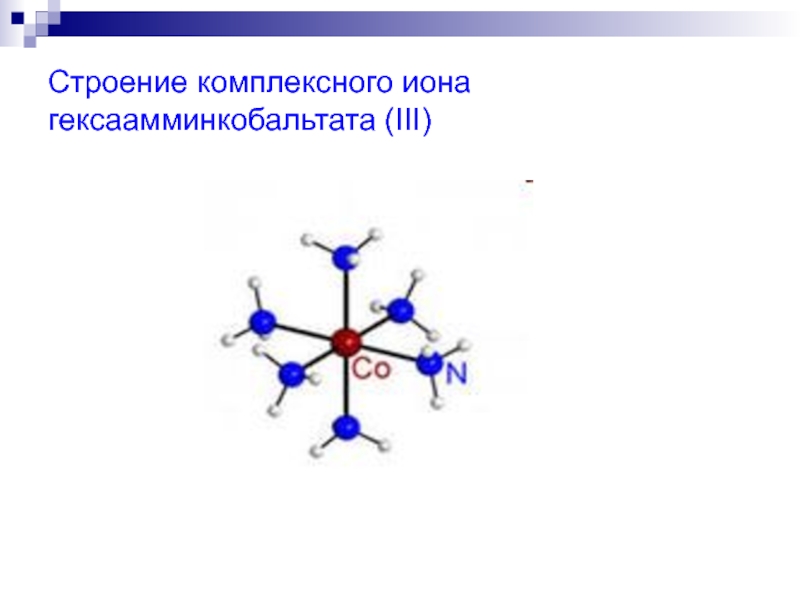
- 15. Строение комплексного иона гексаамминкобальтата (III)
- 16. Классификация. В зависимости от природы лиганда различают:
- 18. Упражнение в номенклатуре. 1. Назовите
- 19. Назовите исследуемое вещество.
- 20. Самостоятельная работа. Напишите формулы веществ:
- 21. I вариант
- 22. Задание на дом . §12 стр. 76-80,
Слайд 3
NH3 + HCl → [NH4]Cl
Донорно-акцепторный
+
_
..
Н ∙ + ∙ Н → Н : Н
Обменный механизм образования связи
Слайд 4Исследовательский урок химии
в 11 классе
Комплексные соединения.
Строение.
Классификация и номенклатура.
Слайд 5Цели урока:
повторить виды химической связи
сформировать понятие о составе и строении комплексных
познакомиться с основами координационной теории А. Вернера,
на примере комплексных соединений расширить понятие о многообразии веществ,
рассмотреть классификацию и номенклатуру комплексных соединений.
Слайд 6 Решите задачу
Молярная масса соединения равна 329 г/моль. Массовая
Слайд 9Лабораторный опыт
1). Внесите кристаллы исследуемого вещества в пламя спиртовки. Отметьте
2). Растворите вещество в воде и проделайте качественную реакцию на ион железа (III) с роданидом калия. Прокомментируйте наблюдения.
3). Сделайте вывод о составе данного вещества.
Слайд 10 Проблема 2
-Как может быть построен ион, содержащий железо?
К3[Fe (CN)6 ] – комплексное соединение
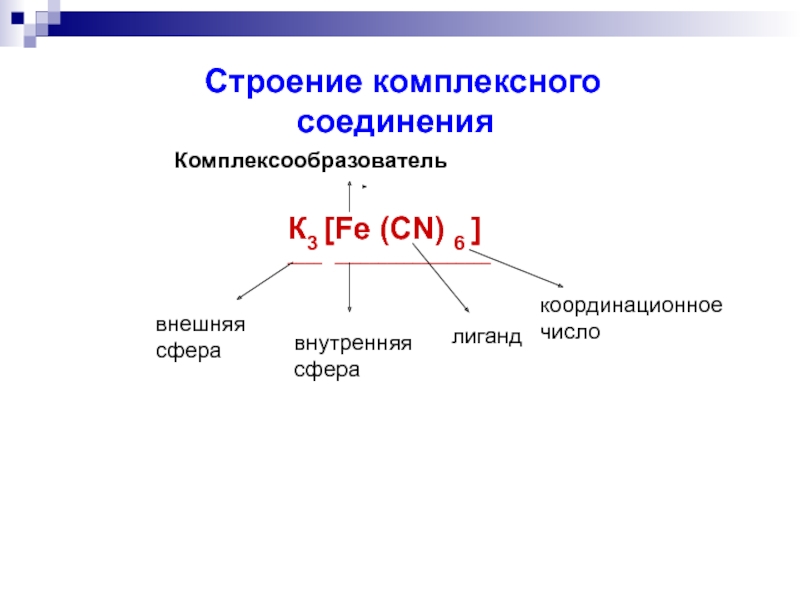
Слайд 12 Строение комплексного
Комплексообразователь
К3 [Fe (CN) 6 ]
____ __________________
внешняя
сфера
внутренняя сфера
лиганд
координационное число
Слайд 14 «Только с появлением теории Вернера химия комплексных соединений утратила
Л.Чугаев.
Слайд 16Классификация.
В зависимости от природы лиганда различают:
аквакомплексы
аммиакаты [ Сu (NН3)4] SО4;
гидроксокомплексы К2[Zn (ОН)4];
ацидокомплексы К4 [Fe (CN) 6 ].
Слайд 17 Номенклатура
Н2О –
NН3 – «аммин-»
Сl- – «хлоро-»
NО2- – «нитро-»
СN- – «циано-»
ОН - – «гидроксо-»
SО42- – «сульфато-»
СО - «карбонил»
Слайд 18Упражнение в номенклатуре.
1. Назовите вещества:
- тетрагидроксоалюминат натрия
- перхлорат хлоронитротетраамминкобальта (III)
- сульфат тетраамминмеди (II)
2. Напишите формулы
Хлорид гексааквахрома (III)
Тетрагидроксоцинкат (II) калия
[Сr+3(Н2О)6] Сl3
-
К2+[Zn+2(ОН)-4]
Nа+[Аl+3(ОН-)4]
[ Со+3(NН30)4 (NО2-)Сl-]СlО4-
[ Сu+2(NН30)4] SО4-2
Слайд 20Самостоятельная работа.
Напишите формулы веществ:
Тетрагидроксокупрата (II) натрия
Гексанитрокобальтата (III) калия
2. Назовите вещества:
[ Рt(NН3)3Сl]Сl К[ Рt(NН3)Сl3]
Слайд 21I вариант
1. Тетрагидроксокупрат (II) натрия
Гексанитрокобальтат (III) калия
2. [ Рt(NН3)3Сl]Сl
К[ Рt(NН3)Сl3]
Na2 [ Cu (OH)4]
K3 [ Co (NO2)6]
Хлорид хлоротриамминплатины (II)
Трихлороамминплатинат (II) калия


![NH3 + HCl → [NH4]ClДонорно-акцепторный механизм образования связи+_..Н ∙ + ∙ Н](/img/tmb/3/295341/53a880b2e4ca208afb4a15da74fae028-800x.jpg)







![N H3 + H Cl → [NH4] Cl+_..+_Ион аммония – комплексный ион](/img/tmb/3/295341/c257974911938a9947b317561bbb5228-800x.jpg)


![Классификация.В зависимости от природы лиганда различают:аквакомплексы [Сr (Н2О)6] Сl3;аммиакаты](/img/tmb/3/295341/ff02552c35632923bfb2649318300a07-800x.jpg)


![Назовите исследуемое вещество.К3[Fe (CN) 6 ]](/img/tmb/3/295341/0da874b063ed8c779e5a14f6ffc083d8-800x.jpg)








