- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Предельные углеводороды.(Алканы) презентация
Содержание
- 1. Предельные углеводороды.(Алканы)
- 2. Предельные углеводороды (Алканы) Соотношение атомов в молекуле
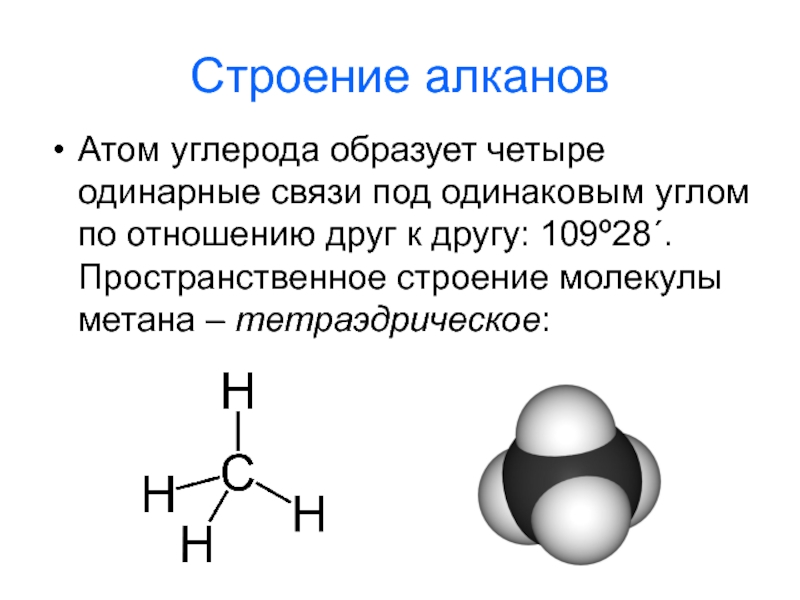
- 3. Строение алканов Атом углерода образует четыре одинарные
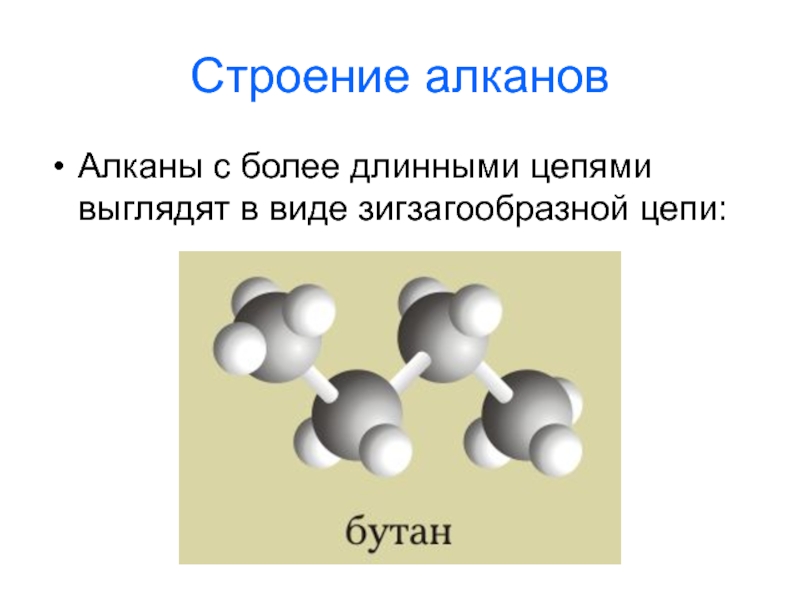
- 4. Строение алканов Алканы с более длинными цепями выглядят в виде зигзагообразной цепи:
- 5. Гомологический ряд алканов Первым членом гомологического ряда
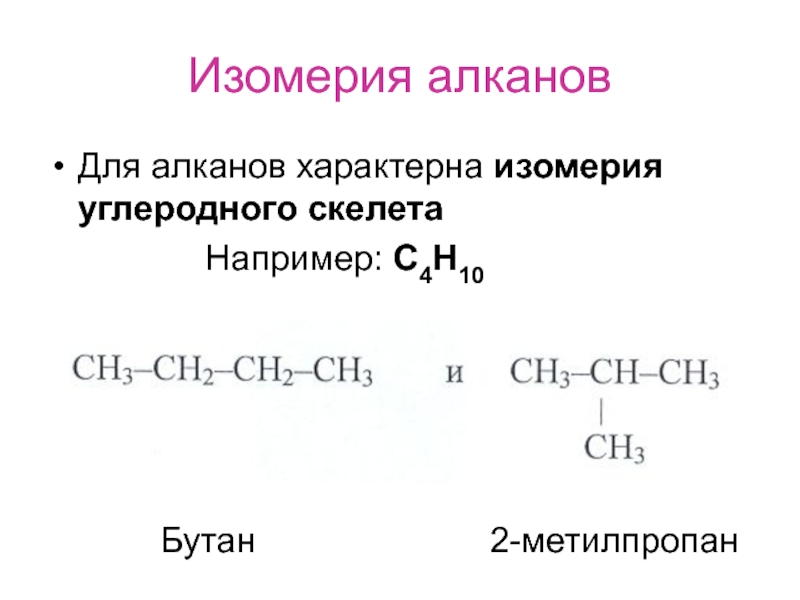
- 6. Изомерия алканов Для алканов характерна изомерия углеродного
- 7. Номенклатура разветвлённых алканов Пронумеровать наиболее длинную
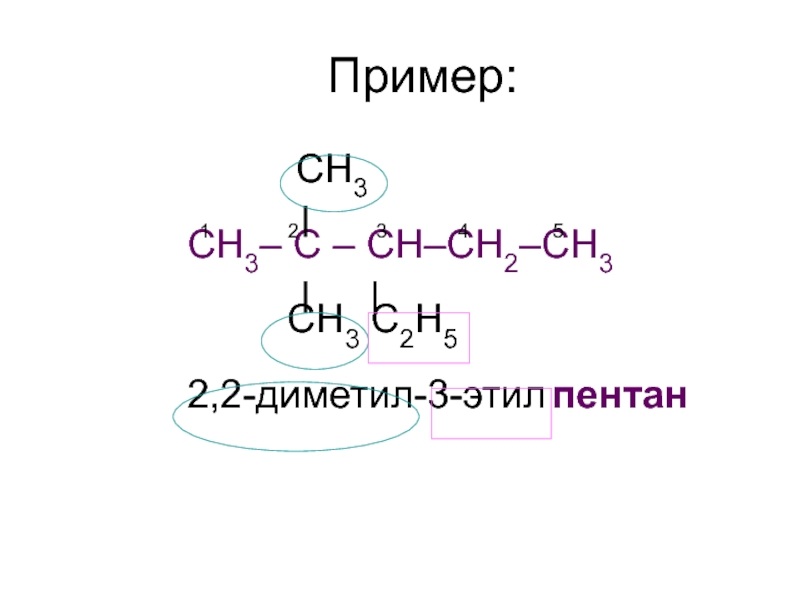
- 8. Пример:
- 9. Физические свойства алканов Метан, этан, пропан, бутан
- 10. Химические свойства алканов Алканы горят:
- 11. Химические свойства алканов При нагревании без доступа
- 12. Химические свойства алканов Разложение алканов может быть
- 13. Химические свойства алканов Алканы НЕ вступают в реакции присоединения и НЕ окисляются перманганатом калия.
- 14. Химические свойства алканов Алканы вступают в реакции
- 15. Получение алканов
- 16. Применение алканов Горючее; Сырьё для получения сажи
Слайд 2Предельные углеводороды
(Алканы)
Соотношение атомов в молекуле предельных углеводородов записывают в виде общей
СnH2n+2
где n – количество атомов углерода.
Слайд 3Строение алканов
Атом углерода образует четыре одинарные связи под одинаковым углом по
Слайд 5Гомологический ряд алканов
Первым членом гомологического ряда алканов является метан - СН4.
Молекулы алканов при содержании четырёх или более атомов углерода могут иметь неразветвлённое и разветвлённое строение.
Слайд 6Изомерия алканов
Для алканов характерна изомерия углеродного скелета
Бутан
2-метилпропан
Слайд 7Номенклатура
разветвлённых алканов
Пронумеровать наиболее длинную углеводородную цепь (нумерацию начинать с того
Цифрой указать номера углеродных атомов, у которых находятся заместители;
Назвать эти заместители;
Назвать углеводород, который взят за основу (пронумерован) с окончанием –ан для алканов;
Если в формуле несколько одинаковых заместителей, то перед их названием указывают число прописью (ди-, три-, тетра-), а номера заместителей разделяют запятыми.
Слайд 9Физические свойства алканов
Метан, этан, пропан, бутан – газы; последующие (до С15Н32)
В воде практически не растворяются;
Электрический ток не проводят.
Слайд 10Химические свойства алканов
Алканы горят:
СН4 + 2О2 →
С3Н8 + 5О2 → 3СО2 + 4Н2О
Смесь метана с воздухом взрывоопасна!
Слайд 11Химические свойства алканов
При нагревании без доступа воздуха алканы разлагаются:
С2Н6 → 2С + 3Н2
t
t
Слайд 12Химические свойства алканов
Разложение алканов может быть неполным:
СН3–СН3 → СН2=СН2 + Н2
Это реакции дегидрирования.
t, Ni
t, Ni
Слайд 13Химические свойства алканов
Алканы НЕ вступают в реакции присоединения и НЕ окисляются
Слайд 14Химические свойства алканов
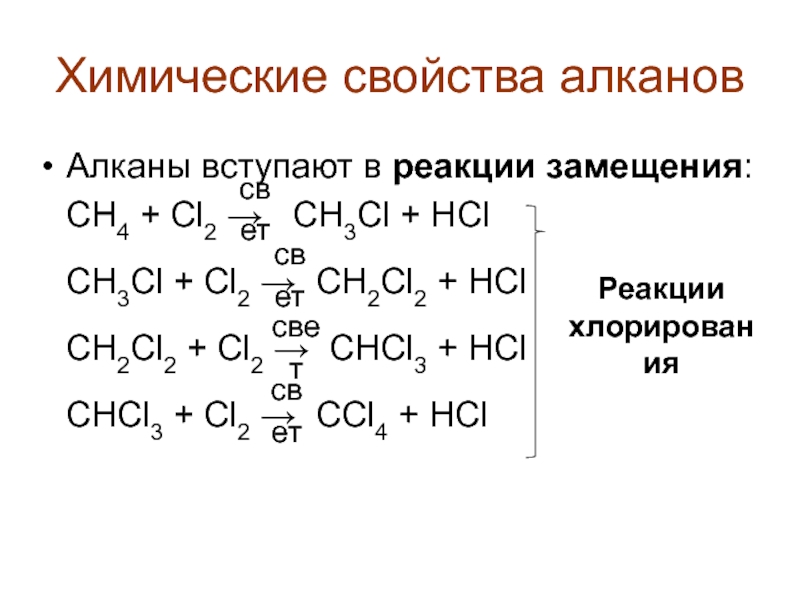
Алканы вступают в реакции замещения:
СН4 + Cl2
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
Реакции
хлорирования
свет
свет
свет
свет
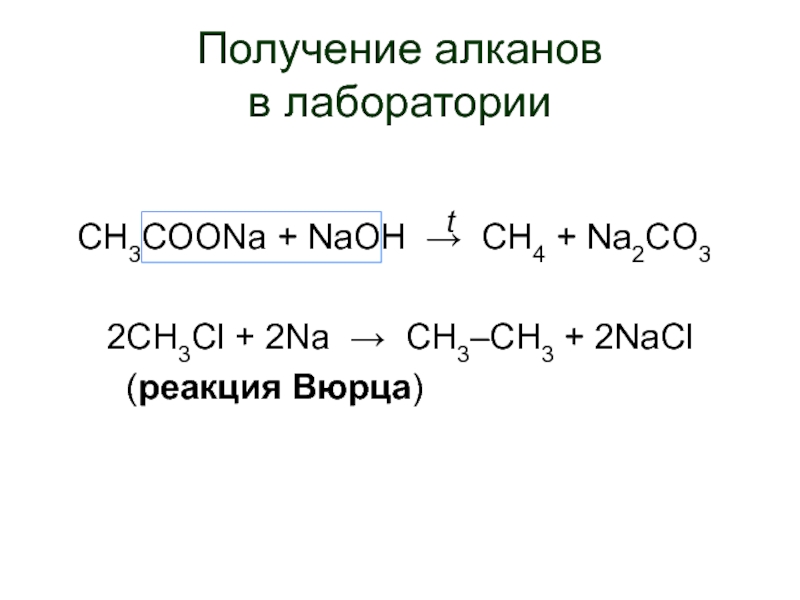
Слайд 15Получение алканов
СН3СООNa + NaOH → CH4 + Na2CO3
2CH3Cl + 2Na → CH3–CH3 + 2NaCl
(реакция Вюрца)
t