- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обобщающий урок по темеОсновные классы неорганических соединений презентация
Содержание
- 1. Обобщающий урок по темеОсновные классы неорганических соединений
- 2. Цель: Обобщить и систематизировать знания учащихся о
- 3. Загадка 1. Два элемента в них всего- Кислород важней всего.
- 4. 1. Известно ли вам, дети, какие есть
- 5. Оксид 10 баллов. Найти оксиды и распределить
- 6. Оксид 20 баллов. Вопрос: Соотнесите название и
- 7. Оксид 30 баллов. Вопрос: кварцевый песок, кремнезём,
- 8. Загадка 2. Группы атомов о-аш -
- 9. Основание 10 баллов Найти основания и распределите
- 10. Основание 20 баллов. «Третий лишний». Найдите лишнее
- 11. Основание Практическое задание (30 баллов) Изучим свойства
- 12. Физминутка
- 13. Загадка 3. Водород в состав их
- 14. Кислота 10 баллов. Найти основания и распределите
- 15. Кислота 20 баллов. Вопрос: соотнесите формулу кислоты
- 16. Кислота Записать уравнения реакции.(30 баллов) Кислота, кроме
- 17. Загадка 4. Металл и кислотный
- 18. Соль 10 баллов. Найти основания и распределите
- 19. Соль 20 баллов. Вопрос: Найдите потерявшихся родственников:
- 20. Соль 30 баллов. Реши задачу: При взаимодействии
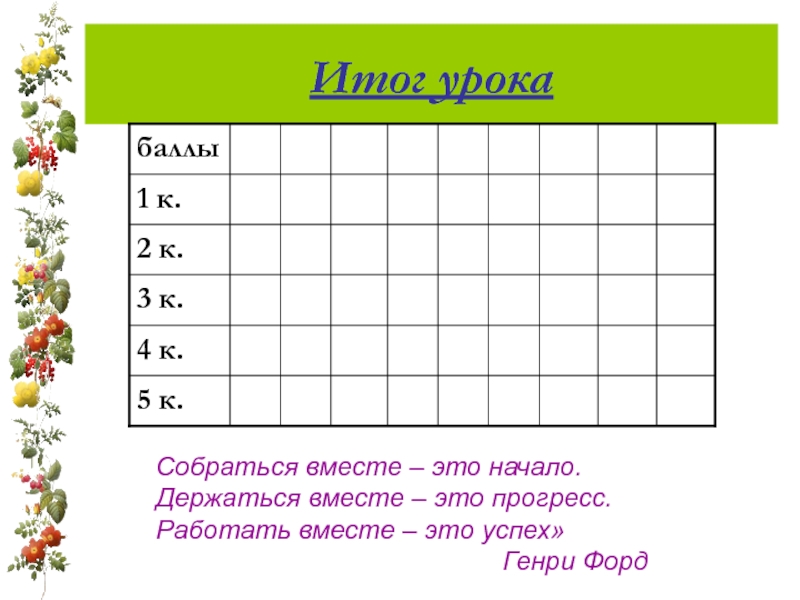
- 21. Итог урока Собраться вместе – это начало.
- 22. Домашние задание: повторить тему: «Основные
- 23. Рефлексия Понравился ли вам урок?
- 24. Ну что ж? Закончился
- 25. СПАСИБО!
Слайд 1Обобщающий урок по теме
«Основные классы неорганических соединений»
Учитель химии МОУ ССОШ Жигачева
Слайд 2Цель: Обобщить и систематизировать знания учащихся о составе, строении и свойствах
Задачи:
Обучающие:
закрепить знания учащихся о классификации основных классов неорганических соединений и умения давать названия веществам.
Развивающие:
развивать “химическую” зоркость уч-ся, находить логические связи между названием вещества и его химической формулой.
Воспитательные:
воспитывать у учащихся чувство взаимопомощи, умения работать в коллективе.
Здоровьесберегающие:
соблюдать правила техники безопасности на уроке при проведении эксперимента; добиваться оптимальной работоспособности в течение всего урока, за счет смены видов деятельности; создавать благоприятный психологический климат на уроке.
Слайд 41. Известно ли вам, дети, какие есть оксиды на планете? У
то кислоты им нравятся праздные, то к воде их душа склоняется — скажите, как они называются?
2. А эти спешат к основаниям, растворимые, очень желанные, но с водой дружбу водят не все, ж, поверь.
Назовите оксиды теперь.
3. Бывает двойственный оксид, он, позабыв и честь, и стыд, то к сильной кислоте спешит, то где-то щелочь сторожит, и тем и другим поклоняется. Как такой оксид называется?
Слайд 5Оксид
10 баллов. Найти оксиды и распределить их по группам. Дать названия.
А1(0Н)3,
Слайд 6Оксид
20 баллов. Вопрос: Соотнесите название и степень окисления атома химического элемента
Слайд 7Оксид
30 баллов. Вопрос: кварцевый песок, кремнезём, горный хрусталь, агат, опал, яшма,
Слайд 8Загадка 2.
Группы атомов о-аш -
«Фенолфталеиновый» в нас
Становится малиновым.
Слайд 9Основание
10 баллов Найти основания и распределите их по группам. Дать названия.
А1(0Н)3,
Слайд 10Основание
20 баллов. «Третий лишний». Найдите лишнее в каждом ряду.
1)LiOH, Cu(OH)2, Ba(OH)2
2) Fe(OH)3, Zn(OH)2, NaOH
3) Al(OH)3, Fe(OH)3, KOH.
Объясните результаты
Слайд 11Основание
Практическое задание (30 баллов)
Изучим свойства оснований поскорей. Начнем эксперимент со щелочей.
Провести реакцию нейтрализации едкого натрия с серной кислотой и записать уравнение реакции в тетрадях.
А если с солью щелочь взять, получатся другая соль и основание опять.
Теперь возьмем оксид кислотный
И растворимый гидроксид,
И под водой на дне стакана —
Очередная соль лежит.
Выполнить эксперимент. Получить углекислый газ и пропустить через него раствор гидроксида кальция. Взять любой нерастворимый гидроксид, который с кислотой любезничать спешит, а в результате — соль с водою.
Слайд 13Загадка 3.
Водород в состав их входит,
Они кислые на вкус Их ……………. зовут.
Слайд 14Кислота
10 баллов. Найти основания и распределите их на группы. Дать названия.
А1(0Н)3,
Слайд 15Кислота
20 баллов. Вопрос: соотнесите формулу кислоты 1) H2SO4, 2) HNO3, 3)
Слайд 16Кислота
Записать уравнения реакции.(30 баллов)
Кислота, кроме азотной,
И металл до водорода,
Образуют
И, конечно, водород.
Кислота и основание
Образуют соль и воду.
Именно вот это свойство
Взяли все кислоты в моду.
В кислоту внесешь оксид ты
Настоящего металла,
Без сомненья, соль и воду
Ты получишь, если надо.
Слайд 18Соль
10 баллов. Найти основания и распределите их на группы. Дать названия.
А1(0Н)3,
Слайд 19Соль
20 баллов. Вопрос: Найдите потерявшихся родственников: KNO3, MnCl2, Ca3(PO4)2, AlCl3, CaCO3,
Слайд 20Соль
30 баллов. Реши задачу:
При взаимодействии 5г оксида кальция с оксидом углерода
Слайд 21Итог урока
Собраться вместе – это начало.
Держаться вместе – это прогресс.
Слайд 22Домашние задание:
повторить тему:
«Основные классы неорганических веществ».
Письменно:
из перечисленных
превращений и запишите уравнения реакций.
1 вариант. Na, BaSО4, SO2, Ba, КCI, PbO, ZnSO4,
Ba(OH)2, CO2, BaO.
2 вариант. NaNO3, P 2O5, PbCI2, H 2SO4, K 3PO4,
CuO, H 3PO4, Fe, CaO, P.
Слайд 23Рефлексия
Понравился ли вам урок?
Какие трудности вы испытали?
Каковы ваши
Поднимите руки, если вы с этим утверждением согласны:
1-мне было комфортно на уроке;
2-я получил ответы на все интересующие меня вопросы
Слайд 24
Ну что ж? Закончился урок.
Пускай пойдёт он нам всем впрок.
Посев научный
Всегда взойдёт для жатвы всенародной.