- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислоты презентация
Содержание
- 1. Кислоты
- 2. Кислоты вокруг нас Состав кислот Свойства важнейших
- 3. Яблочная кислота – в яблоках и ревене В природе существует множество различных кислот
- 4. Лимонная кислота – в лимонах
- 5. Кислый вкус листьев щавеля, шпината и томатов обусловлен щавелевой кислотой
- 6. Молочная кислота – в мышцах
- 7. Уксусная кислота – в уксусе
- 8. Винная кислота – в винограде
- 9. Муравьиная кислота – в яде муравьев и пчел
- 10. Кроме природных кислот, существуют и такие, которые
- 11. Твердые кислоты: лимонная кислота, пальмитиновая кислота, борная кислота и другие.
- 12. Кислоты – это сложные вещества, в состав
- 13. Хлороводородная (соляная) кислота HCl – бесцветная жидкость.
- 14. Химическая формула серной кислоты – H2SO4. Плотность
- 15. Концентрированная серная кислота разрушает ткани,
- 16. …обугливает бумагу,
- 17. …обугливает сахар.
- 18. При смешивании концентрированной серной кислоты с
- 19. При разбавлении концентрированной серной кислоты всегда соблюдайте
- 20. Хлороводородная кислота – едкое вещество, она повреждает
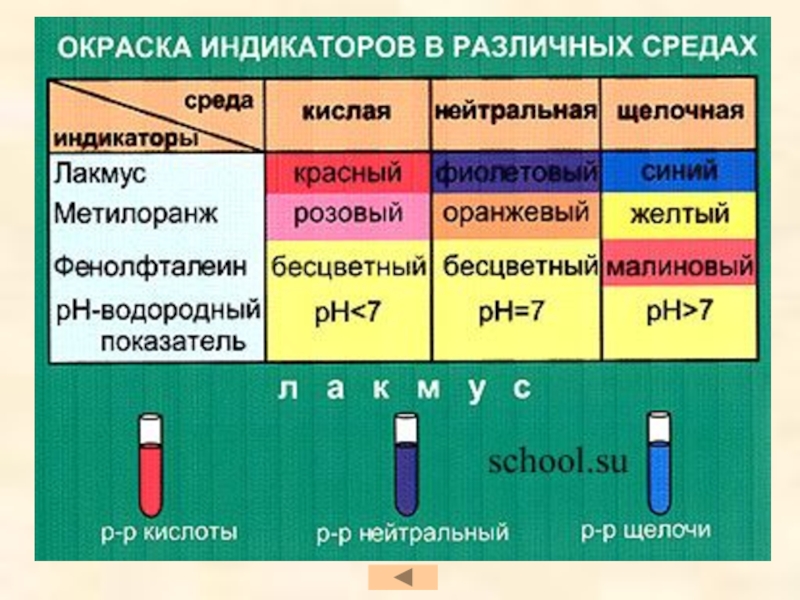
- 21. Химические свойства кислот Изменение окраски индикаторов
- 23. Металлы имеют разную реакционную активность,
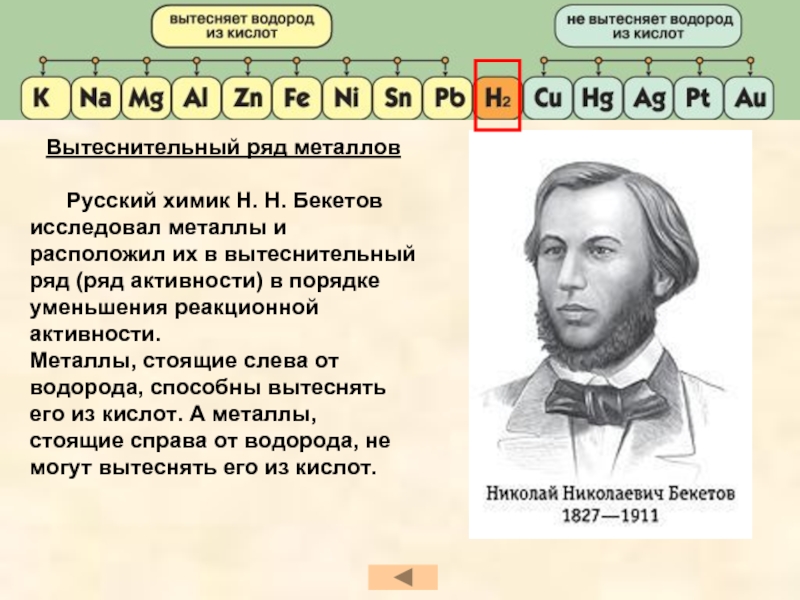
- 24. Вытеснительный ряд металлов
- 25. При взаимодействии кислот с оксидами металлов (основными
- 26. При взаимодействии кислот с основаниями образуется соль
- 28. Основные способы получения кислот: 1-
- 29. Применение кислот разнообразно –химическая и пищевая промышленность, лабораторные и медицинские исследования, получение энергии (аккумуляторы).
- 30. Кислоты в вашей аптечке В
- 35. Кислотные дожди
- 40. Кислоты попадают на землю вместе с дождем,
- 41. Кислотная среда ускоряет рост грибков и бактерий,
- 43. Кислотные дожди также разрушают здания, памятники и металлические конструкции.
- 46. Кислотные дожди воздействуют на пигменты, входящие в состав красок
Слайд 2Кислоты вокруг нас
Состав кислот
Свойства важнейших кислот
Химические свойства кислот
Способы получения
Применение кислот
Экологические проблемы
Слайд 10Кроме природных кислот, существуют и такие, которые получают промышленным путем для
Кислоты могут быть как в жидком, так и в твердом агрегатном состоянии.
Жидкие кислоты:
серная кислота
азотная кислота
хлороводородная (соляная) кислота…
Слайд 12Кислоты – это сложные вещества, в состав которых входят атомы водорода,
Кислоты можно разделить на кислородсодержащие (например, серная и угольная кислоты) и бескислородные (например, хлороводородная и сероводородная кислоты).
Кислотный остаток представляет собой атом неметалла (в бескислородных кислотах) или группу атомов неметалла и кислорода (в кислородсодержащих кислотах), входящую в состав молекулы кислоты помимо водорода.
Валентность кислотного остатка равна числу атомов водорода в молекуле данной кислоты.
Кислоты – едкие вещества, и обращаться с ними следует с особой осторожностью!
Слайд 13Хлороводородная (соляная) кислота HCl – бесцветная жидкость. Она имеет запах хлороводорода.
Слайд 14Химическая формула серной кислоты – H2SO4.
Плотность серной кислоты – 1,84 г
Концентрированная серная кислота – это бесцветная маслянистая жидкость, без запаха, примерно в два раза тяжелее воды.
Слайд 18 При смешивании концентрированной серной кислоты с водой выделяется большое количество
Слайд 19При разбавлении концентрированной серной кислоты всегда соблюдайте следующее правило: нужно добавлять
Слайд 20Хлороводородная кислота – едкое вещество, она повреждает ткань, бумагу и древесину.
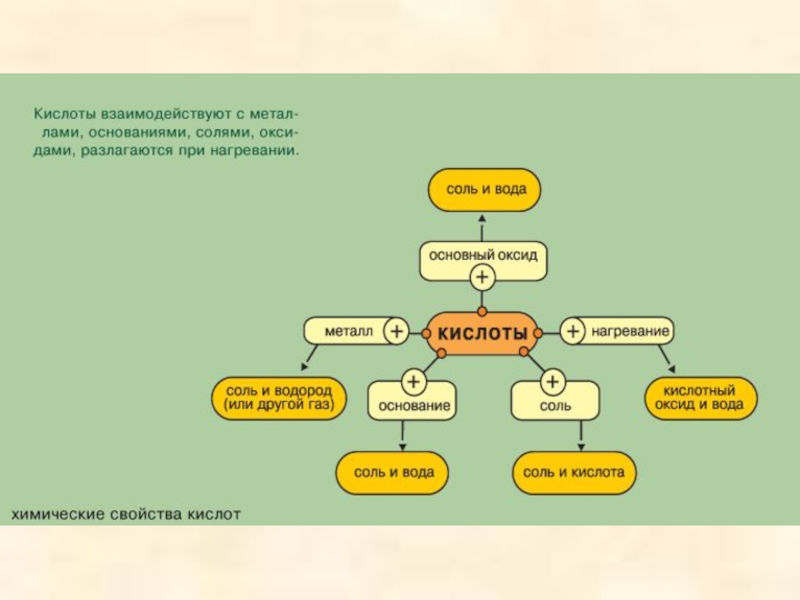
Слайд 21Химические свойства кислот
Изменение окраски индикаторов
Взаимодействие с металлами
Взаимодействие с основными оксидами
Взаимодействие с
Взаимодействие с солями
Слайд 23 Металлы имеют разную реакционную активность, поэтому в присутствии кислот
Кислоты взаимодействуют с металлами, стоящими в вытеснительном ряду до водорода. При этом образуются соль и водород.
Zn + 2HCl = ZnCl2 + H2↑
Слайд 24Вытеснительный ряд металлов
Русский химик Н. Н. Бекетов исследовал
Металлы, стоящие слева от водорода, способны вытеснять его из кислот. А металлы, стоящие справа от водорода, не могут вытеснять его из кислот.
Слайд 25При взаимодействии кислот с оксидами металлов (основными и амфотерными оксидами) образуются
Химическая реакция между двумя сложными веществами, при которой они обмениваются составными частями, называется реакцией обмена. Взаимодействие кислот с оксидами металлов является реакцией обмена.
3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O
Слайд 26При взаимодействии кислот с основаниями образуется
соль и вода. Реакция нейтрализации.
H2SO4 +
При взаимодействии кислот с солями образуется новая
соль и новая кислота.
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
Некоторые кислоты обладают специфическими свойствами. Например, при действии азотной кислоты на металл водород не выделяется. Кремниевая кислота в воде нерастворима, угольная кислота очень неустойчива и распадается на углекислый газ и воду.
Слайд 28Основные способы получения кислот:
1- Кислородсодержащие кислоты могут быть получены реакцией соответствующих
N2O5 + H2O = 2HNO3
SO3 + H2O = H2SO4
SO2 + H2O = H2SO3
P2O5 + 3H2O = 2H3PO4
2- Взаимодействие сильных кислот - окислителей с неметаллами:
ЗР + 5HN03(конц) + 2H2O = 3H3PO4 + 5NO
3- Реакции солей слабых кислот с более сильными кислотами, чем получаемая:
CaCO3 + 2HCl = CaCl2 + H2CO3 (CO2↑ + H2O)
4- Получение напрямую из простых веществ:
H2 + Cl2 = 2НСI
Слайд 29Применение кислот разнообразно –химическая и пищевая промышленность, лабораторные и медицинские исследования,
Слайд 30Кислоты в вашей аптечке
В своей домашней аптечке вы также можете найти
Борная кислота H3BO3 – может быть использована в компрессах
благодаря своим антисептическим и противовоспалительным
действиям.
Ацетилсалициловая кислота (аспирин) – это жаропонижающее, противовоспалительное и обезболивающее средство.
Аскорбиновая кислота, или витамин С, – содержится в цитрусовых, боярышнике, шпинате, картофеле, сладком перце, томатах и некоторых других овощах. Недостаток аскорбиновой кислоты приводит к снижению сопротивляемости организма и в особенно тяжёлых случаях вызывает заболевание, называемое цингой.
Салициловая кислота – компонент смеси, состоящей из 2% салициловой кислоты, 28% воды и 70% спирта. Эта смесь обладает антисептическим действием и используется для дезинфекции.