- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Важнейшие классы неорганических соединений. презентация
Содержание
- 1. Важнейшие классы неорганических соединений.
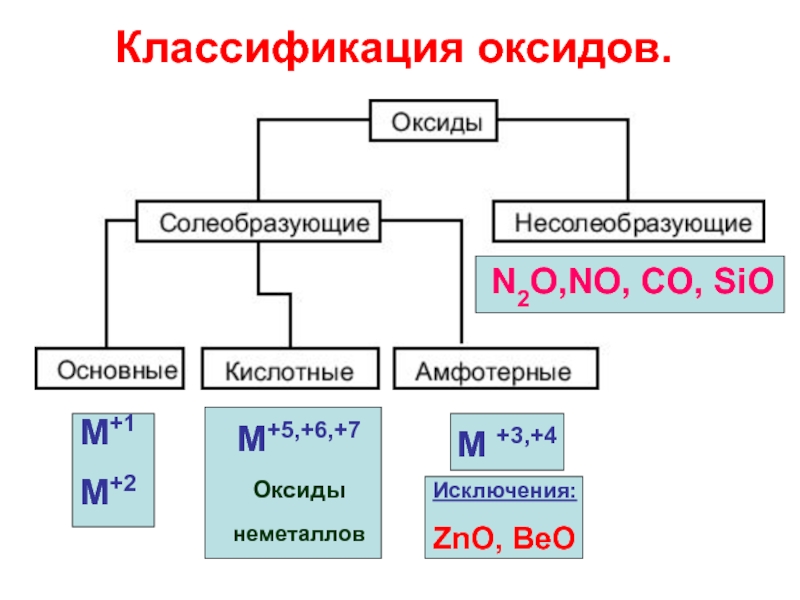
- 2. Оксиды
- 3. Оксиды – это сложные вещества, состоящие из
- 4. Классификация оксидов. М+1
- 6. Важнейшие оксиды: – самое распространенное и самое
- 7. Жизнь и вода неразделимы. Вода определяет
- 8. В сутки человек должен потреблять около 3
- 9. При колоссальном количестве воды на Земле многие
- 10. К воде нужно относиться бережно, не расходовать
- 11. Важнейшие оксиды: Дыхание – один из процессов,
- 12. При большом содержании в воздухе углекислый газ
- 13. Большой тыквенный лист в течение дня на
- 14. Углекислый газ мало растворим в воде.
- 15. В результате возникает и усиливается так называемый «парниковый эффект».
- 16. Люди научились использовать углекислый газ. Им
- 17. Углекислый газ в сжатом состоянии хранят в
- 18. SiO2 Важнейшие оксиды: Основу земной коры
- 19. Диоксид кремния содержат некоторых растения: (диатомовые
- 20. Диоксид кремния – замечательный «строитель». Из
- 21. Какие вещества называются оксидами? Из приведенного перечня
- 22. 2. Рассчитайте массовые доли элементов в оксидах,
- 23. 3. Оксид некоторого элемента имеет формулу Э2О3,
- 24. 4. Установите формулу оксида лития, если известно, что массовая доля лития в нем равна 46,7%.
- 25. Основания
- 26. Основания – это сложные вещества, состоящие из катиона металла и одного или нескольких гидроксид-анионов (О-2Н+1)-
- 27. Основания Однокислотные Двухкислотные Трёхкислотные Основания
- 28. Важнейшие щёлочи. Впервые химики познакомились с этим
- 29. Беспощадно гидроксид натрия относится к тканям, бумаге,
- 31. Гидроксид натрия применяется для очистки нефти и
- 32. Важнейшие щёлочи. Это едкое вещество, которое вызывает
- 33. Важнейшие щёлочи. Белый рыхлый порошок, из-за чего
- 35. Гидроксид кальция применяется в строительстве для приготовления
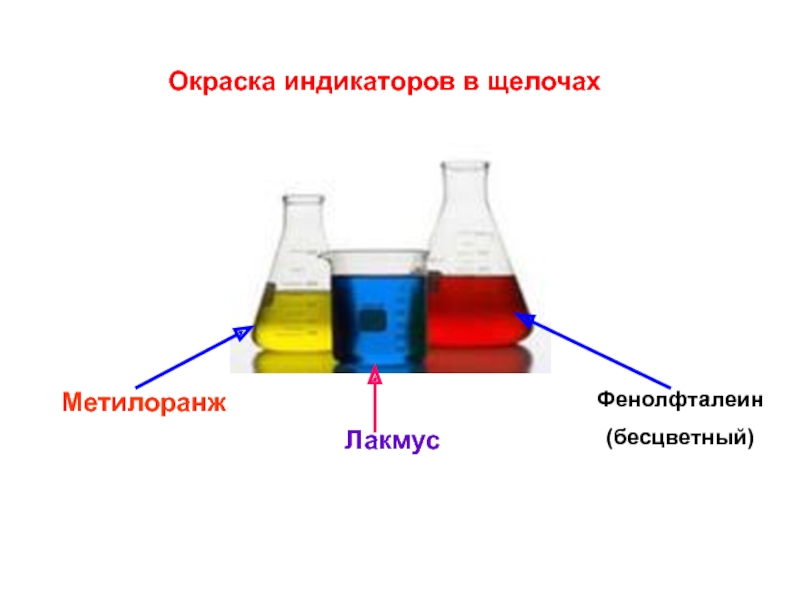
- 36. Окраска индикаторов в щелочах Метилоранж Лакмус Фенолфталеин (бесцветный)
- 37. Какие вещества называются основаниями? Из приведенного перечня
- 38. 2. Массовая доля металла в основании М(ОН)2 равна 80,1%. Определите, что это за металл.
- 39. 3. В двух пробирках находятся раствор гидроксида
- 40. 4. Найдите количество вещества, содержащееся в 390
- 41. 5. За счет каких типов связей образовано
- 42. Что общего между?
- 43. Кислоты
- 44. Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
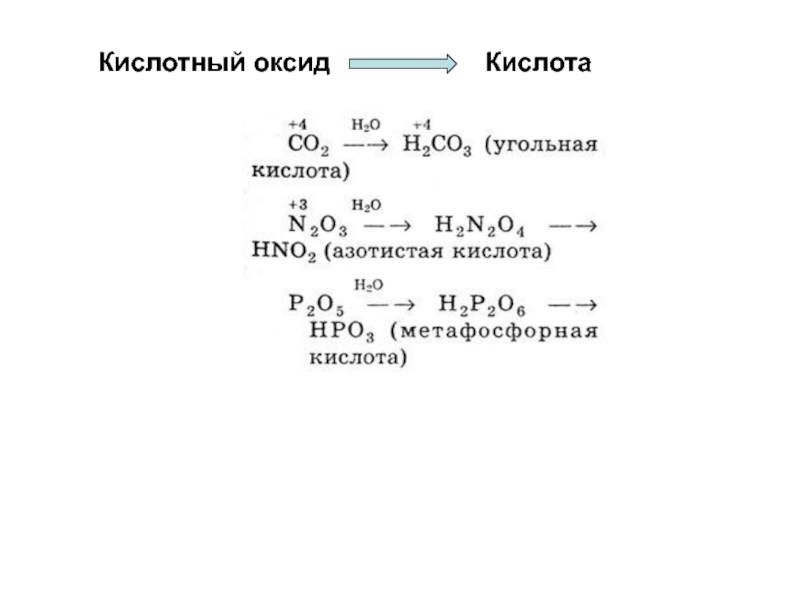
- 46. Кислотный оксид Кислота
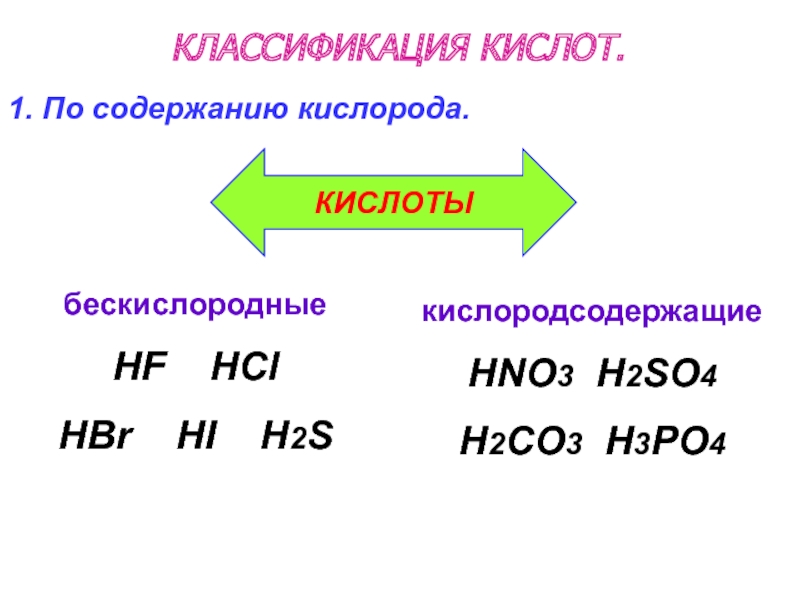
- 47. КЛАССИФИКАЦИЯ КИСЛОТ. бескислородные
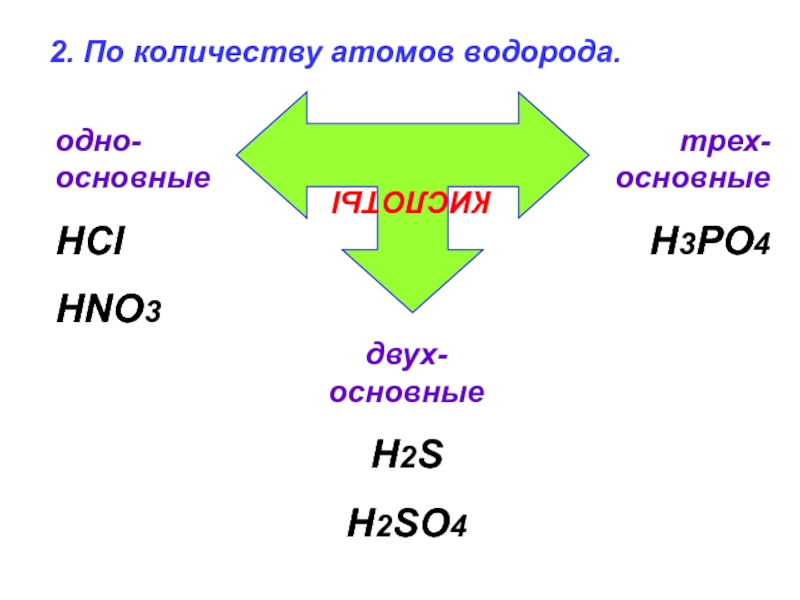
- 48. 2. По количеству атомов водорода. КИСЛОТЫ одно-основные HCl HNO3 двух-основные H2S H2SO4 трех-основные H3PO4
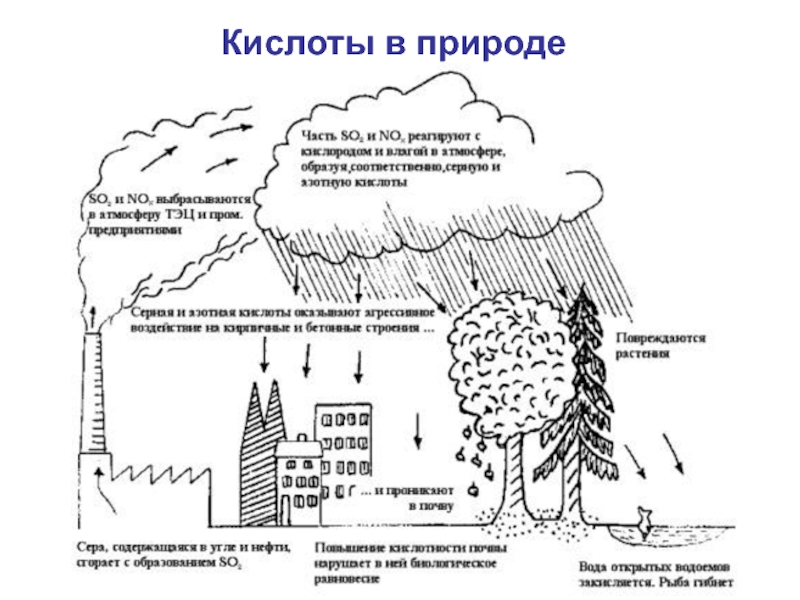
- 49. Кислоты в природе
- 50. Желудочный сок человека и животных представляет собой,
- 51. Важнейшие кислоты: Алхимики впервые получили серную кислоту
- 52. Попадание кислоты на кожу вызывает сильные химические
- 53. Серная кислота прекрасно растворяется в воде,
- 54. Серную кислоту применяют для получения солей, красителей,
- 55. Важнейшие кислоты: Алхимики заметили, что при прокаливании
- 56. Растворимость газообразного хлороводорода в воде ограничена, поэтому
- 57. Соляную кислоту используют для получения ее солей,
- 58. Важнейшие кислоты: Тоже имеет «алхимические корни».
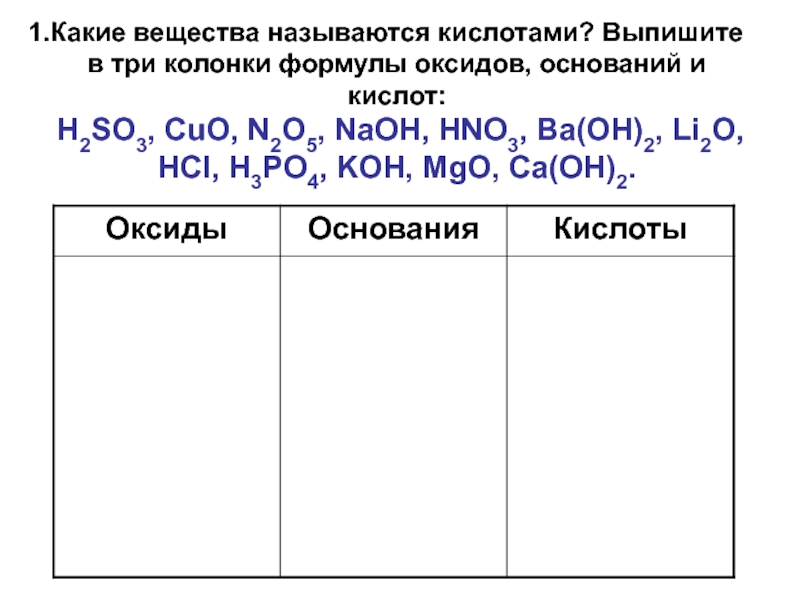
- 59. Какие вещества называются кислотами? Выпишите в три
- 60. 2. В трех одинаковых пробирках находятся вода,
- 61. 3. В один открытый химический стакан налили
- 62. 4. На двух чашках весов в одинаковых
- 63. 5. Укажите степени окисления элементов и заряды
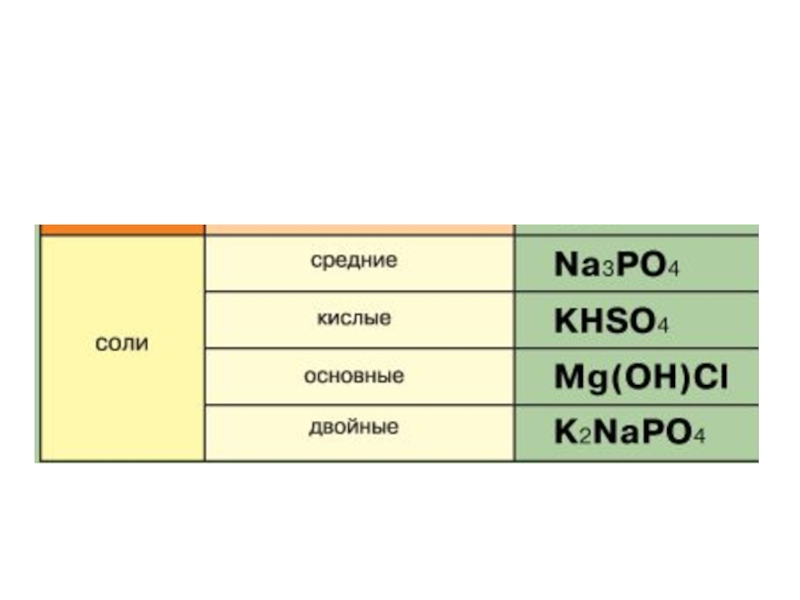
- 64. Соли
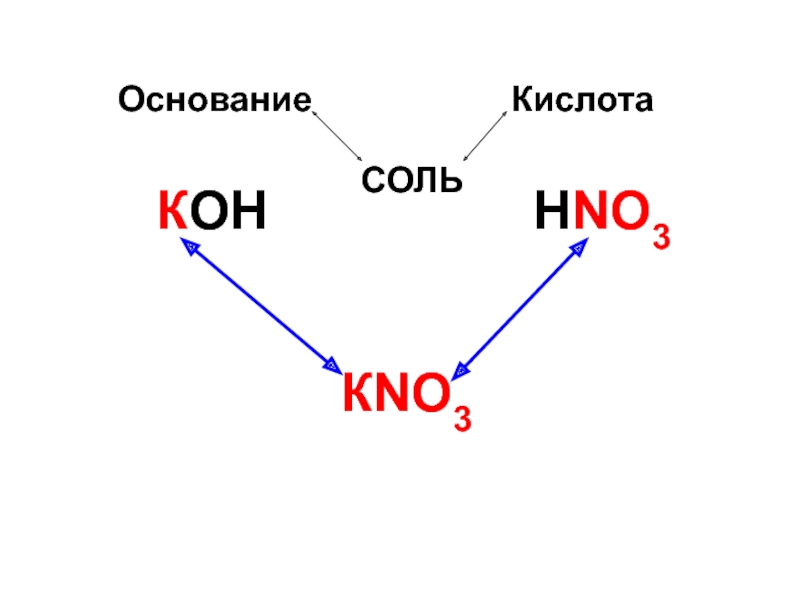
- 65. Соли – это сложные вещества, состоящие из катионов металлов и анионов кислотных остатков.
- 66. Основание Кислота КОН НNO3 КNO3 CОЛЬ
- 68. Важнейшие соли Поваренная соль необходима для жизнедеятельности
- 69. Суточная потребность в поваренной соли взрослого человека
Слайд 3Оксиды – это сложные вещества, состоящие из двух элементов, один из
Слайд 4
Классификация оксидов.
М+1
М+2
М+5,+6,+7
Оксиды неметаллов
М +3,+4
Исключения:
ZnO, BeO
N2O,NO, CO, SiO
Слайд 6Важнейшие оксиды:
– самое распространенное и самое удивительное вещество.
Мировой океан, на
Снежные шапки горных вершин, бескрайние ледяные пустыни Арктики и Антарктики – это тоже вода. Тучи и облака, туман и осадки, несущие влагу всему живому на планете – и это вода.
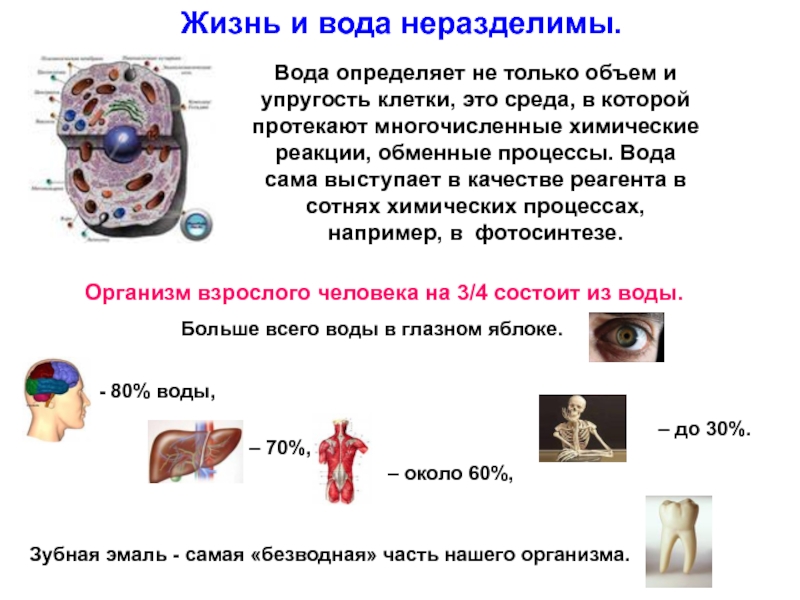
Слайд 7Жизнь и вода неразделимы.
Вода определяет не только объем и упругость
Организм взрослого человека на 3/4 состоит из воды.
Больше всего воды в глазном яблоке.
- 80% воды,
– 70%,
– около 60%,
– до 30%.
Зубная эмаль - самая «безводная» часть нашего организма.
Слайд 8В сутки человек должен потреблять около 3 литров воды.
Вода содержится
- 40%,
– 75%,
– 80%,
– более 90%.
Обыкновенный огурец – это на 98% вода!
Слайд 9При колоссальном количестве воды на Земле многие страны испытывают ее нехватку!
Для
Пресная вода - это, главным образом, недоступные пока для использования полярные шапки земли, ледники, айсберги.
Слайд 10К воде нужно относиться бережно, не расходовать ее бесконтрольно и бездумно,
Загрязнение водоемов приводит к экологическим катастрофам.
Слайд 11Важнейшие оксиды:
Дыхание – один из процессов, присущих только живым организмам.
Содержание
Выдыхаемый человеком воздух содержит уже около 4% СО2.
За сутки человек выдыхает примерно один килограмм углекислого газа.
Но даже шесть миллиардов человек населения Земли не выдыхают углекислого газа столько, сколько его поступает в атмосферу в результате сжигания различных видов топлива – более 10 млрд. тонн ежегодно!
Слайд 12При большом содержании в воздухе углекислый газ ядовит.
При повышении содержания
Воздух, который содержит 14% углекислого газа, смертелен.
Слайд 13Большой тыквенный лист в течение дня на ярком солнечном свете в
Зеленые растения в процессе фотосинтеза поглощают углекислый газ и выделяют кислород.
Слайд 14Углекислый газ мало растворим в воде.
В одном литре жидкой воды
В последние десятилетия хрупкое равновесие круговорота углекислого газа в природе пошатнулось.
Большая часть его поступает в атмосферу за счет развития промышленности, а массовая вырубка лесов и уничтожение планктона из-за загрязнения мирового океана уменьшают возможности утилизации.
Слайд 16Люди научились использовать углекислый газ.
Им газируют напитки, тушат пожары, используют
Слайд 17Углекислый газ в сжатом состоянии хранят в баллонах черного цвета.
Если
Газ, вырываясь из тесноты баллона на свободу, сильно охлаждается и переходит в твердое состояние.
Полученный «снег» имеет температуру –78оС и называется «сухой лед».
Сухой лед из твердого состояния переходит сразу в газообразное, минуя жидкое. Такой переход называется возгонкой (сублимацией).
Слайд 18SiO2
Важнейшие оксиды:
Основу земной коры составляют соединения кремния.
В результате эрозии
Песок – это только одна из форм кремнезема, оксида кремния.
Трудно себе представить, что самый распространенный в земной коре минерал кварц и чистый, как слеза, горный хрусталь, нежно-фиолетовый аметист и завораживающий сердолик, полосатые агат и оникс – это одно и тоже с химической точки зрения вещество. Такими разными их делают содержащиеся примеси и условия, в которых они «созревали».
Слайд 19Диоксид кремния содержат некоторых растения:
(диатомовые водоросли, хвощ)
и даже
Слайд 20Диоксид кремния – замечательный «строитель».
Из него изготавливают цемент, добавляют в
Люди давным-давно используют керамическую посуду, восхищаются хрупкой красотой фарфора, превращают стеклянную массу в миллионы уникальных изделий.
Слайд 21Какие вещества называются оксидами? Из приведенного перечня формул веществ различных классов
Слайд 222. Рассчитайте массовые доли элементов в оксидах, имеющих формулы:
а) SnO2,
Назовите все вещества.
Слайд 233. Оксид некоторого элемента имеет формулу Э2О3, массовая доля кислорода в
Слайд 244. Установите формулу оксида лития, если известно, что массовая доля лития
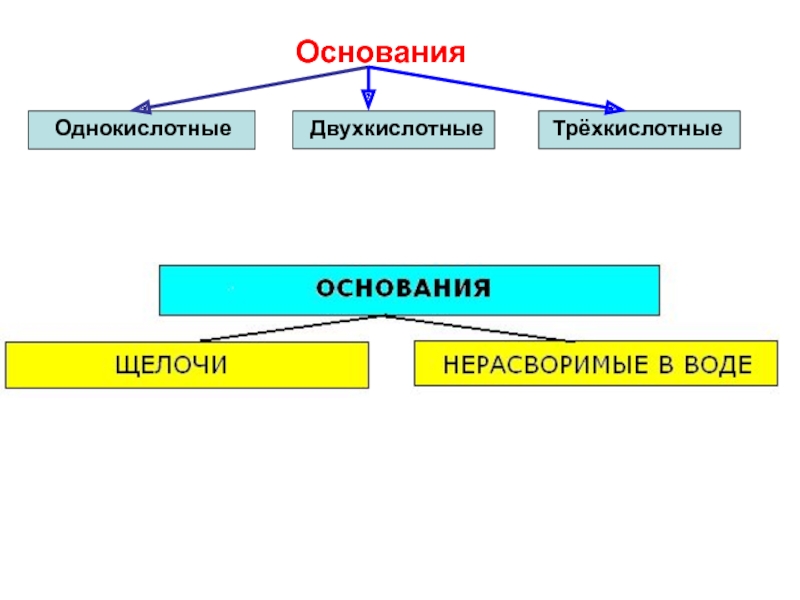
Слайд 26Основания – это сложные вещества, состоящие из катиона металла и одного
(О-2Н+1)-
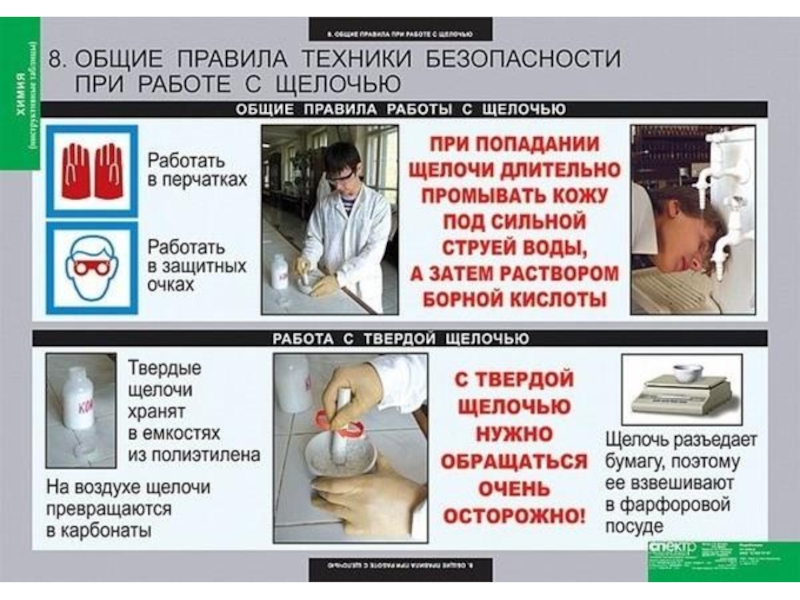
Слайд 28Важнейшие щёлочи.
Впервые химики познакомились с этим соединением в первой половине XVIII
Слайд 29Беспощадно гидроксид натрия относится к тканям, бумаге, а также к человеческой
Именно поэтому растворимые в воде основания называют едкими щелочами, а гидроксид натрия – едким натром, каустической содой или каустиком (от греч. каустикос – едкий, жгучий).
Работать с этими веществами нужно крайне осторожно, избегая их попадания на одежду, мебель, тем более руки, лицо.
Слайд 31Гидроксид натрия применяется для очистки нефти и масел, в производстве бумаги,
Раствор NaOH используется в качестве электролита в аккумуляторах, которые так и называются – щелочные.
Слайд 32Важнейшие щёлочи.
Это едкое вещество, которое вызывает еще более сильные химические ожоги,
При растворении этого белого твердого вещества в воде выделяется большое количество теплоты, раствор становится горячим.
Поскольку гидроксид калия жадно поглощает воду, его применяют для осушки некоторых жидкостей и газов.
Гидроксид калия используют для получения соединений калия, жидкого мыла, в качестве электролита в щелочных аккумуляторах.
Слайд 33Важнейшие щёлочи.
Белый рыхлый порошок, из-за чего его иногда называют смешным названием
Это вещество именуют также гашеной известью, поскольку получают его взаимодействием оксида кальция СаО (негашеной извести) с водой
(процесс гашения).
Известковое молоко
Известковая вода
Гидроксид кальция малорастворим в воде: в 100 г воды при комнатной температуре растворяется всего 0,16 г гидроксида кальция.
отстаивание
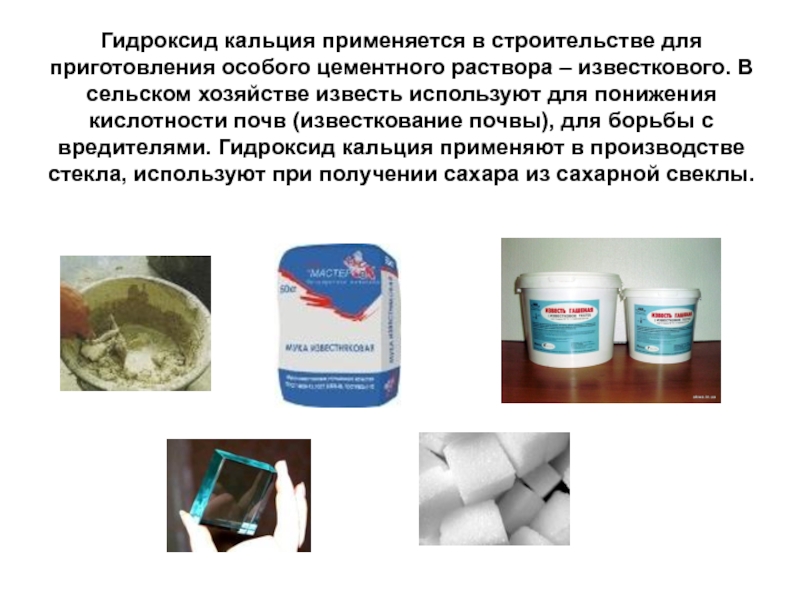
Слайд 35Гидроксид кальция применяется в строительстве для приготовления особого цементного раствора –
Слайд 37Какие вещества называются основаниями? Из приведенного перечня формул веществ различных классов
H2S, LiOH, NiO, Fe(OH)2, Sr(OH)2, Cu(OH)2, KOH, Cr(OH)2, NaH, RbOH.
Щёлочи
Нерастворимые основания
Слайд 393. В двух пробирках находятся раствор гидроксида калия и известковая вода.
Слайд 404. Найдите количество вещества, содержащееся в 390 г гидроксида калия, если
Слайд 415. За счет каких типов связей образовано соединение гидроксид натрия NaOH?
Слайд 44Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода
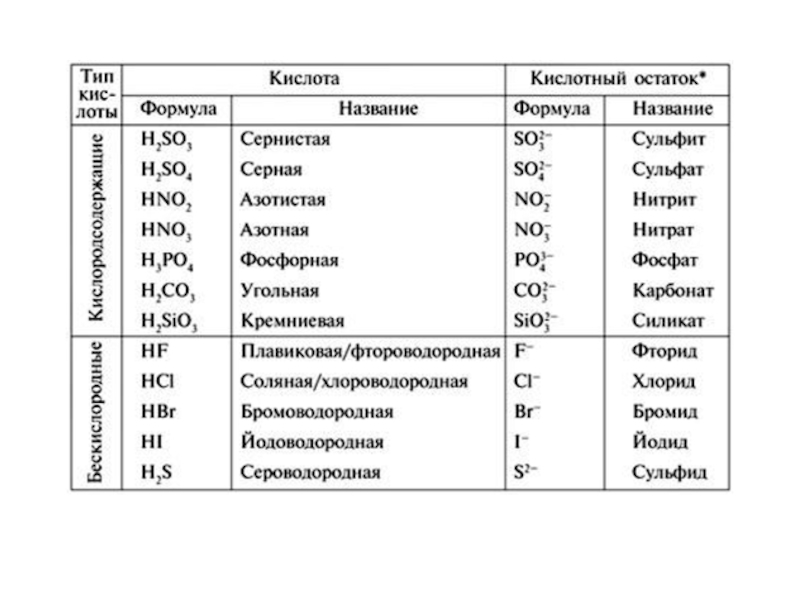
Слайд 47 КЛАССИФИКАЦИЯ КИСЛОТ.
бескислородные
HF
HBr HI H2S
1. По содержанию кислорода.
кислородсодержащие
HNO3 H2SO4
H2CO3 H3PO4
КИСЛОТЫ
Слайд 482. По количеству атомов водорода.
КИСЛОТЫ
одно-основные
HCl
HNO3
двух-основные
H2S
H2SO4
трех-основные
H3PO4
Слайд 50Желудочный сок человека и животных представляет собой, главным образом, соляную кислоту.
Многие растения в клеточном соке листьев и плодов содержат природные кислоты с характерными названиями:
Молочная кислота образуется в мышцах при физической нагрузке.
Слайд 51Важнейшие кислоты:
Алхимики впервые получили серную кислоту нагреванием соли, которую называли железным
Серная кислота оказалась одной из самых сильных кислот, известных алхимикам. Она реагировала с большинством металлов, растворяла минералы, обугливала древесину, бумагу и ткани.
Слайд 52Попадание кислоты на кожу вызывает сильные химические ожоги.
При работе с
Слайд 53
Серная кислота прекрасно растворяется в воде, при этом выделяется большое количество
Поэтому, приготавливая раствор,
серную кислоту тонкой струйкой вливают в воду (а не наоборот!) при постоянном перемешивании.
Слайд 54Серную кислоту применяют для получения солей, красителей, удобрений, взрывчатых веществ, лекарств,
Слайд 55Важнейшие кислоты:
Алхимики заметили, что при прокаливании все того же железного купороса
Немецкий алхимик Иоганн Глаубер в середине XVII в. пришел к выводу, что вытесняет хлороводород из поваренной соли NaCl не железный купорос, а образующаяся при его прокаливании серная кислота. Глаубер предложил получать соляную кислоту растворением в воде хлороводорода, образующегося при действии концентрированной серной кислоты на поваренную соль.
Слайд 56Растворимость газообразного хлороводорода в воде ограничена, поэтому соляной кислоты с концентрацией
Концентрированная соляная кислота «дымит» на воздухе: выделяющийся хлороводород, поглощая водяные пары, образует мельчайшие капельки кислоты. Конечно, склянку с концентрированной соляной кислотой нужно держать плотно закрытой, иначе понижается массовая доля хлороводорода в растворе, а выделяющиеся пары вызывают сильную коррозию окружающих металлических предметов.
Слайд 57Соляную кислоту используют для получения ее солей, обработки руд, травления металлов,
В желудке соляная кислота выполняет несколько функций: участвует в процессе переваривания пищи, расщеплении белков, жиров, углеводов, дезинфицирующая функция (большинство болезнетворных микроорганизмов гибнут в кислой среде). Желудочный сок начинает выделяться уже тогда, когда вы начинаете пережевывать пищу. Поэтому жевать резинку на голодный желудок очень вредно: в отсутствии пищи соляная кислота разрушительно действует на стенки желудка. Кроме того, вид постоянно жующего человека – не самое эстетичное зрелище.
Слайд 58Важнейшие кислоты:
Тоже имеет «алхимические корни».
Впервые ее научились получать из… костей.
Оказывается, твердые кислоты тоже бывают, и фосфорная кислота – тому пример. Это белая твердая масса, прекрасно растворяется в воде, очень гигроскопична. На воздухе кристаллы фосфорной кислоты расплываются за счет поглощения влаги и превращаются в вязкую жидкость.
Фосфорная кислота, в отличие от серной и соляной, не такая сильная и не столь агрессивная. Тщательно очищенная фосфорная кислота применяется даже в пищевой промышленности для подкисления напитков.
Слайд 59Какие вещества называются кислотами? Выпишите в три колонки формулы оксидов, оснований
H2SO3, CuO, N2O5, NaOH, HNO3, Ba(OH)2, Li2O, HCl, H3PO4, KOH, MgO, Ca(OH)2.
Слайд 602. В трех одинаковых пробирках находятся вода, раствор гидроксида натрия и
Слайд 613. В один открытый химический стакан налили концентрированную серную кислоту, в
Слайд 624. На двух чашках весов в одинаковых стаканах находятся:
а) 0,6 моль
б) 0,5 моль серной кислоты и 0,5 моль фосфорной кислоты.
Укажите положение чашек весов в обоих случаях.
Слайд 635. Укажите степени окисления элементов и заряды анионов для кислородсодержащих кислот:
Дайте названия анионам.
Слайд 68Важнейшие соли
Поваренная соль необходима для жизнедеятельности организма человека и животных. Длительное
Слайд 69Суточная потребность в поваренной соли взрослого человека составляет 10-15 г. В
Это связано с тем, что хлорид натрия выводится из организма с потом, и для восстановления утраты нужно потреблять больше соли.
При работе в горячих цехах и в условиях сухого и жаркого климата врачи рекомендуют пить подсоленную воду, так как соль способствует удержанию воды в тканях.