- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
СТРОЕЖ НА ЕЛЕКТРОННАТА ОБВИВКА презентация
Содержание
- 1. СТРОЕЖ НА ЕЛЕКТРОННАТА ОБВИВКА
- 2. ХАРАКТЕРИСТИКИ НА ЕЛЕКТРОНА ЗНАК -
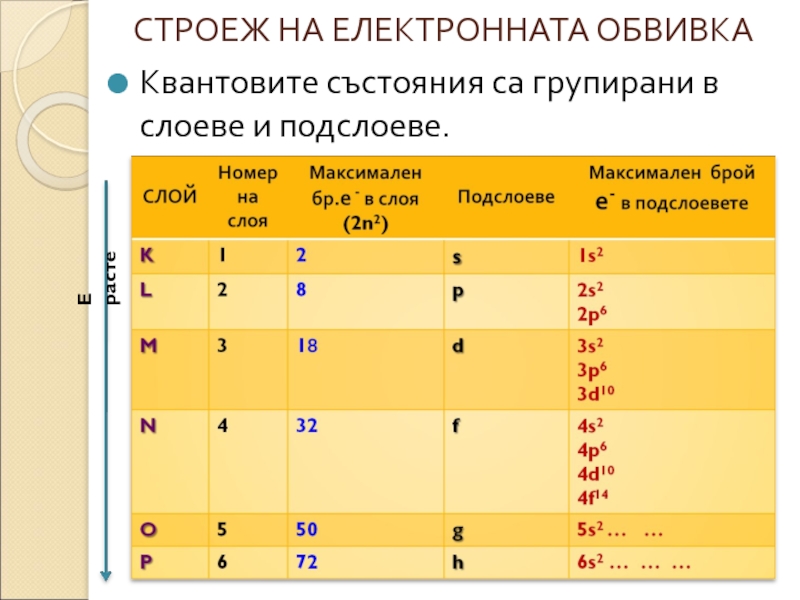
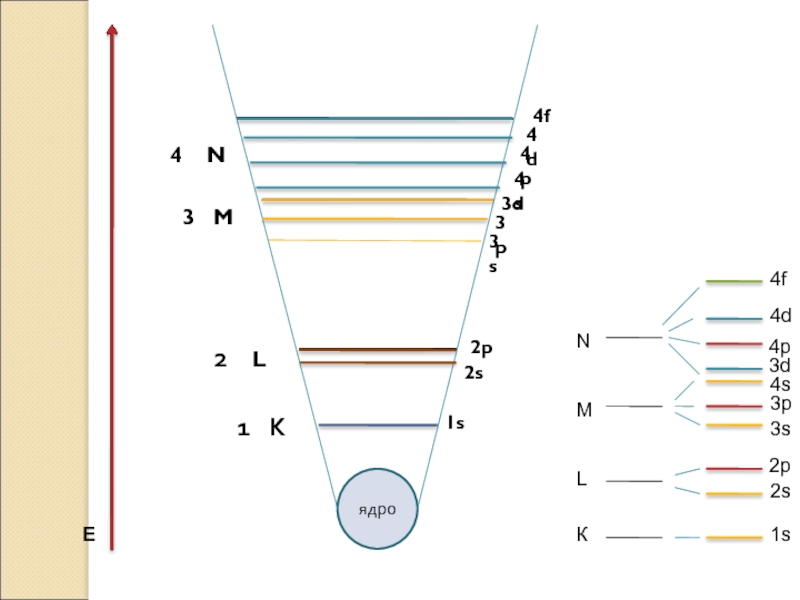
- 3. СТРОЕЖ НА ЕЛЕКТРОННАТА ОБВИВКА Квантовите състояния са групирани в слоеве и подслоеве. E расте
- 4. ядро 1 К 2
- 5. * Броят на подслоевете в даден
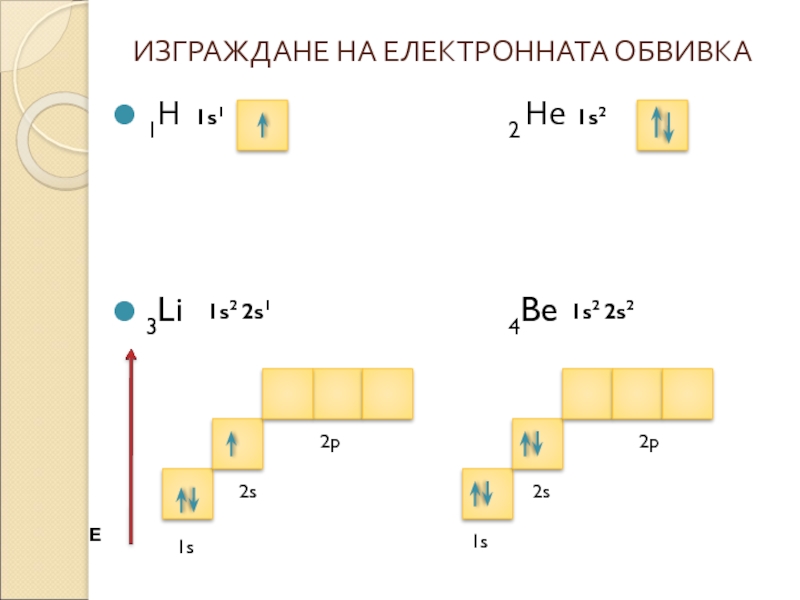
- 6. ИЗГРАЖДАНЕ НА ЕЛЕКТРОННАТА ОБВИВКА 1Н
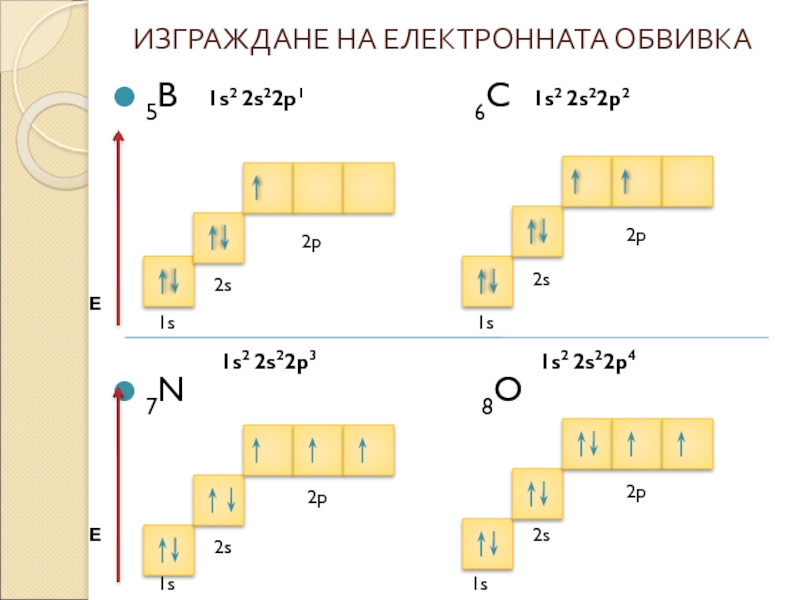
- 7. ИЗГРАЖДАНЕ НА ЕЛЕКТРОННАТА ОБВИВКА 5B
- 8. ИЗГРАЖДАНЕ НА ЕЛЕКТРОННАТА ОБВИВКА 9F
- 9. ОСНОВНО И ВЪЗБУДЕНО СЪСТОЯНИЕ Състояние на атома
- 10. Йонизационна енергия – енергията , която е
- 11. ЕЛЕКТРООТРИЦАТЕЛНОСТ (Х ) – свойството на атомите
- 12. Благодаря за вниманието!
Слайд 2ХАРАКТЕРИСТИКИ НА ЕЛЕКТРОНА
ЗНАК - e- заряд -1;
Магнитни свойства - спин -
Два e- могат да бъдат с еднакви или с противоположни спинове
Електроните с противоположни спинове образуват електронни двойки.
Електроните в атома заемат състояния само с точно определена енергия – Е1,Е2,Е3... Еn, наречени квантови състояния.
Слайд 5 * Броят на подслоевете в даден слой е равен на номера
Нарастване на Е
* Състояние на атома , което има минимална енергия се нарича основно състояние. Електроните запълват подслоевете и слоевете като винаги заемат състояние с възможно най-ниска енергия.
1s2 <2s2 <2p6 <3s2< 3p6<4s2 <3d10 <4p6 <5s2 <4d10...4f14...
*Редът на подслоевете по енергия е следния:
* Разпределението на електроните по подслоеве и слоеве се нарича електронна конфигурация на атома.
Слайд 7ИЗГРАЖДАНЕ НА ЕЛЕКТРОННАТА ОБВИВКА
5B
7N 8O
E
E
1s2 2s22p2
1s2 2s22p1
1s2 2s22p4
1s2 2s22p3
1s
1s
1s
1s
2s
2s
2s
2s
2p
2p
2p
2p
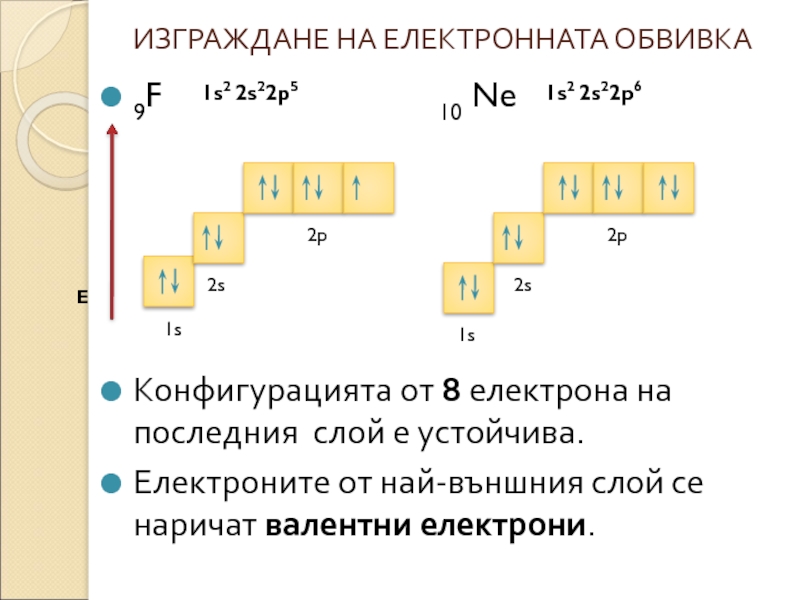
Слайд 8ИЗГРАЖДАНЕ НА ЕЛЕКТРОННАТА ОБВИВКА
9F
Конфигурацията от 8 електрона на последния слой е устойчива.
Електроните от най-външния слой се наричат валентни електрони.
E
1s2 2s22p5
1s2 2s22p6
1s
1s
2s
2s
2p
2p
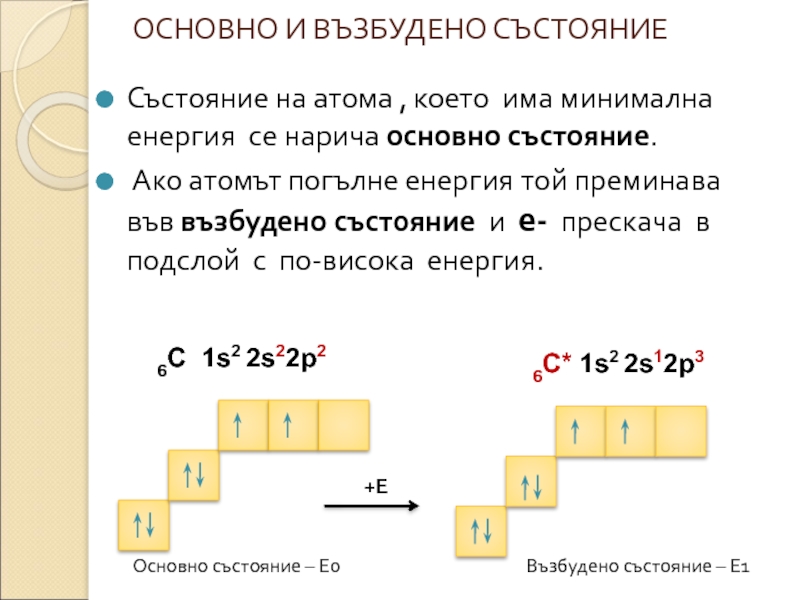
Слайд 9ОСНОВНО И ВЪЗБУДЕНО СЪСТОЯНИЕ
Състояние на атома , което има минимална енергия
Ако атомът погълне енергия той преминава във възбудено състояние и е- прескача в подслой с по-висока енергия.
6С 1s2 2s22p2
6С* 1s2 2s12p3
Основно състояние – Е0
Възбудено състояние – Е1
+Е
Слайд 10Йонизационна енергия – енергията , която е необходима за отделяне на
3Li - е- ? 3Li+
Електронно сродство(А) – енергията ,коята характеризира присъединяването на е- към основното състояние на атома. Атомите се превръщат в аниони.
9F + е- ? 9F-
(1s2 2s22p5)
(1s2 2s22p6)
(1s2 2s1)
(1s2)