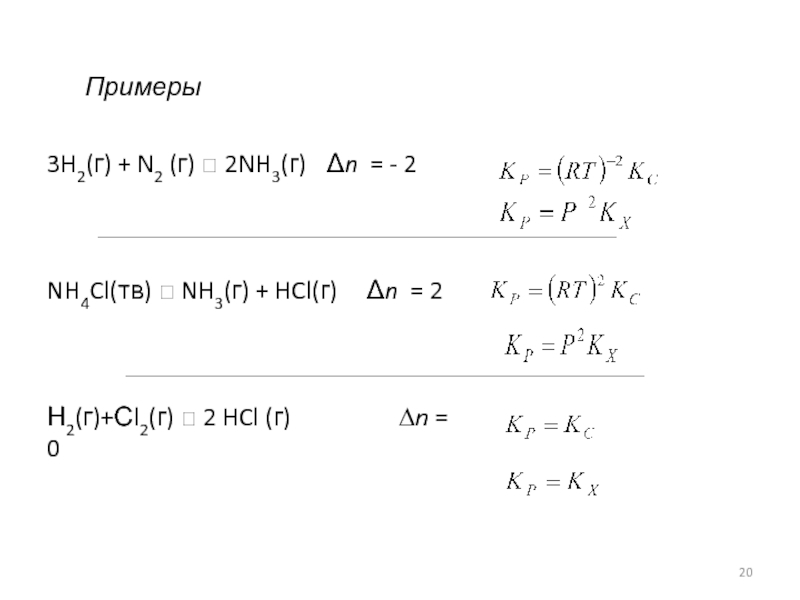- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика химического равновесия презентация
Содержание
- 1. Термодинамика химического равновесия
- 2. Введение Самопроизвольный процесс: dG < 0,
- 3. *Химическое равновесие. Термодинамические условия химического равновесия. Константа
- 4. !!!! Т/д условие равновесия
- 5. Для всех участников реакции при равновесии
- 6. термодинамическая константа равновесия,
- 7. ΔGr0298 =∑vΔGf0298 прод -∑vΔGf0298 исх. ΔGr0
- 8. способ вычисления т/д константы
- 9. Пример
- 10. Используя КP (или КС) можно рассчитать сколько
- 11. Пример Определим теор. выход и глубину
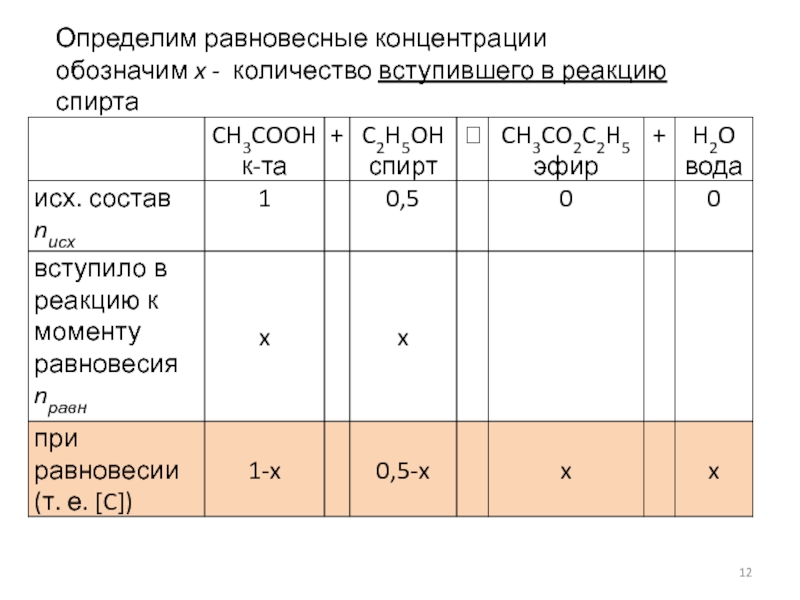
- 12. Определим равновесные концентрации обозначим x - количество вступившего в реакцию спирта
- 13. (0,5 – x – 0,5x + x2)
- 14. Константа равновесия гомогенной реакции
- 15. FeO(тв) + CO(г) ⮀ Fe(тв) + CO2(г)
- 16. *Способы выражения константы химического равновесия через молярные
- 17. Взаимосвязь между KP и KC
- 20. Примеры 3H2(г) + N2 (г) ⮀
- 21. *Уравнение изотермы химической реакции Прогнозирование направления
- 22. Уравнение изотермы реакции
- 23. * Влияние температуры на химическое равновесие. Уравнения
- 24. При Т1
- 25. Уравнение изохоры химической реакции
- 26. Способ вычисления КP при другой T
- 27. *Принцип Ле-Шателье – Брауна, прогнозирование смещения химического
- 28. при равновесии ∆Gr = 0
- 29. 3) Изменено общее давление (для реакций с
- 30. 4) *Влияние температуры – по
- 31. FeCl3 + 3KCNS ⮀ Fe(CNS)3 + 3KCl
Слайд 2Введение
Самопроизвольный процесс: dG < 0, dF < 0
Свободная энергия системы
Идет до состояния равновесия.
Равновесие - минимум свободной энергии.
dG = 0, dF =0
Частный случай термодинамического равновесного состояния – химическое равновесие.
Напоминание
Равновесным называют такое состояние системы, которое может сохраняться неизменным сколь угодно долго, если внешние условия не изменяются.
Слайд 3*Химическое равновесие. Термодинамические условия химического равновесия. Константа химического равновесия и способы
Хим. равновесие:
одновременно протекают прямая и обратная реакции.
В состоянии равновесия скорости прямой и обратной реакции равны
⮀
Слайд 4
!!!! Т/д условие равновесия ∆G = 0
По ур.
Химический потенциал компонента
(газ)
в состоянии равновесия
P и [P] – парциальные давления компонента в ходе реакции и при равновесии
Слайд 6
термодинамическая константа равновесия, выраженная через давление.
изменение стандартного изобарно-изотермического потенциала.
Стандартные
Равновесные парциальные
давления
т/д обоснование
з-на действующих масс
Слайд 7ΔGr0298 =∑vΔGf0298 прод -∑vΔGf0298 исх.
ΔGr0 - функция состояния
При 298 К
Слайд 8
способ вычисления
т/д константы равновесия (газы)
аналогично
для реакций в растворах
константа выражена через С
Слайд 10Используя КP (или КС) можно рассчитать сколько вещества вступит в реакцию
Степень превращения вещества - отношение количеств (моль) в-ва, вступившего в реакцию к моменту равновесия, к его исходному количеству
Глубина протекания реакции (к моменту равновесия) ξ - отношение количества моль в-ва, вступившего в реакцию к моменту равновесия, к его стехиометрическому коэффициенту
Теоретический выход продукта реакции – через степень превращения, χ - отношение количеств (моль) в-ва, образовавшегося к моменту равновесия, к его теоретически возможному количеству
Слайд 11Пример
Определим теор. выход и глубину протекания реакции
в растворе, если
0,5 моль этилового спирта
CH3COOH + C2H5OH ⮀ CH3CO2C2H5 + H2O
к-та спирт эфир вода
∆Gr0 = –2,76 кДж/моль.
.
Слайд 13(0,5 – x – 0,5x + x2) 3,05 = x2
2,05x 2–
x1 = 0, 41 моль
x2= 1,84 моль (несовместимо с условиями задачи).
В равновесной смеси 0,41 моль эфира
из максимально возможных 0,5 моль
Глубина протекания
.
Теоретический выход
Слайд 14
Константа равновесия гомогенной реакции
если все участники реакции – газы
3H2(г) +
⮀
Слайд 15FeO(тв) + CO(г) ⮀ Fe(тв) + CO2(г)
NH4Cl(тв) ⮀ NH3(г) + HCl(г)
если в реакции участвуют газы и тв. в-ва
Для тв. в-в P не отличается от стандартного (P =1),
[P] тв. фазы =1, не входит в КР гетерогенной реакции.
Слайд 16*Способы выражения константы химического равновесия
через молярные
концентрации С [моль/л]
через давление
через
если все участники реакции – газы
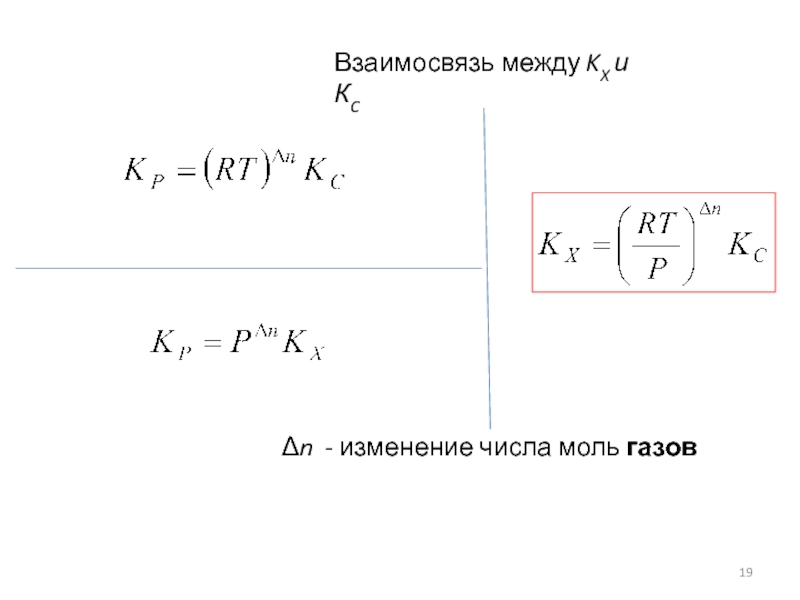
Слайд 17Взаимосвязь между KP и KC
связь P и С
в нашем случае – [P] (равновесное); [PA]=[CA]RT
Δn - изменение числа моль газов
Слайд 18
Взаимосвязь между KP и КХ
Мольная доля компонента Хi – отношение
Парциальное давление вещества Pi
пропорционально Хi.
,
.
P – общее давление
смеси газов
в нашем случае – [Pi] (равновесное);
[PA]=[XA] P
Слайд 20Примеры
3H2(г) + N2 (г) ⮀ 2NH3(г) Δn = - 2
NH4Cl(тв) ⮀
Н2(г)+Сl2(г) ⮀ 2 HCl (г) ∆n = 0
Слайд 21
*Уравнение изотермы химической реакции
Прогнозирование направления протекания химической реакции по величине ΔGr
Если система не достигла равновесия, то ∆Gr ≠ 0
не равновесные,
а «текущие» P!
Слайд 22
Уравнение изотермы реакции
позволяет вычислять ΔGr на любом этапе реакции не
если ΔGr <0 - самопроизвольно в прямом направлении
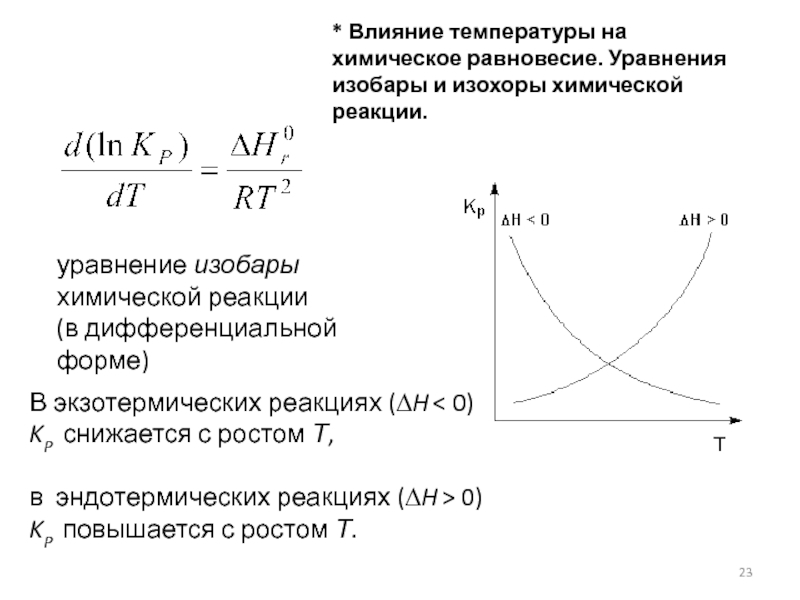
Слайд 23* Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической
уравнение изобары
химической реакции
(в дифференциальной форме)
В экзотермических реакциях (∆H < 0)
KP снижается с ростом Т,
в эндотермических реакциях (∆H > 0)
KP повышается с ростом Т.
Слайд 24
При Т1 - константа KP1 ,
при Т2 - константа KP2
Уравнение изобары
в интегральной форме
считая, что ∆H не зависит от T
Слайд 26Способ вычисления КP при другой T
Н2 + Сl2 ⮀ 2HCl
КP = 2,67∙ 1033 при 298 К
∆H0r298 = –184,6 кДж/моль.
КP при 350 К =?
Слайд 27*Принцип Ле-Шателье – Брауна, прогнозирование смещения химического равновесия
Принцип Ле Шателье –
Если на систему, находящуюся в состоянии равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Слайд 28
при равновесии ∆Gr = 0
1) В систему добавлено исходное вещество
∆Gr < 0
равновесие смещается вправо
2) В систему добавлен продукт реакции (D)
∆Gr > 0
равновесие смещается влево
⮀
Слайд 293) Изменено общее давление (для реакций с участием газов)
смещения равновесия
Если Δn > 0
C4H10 (г) ⮀ C4H6(г) + 2 H2(г) Δn = 2,
то с ростом P
Если Δn < 0,
2H2(г) + O2(г) ⮀ 2H2O (г) Δn= –1
c ростом P
Если Δn = 0
H2(г) + I2(г) ⮀ 2HI (г) Δn = 0,
P не влияет на смещение химического равновесия.
Слайд 30
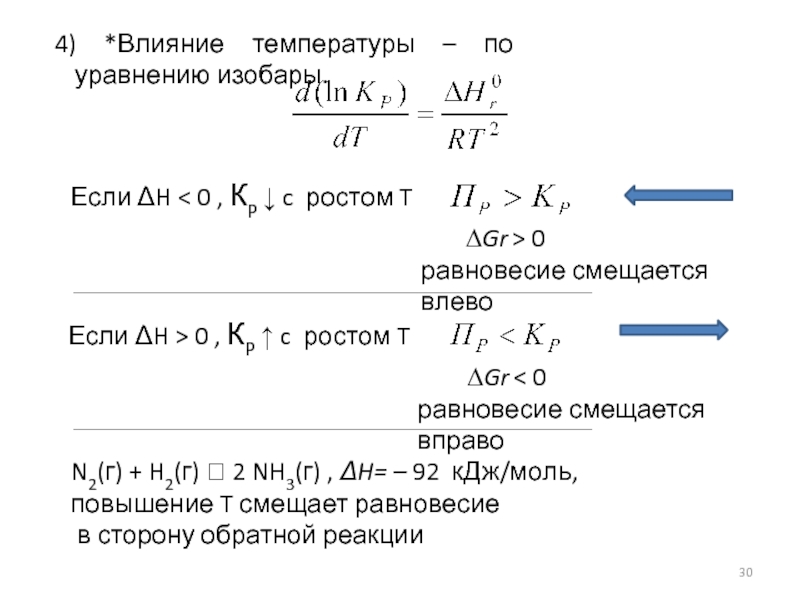
4) *Влияние температуры – по уравнению изобары.
Если ΔH < 0
Если ΔH > 0 , КP ↑ c ростом T
N2(г) + H2(г) ⮀ 2 NH3(г) , ΔH= – 92 кДж/моль,
повышение T смещает равновесие
в сторону обратной реакции
∆Gr < 0
равновесие смещается вправо
∆Gr > 0
равновесие смещается влево














![*Способы выражения константы химического равновесиячерез молярные концентрации С [моль/л] через давлениечерез мольные доли X если](/img/tmb/2/158576/735e39fe8d7cec7b541021384115032f-800x.jpg)