- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислородсодержащие органические соединения презентация
Содержание
- 1. Кислородсодержащие органические соединения
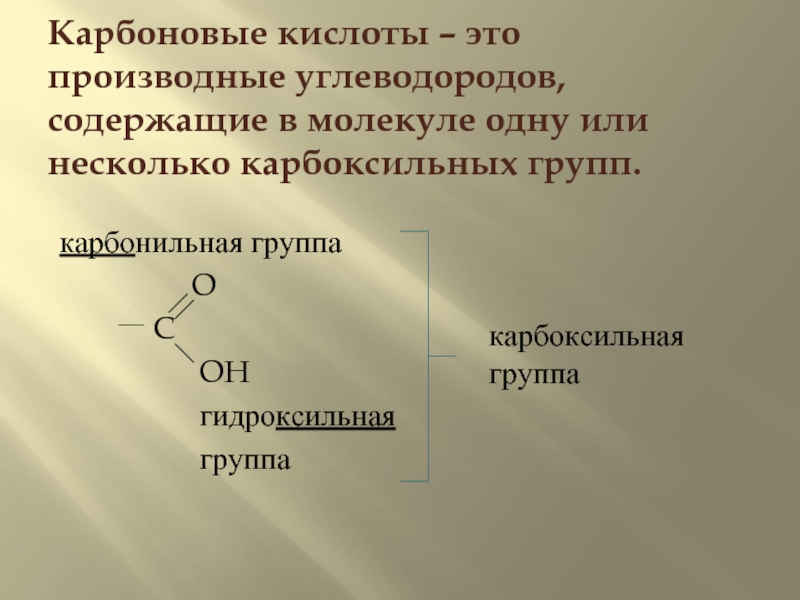
- 2. Карбоновые кислоты – это производные углеводородов, содержащие
- 3. Классификация карбоновых кислот 1. По числу карбоксильных
- 4. Общая формула одноосновных карбоновых кислот Номенклатура К
- 5. Карбоновые кислоты широко распространены в природе: Масляная
- 6. Физические свойства одноосновных карбоновых кислот Низшие карбоновые
- 7. Химические свойства кислот Общие свойства карбоновых кислот
- 8. 1. Кислоты диссоциируют на ионы водорода и
- 9. 1. Кислоты диссоциируют на ионы водорода и
- 10. 3. Реагируют с основными и амфотерными оксидами
Слайд 2Карбоновые кислоты – это производные углеводородов, содержащие в молекуле одну или
карбонильная группа
O
C
OH
гидроксильная
группа
карбоксильная группа
Слайд 3Классификация карбоновых кислот
1. По числу карбоксильных групп:
Одноосновные : CH3COOH УКСУСНАЯ
Двухосновные :
Многоосновные: HOOC – CH2C(OH)(COOH)CH2 – COOH
ЛИМОННАЯ
2. По характеру углеводородного радикала:
Предельные : CH3 – (CH2)10 – COOH лауриновая
Непредельные: CH2 = CH – COOH акриловая
Ароматические: C6H5 – COOH бензойная
Слайд 4Общая формула одноосновных карбоновых кислот
Номенклатура
К названию соответствующего предельного УВ прибавляется окончание
Метан – метановая кислота HCOOH
Этан – этановая кислота CH3 - COOH
Пропан – пропановая CH3 – CH2 - COOH
Бутан – бутановая кислота СН3 – СН2 – СН2 - СООН
R – COOH или CnH2n+1COOH
Слайд 5Карбоновые кислоты широко распространены в природе:
Масляная (бутановая) кислота – в коровьем
Муравьиная (метановая) кислота содержится в ядовитых железах муравьев, в крапиве, в еловой хвое
Лимонная кислота – в ягодах и фруктах
Слайд 6Физические свойства одноосновных карбоновых кислот
Низшие карбоновые кислоты – жидкости с острым
С повышением относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается.
Высшие кислоты, начиная с пеларгоновой (нонановой) CH3 – (CH2)7 – COOH, - твердые вещества, без запаха, нерастворимые в воде.
Слайд 7Химические свойства кислот
Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот:
Диссоциируют
Реагируют с металлами.
Реагируют с основными и амфотерными оксидами и гидроксидами.
Реагируют с солями более слабых летучих кислот.
Реагируют со спиртами
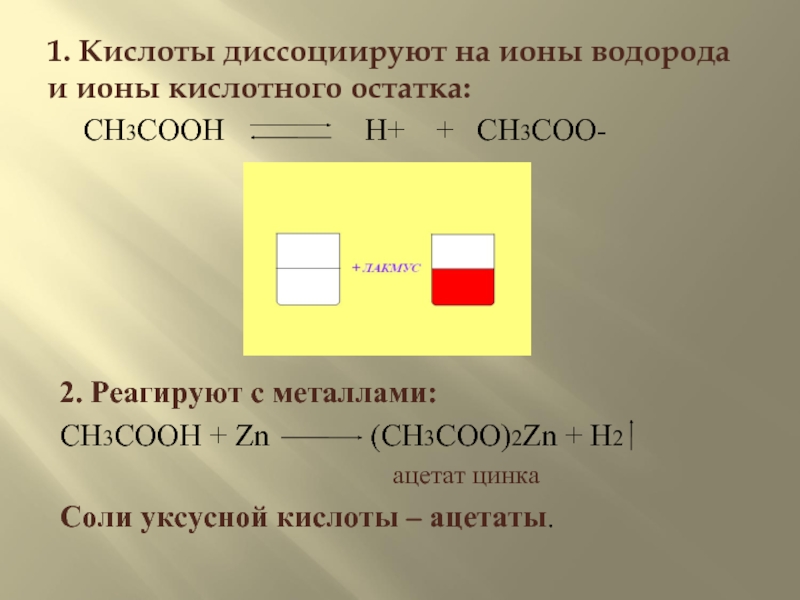
Слайд 81. Кислоты диссоциируют на ионы водорода и ионы кислотного остатка:
CH3COOH
2. Реагируют с металлами:
CH3COOH + Zn (CH3COO)2Zn + H2
ацетат цинка
Соли уксусной кислоты – ацетаты.
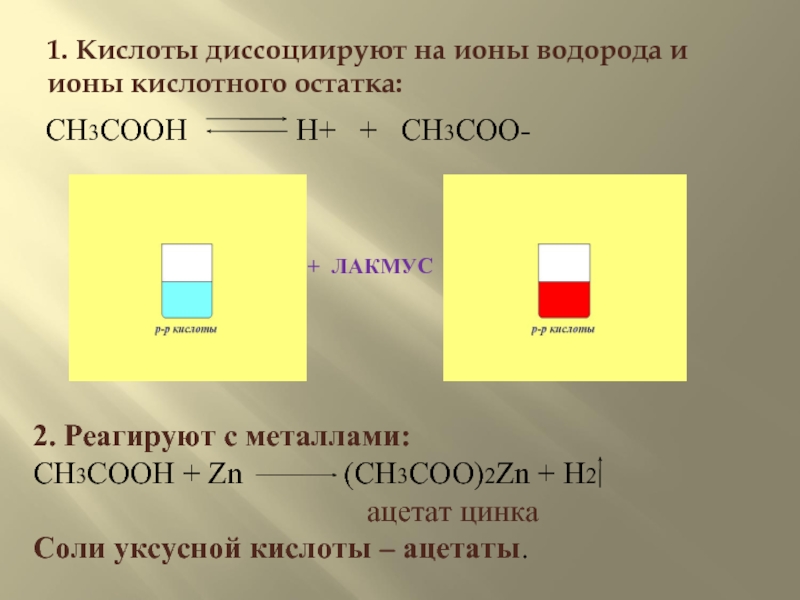
Слайд 91. Кислоты диссоциируют на ионы водорода и ионы кислотного остатка:
+ ЛАКМУС
CH3COOH
2. Реагируют с металлами:
CH3COOH + Zn (CH3COO)2Zn + H2
ацетат цинка
Соли уксусной кислоты – ацетаты.
Слайд 103. Реагируют с основными и амфотерными оксидами и гидроксидами.
2HCOOH + MgO
2CH3COOH + Zn(OH)2 (CH3COO)2Zn + H2O
4. Реагируют с солями более слабых летучих кислот.
2HCOOH + Na2SiO3 2HCOONa + H2SiO3
2CH3COOH + Na2CO3 2CH3COONa + H2O + CO2
5. Реагируют со спиртами.
O O
R C + H OR* R C + H2O
OH O R*
кислота спирт сложный эфир