- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ковалентная связь презентация
Содержание
- 1. Ковалентная связь
- 2. Химическая связь - это взаимодействие двух атомов,
- 6. Ковалентная связь- химическая связь, возникающая за
- 7. КНС- это связь между атомами неметаллов с одинаковой эо.
- 8. В случае неполярной ковалентной связи электронное
- 9. Водород как элемент доминирует во Вселенной.
- 11. Открытие кислорода Кислород был выделен в последние
- 12. АЗОТ. Из-за наличия тройной связи азот химически
- 13. Если в мире что-то происходит само по
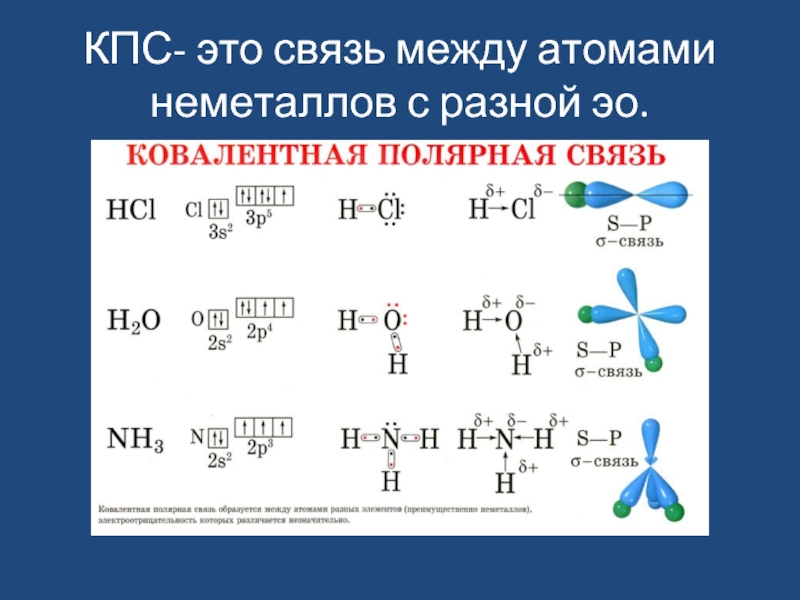
- 16. КПС- это связь между атомами неметаллов с разной эо.
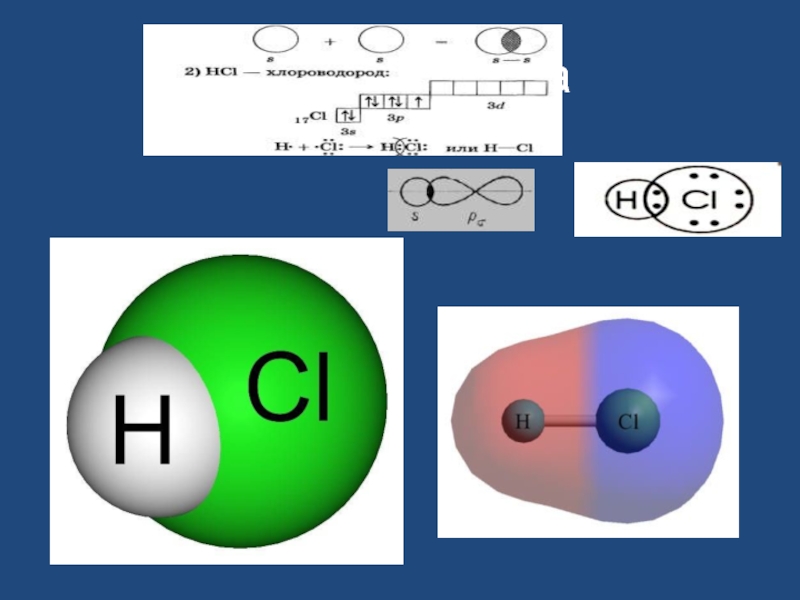
- 17. хлороводорода
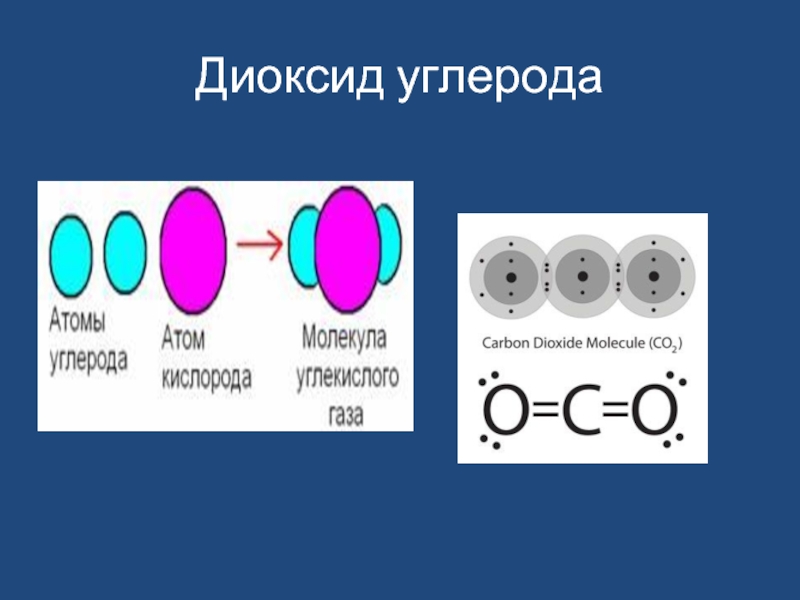
- 19. Диоксид углерода
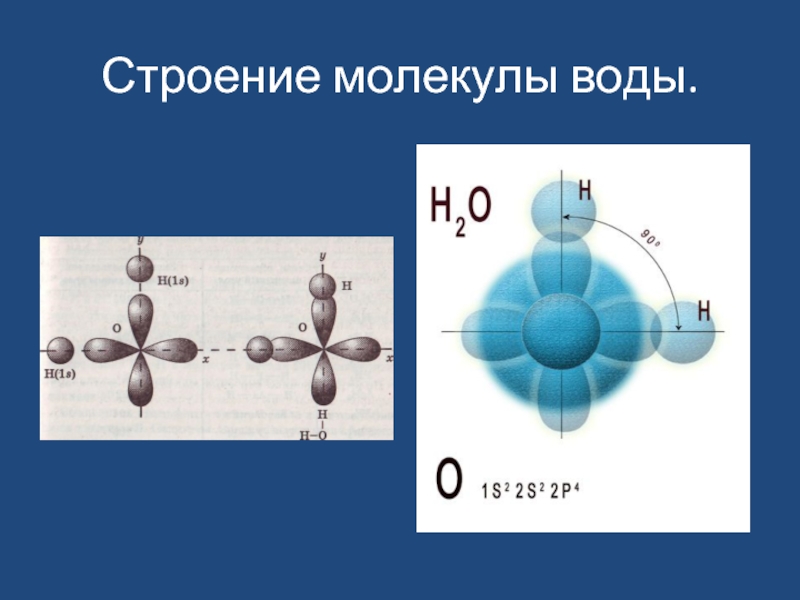
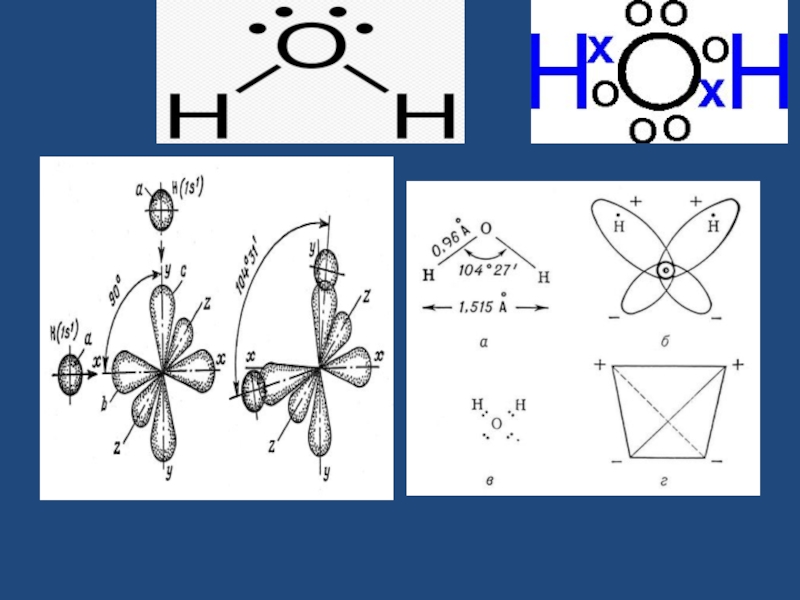
- 20. Строение молекулы воды.
- 22. Где вода может замёрзнуть при температуре +20
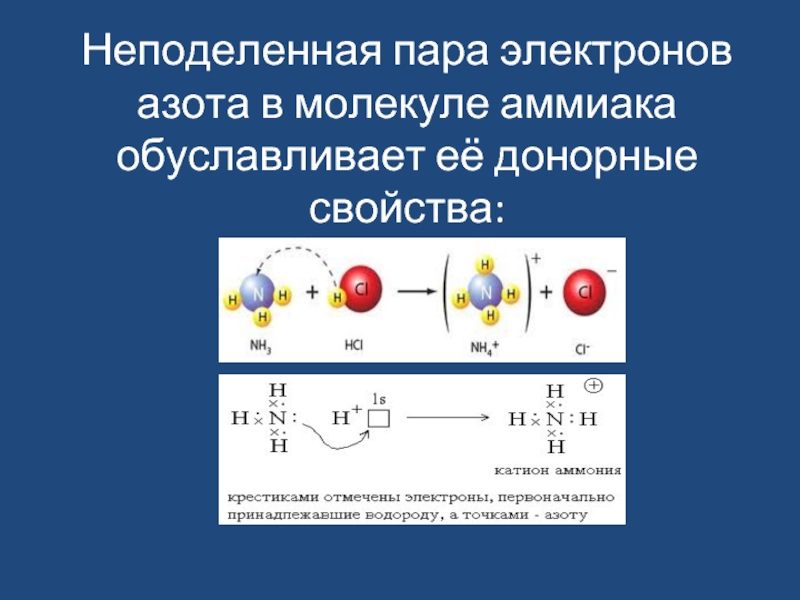
- 25. Неподеленная пара электронов азота в молекуле аммиака обуславливает её донорные свойства:
- 26. Аммиак NH3 — бесцветный газ с
- 27. Ион гидроксония. Говоря об ионах H+ делается
- 28. Схема образования молекулы азотной кислоты. 1. Атом
- 29. 3. Два неспаренных электрона атома азота
- 30. 4. Третий атом кислорода, возбуждаясь, образует
- 32. Доказано, что в молекуле азотной кислоты
- 33. «Строение молекулы угарного газа (оксида углерода(II)) СО»
Слайд 2Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами.
При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа.
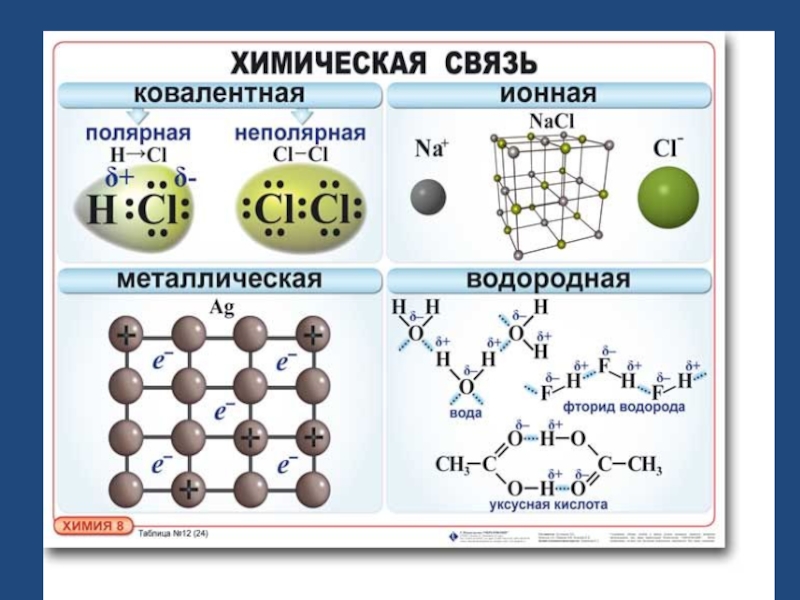
Различают следующие виды химической связи:
ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная,
водородная ,
металлическая.
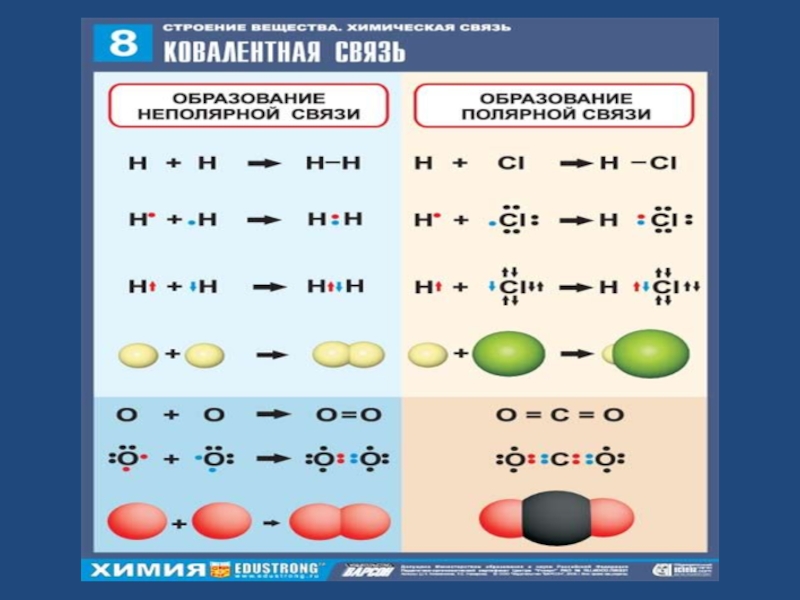
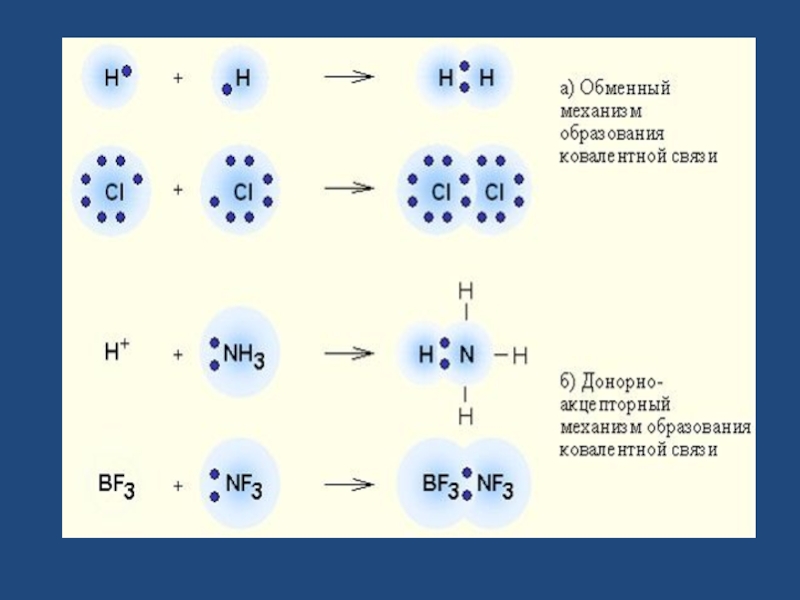
Слайд 6Ковалентная связь-
химическая связь, возникающая за счет образования общей пары электронов.
Слайд 8
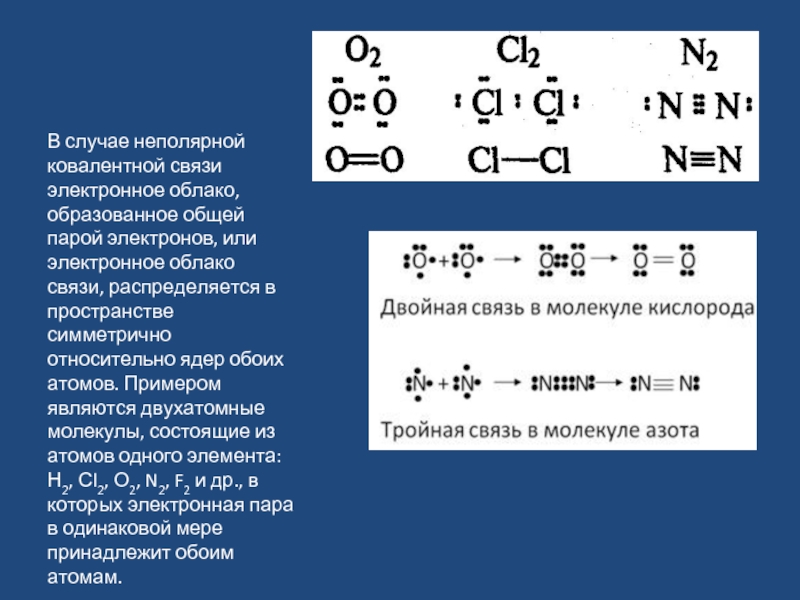
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов,
Слайд 9
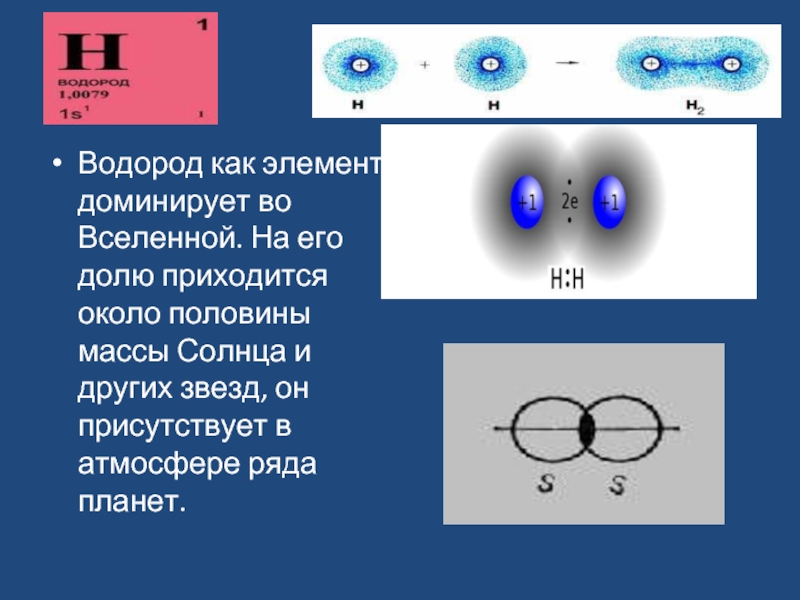
Водород как элемент доминирует во Вселенной. На его долю приходится около
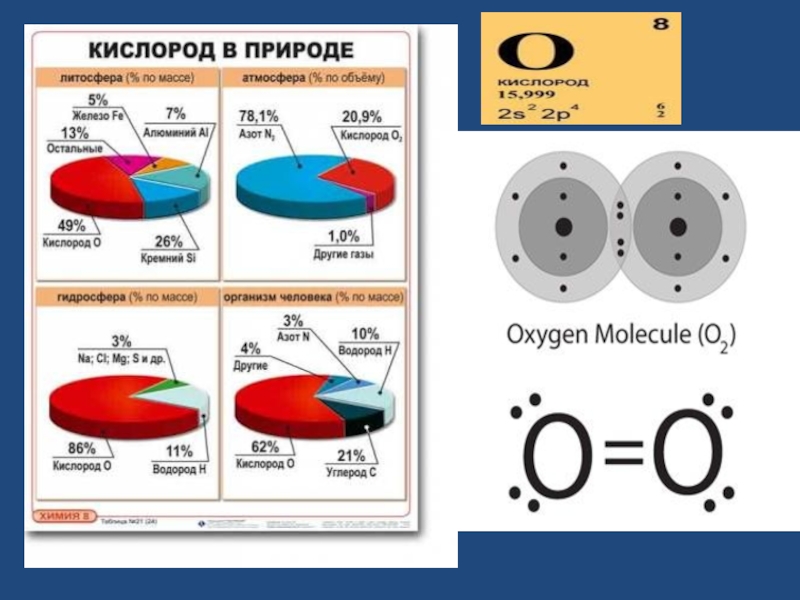
Слайд 11Открытие кислорода
Кислород был выделен в последние десятилетия XVIII века французом А.
Все три первооткрывателя кислорода были в химии дилетантами. Антуан Боме и Карл Шееле по профессии аптекари, а Джозеф Пристли и вовсе далек от химии да и от естествознания вообще. По образованию он филолог и богослов. Заметим, однако, что, несмотря на свое богословское «происхождение», это был выдающийся материалист, философские идеи которого шагнули далеко за пределы своего времени.
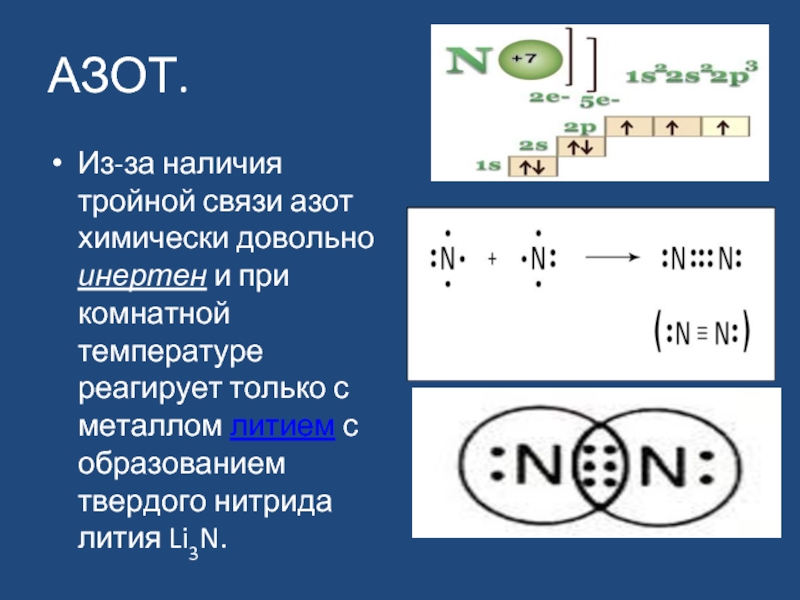
Слайд 12АЗОТ.
Из-за наличия тройной связи азот химически довольно инертен и при комнатной
Слайд 13Если в мире что-то происходит само по себе, значит, природе это
Эту энергию химики называют энергией связи, и она может большой или маленькой. Чем больше эта энергия, тем прочнее химическая связь.
Тройная связь азота образует самую стабильную из всех известных двухатомных молекул. Нужно приложить колоссальные усилия, чтобы разрушить эту связь.
Тройная связь в молекуле азота очень прочна, при ее образовании выделяется много энергии. Атомы азота в молекуле N2 трехвалентны, они связаны друг с другом тремя электронными парами.
Слайд 22Где вода может замёрзнуть при температуре +20 °C?
Вода может замёрзнуть в
Слайд 26Аммиак NH3 —
бесцветный газ с резким характерным запахом, почти в
Слайд 27Ион гидроксония.
Говоря об ионах H+ делается упрощение, так как в воде
НХ + H2O ↔ H3O+ + Х-
Слайд 28Схема образования молекулы азотной кислоты.
1. Атом водорода связывается с атомом кислорода
Слайд 29
3. Два неспаренных электрона атома азота образуют ковалентную связь со вторым
Слайд 30
4. Третий атом кислорода, возбуждаясь, образует свободную 2р-орбиталь путем спаривания неспаренных
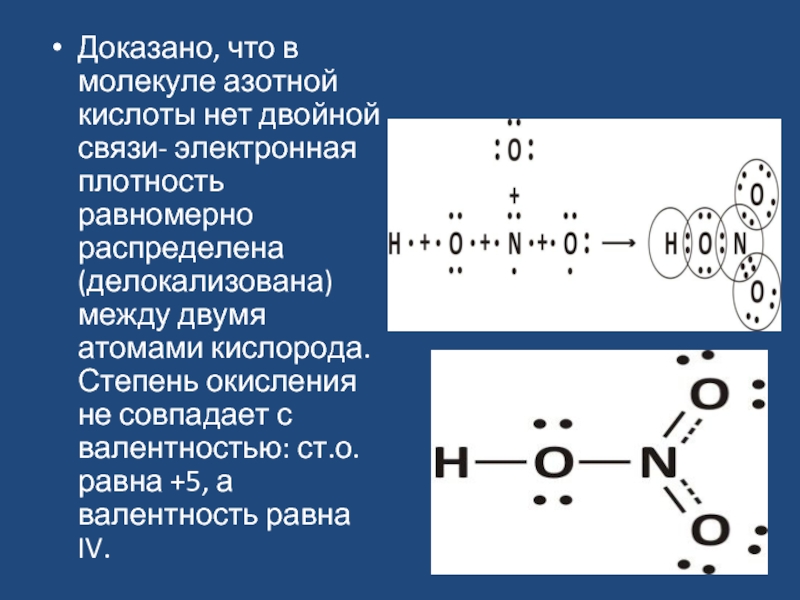
Слайд 32
Доказано, что в молекуле азотной кислоты нет двойной связи- электронная плотность
Слайд 33«Строение молекулы угарного газа (оксида углерода(II)) СО»
Молекула CO имеет тройную связь,
Благодаря наличию тройной связи молекула CO весьма прочная.