- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Адсорбционные явления. Общая характеристика адсорбции презентация
Содержание
- 2. Адсорбционные явления
- 4. Общая характеристика адсорбции Адсорбция в общем случае
- 5. Для А и Г можно записать:
- 6. A = f(C) (T = const) –
- 7. где Г – гиббсовская адсорбция
- 8. Принимая во внимание, что
- 10. Зависимости поверхностного натяжения и адсорбции от концентрации
- 12. Поверхностная активность. Классификация веществ по поверхностной
- 14. Поверхностно-активные вещества (ПАВ) Рис. 6 Полярная
- 20. Молекулы ПАВ снижают интенсивность силового поля
- 21. Правило Дюкло – Траубе (эмпирическое) Поверхностная активность
- 22. Ориентация молекул ПАВ в поверхностном слое «частокол
- 23. Влияние длины углеводородных радикалов ПАВ на свойства
- 24. Строение адсорбционных слоев Рис. 10 Газообразный адсорбционный
- 25. Определение размеров молекул ПАВ В насыщенном адсорбционном
- 26. неполярный углеводородный радикал полярная группа
- 27. Практическое значение поверхностно-активных веществ 1. Производство ПАВ
- 29. Классификация поверхностно-активных веществ. ПАВ Водорастворимые (проявляют поверхностную
- 30. Анионные ПАВ – это органические соединения, которые
- 31. Классы поверхностно- активных веществ Анионные ПАВ (соли
- 32. Структуры некоторых анионных ПАВ Этоксилированный алкилкарбоксилат Алкилбензолсульфонат Диалкилсульфосукцинат
- 33. Катионные ПАВ
- 34. Структуры некоторых катионных ПАВ Соль алкиламина Алкил
- 35. Амфолитные (амфотерные) ПАВ – это соединения, содержащие
- 36. Неионогенные ПАВ – вещества, не диссоциирующие на
- 37. Особое значение имеют длинноцепочечные ПАВ с числом
- 38. Влияние длины углеводородных радикалов ПАВ на свойства
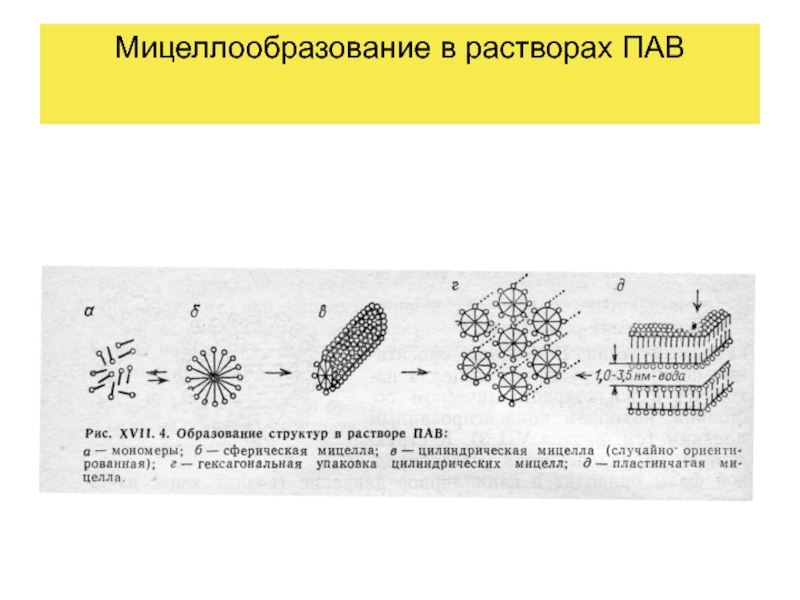
- 39. Мицеллообразование в растворах ПАВ. Критическая концентрация мицеллообразования
- 40. Метод определения ККМ по изменению поверхностного натяжения
- 41. Возникновение мицелл ПАВ соответствует переходу гомогенной системы
- 42. Методы определения ККМ σ – поверхностное натяжение
- 43. Способностью к мицеллообразованию обладают не все длинноцепочечные
- 44. Модели мицеллы На рис. 10, представлена схема
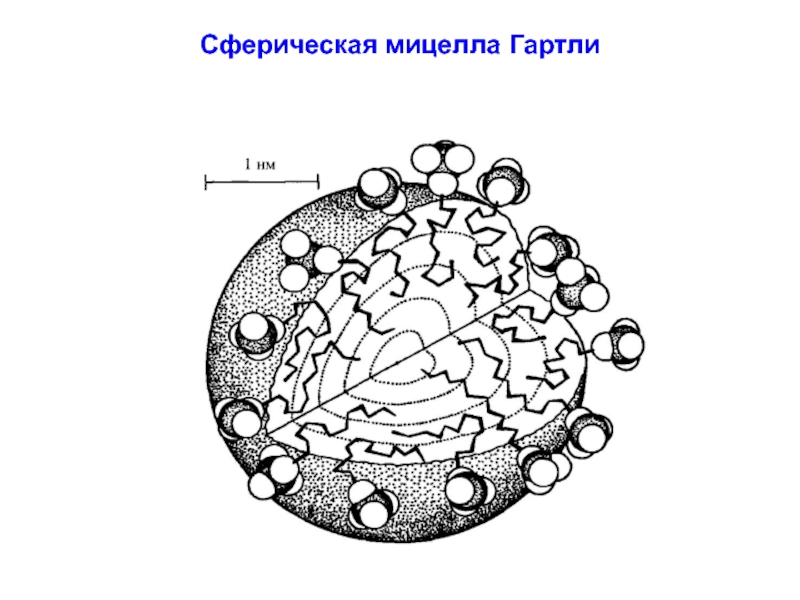
- 45. Сферическая мицелла Гартли
- 46. Вид ламелярных жидкокристаллических фаз
- 47. Явление солюбилизации Процесс растворения веществ в
- 48. Мицеллообразование в растворах ПАВ
- 49. Биконтинуальная структура ПАВ
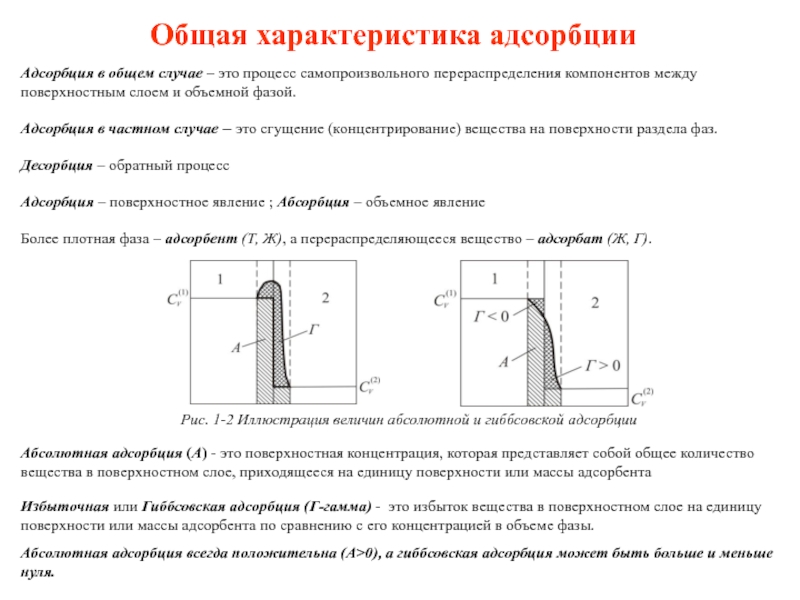
Слайд 4Общая характеристика адсорбции
Адсорбция в общем случае – это процесс самопроизвольного перераспределения
Адсорбция в частном случае – это сгущение (концентрирование) вещества на поверхности раздела фаз.
Десорбция – обратный процесс
Адсорбция – поверхностное явление ; Абсорбция – объемное явление
Более плотная фаза – адсорбент (Т, Ж), а перераспределяющееся вещество – адсорбат (Ж, Г).
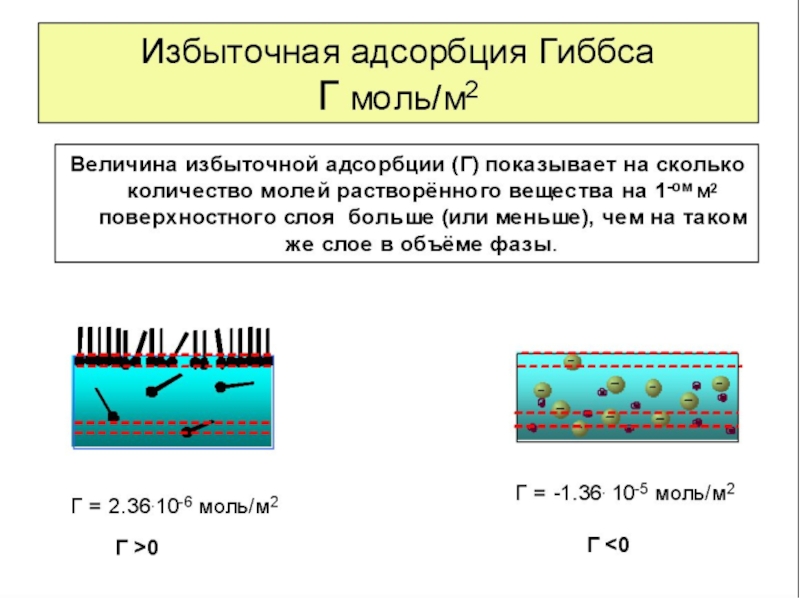
Абсолютная адсорбция (А) - это поверхностная концентрация, которая представляет собой общее количество вещества в поверхностном слое, приходящееся на единицу поверхности или массы адсорбента
Избыточная или Гиббсовская адсорбция (Г-гамма) - это избыток вещества в поверхностном слое на единицу поверхности или массы адсорбента по сравнению с его концентрацией в объеме фазы.
Абсолютная адсорбция всегда положительна (А>0), а гиббсовская адсорбция может быть больше и меньше нуля.
Рис. 1-2 Иллюстрация величин абсолютной и гиббсовской адсорбции
Слайд 5Для А и Г можно записать:
где CS – средняя концентрация вещества
VS – объем поверхностного слоя;
S – площадь поверхности;
hS – толщина поверхностного слоя.
(1)
(3)
(4)
где С0 и Ср – концентрации вещества в объеме раствора до и после адсорбции;
V – объем раствора;
S(m) – площадь поверхности (или масса) адсорбента.
(2)
где СV – концентрация в объеме.
Слайд 6A = f(C) (T = const) – изотерма;
A = f(T)
C = f(T) (A = const) – изостера.
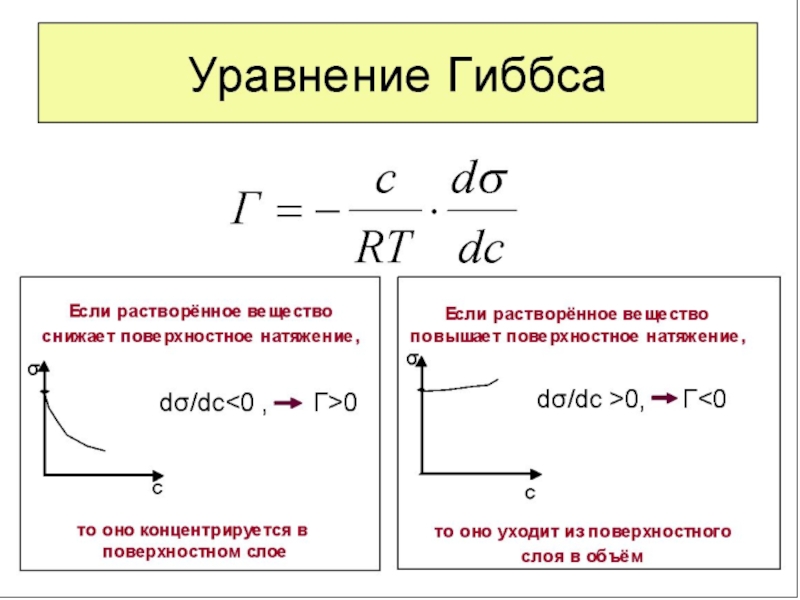
Адсорбционное уравнение Гиббса ( σ,μ,Г )
Воспользуемся методом избытков Гиббса (Vп.с.=0)
(5)
(6)
(7)
(8)
=>
Для поверхностного слоя при q=const
Рис. 3
Из уравнения (5) и (7) при V=0:
Слайд 7
где Г – гиббсовская адсорбция или плотность избытка массы i-го компонента
При постоянной температуре после преобразований соотношение (8) примет вид:
(9)
(10)
(11)
С учетом (11), будем иметь
(12)
Фундаментальное или общее уравнение Гиббса (12)
Запишем уравнение (12) для системы из двух компонентов – растворителя 1 и растворенного вещества 2:
(13)
В разбавленном растворе
будем иметь:
(14)
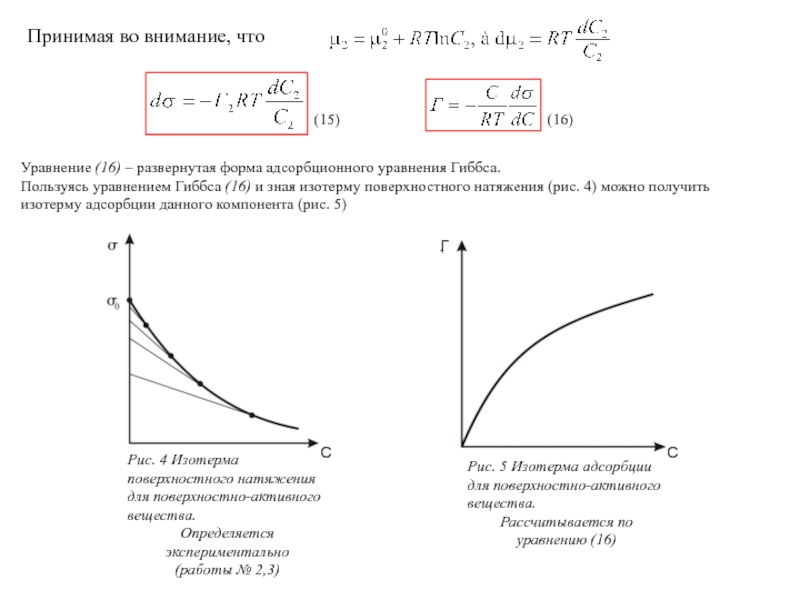
Слайд 8Принимая во внимание, что
(15)
(16)
Уравнение (16) – развернутая форма адсорбционного уравнения Гиббса.
Пользуясь уравнением Гиббса (16) и зная изотерму поверхностного натяжения (рис. 4) можно получить изотерму адсорбции данного компонента (рис. 5)
Рис. 4 Изотерма поверхностного натяжения для поверхностно-активного вещества.
Определяется экспериментально
(работы № 2,3)
Рис. 5 Изотерма адсорбции для поверхностно-активного вещества.
Рассчитывается по уравнению (16)
С
С
Г
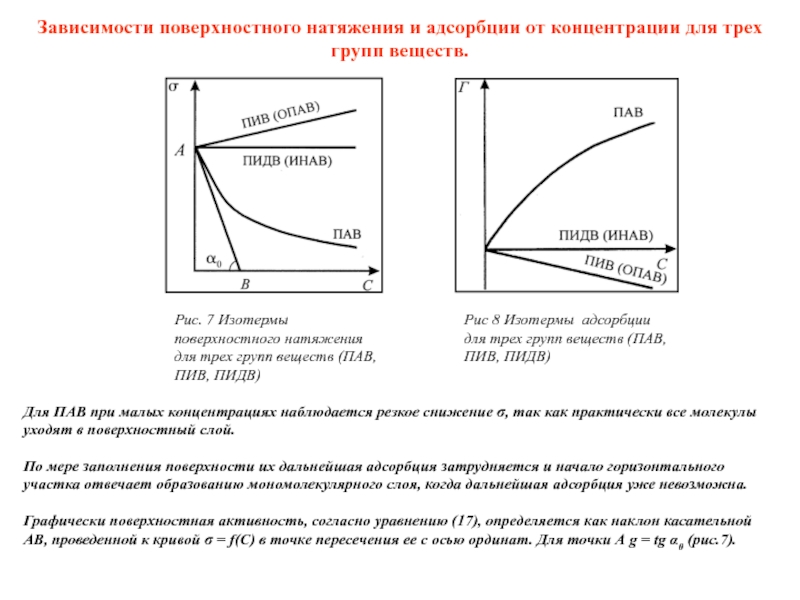
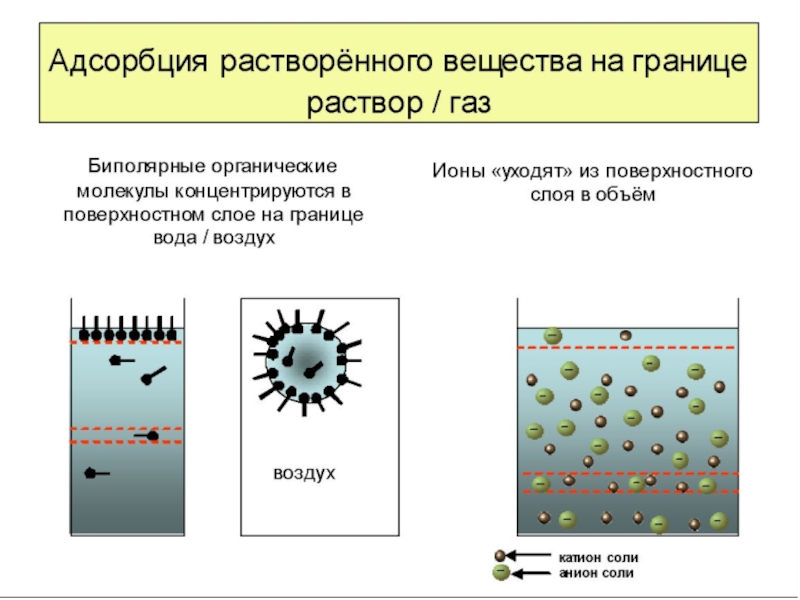
Слайд 10Зависимости поверхностного натяжения и адсорбции от концентрации для трех групп веществ.
Для
уходят в поверхностный слой.
По мере заполнения поверхности их дальнейшая адсорбция затрудняется и начало горизонтального
участка отвечает образованию мономолекулярного слоя, когда дальнейшая адсорбция уже невозможна.
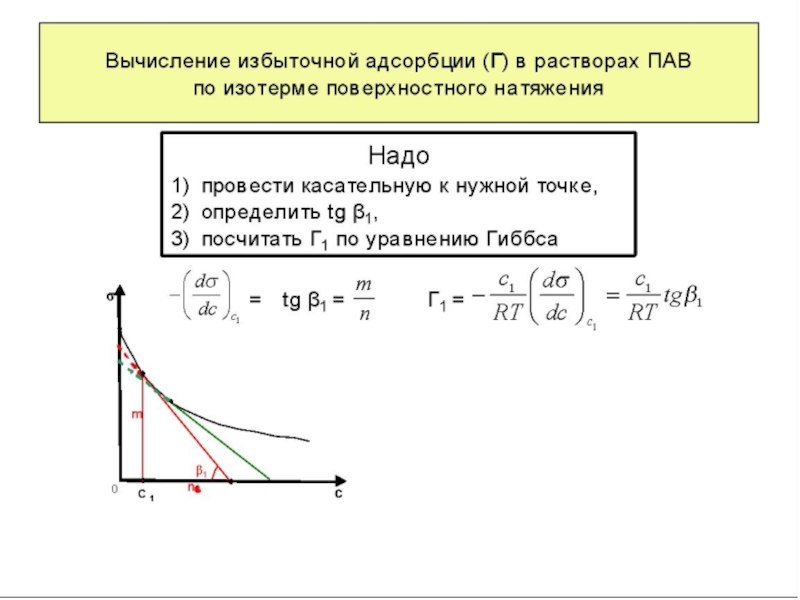
Графически поверхностная активность, согласно уравнению (17), определяется как наклон касательной
АВ, проведенной к кривой σ = f(C) в точке пересечения ее с осью ординат. Для точки А g = tg α0 (рис.7).
Рис. 7 Изотермы поверхностного натяжения для трех групп веществ (ПАВ, ПИВ, ПИДВ)
Рис 8 Изотермы адсорбции для трех групп веществ (ПАВ, ПИВ, ПИДВ)
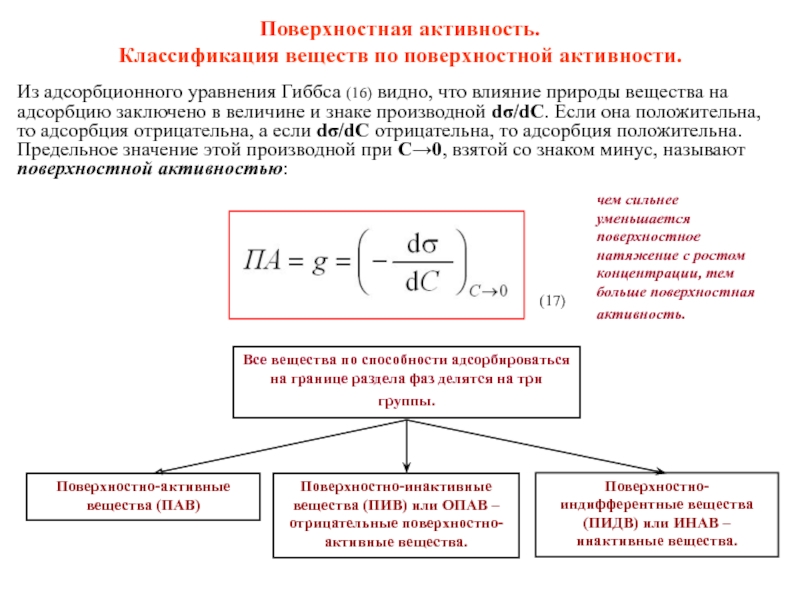
Слайд 12Поверхностная активность.
Классификация веществ по поверхностной активности.
чем сильнее уменьшается поверхностное натяжение
(17)
Из адсорбционного уравнения Гиббса (16) видно, что влияние природы вещества на адсорбцию заключено в величине и знаке производной dσ/dC. Если она положительна, то адсорбция отрицательна, а если dσ/dC отрицательна, то адсорбция положительна. Предельное значение этой производной при C→0, взятой со знаком минус, называют поверхностной активностью:
Все вещества по способности адсорбироваться на границе раздела фаз делятся на три группы.
Поверхностно-активные вещества (ПАВ)
Поверхностно-инактивные вещества (ПИВ) или ОПАВ – отрицательные поверхностно-активные вещества.
Поверхностно-индифферентные вещества (ПИДВ) или ИНАВ – инактивные вещества.
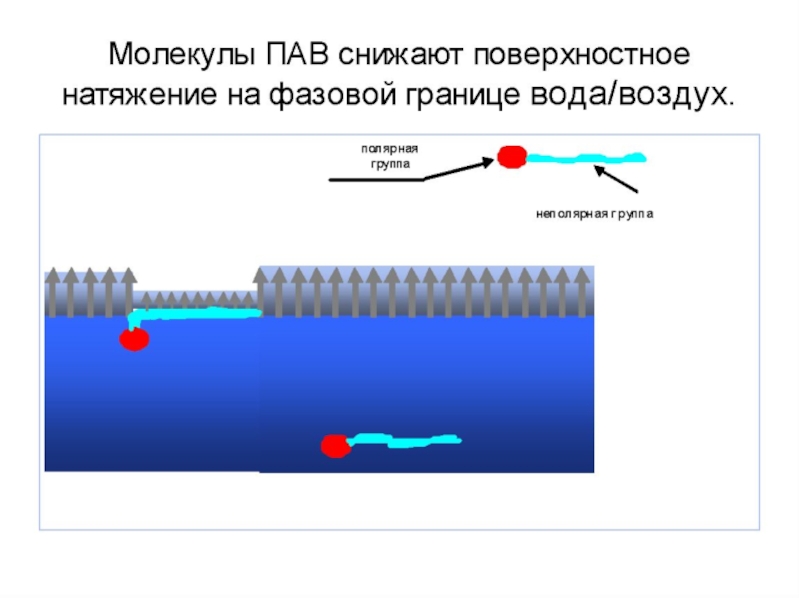
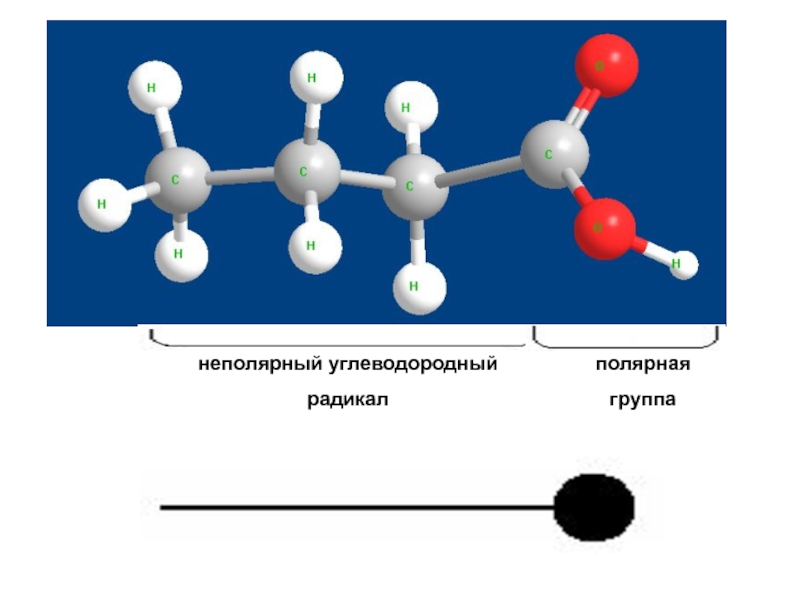
Слайд 14Поверхностно-активные вещества (ПАВ)
Рис. 6
Полярная
часть
Неполярная
часть
Примеры:
1. Основа мыла – стеараты
Схематичное изображение молекулы ПАВ
Для таких веществ g > 0, dσ/dC < 0, Г >0
Поверхностно-активные вещества способны накапливаться в поверхностном слое и снижать при этом поверхностное натяжение.
Характерные особенности ПАВ:
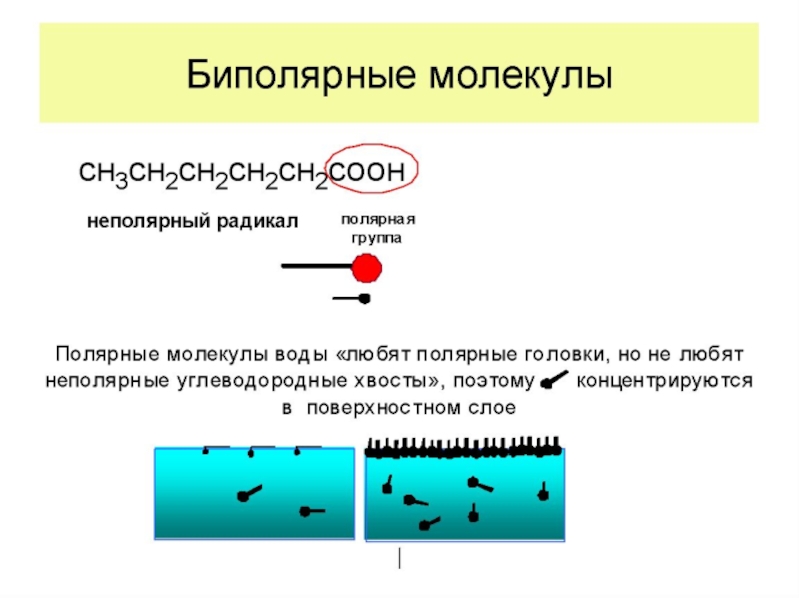
1) Дифильность молекулы, то есть она состоит из двух разных частей – неполярной (углеводородного радикала) и полярной, представленной функциональными группами
-СООН, -NH2, -OH, -NO2, -SH, -CNS.
Это – органические кислоты, амины, спирты, белки, мыла и т. д.
На границе водный раствор–воздух полярная группа ПАВ втягивается в воду, а неполярный радикал выталкивается в неполярную фазу (воздух). В результате молекулы ПАВ концентрируются (адсорбируются) на поверхности.
2) σпав < σ0 (растворителя)
Замена молекул растворителя в поверхностном слое на молекулы ПАВ является энергетически выгодной.
3) Малая растворимость
2. ПАВ (в пищевой промышлености) лимонная кислота, белки, эфиры сахарозы, жирные кислоты, фосфолипиды (↓σ до 30-50 мДж/м²)
1 группа
Слайд 18 g < 0; dσ/dC
Для ПИВ характерно стремление уйти с поверхности в
объем раствора,
Отрицательная гиббсовская адсорбция (Г< 0) для ПИВ
означает, что концентрация вещества в объеме больше,
чем на поверхности.
Характерные особенности:
1) Имеют 2 одинаковые части (полярные), не имеют
гидрофобной части. Характеризуются сильным
взаимодействием с молекулами растворителя.
2) σ > σ0
3) Хорошая растворимость - беспечивает переход молекул
в глубь раствора, а большое значение поверхностного
натяжения способствует замене молекул ПИВ в
поверхностном слое на молекулы растворителя.
Таким условиям отвечают неорганические основания,
кислоты, соли в водных растворах.
Поверхностно-индифферентные вещества (ПИДВ) или инактивные вещества (ИНАВ)
g = 0; dσ/dC = 0; Г = 0
Они равномерно распределяются
между объемом фазы и
поверхностным слоем.
У них создается баланс полярной и
неполярной частей, и поверхностное
натяжение оказывается близким к
поверхностному натяжению растворителя.
Примером таких веществ являются
глицерин, все сахара.
Поверхностно-инактивные вещества (ПИВ) или ОПАВ – отрицательные поверхностно-активные вещества.
2 группа
3 группа
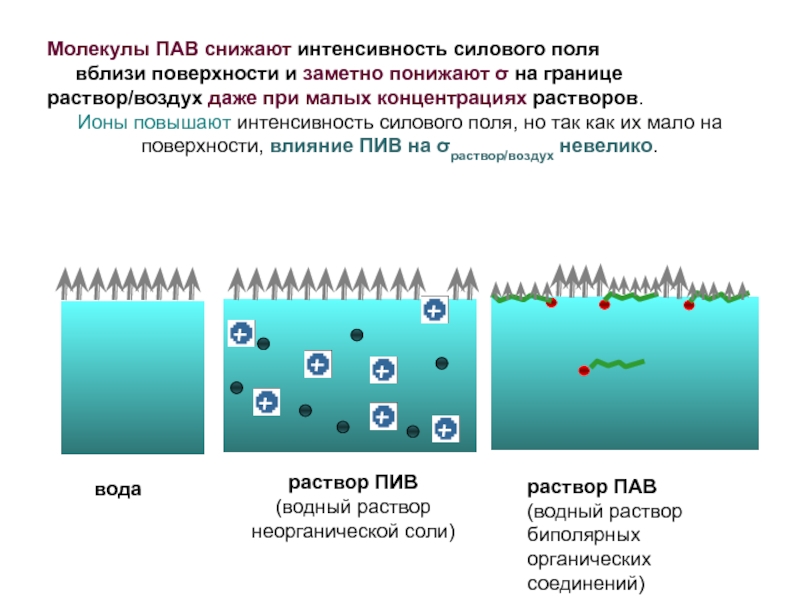
Слайд 20Молекулы ПАВ снижают интенсивность силового поля
вблизи поверхности
Ионы повышают интенсивность силового поля, но так как их мало на поверхности, влияние ПИВ на σраствор/воздух невелико.
вода
раствор ПИВ
(водный раствор
неорганической соли)
раствор ПАВ
(водный раствор
биполярных
органических
соединений)
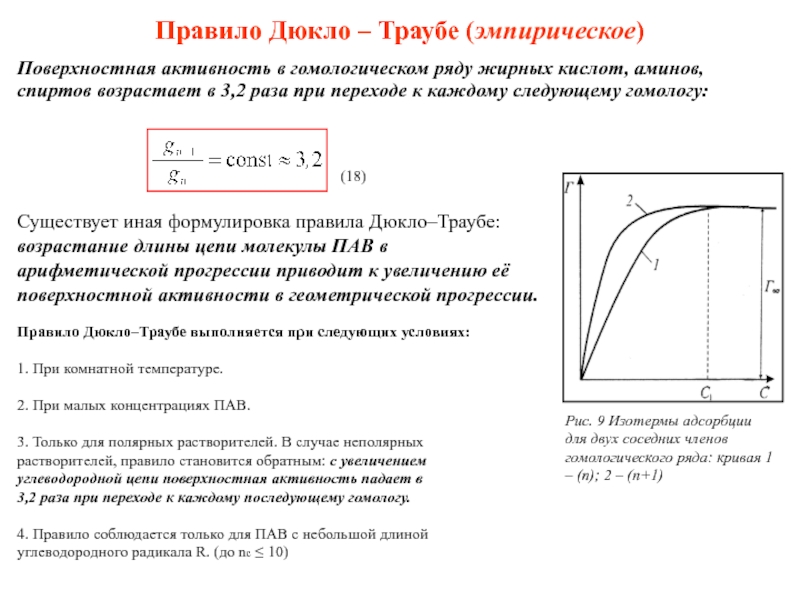
Слайд 21Правило Дюкло – Траубе (эмпирическое)
Поверхностная активность в гомологическом ряду жирных кислот,
Существует иная формулировка правила Дюкло–Траубе: возрастание длины цепи молекулы ПАВ в арифметической прогрессии приводит к увеличению её поверхностной активности в геометрической прогрессии.
(18)
Рис. 9 Изотермы адсорбции для двух соседних членов гомологического ряда: кривая 1 – (n); 2 – (n+1)
Правило Дюкло–Траубе выполняется при следующих условиях:
1. При комнатной температуре.
2. При малых концентрациях ПАВ.
3. Только для полярных растворителей. В случае неполярных
растворителей, правило становится обратным: с увеличением
углеводородной цепи поверхностная активность падает в
3,2 раза при переходе к каждому последующему гомологу.
4. Правило соблюдается только для ПАВ с небольшой длиной
углеводородного радикала R. (до nc ≤ 10)
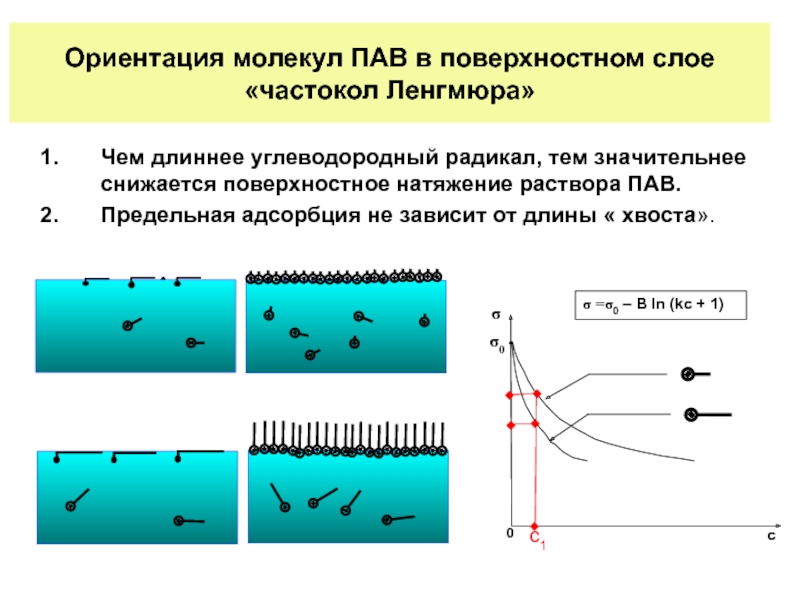
Слайд 22Ориентация молекул ПАВ в поверхностном слое
«частокол Ленгмюра»
Чем длиннее углеводородный радикал, тем
Предельная адсорбция не зависит от длины « хвоста».
σ0
с1
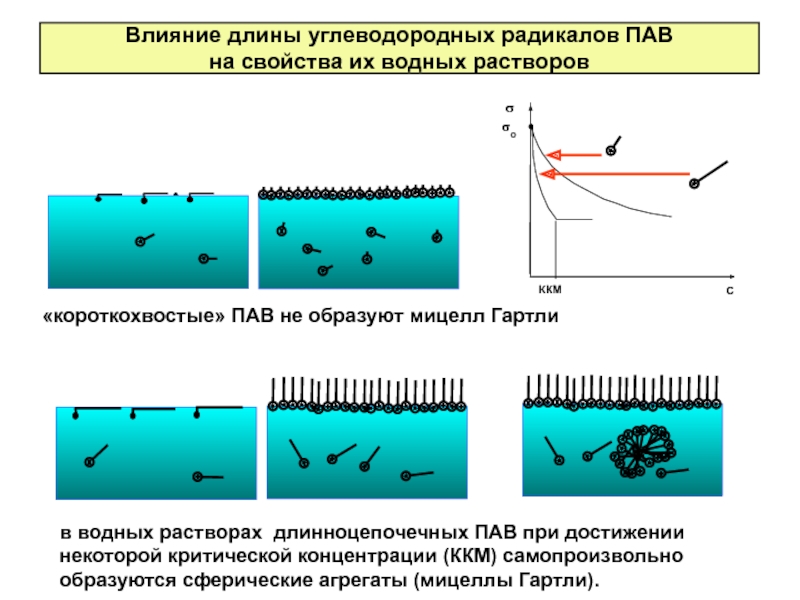
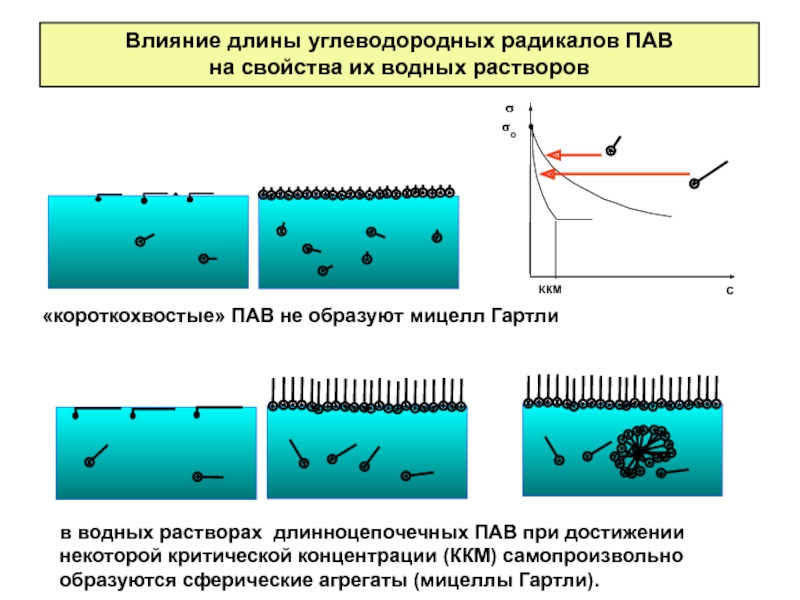
Слайд 23Влияние длины углеводородных радикалов ПАВ
на свойства их водных растворов
«короткохвостые» ПАВ не
в водных растворах длинноцепочечных ПАВ при достижении некоторой критической концентрации (ККМ) самопроизвольно образуются сферические агрегаты (мицеллы Гартли).
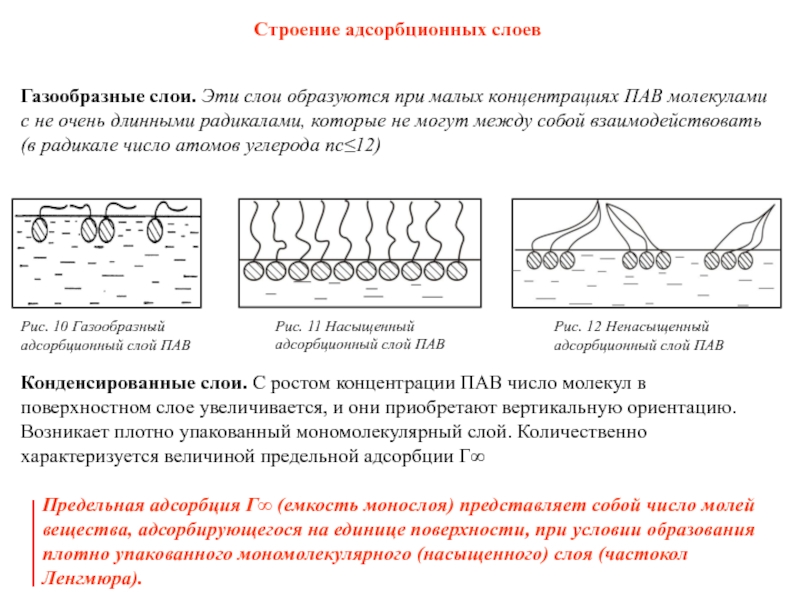
Слайд 24Строение адсорбционных слоев
Рис. 10 Газообразный адсорбционный слой ПАВ
Рис. 11 Насыщенный адсорбционный
Рис. 12 Ненасыщенный адсорбционный слой ПАВ
Газообразные слои. Эти слои образуются при малых концентрациях ПАВ молекулами с не очень длинными радикалами, которые не могут между собой взаимодействовать (в радикале число атомов углерода nс≤12)
Конденсированные слои. С ростом концентрации ПАВ число молекул в поверхностном слое увеличивается, и они приобретают вертикальную ориентацию. Возникает плотно упакованный мономолекулярный слой. Количественно характеризуется величиной предельной адсорбции Г∞
Предельная адсорбция Г∞ (емкость монослоя) представляет собой число молей вещества, адсорбирующегося на единице поверхности, при условии образования плотно упакованного мономолекулярного (насыщенного) слоя (частокол Ленгмюра).
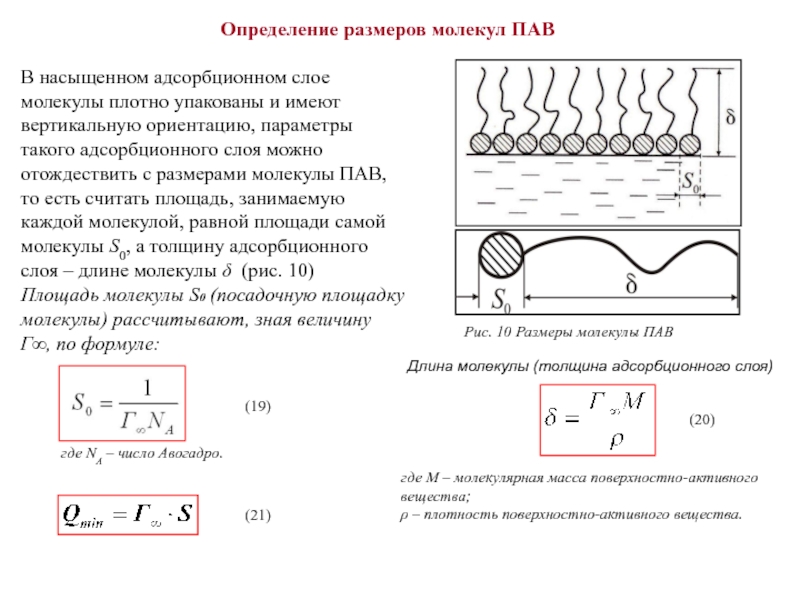
Слайд 25Определение размеров молекул ПАВ
В насыщенном адсорбционном слое молекулы плотно упакованы и
Рис. 10 Размеры молекулы ПАВ
где М – молекулярная масса поверхностно-активного вещества;
ρ – плотность поверхностно-активного вещества.
где NA – число Авогадро.
Площадь молекулы S0 (посадочную площадку молекулы) рассчитывают, зная величину Г∞, по формуле:
(19)
(20)
Длина молекулы (толщина адсорбционного слоя)
(21)
Слайд 27Практическое значение поверхностно-активных веществ
1. Производство ПАВ – наиболее распространенный синтетический продукт
2. Ассортимент ПАВ – тысячи наименований. Цена до 300$ за 1 кг
3. Они обладают особыми свойствами – производство и использование ПАВ определяется их биоразлагаемость. Они находят широкое применение в народном хозяйстве.
Поверхностно-активные вещества при адсорбции на поверхности могут радикально изменять ее свойства и тем самым менять течение процессов, происходящих на границе раздела фаз.
1) Уменьшение поверхностного натяжения на межфазных границах способствует понижению прочности материалов при дроблении и резании, добыче нефти, бурении.
2) Возможность тонкого регулирования условий смачивания поверхностей.
3) Модифицирование поверхности, то есть нанесение на нее прочно закрепленного адсорбционного слоя, применяется для изменения свойств наполнителей резин, синтетических полимеров.
4) Придание гидрофобности поверхности путем введения ПАВ используется для предотвращения слеживания удобрений, защиты металлов от коррозии. При обработке растений ядохимикатами необходима гидрофилизация листьев поверхностно-активными веществами.
5) ПАВ широко применяются как моющие средства (детергенты).
К основным потребителям ПАВ относятся:
1) горнодобывающая, металлообрабатывающая и перерабатывающая промышленности (добыча нефти,)
2) флотационное обогащение руд и транспорт (смазки, смазочно-охлаждающие жидкости – СОЖ)
3) промышленность полимерных материалов (пластификаторы, активаторы, наполнители), строительная, пищевая, парфюмерия, фармацевтическая, полиграфическая и др.
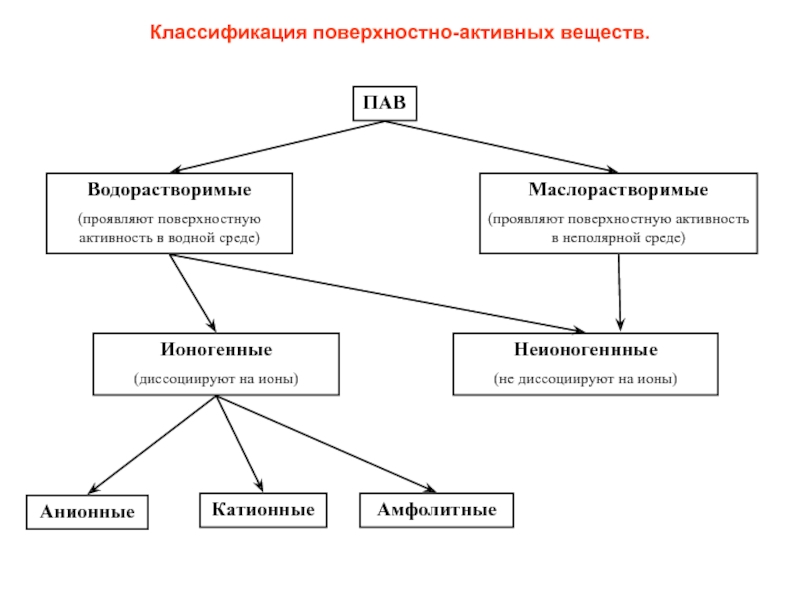
Слайд 29Классификация поверхностно-активных веществ.
ПАВ
Водорастворимые
(проявляют поверхностную активность в водной среде)
Маслорастворимые
(проявляют поверхностную активность в
Ионогенные
(диссоциируют на ионы)
Неионогеннные
(не диссоциируют на ионы)
Анионные
Катионные
Амфолитные
Слайд 30Анионные ПАВ – это органические соединения, которые диссоциируют на небольшой катион
К анионным ПАВ относятся соли карбоновых кислот, олеат натрия (калия) − C17H33COONa(K); миристат натрия (калия) − C13H27COONa(K), а также соли сульфоновых кислот – алкилсульфонаты − RSO3Na, алкиларилсульфонаты − RArSO3K, где R − CnH2n+1, Ar – C6H5 и др. Используются как смачиватели, эмульгаторы, как основные компоненты пенообразователей, мыл, кремов, паст, порошков.
Катионные ПАВ – вещества, диссоциирующие с образованием крупного поверхностно-активного катиона и небольшого аниона (Cl-, SO42−), не обладающего поверхностной активностью. Крупный радикал с катионной группой адсорбируется на поверхности и придает ей положительный заряд. Эти вещества проявляют поверхностную активность только при пониженном значении pH, то есть в кислой среде.
Наиболее "жесткие" к разложению из всех поверхностно-активных веществ. Они токсичны, что используется для изготовления бактерицидных и дезинфицирующих препаратов на основе этих веществ, а также для изготовления лекарств, антистатиков, закрепителей при крашении, ингибиторов коррозии.
Молекула анионного ПАВ
Молекула катионного ПАВ
Сl–, где R: С12Н25-
С14Н29-
+
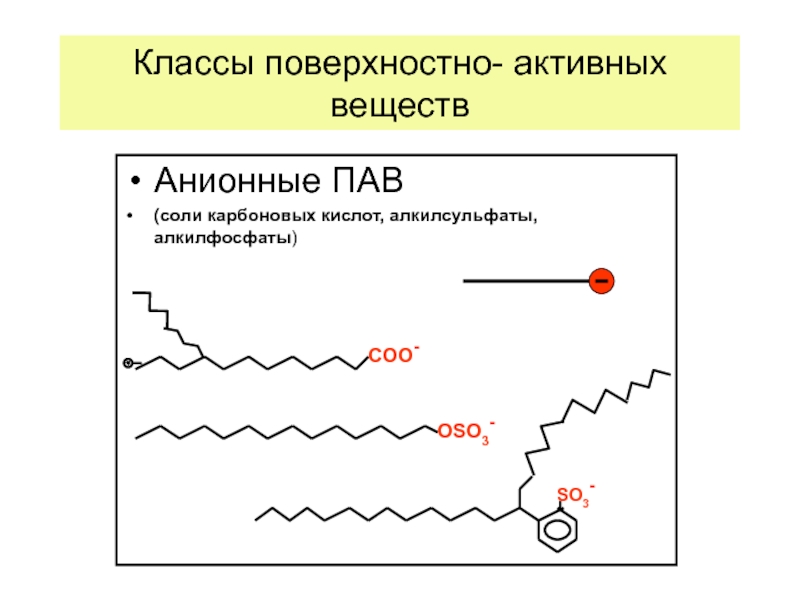
Слайд 31Классы поверхностно- активных веществ
Анионные ПАВ
(соли карбоновых кислот, алкилсульфаты, алкилфосфаты)
ОSO3-
COO-
SO3-
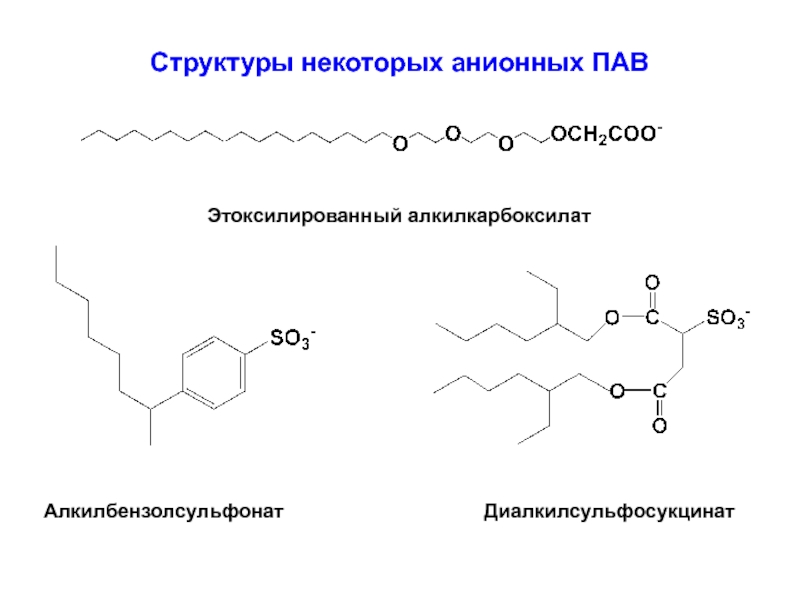
Слайд 32Структуры некоторых анионных ПАВ
Этоксилированный алкилкарбоксилат
Алкилбензолсульфонат
Диалкилсульфосукцинат
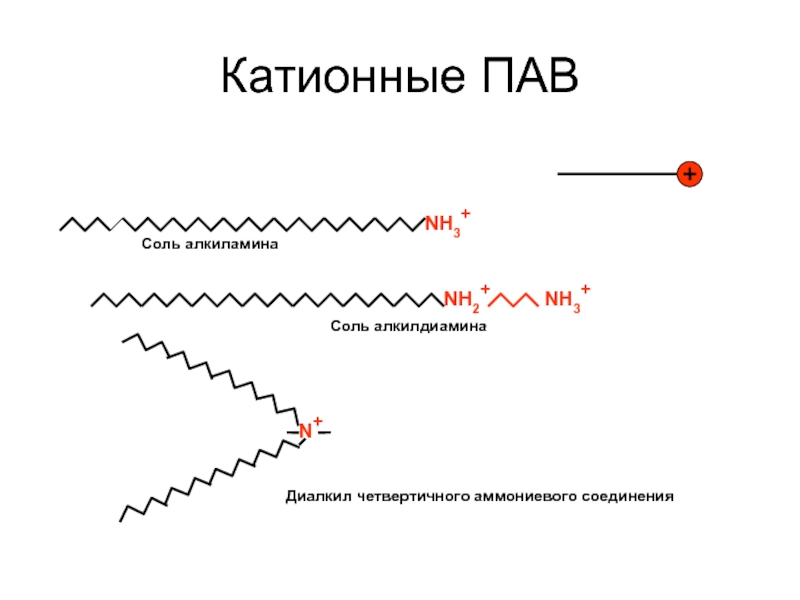
Слайд 33Катионные ПАВ
NH3+
NH2+
NH3+
N+
Диалкил четвертичного аммониевого соединения
Соль алкилдиамина
Соль алкиламина
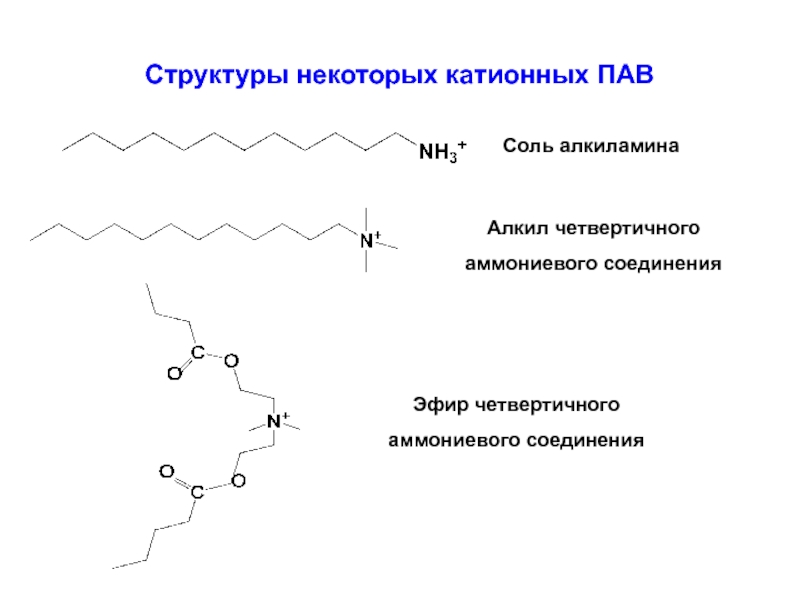
Слайд 34Структуры некоторых катионных ПАВ
Соль алкиламина
Алкил четвертичного
аммониевого соединения
Эфир четвертичного
аммониевого соединения
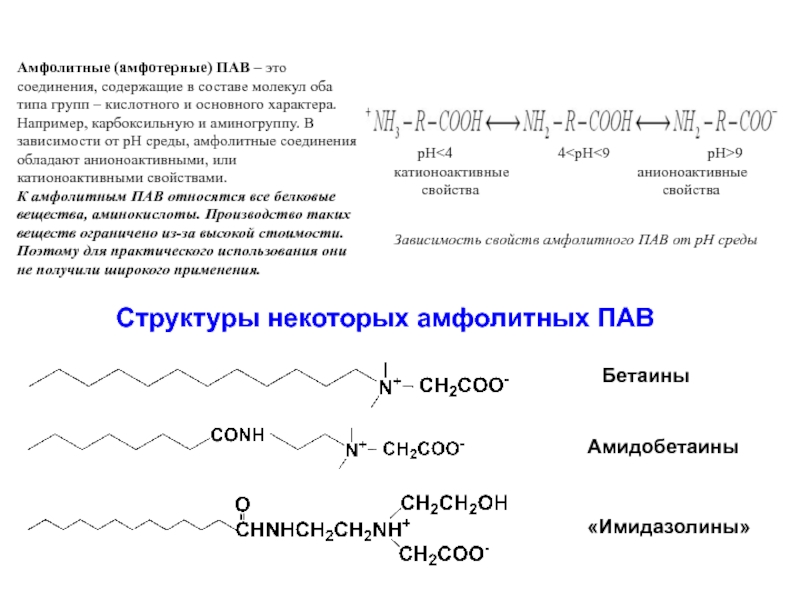
Слайд 35Амфолитные (амфотерные) ПАВ – это соединения, содержащие в составе молекул оба
К амфолитным ПАВ относятся все белковые вещества, аминокислоты. Производство таких веществ ограничено из-за высокой стоимости. Поэтому для практического использования они не получили широкого применения.
Зависимость свойств амфолитного ПАВ от pH среды
pH<4 4 Структуры некоторых амфолитных ПАВ Бетаины Амидобетаины «Имидазолины»
катионоактивные анионоактивные
cвойства cвойства
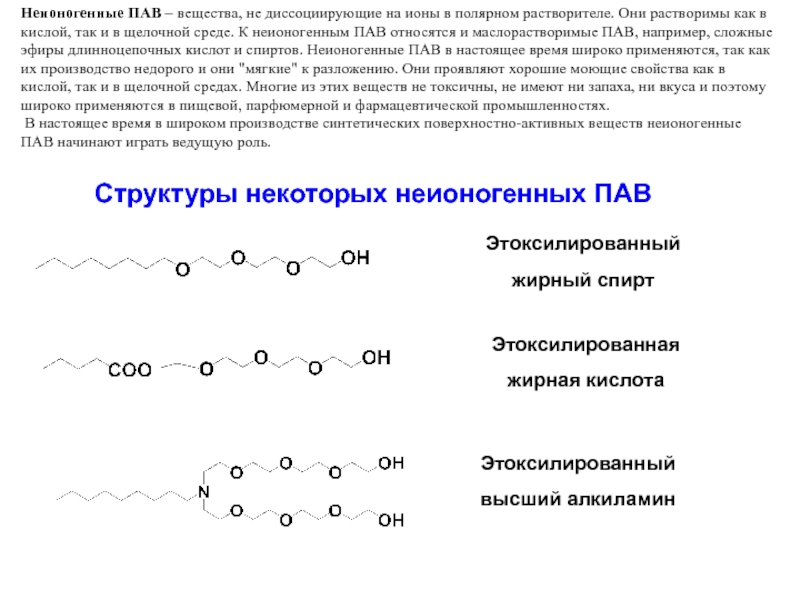
Слайд 36Неионогенные ПАВ – вещества, не диссоциирующие на ионы в полярном растворителе.
В настоящее время в широком производстве синтетических поверхностно-активных веществ неионогенные ПАВ начинают играть ведущую роль.
Структуры некоторых неионогенных ПАВ
Этоксилированный
жирный спирт
Этоксилированная
жирная кислота
Этоксилированный
высший алкиламин
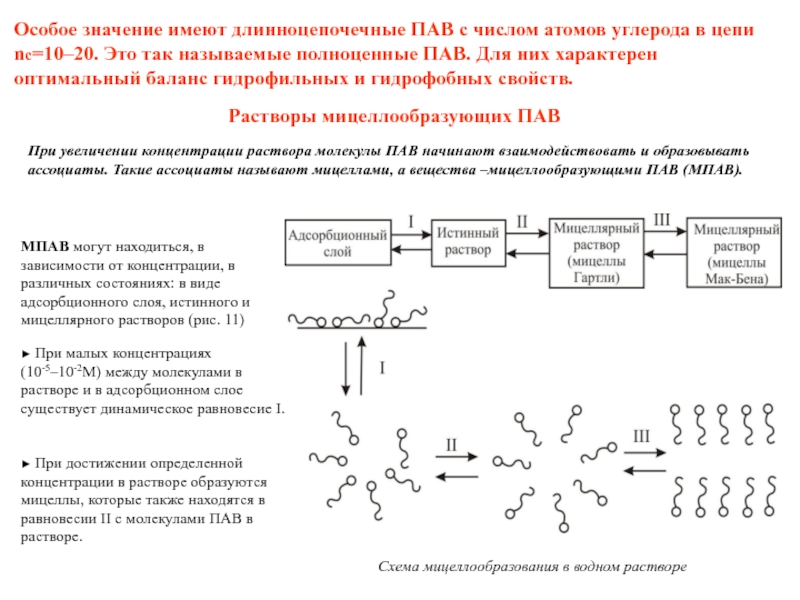
Слайд 37Особое значение имеют длинноцепочечные ПАВ с числом атомов углерода в цепи
Растворы мицеллообразующих ПАВ
При увеличении концентрации раствора молекулы ПАВ начинают взаимодействовать и образовывать ассоциаты. Такие ассоциаты называют мицеллами, а вещества –мицеллообразующими ПАВ (МПАВ).
Схема мицеллообразования в водном растворе
МПАВ могут находиться, в зависимости от концентрации, в различных состояниях: в виде адсорбционного слоя, истинного и мицеллярного растворов (рис. 11)
► При малых концентрациях
(10-5–10-2М) между молекулами в растворе и в адсорбционном слое существует динамическое равновесие I.
► При достижении определенной концентрации в растворе образуются
мицеллы, которые также находятся в равновесии II с молекулами ПАВ в растворе.
Слайд 38Влияние длины углеводородных радикалов ПАВ
на свойства их водных растворов
«короткохвостые» ПАВ не
в водных растворах длинноцепочечных ПАВ при достижении некоторой критической концентрации (ККМ) самопроизвольно образуются сферические агрегаты (мицеллы Гартли).
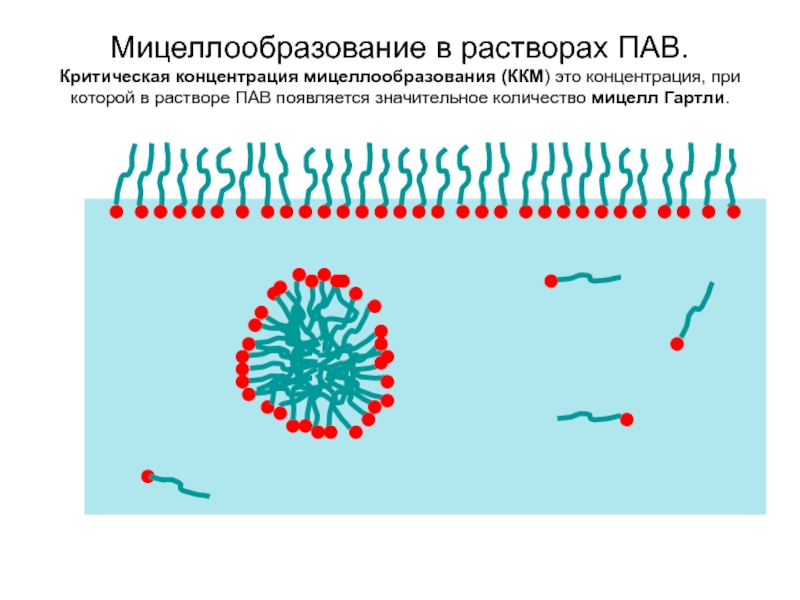
Слайд 39Мицеллообразование в растворах ПАВ. Критическая концентрация мицеллообразования (ККМ) это концентрация, при которой
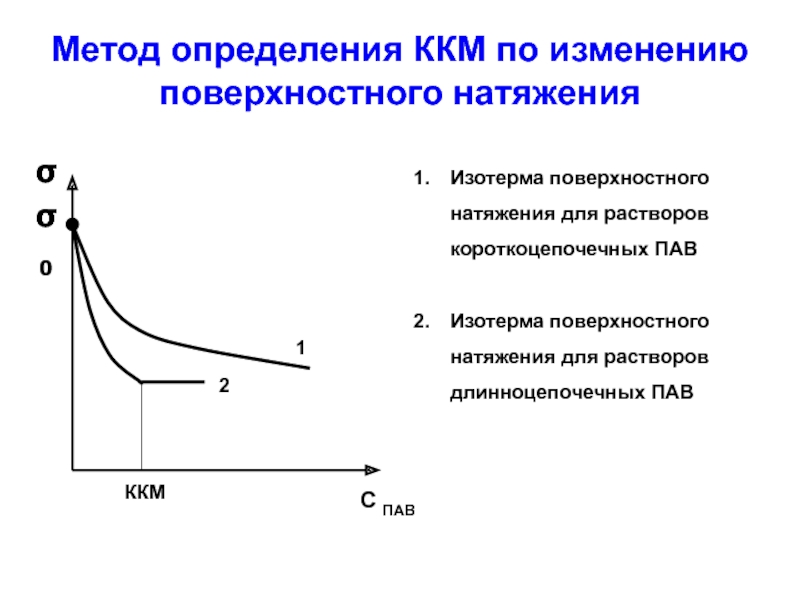
Слайд 40Метод определения ККМ по изменению поверхностного натяжения
σ
С ПАВ
ККМ
σ0
1
2
Изотерма поверхностного натяжения для
Изотерма поверхностного натяжения для растворов длинноцепочечных ПАВ
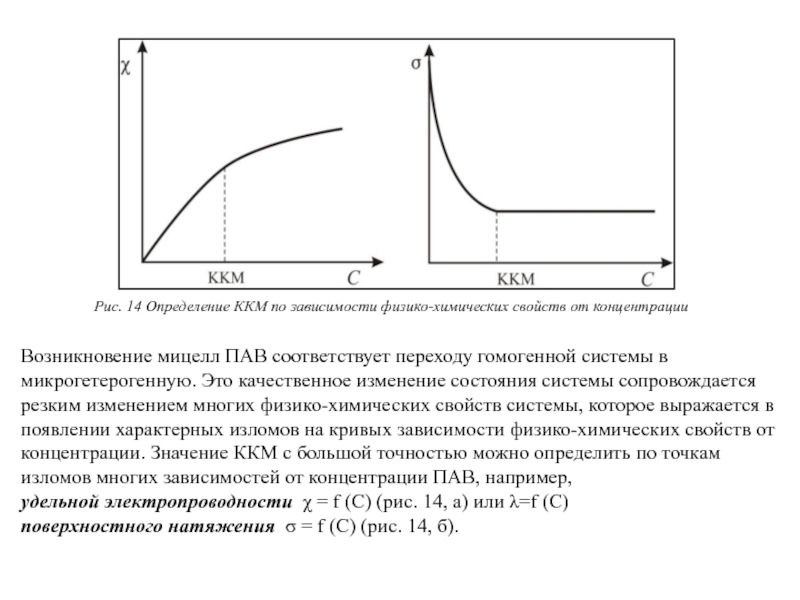
Слайд 41Возникновение мицелл ПАВ соответствует переходу гомогенной системы в микрогетерогенную. Это качественное
удельной электропроводности χ = f (С) (рис. 14, а) или λ=f (C)
поверхностного натяжения σ = f (С) (рис. 14, б).
Рис. 14 Определение ККМ по зависимости физико-химических свойств от концентрации
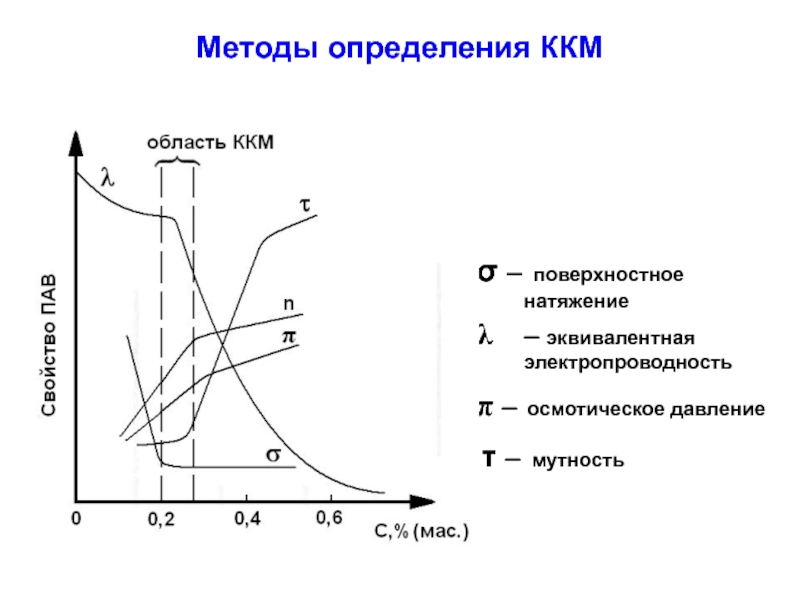
Слайд 42Методы определения ККМ
σ – поверхностное натяжение
– эквивалентная электропроводность
π –
τ – мутность
Слайд 43Способностью к мицеллообразованию обладают не все длинноцепочечные ПАВ, а только те,
Числа ГЛБ можно рассчитать по методу групповых чисел. Он основан на вкладе различных групп в общий гидрофильно-липофильный баланс молекулы:
ГЛБПАВ = 7 + Σ (ГЛБ)г – Σ (ГЛБ)л или ГЛБ = 7 + ΣNi (21)
где Σ (ГЛБ)г – сумма ГЛБ всех гидрофильных групп;
Σ (ГЛБ)л – сумма ГЛБ всех липофильных (гидрофобных) групп.
Суммирование ведется с учетом знака группового числа Ni. Он положителен для гидрофильных групп и отрицателен – для липофильных.
Чем выше число ГЛБ, тем больше баланс сдвинут в сторону гидрофильных (полярных) свойств ПАВ. Для мицеллообразующих ПАВ необходимо, чтобы обе части были достаточно ярко выражены.
Существует понятие критической концентрации мицеллообразования (ККМ). Это тот концентрационный предел, выше которого в растворе уже присутствует экспериментально фиксируемое количество мицелл.
Если концентрация ПАВ превышает ККМ в 40–50 раз, то мицеллы вместе с молекулами растворителя образуют жидкокристаллическую структуру, которая постепенно через гелеобразную переходит в твердокристаллическую.
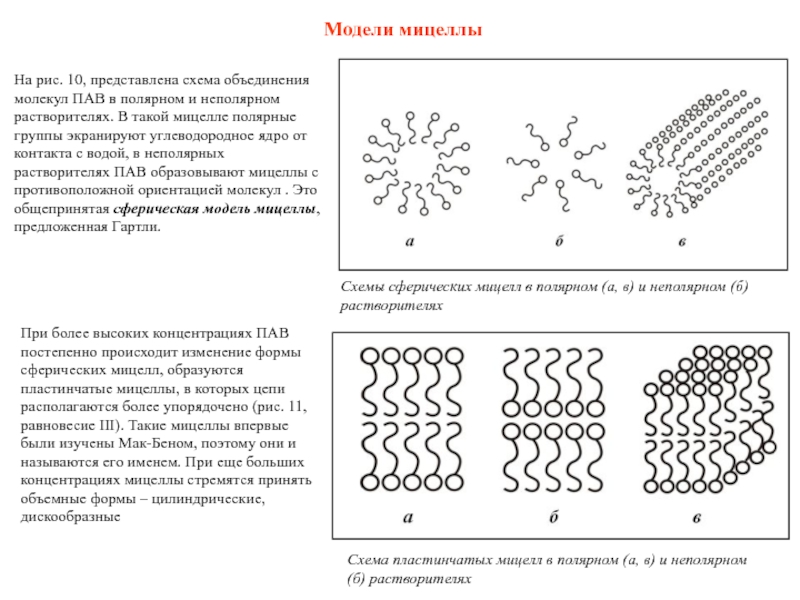
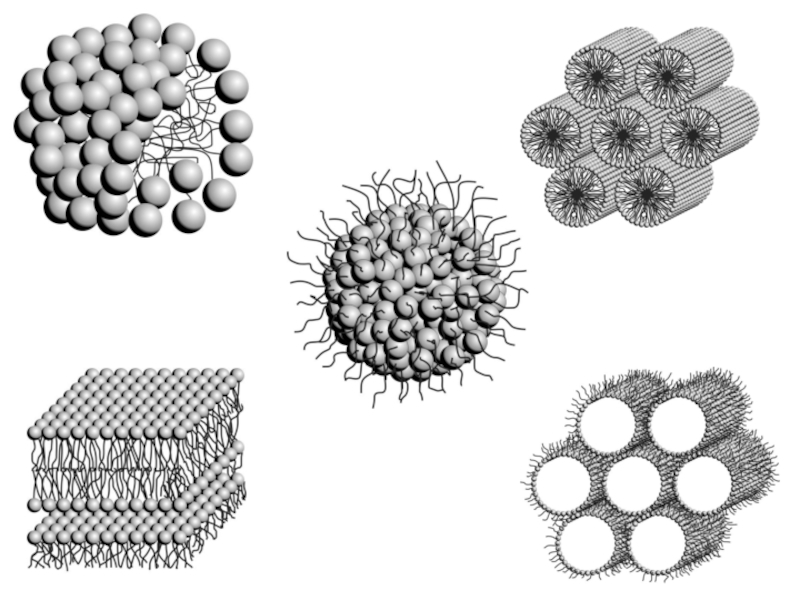
Слайд 44Модели мицеллы
На рис. 10, представлена схема объединения молекул ПАВ в полярном
При более высоких концентрациях ПАВ постепенно происходит изменение формы сферических мицелл, образуются пластинчатые мицеллы, в которых цепи располагаются более упорядочено (рис. 11, равновесие III). Такие мицеллы впервые были изучены Мак-Беном, поэтому они и называются его именем. При еще больших концентрациях мицеллы стремятся принять объемные формы – цилиндрические, дискообразные
Схемы сферических мицелл в полярном (а, в) и неполярном (б) растворителях
Схема пластинчатых мицелл в полярном (а, в) и неполярном (б) растворителях
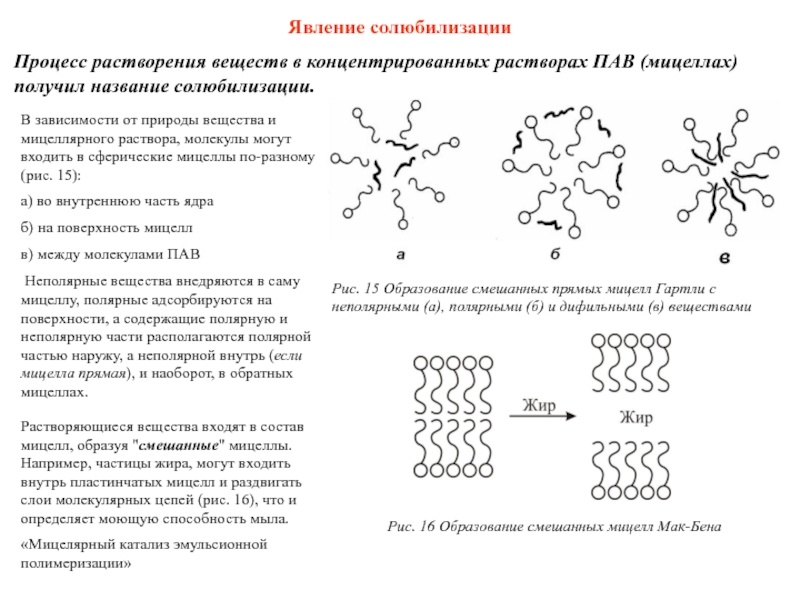
Слайд 47Явление солюбилизации
Процесс растворения веществ в концентрированных растворах ПАВ (мицеллах) получил
В зависимости от природы вещества и мицеллярного раствора, молекулы могут входить в сферические мицеллы по-разному (рис. 15):
a) во внутреннюю часть ядра
б) на поверхность мицелл
в) между молекулами ПАВ
Неполярные вещества внедряются в саму мицеллу, полярные адсорбируются на поверхности, а содержащие полярную и неполярную части располагаются полярной частью наружу, а неполярной внутрь (если мицелла прямая), и наоборот, в обратных мицеллах.
Растворяющиеся вещества входят в состав мицелл, образуя "смешанные" мицеллы. Например, частицы жира, могут входить внутрь пластинчатых мицелл и раздвигать слои молекулярных цепей (рис. 16), что и определяет моющую способность мыла.
«Мицелярный катализ эмульсионной полимеризации»
Рис. 15 Образование смешанных прямых мицелл Гартли с неполярными (а), полярными (б) и дифильными (в) веществами
Рис. 16 Образование смешанных мицелл Мак-Бена