- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация неорганических веществ презентация
Содержание
- 1. Классификация неорганических веществ
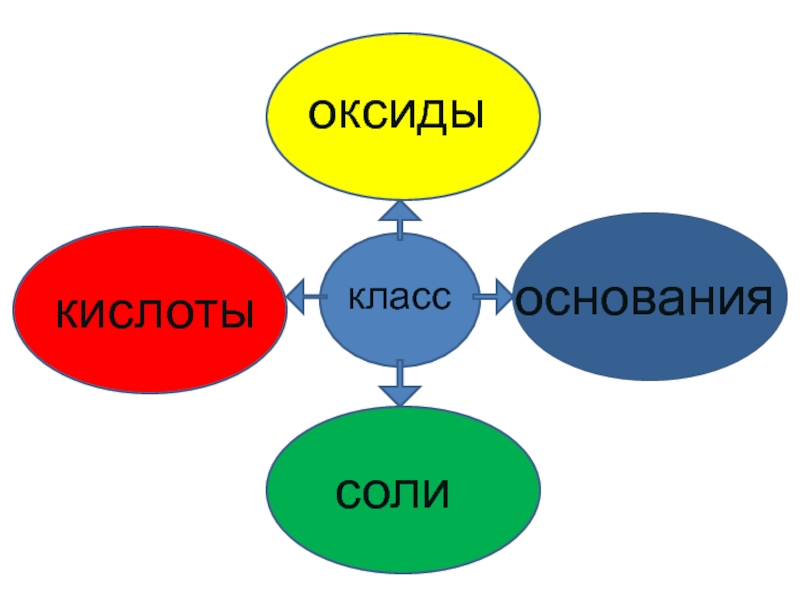
- 2. кислоты оксиды класс соли основания
- 3. Э – элемент О – кислород Н
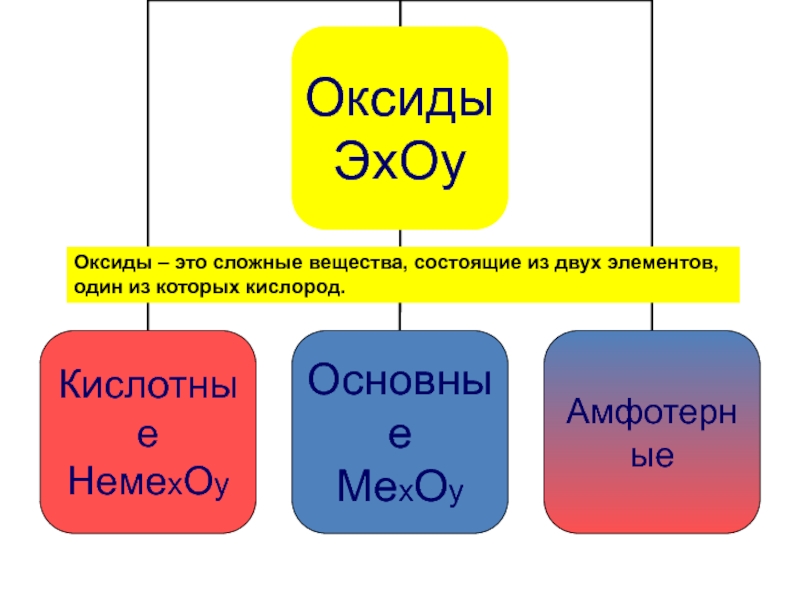
- 4. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород.
- 5. Основные оксиды – это оксиды металлов МехОy
- 6. Основные оксиды СаО – оксид кальция, негашеная
- 7. Кислотные оксиды – это оксиды неметаллов НемеО
- 8. Оксид углерода (IV)
- 9. Оксид углерода (IV) Большая
- 10. Оксид углерода (IV) Рост
- 11. SO2 Один из сильнейших
- 12. SO2 Оксид серы (IV) легко соединяется с
- 13. NO -> NO2 В выбросах некоторых
- 14. Оксид азота (IV) NO2 реагирует
- 15. Кислотные дожди Кислотные дожди поражают растительность, губят
- 16. Кислоты НхR Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков.
- 17. Соляная кислота НСl В начале 16 века
- 18. Кислотность желудка Соляная кислота запускает пищеварение во
- 19. Яблочная кислота Щавелевая кислота Аскорбиновая кислота Муравьиная кислота Кислоты вокруг нас
- 20. Основания Ме(ОН)х Основания – это сложные вещества, состоящие из атомов металла и гидроксогрупп
- 21. Основания МеОН Растворимые основания - щёлочи
- 22. Fe(OH)2 + H2O + O2 = Fe(OH)3
- 23. Соли МеxRy Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков
- 24. Поваренная соль NaCl Недостаток этой
- 25. Химия в саду Все удобрения относятся
- 26. Виды удобрений: Фосфат кальция Са3(РО4)2 сульфат
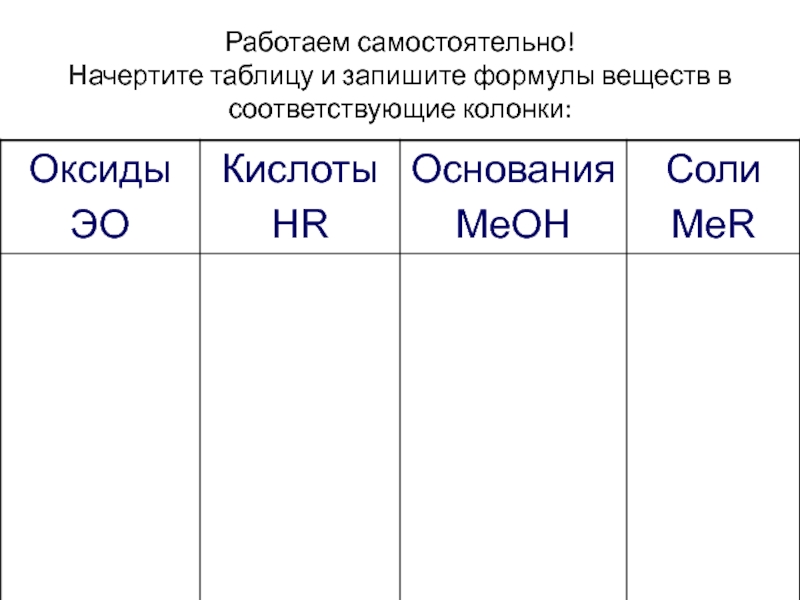
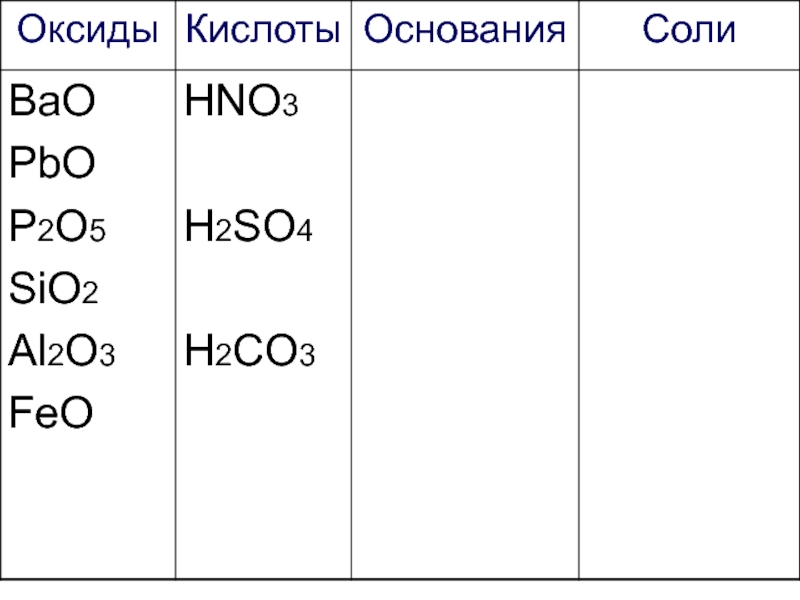
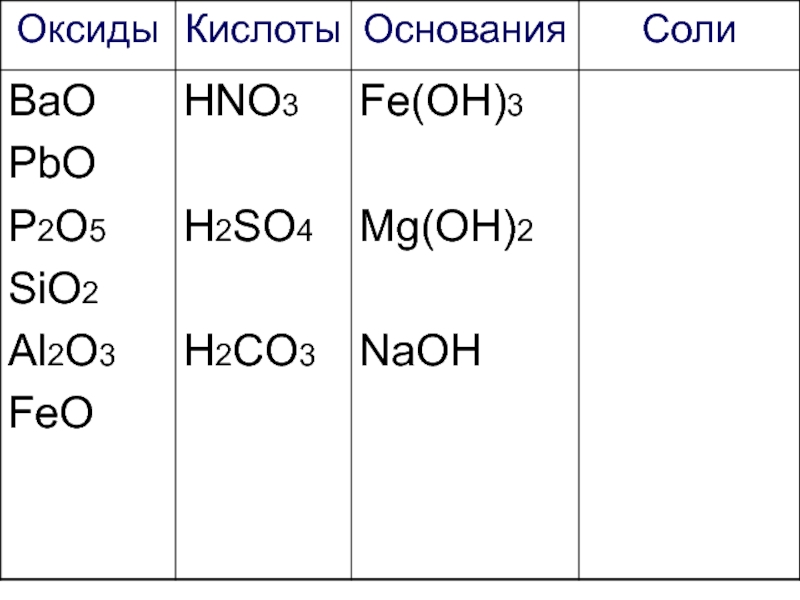
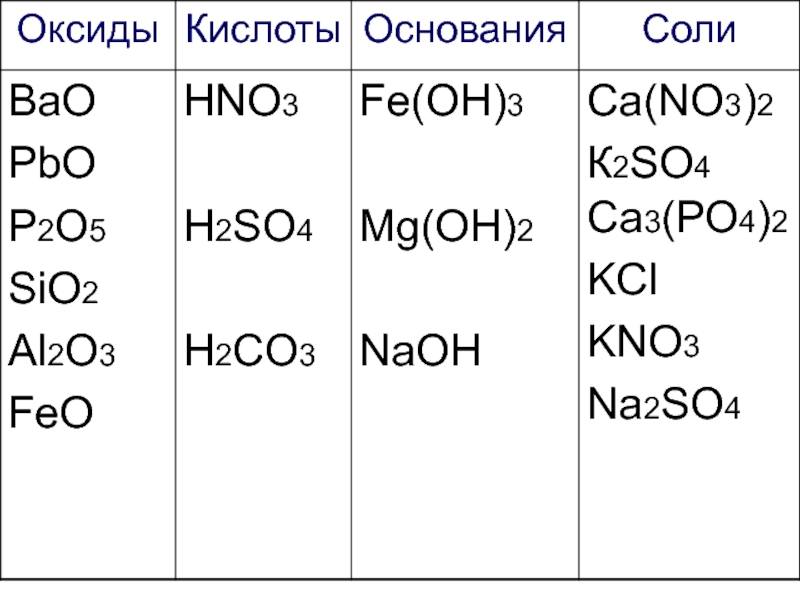
- 27. Работаем самостоятельно! Начертите таблицу и запишите формулы веществ в соответствующие колонки:
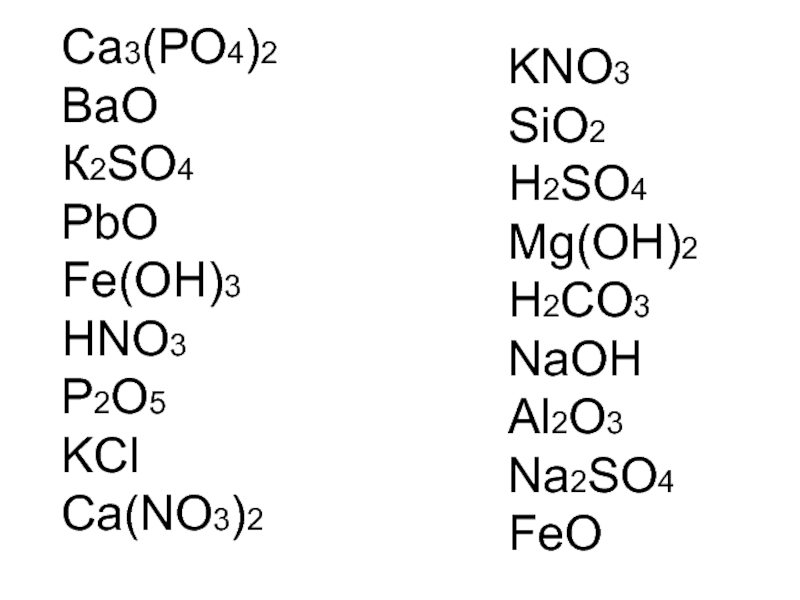
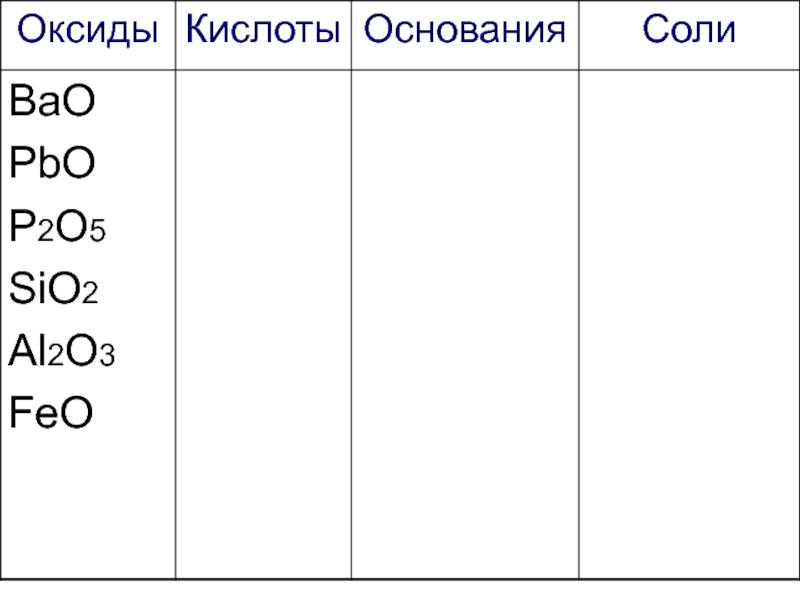
- 28. Са3(РО4)2 ВаО К2SO4 PbO Fe(OH)3 HNO3
Слайд 6Основные оксиды
СаО – оксид кальция, негашеная известь.
Nа2O – оксид натрия.
Входит в состав оконного стекла.
РbO – оксид свинца.
Входит в состав хрусталя.
Слайд 8Оксид углерода (IV)
Одной из проблем, имеющих глобальный
Деятельность человека привела к заметному истреблению растений, которые усваивают оксид углерода (IV) в процессе фотосинтеза.
Слайд 9Оксид углерода (IV)
Большая часть СО2
в атмосфере образуется
Слайд 10Оксид углерода (IV)
Рост концентрации оксида углерода (IV) в атмосфере
Таяние льдов Антарктиды
Затопление прибрежных зон
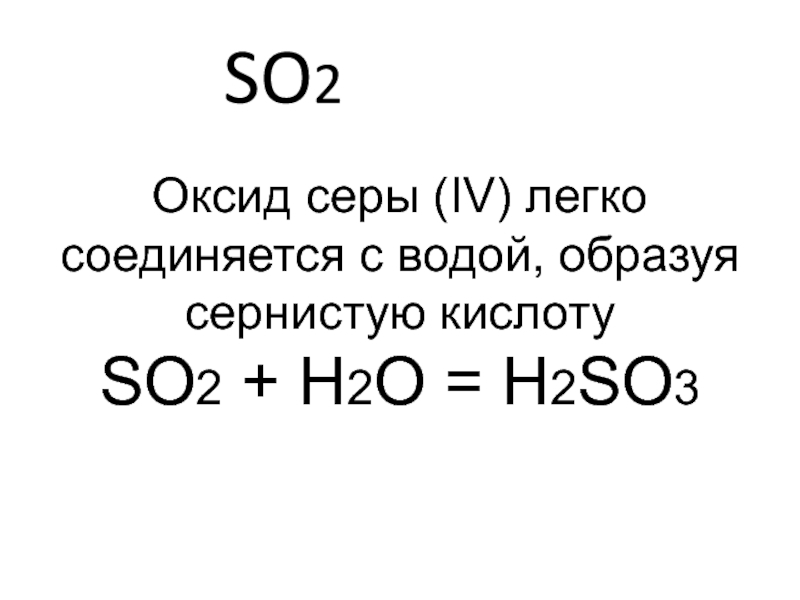
Слайд 11SO2
Один из сильнейших
Попадает в атмосферу при обжиге сульфидных руд для производства серной кислоты и некоторых металлов:
4FeS
2
+
11O
2
=
8SO
2
+
2Fe
2
O
3
Слайд 13NO -> NO2
В выбросах некоторых предприятий есть оксид азота (II).
Он
Тривиальное название оксида азота (IV) - «лисий хвост».
2NO + O2 = 2NO2
Слайд 14
Оксид азота (IV) NO2 реагирует
с водой с образованием азотной
3NO2 + H2O = 2HNO3 + + NO
Сернистая и азотная кислоты могут входить в состав «кислотных дождей».
Слайд 15Кислотные дожди
Кислотные дожди поражают растительность, губят живые организмы водоемов и почв,
Лес после кислотного дождя
Слайд 16Кислоты
НхR
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных
Слайд 17Соляная кислота НСl
В начале 16 века Парацельс предположил, что в желудке
В 1824 году английский врач и биохимик Уильям Праут определил, что кислотой, входящей в состав желудочного сока, является соляная кислота
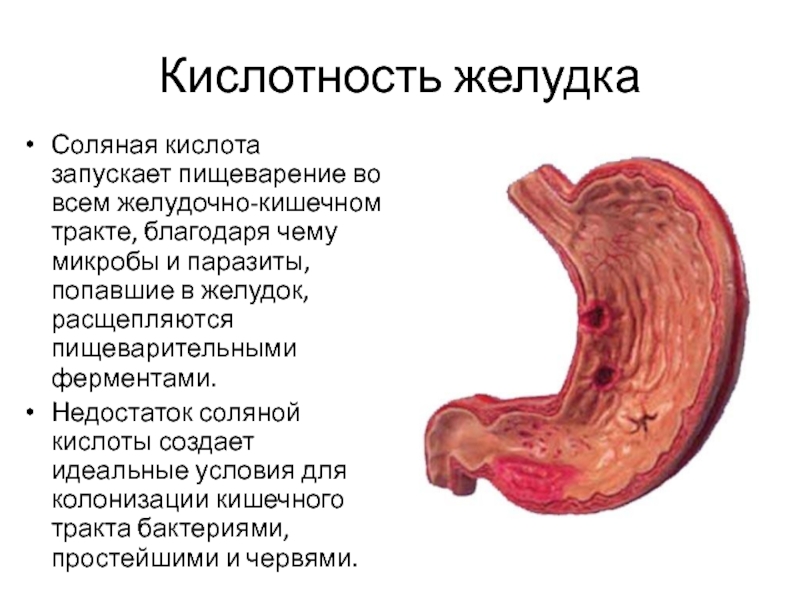
Слайд 18Кислотность желудка
Соляная кислота запускает пищеварение во всем желудочно-кишечном тракте, благодаря чему
Недостаток соляной кислоты создает идеальные условия для колонизации кишечного тракта бактериями, простейшими и червями.
Слайд 20Основания
Ме(ОН)х
Основания – это сложные вещества, состоящие из атомов металла и гидроксогрупп
Слайд 21Основания МеОН
Растворимые основания - щёлочи - содержатся в большом количестве
Их бытовые названия - каустическая сода (NaOH), каустический поташ (KOH), гашеная известь (Ca(OH)2)
Слайд 22Fe(OH)2 + H2O + O2 = Fe(OH)3
Ржавчина – это гидроксид железа
Вещество относится к классу оснований, точнее – нерастворимых оснований
Слайд 24Поваренная соль NaCl
Недостаток этой соли приводит к функциональным и
Суточная потребность в поваренной соли взрослого человека составляет 10-15 г
Слайд 25Химия в саду
Все удобрения относятся к классу солей.
Избыток и
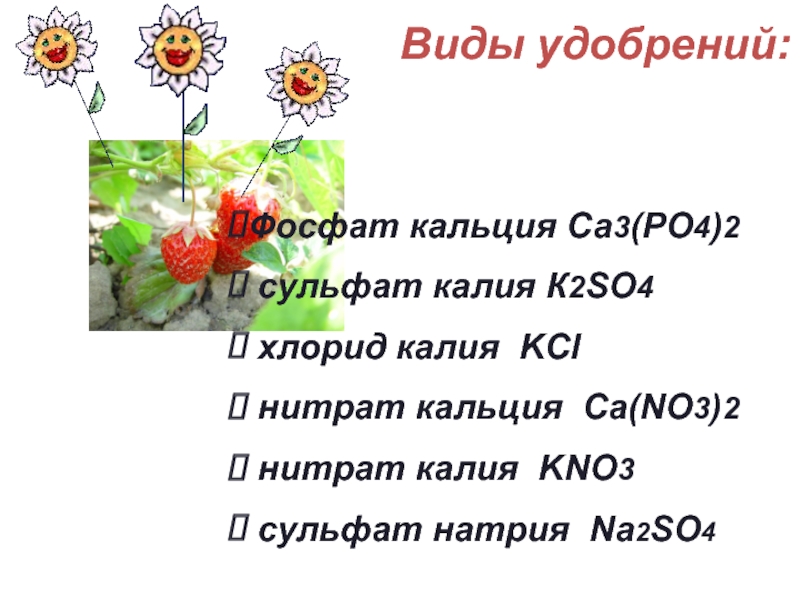
Слайд 26Виды удобрений:
Фосфат кальция Са3(РО4)2
сульфат калия К2SO4
хлорид калия KCl
нитрат
нитрат калия KNO3
сульфат натрия Na2SO4