- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия полимерных материалов для буровых растворов. Лекция 3. Технологические жидкости для бурения скважин презентация
Содержание
- 1. Химия полимерных материалов для буровых растворов. Лекция 3. Технологические жидкости для бурения скважин
- 2. ПОЛИМЕРЫ Три основных типа полимеров Природные Крахмал,
- 3. ПОЛИМЕРЫ Простейшим полимером является полиэтилен: (C2H4)n
- 4. ПОЛИМЕРЫ Область применения: Контроль фильтрации Регулирование вязкости
- 5. ПОЛИМЕРЫ Применение: Контроль фильтрации Стабилизация- КМЦ (низкой
- 6. ПОЛИМЕРЫ СТРУКТУРА ПОЛИМЕРОВ: ЛИНЕЙНАЯ -
- 7. ЛИНЕЙНАЯ СТРУКТУРА Примеры: КМЦ, ГЭЦ, Полиакрилат, PHPA
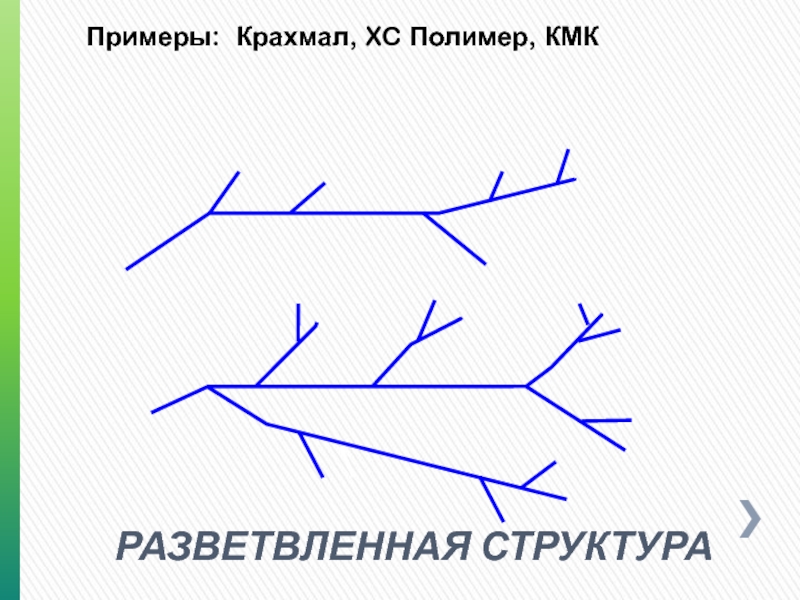
- 8. РАЗВЕТВЛЕННАЯ СТРУКТУРА Примеры: Крахмал, XC Полимер, КМК
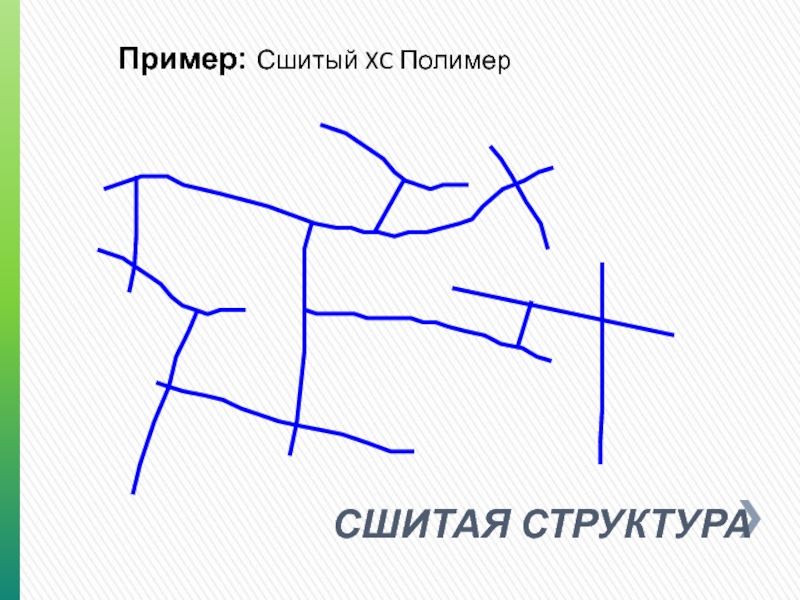
- 9. СШИТАЯ СТРУКТУРА Пример: Сшитый XC Полимер
- 10. ПОЛИМЕРЫ СТЕПЕНЬ ПОЛИМЕРИЗАЦИИ: Длина полимера, определяемая числом
- 11. ПОЛИМЕРЫ Длина цепи - Определяет функцию полимера
- 12. ПОЛИМЕРЫ СТЕПЕНЬ ЗАМЕЩЕНИЯ: Доля замещенных групп на
- 13. O O O H H
- 14. ХИМИЧЕСКИЕ СВОЙСТВА Трехмерная структура O O
- 15. O O O H
- 16. Модифицирующие агенты Монохлорацетат натрия Cl
- 17. Реакция замещения (первый способ) Щелочная
- 18. Реакция замещения (второй способ) Щелочная целлюлоза
- 19. ХИМИЧЕСКИЕ СВОЙСТВА - СТЕПЕНЬ ЗАМЕЩЕНИЯ
- 20. ХИМИЧЕСКИЕ СВОЙСТВА ФУНКЦИОНАЛЬНАЯ ГРУППА Функциональные группы разделяются
- 21. ХИМИЧЕСКИЕ СВОЙСТВА ФУНКЦИОНАЛЬНАЯ ГРУППА Гидроксильная (--ОН) Гидроксиэтильная
- 22. Концентрация функциональных групп на цепи молекулы влияет
- 23. Форма полимера Форма полимера зависит и от
- 24. Форма полимера _ - - -
- 25. - - - -
- 26. Форма большинства полимеров будет зависеть от pH
- 27. ФАКТОРЫ ВОЗДЕЙСТВУЮЩИЕ НА ЭФФЕКТИВНОСТЬ ПОЛИМЕРА Концентрация полимера
- 28. Природные полимеры
- 29. ПРИРОДНЫЕ ПОЛИМЕРЫ К природным полимерам относятся кукурузный
- 30. КРАХМАЛ Трехмерная структура O O O H
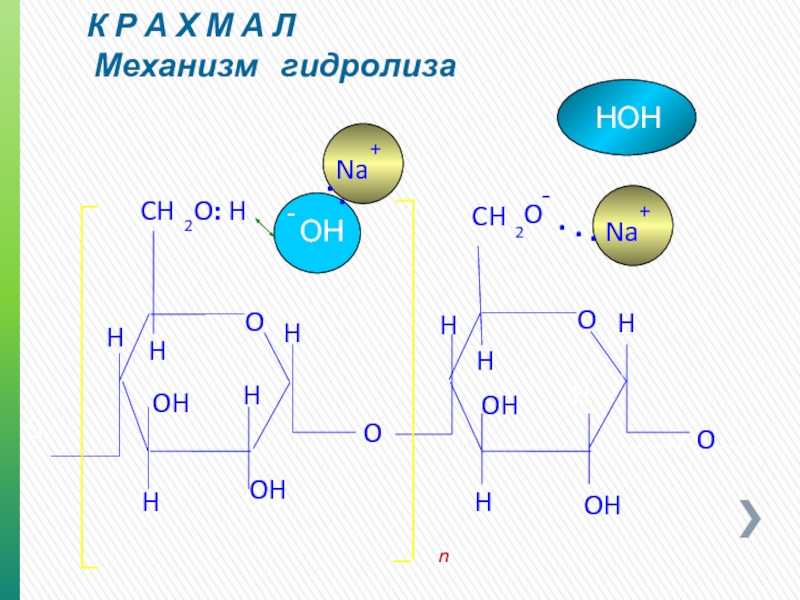
- 31. К Р А Х М А Л
- 32. ПРИРОДНЫЕ ПОЛИМЕРЫ Кукурузный крахмал Неионный (группа-ОН) Средняя молекулярная масса~100,000
- 33. Применение Контроль фильтрации Пресная вода
- 34. Факторы, ограничивающие применение Ферментация Высокий уровень кальция,
- 35. Крахмал O H H
- 36. XC POLYMER Биополимер - Xanthamonas Campestri Тип:
- 37. O H H H OH OH H
- 38. XC / XCD - ПОЛИМЕР Применение Загуститель
- 39. XC / XCD - ПОЛИМЕР Факторы, ограничивающие
- 40. МОДИФИЦИРОВАННЫЕ ПОЛИМЕРЫ МОДИФИЦИРОВАННЫЕ ЭФИРЫ ЦЕЛЛЮЛОЗЫ:
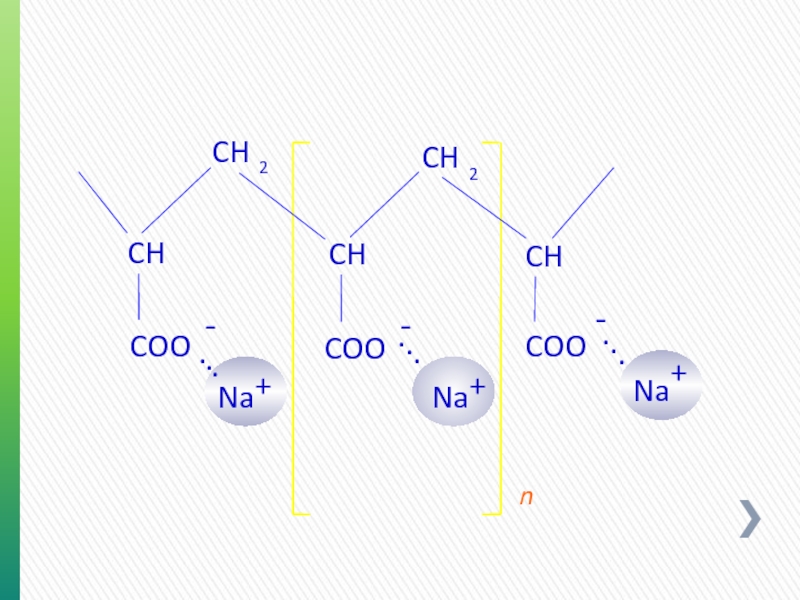
- 41. ПОЛИМЕРЫ СМС (КМЦ) И РАС (ПАЦ)
- 42. CMC и PAC Продукт Мол. мас.
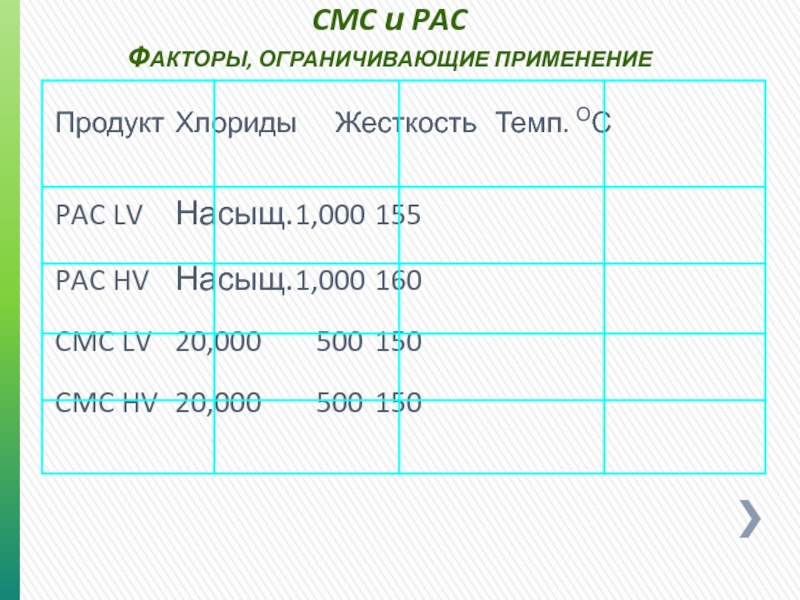
- 43. CMC и PAC ФАКТОРЫ, ОГРАНИЧИВАЮЩИЕ ПРИМЕНЕНИЕ Продукт Хлориды Жесткость Темп.
- 44. КАРБОКСИМЕТИЛИРОВАННЫЙ КРАХМАЛ (КМК) Модифицированный природный Анионный (группы
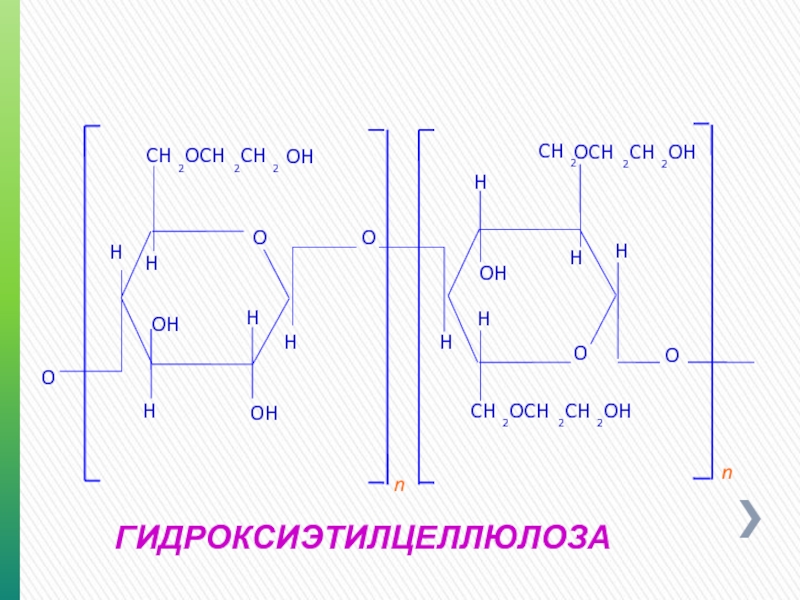
- 45. НЕС (ГЭЦ - ГИДРОКСИЭТИЛЦЕЛЛЮЛОЗА) Модифицированный природный Moлекулярная масса 200 000 – 225 000 Неионный
- 46. ГИДРОКСИЭТИЛЦЕЛЛЮЛОЗА O O O O
- 47. НЕС (ГЭЦ - ГИДРОКСИЭТИЛЦЕЛЛЮЛОЗА) Применение Контроль фильтрации Повышение вязкости Пресная вода, морская вода, рассолы солей
- 48. НЕС (ГЭЦ) ПОЛИМЕР ФАКТОРЫ ОГРАНИЧИВАЮЩИЕ ПРИМЕНЕНИЕ Устойчив
- 49. Синтетические полимеры
- 50. СИНТЕТИЧЕСКИЕ ПОЛИМЕРЫ: Полиакрилат натрия - SP-101 Частичногидролизованный полиакриламид Различные сополимеры
- 51. ПОЛИАКРИЛАТ НАТРИЯ Синтетический Анионный Молекулярная масса
- 52. n CH 2 CH
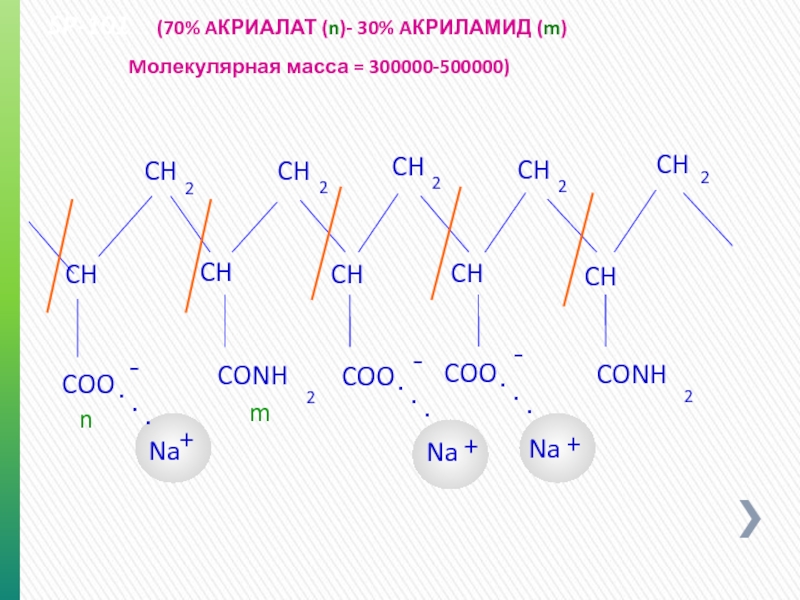
- 53. SP-101 (70% AКРИАЛАТ (n)-
- 54. (SP-101) - ПОЛИАКРИЛАТ НАТРИЯ СО СРЕДНЕЙ
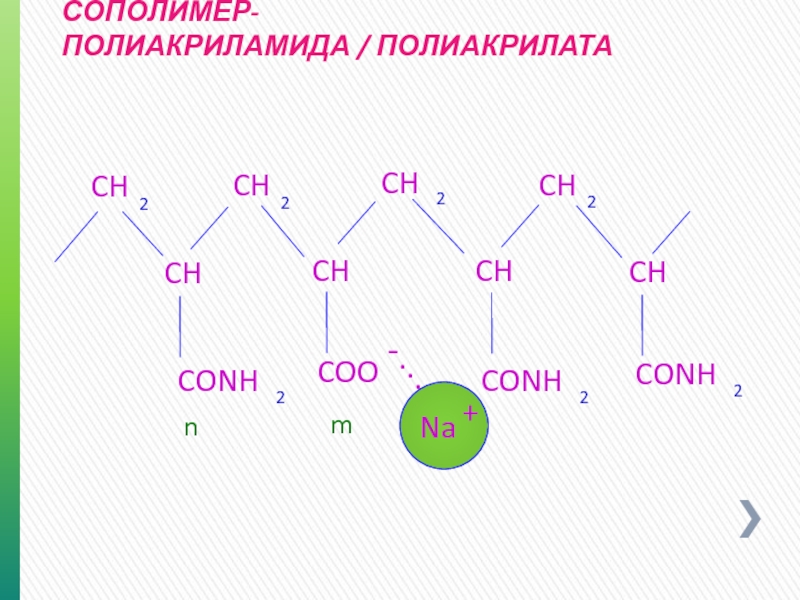
- 55. PHPA Чaстично Гидролизованный Пoлиакриламид или Полиакриламид / Полиакрилат Сополимер
- 56. Чaстично Гидролизованный Пoлиакриламид (PHPA) Moлекулярная масса
- 57. Чaстично Гидролизованный Пoлиакриламид (PHPA) Получается в
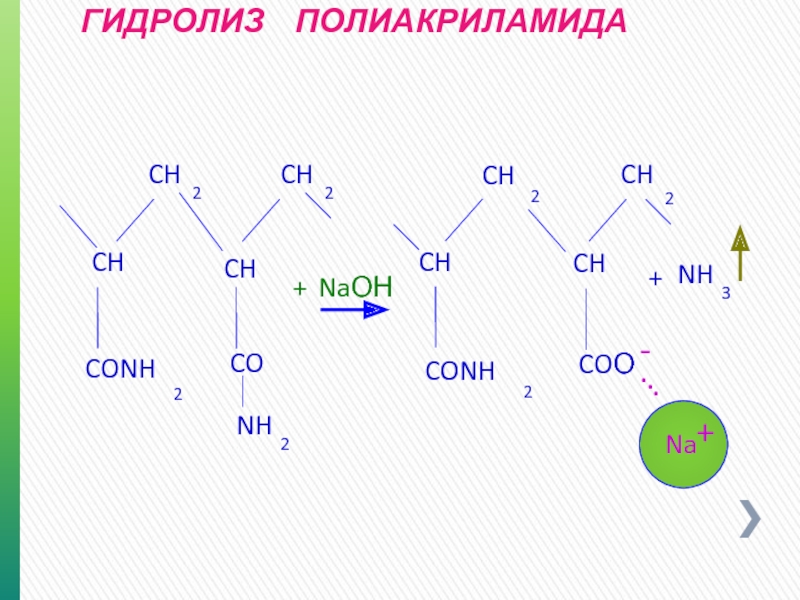
- 58. ГИДРОЛИЗ ПОЛИАКРИЛАМИДА + CH 2
- 59. СОПОЛИМЕР- ПОЛИАКРИЛАМИДА / ПОЛИАКРИЛАТА + -
- 60. Применение Флокуляция твердой фазы Селиктивная Общая
- 61. Полимеры применяемые в буровых растворах
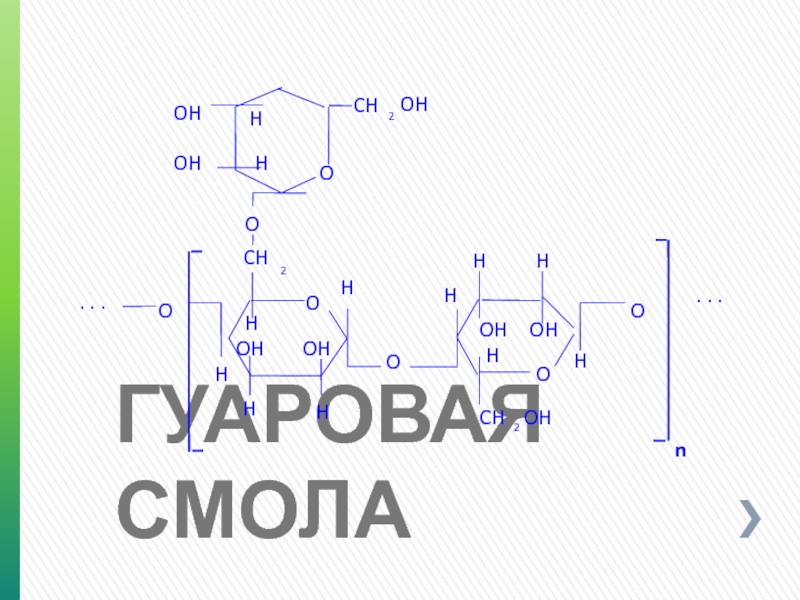
- 62. ГУАРОВАЯ СМОЛА Натуральный водный коллоид полисахаридной природы.
- 63. ГУАРОВАЯ СМОЛА O H
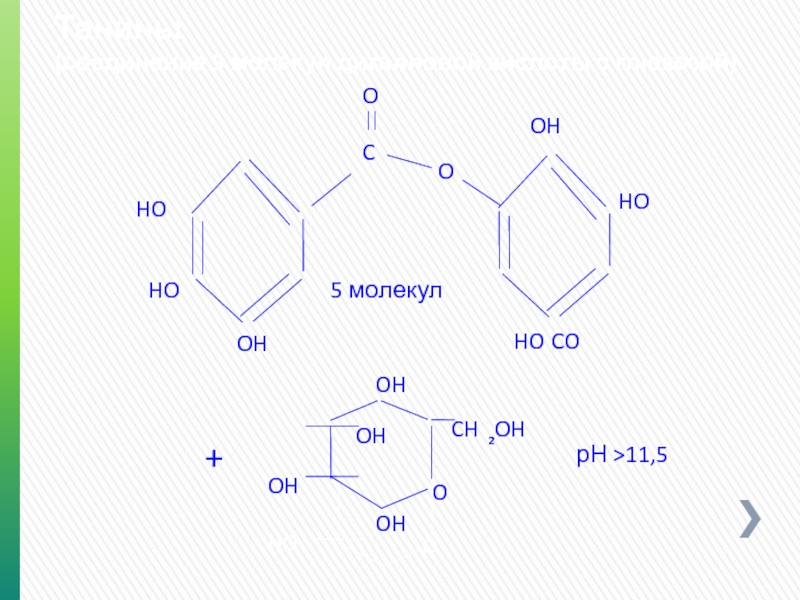
- 64. Танины (соединение 5 молекул дигалловой кислоты с
- 65. Таннины Таннины содержатся в коре, древесине, листьях,
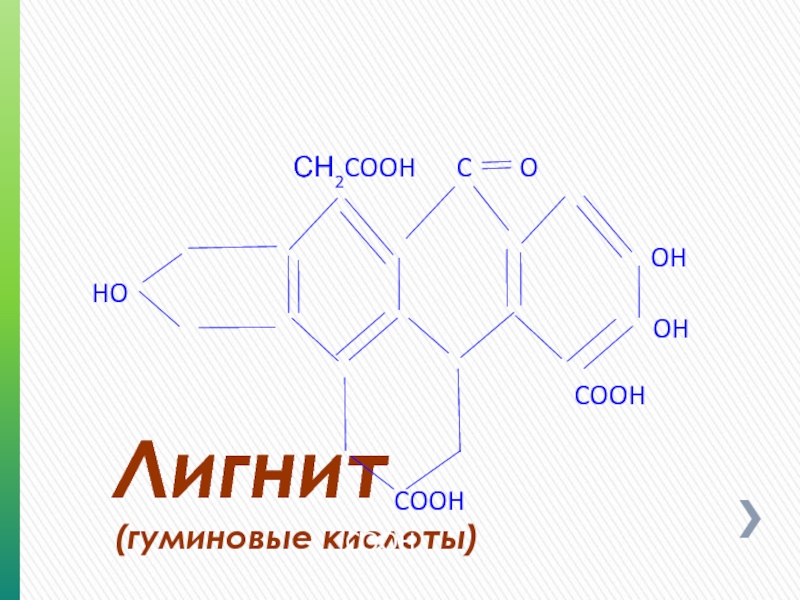
- 66. Лигнит (гуминовые кислоты) OH OH COOH C O HO COOH COOH СН2COOH
- 67. Гуминовые кислоты Гуминовые кислоты являются составной частью
- 68. Гуминовые кислоты По химической структуре гуминовые кислоты
- 69. TANNATHIN Реагент может использоваться в качестве понизителя
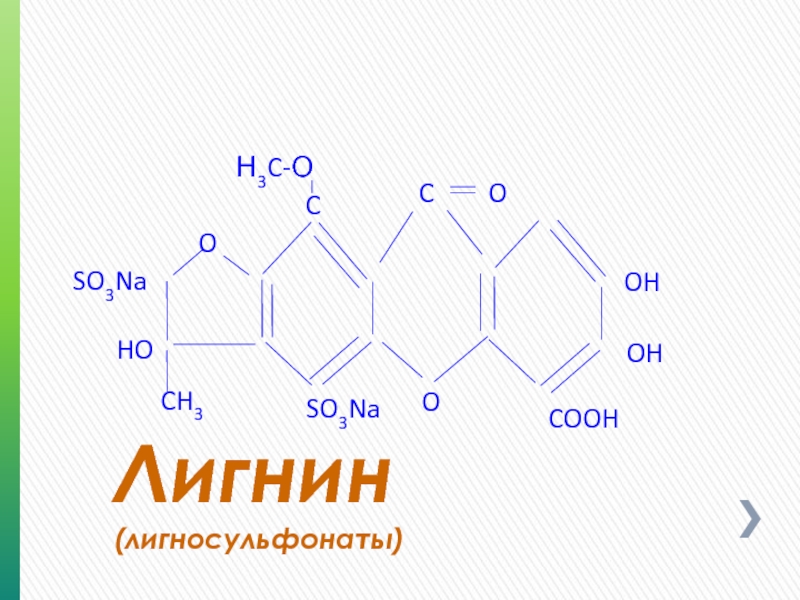
- 70. Лигнин (лигносульфонаты) OH OH COOH C O SO3Na HO O Н3C-О O CH3 SO3Na C
- 71. Лигнин (лигносульфонаты) Молекула лигнина состоит из продуктов
- 72. SPERSENE «SPERSENE» может использоваться в качестве дефлокулянта
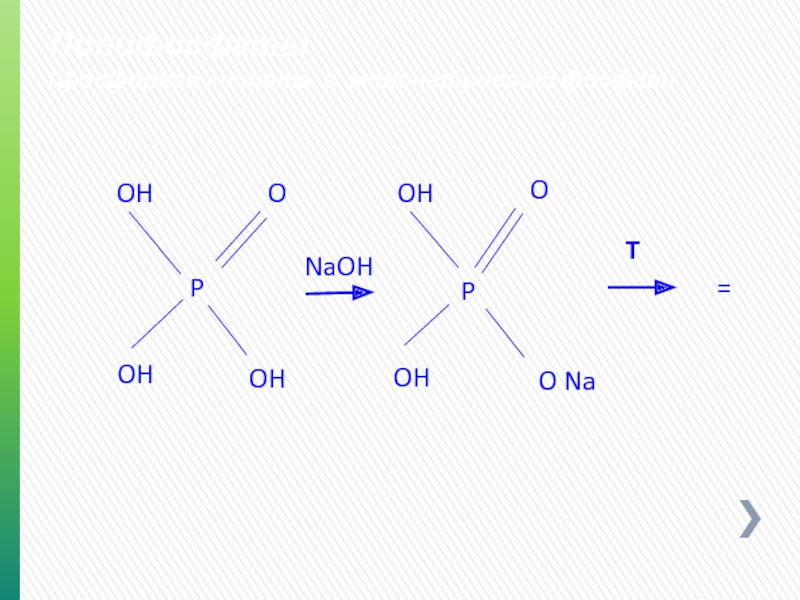
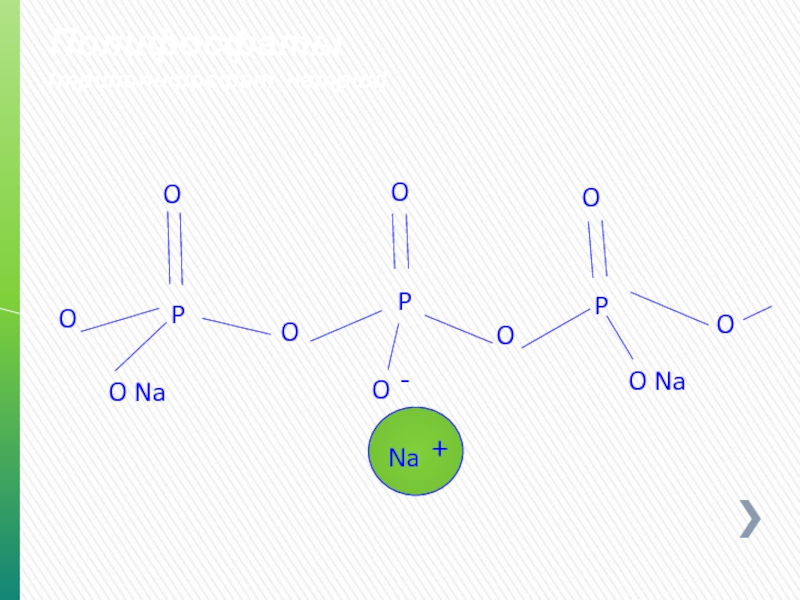
- 73. Полифосфаты (фосфорная кислота в мононатриевый фосфат) O
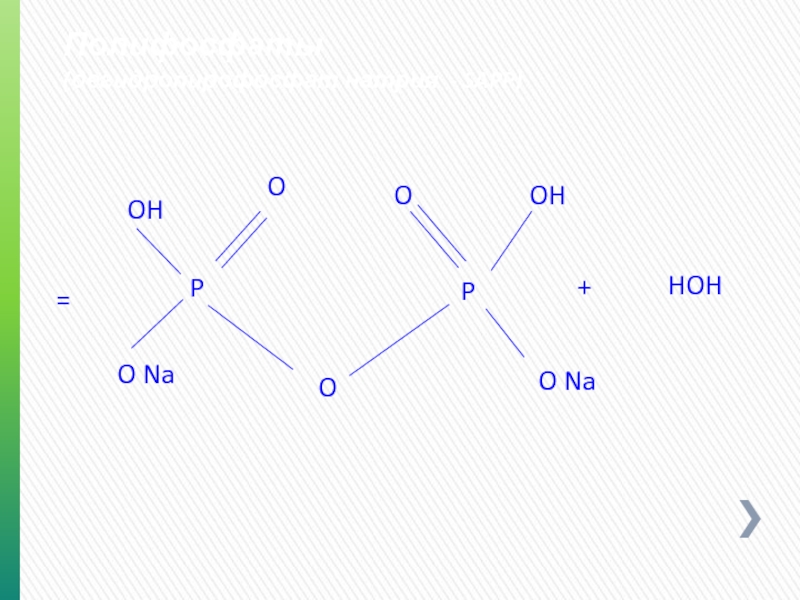
- 74. Полифосфаты (дегидропирофосфат натрия - SAPP) O P
- 75. Полифосфаты (триполифосфат натрия) O P O
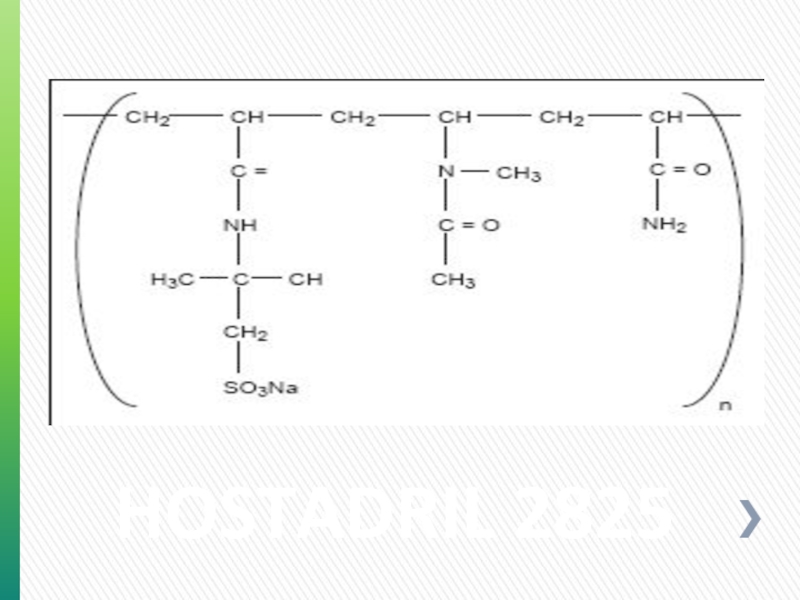
- 76. HOSTADRIL 2825
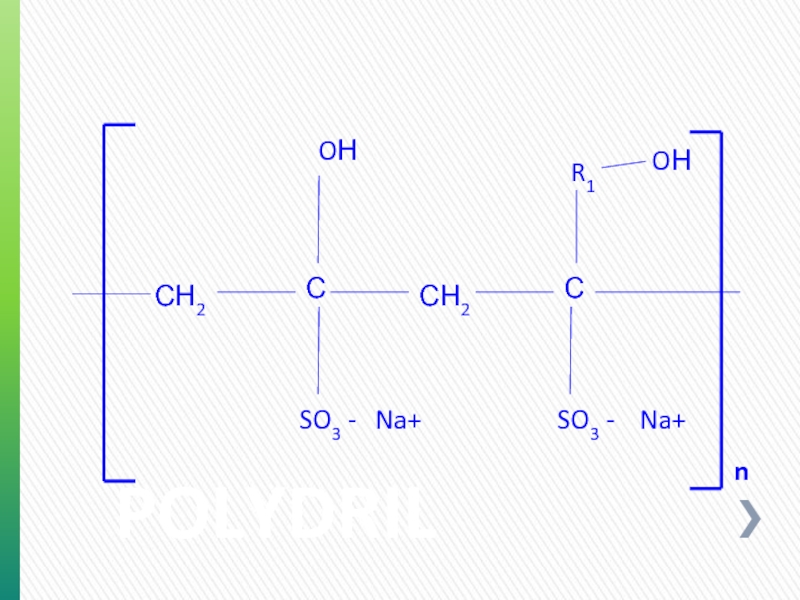
- 77. POLYDRIL OН OН С Na+ С
- 78. РЕЗЮМЕ Функции зависят от: Степени замещения Степени
- 79. Твердая фаза Растворимая твердая фаза, которую невозможно
- 80. Глинистые твердые частицы Обеспечивают вязкость и регулируют
- 81. Классификация глин Физические свойства Размер частиц Тип породы / Минералогия Кристаллическая структура Химический состав
- 82. Классификация глин по кристалической структуре Слоистые силикаты
- 83. Слоистые силикатные глины Глины: Двухслойные Слой кремнезема
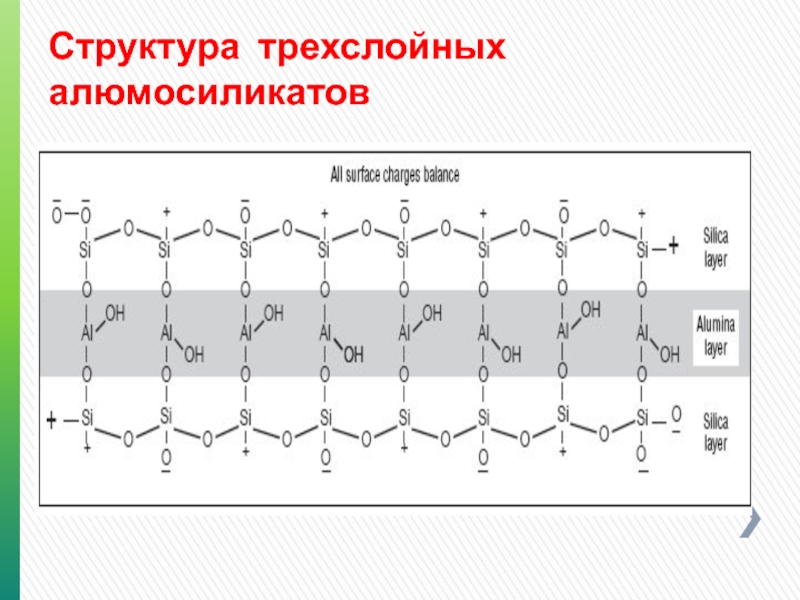
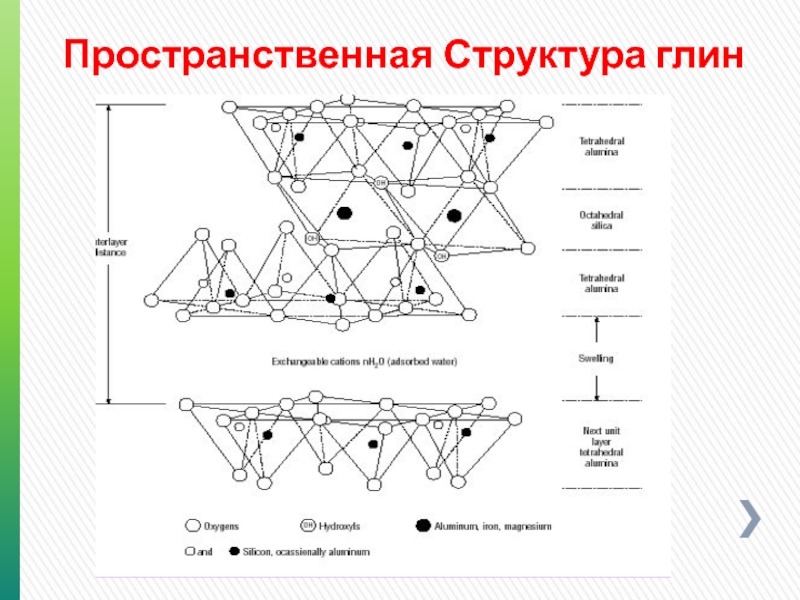
- 84. Структура трехслойных алюмосиликатов
- 85. Пространственная Структура глин
- 86. Слоистые силикатные глины Глины: Четырехслойные (хлорит)
- 87. Кристаллы слоистых силикатных глин Диаметр: ~1 микрон
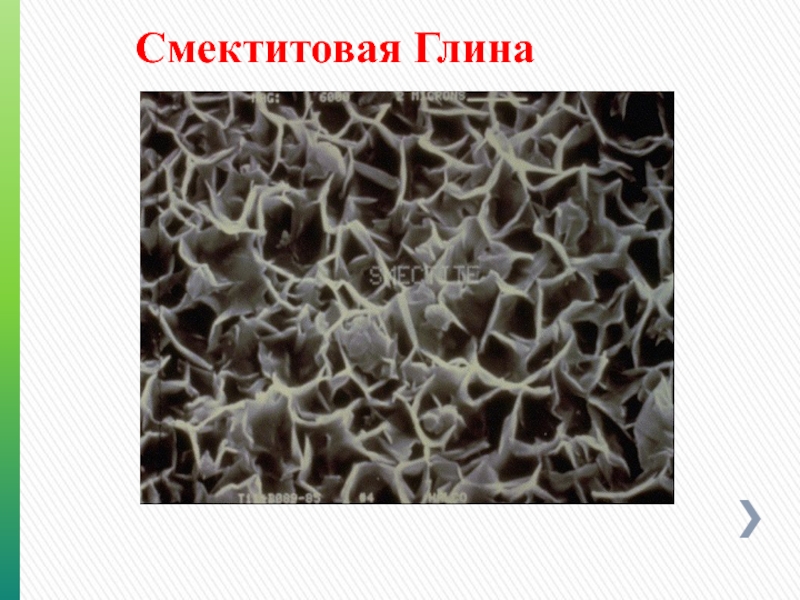
- 88. Смектитовая Глина
- 90. Монтмориллониты В октаэдрическом слое атомы алюминия частично
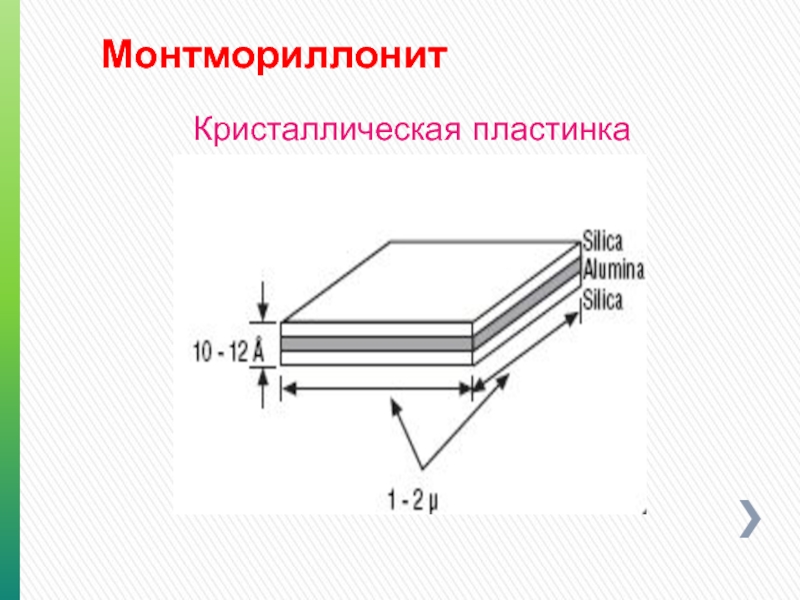
- 91. Монтмориллониты Включает: Монтмориллонит
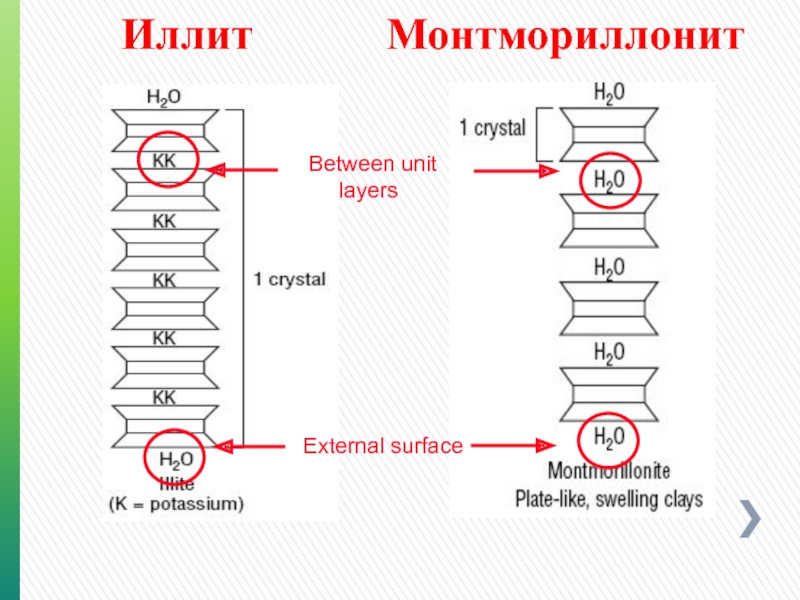
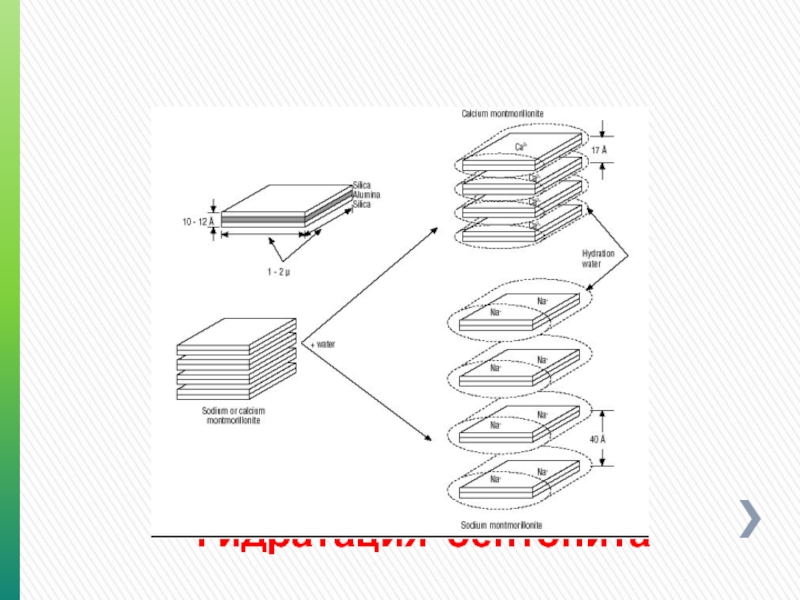
- 92. Монтмориллонит Кристаллическая пластинка
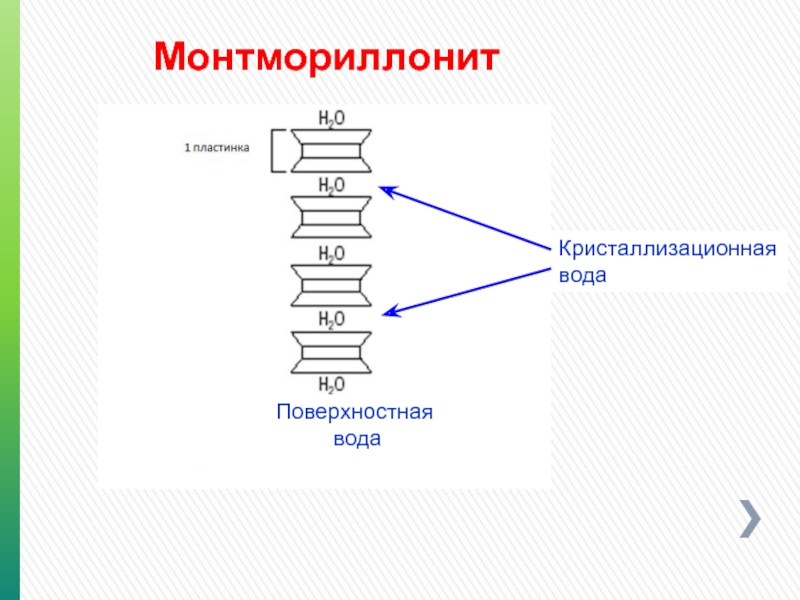
- 93. Монтмориллонит Кристаллизационная вода Поверхностная вода
- 96. Иллит Монтмориллонит
- 99. Аттапульгит (Палыгорскит)
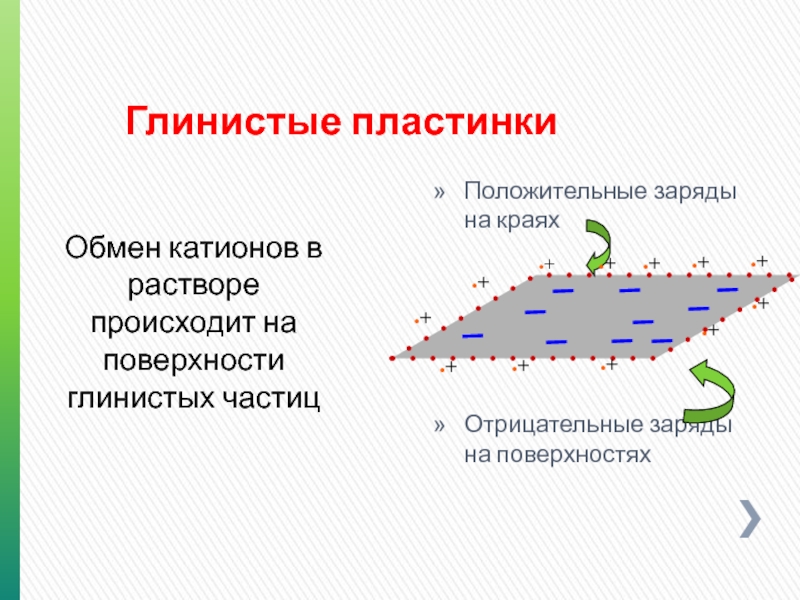
- 100. Глинистые пластинки Положительные заряды на краях
- 101. Факторы, влияющие на ионообмен Тип глин Порядок замещения катионов Размер/Тип катионов Разность зарядов Концентрация катионов
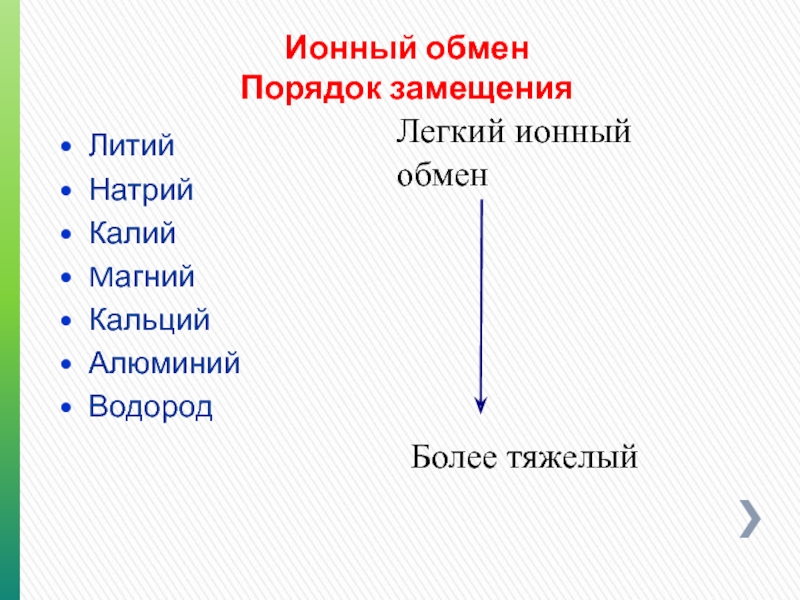
- 102. Ионный обмен Порядок замещения Литий Натрий
- 103. Катионообменная емкость Глины Катионообменная емкость Мг-экв
- 104. Катионообменная емкость Катионообменная емкость глины – способность
- 105. Слоистые глины подразделяются Набухающие глины
- 106. Взаимодействие глин и воды Глины, поглощающие воду,
- 107. Осмотическое давление Р = С*М-1*R*T , где
- 108. Гидратация бентонита
- 109. Гидратация бентонита
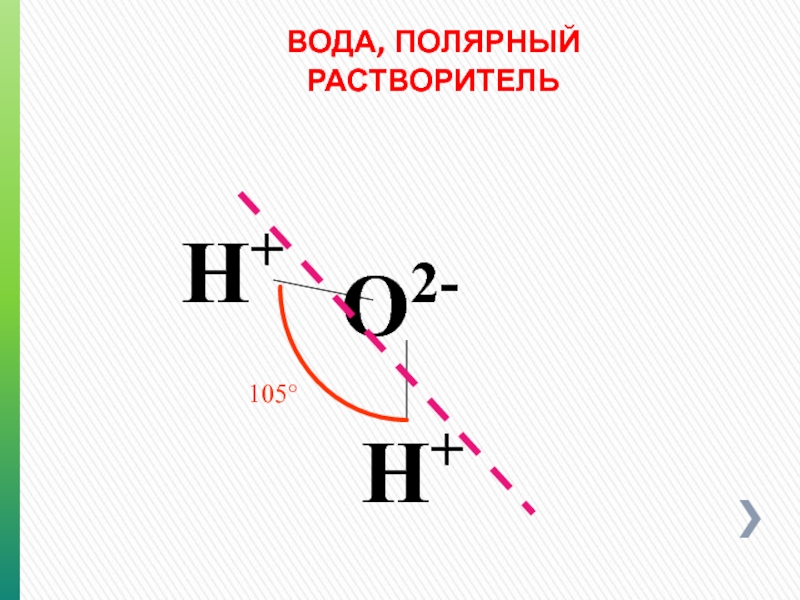
- 110. ВОДА, ПОЛЯРНЫЙ РАСТВОРИТЕЛЬ O2- H+ H+ 105°
- 112. Типы связей глинистых частиц АГГРЕГИРОВАННЫЕ Поверхность к
- 113. Агрегация Поверхность к поверхностям
- 114. Дисперсия Частички глины хаотично расположены Поверхностные заряды влияют на их расположение
- 115. Дисперсия глин Частицы не осаждаются Причины: Броуновское
- 116. Флокуляции (коагуляция) Поверхность к торцу или торец
- 117. Ключевые термины Коагуляция - уменьшение электростатического заряда
- 118. Механизм коагуляции Снижение электрического заряда на поверхности
- 121. Механизм коагуляции
- 122. Флокуляция Слипание частиц в рыхлые и пористые трехмерные структуры произвольной формы, с помощью высокомолекулярных полиэлектро-литов
- 123. Механизм флокуляции Отрицательно-заряженные частицы - -
- 124. Дефлокуляция (стабилизация) Возврат к беспорядочному распределению (дисперсии)
- 125. Механизм стабилизации
- 126. Типы связей глин Агрегация: Снижение вязкости
- 127. Бентонит АНИ Монтмориллонит натрия Бентонит АНИ:
- 128. Классификация глин по АНИ
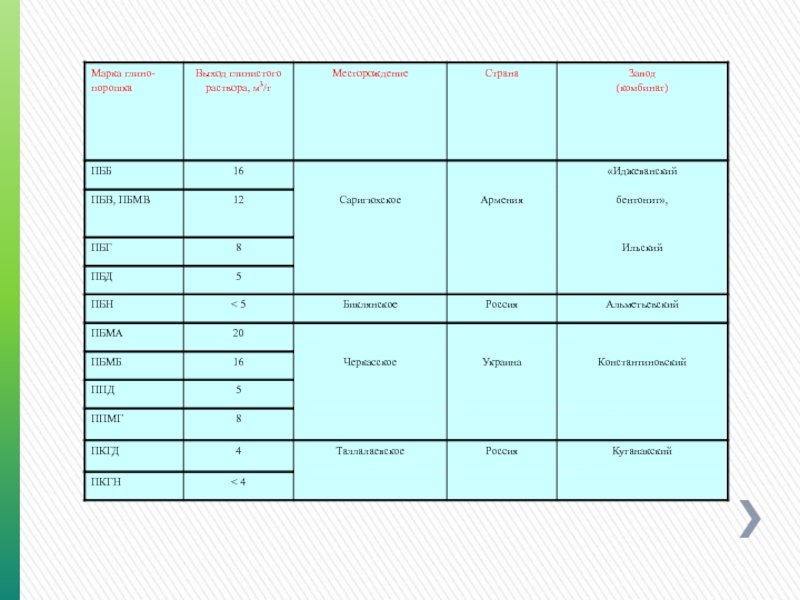
- 129. Выход раствора Выход – объем (м3) раствора
- 130. Факторы, воздействующие на выход раствора Двухвалентные
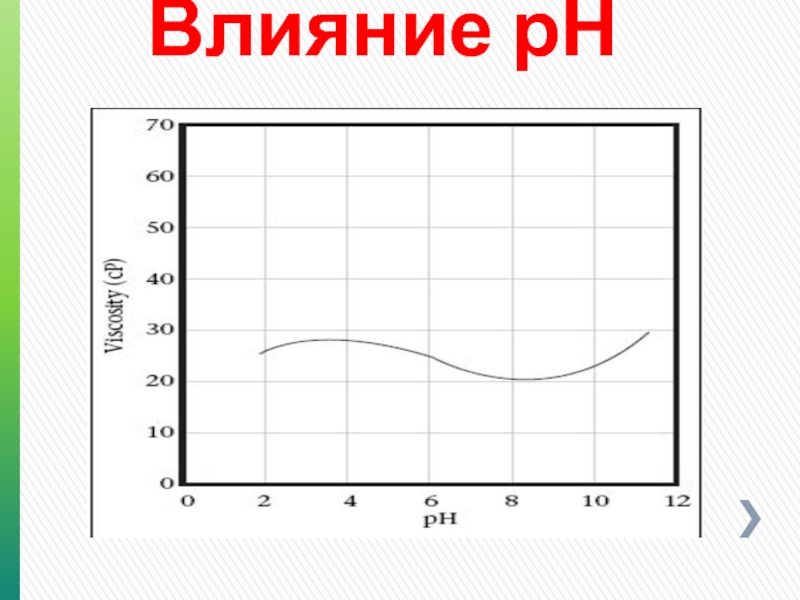
- 131. Влияние рН
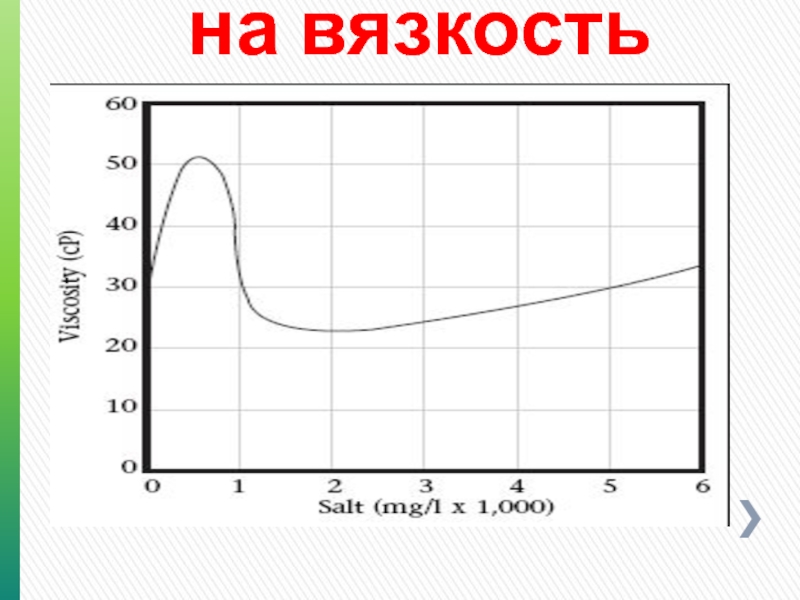
- 132. Влияние солей на вязкость
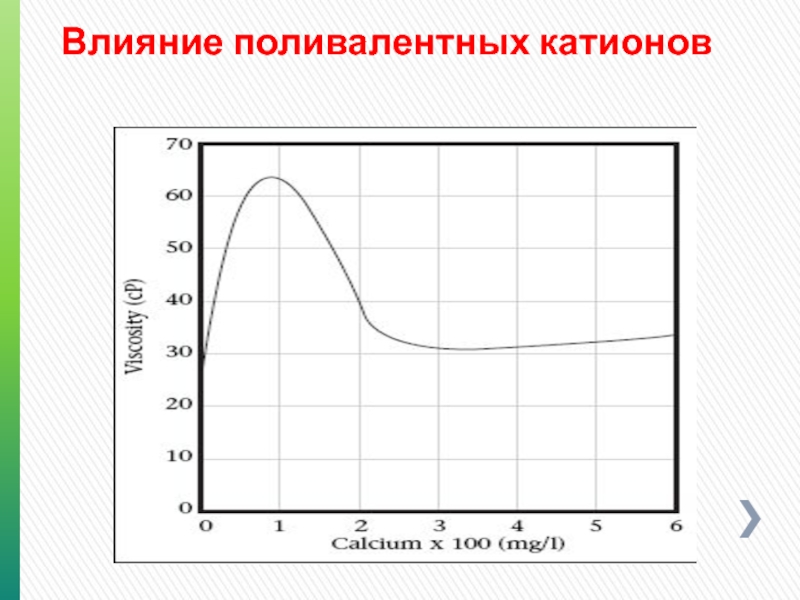
- 133. Влияние поливалентных катионов
- 134. Выход раствора Выход раствора снижается в любой
- 135. Гидратация бентонита в морской воде
- 136. Предварительно гидратированный бентонит По возможности необходимо
- 137. Факторы, воздействующие на выход раствора Двухвалентные катионы: Кальций Магний Соли pH Температура
Слайд 1Технологические жидкости для бурения скважин Лекция 3: Химия полимерных материалов для буровых
Слайд 2ПОЛИМЕРЫ
Три основных типа полимеров
Природные
Крахмал, XC полимер
Природные модифицированные
Карбоксиметилцеллюлоза (кмц), полианионная целлюлоза (пац),
Синтетические
Полиакрилат натрия,
Частично гидролизованный полиакриламид
Слайд 3ПОЛИМЕРЫ
Простейшим полимером является полиэтилен: (C2H4)n
Молекулярная масса =28
Молекулярная масса большинства полимеров в среднем составляет от 50 000 до 200 000
Наибольшая молекулярная масса у биополимеров (Ксантанова смола), от 2 000 000
до 5 000 000
Слайд 4ПОЛИМЕРЫ
Область применения:
Контроль фильтрации
Регулирование вязкости
Обеспечение устойчивости ствола скважины
Полная флокуляция
Селективная флокуляция
Структурирование (Сшивание)
Слайд 5ПОЛИМЕРЫ
Применение:
Контроль фильтрации
Стабилизация- КМЦ (низкой вязкости) , ПАЦ низкой вязкости, крахмалы.
Загущение жидкой
Закупоривание пор в фильтрационной корке
Регулирование вязкости
Загущение жидкой фазы
Флокулянты с высокой молекулярной массой/адсор бируются на глине функциональными группами
Разжижители с малой молекулярной массой
Слайд 6ПОЛИМЕРЫ
СТРУКТУРА ПОЛИМЕРОВ:
ЛИНЕЙНАЯ - КМЦ, ГЭЦ, ПОЛИАКРИЛАТ, ЧАСТИЧНО ГИДРОЛИЗОВАННЫЙ ПОЛИАКРИЛАМИД
РАЗВЕТВЛЕННАЯ –
СШИТАЯ – структурированные биополимеры
Слайд 10ПОЛИМЕРЫ
СТЕПЕНЬ ПОЛИМЕРИЗАЦИИ:
Длина полимера, определяемая числом повторяющихся звеньев в цепи.
Степень полимеризации большинства
Определяет функцию полимера:
Разжижитель Низкая молекулярная масса
Понизитель фильтрации Средняя мол. масса
Загуститель Высокая мол. масса
Ингибитор глин Высокая мол. масса
Селективный флокулянт Высокая мол. масса
Слайд 11ПОЛИМЕРЫ
Длина цепи - Определяет функцию полимера
Короткая:
Полимеры-разжижители - (мм ≈ 10,000)
Средняя:
Понизители фильтрации
Загустители - (мм ≈ 200 000 – 300 000)
Длинная:
Загустители - (мм ≈ 300 000 – 800 000)
Ингибиторы глин - (мм ≈ 800 000 – 2 000 000)
Флокулянты - (мм ≈ 2 000 000 – 50 000 000)
Слайд 12ПОЛИМЕРЫ
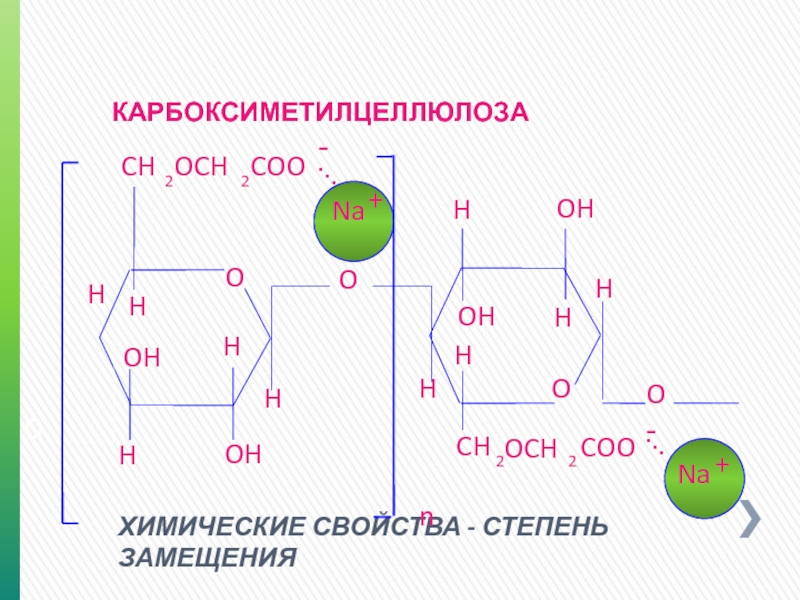
СТЕПЕНЬ ЗАМЕЩЕНИЯ:
Доля замещенных групп на 100 повторяющихся звеньев полимера
Способствует тому, что
Устойчивым к бактериальному воздействию
Более устойчивым к воздействию кальция, магния и хлоридов
Водорастворимым
Максимальная степень замещения молекулы глюкозы – 3,0, т.к. в молекуле содержится три гидроксильные группы, могущие вступать в реакцию. Если степень замещения достигает значения 0,45 и выше, полимер становится водорастворимым. Чем выше данное значение, тем более устойчив полимер к воздействию жесткости и соли.
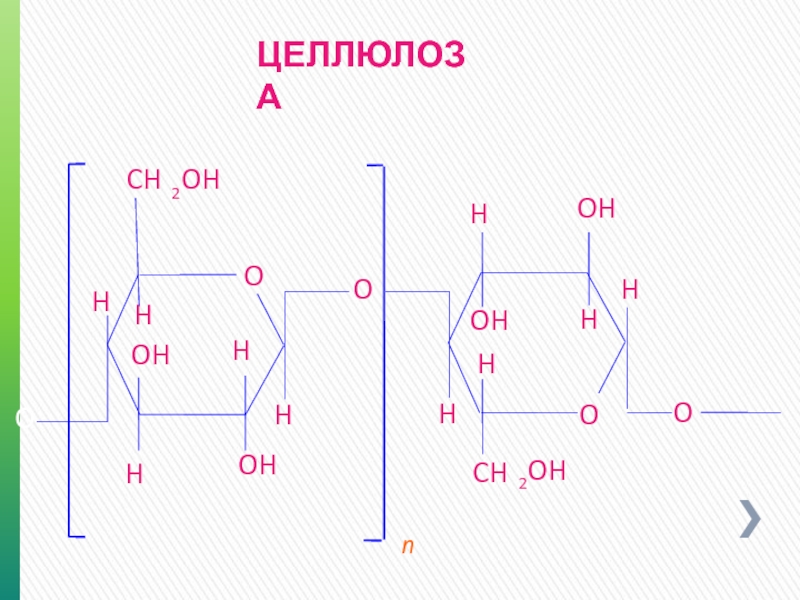
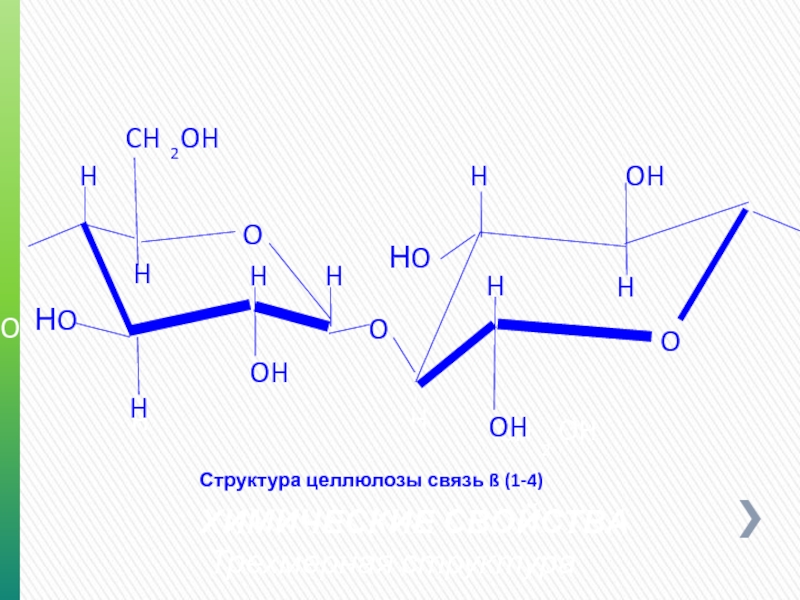
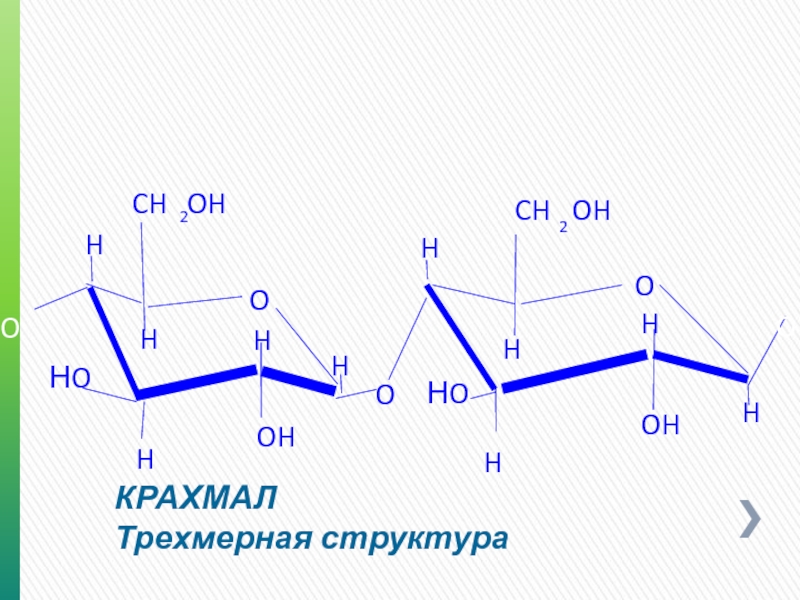
Слайд 14ХИМИЧЕСКИЕ СВОЙСТВА
Трехмерная структура
O
O
O
H
OH
H
НO
НO
H
OH
H
H
H
O
H
CH
2
OH
CH
2
OH
H
H
Структура целлюлозы связь ß (1-4)
H
OH
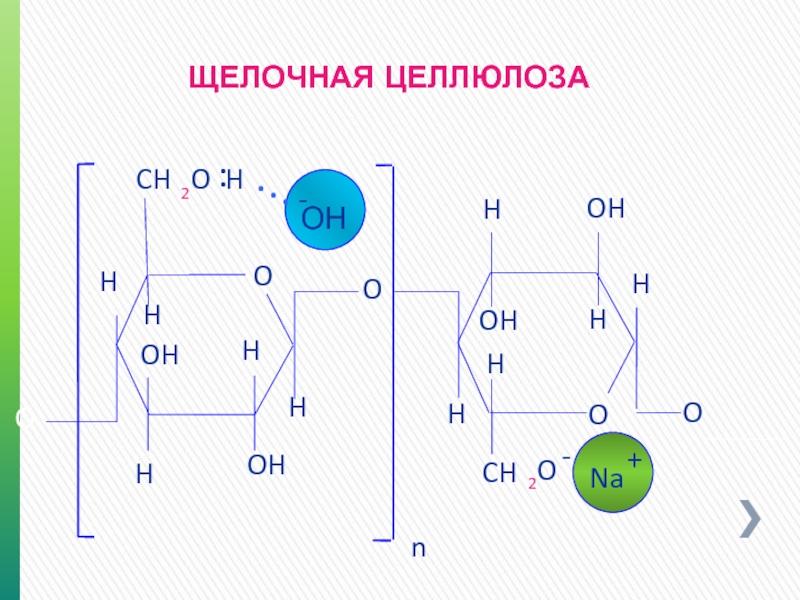
Слайд 17Реакция замещения
(первый способ)
Щелочная целлюлоза + М. А.
--- CH2 O
--- CH2 О CH2 COO Na + Na CL
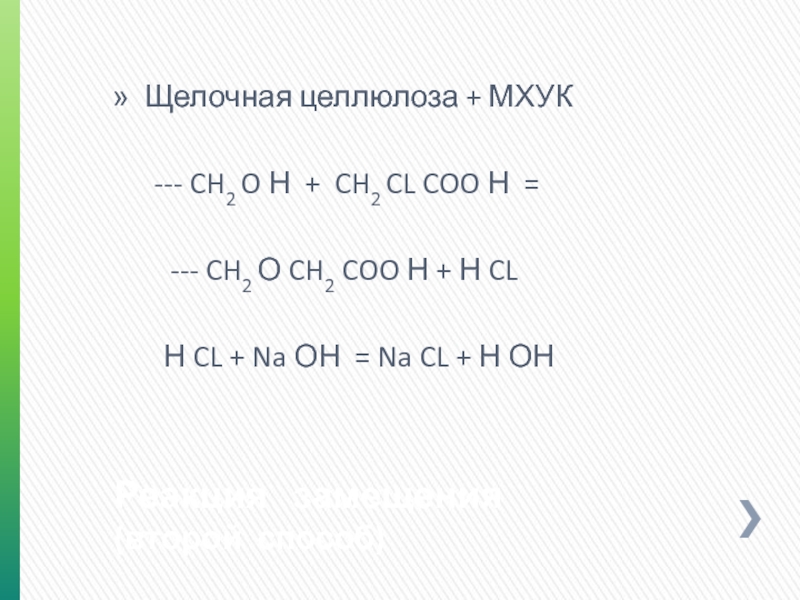
Слайд 18Реакция замещения
(второй способ)
Щелочная целлюлоза + МХУК
--- CH2 O Н +
--- CH2 О CH2 COO Н + Н CL
Н CL + Na ОН = Na CL + Н ОН
Слайд 19
ХИМИЧЕСКИЕ СВОЙСТВА - СТЕПЕНЬ ЗАМЕЩЕНИЯ
КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗА
O
O
O
H
H
+
H
OH
H
OH
OH
H
OH
H
-
H
CH
2
OCH
2
COO
H
CH
2
OCH
2
COO
O
H
O
H
n
Na
.
.
.
.
.
+
Na
.
-
Слайд 20ХИМИЧЕСКИЕ СВОЙСТВА
ФУНКЦИОНАЛЬНАЯ ГРУППА
Функциональные группы разделяются
Неионогенные
Анионные
Катионные
В молекуле может присутствовать более, чем один тип групп. Природа заряда некоторых групп зависит от рН среды и меняется с неионной на катионную или анионную.
Слайд 21ХИМИЧЕСКИЕ СВОЙСТВА
ФУНКЦИОНАЛЬНАЯ ГРУППА
Гидроксильная (--ОН)
Гидроксиэтильная (--OСН2СН2ОH)
Карбоксильная (--СОО- )
Карбоксиметильная (--СН2СОО- )
Сульфогруппа (--SO3-)
Фосфатная (--
Аминная (--NH2+ )
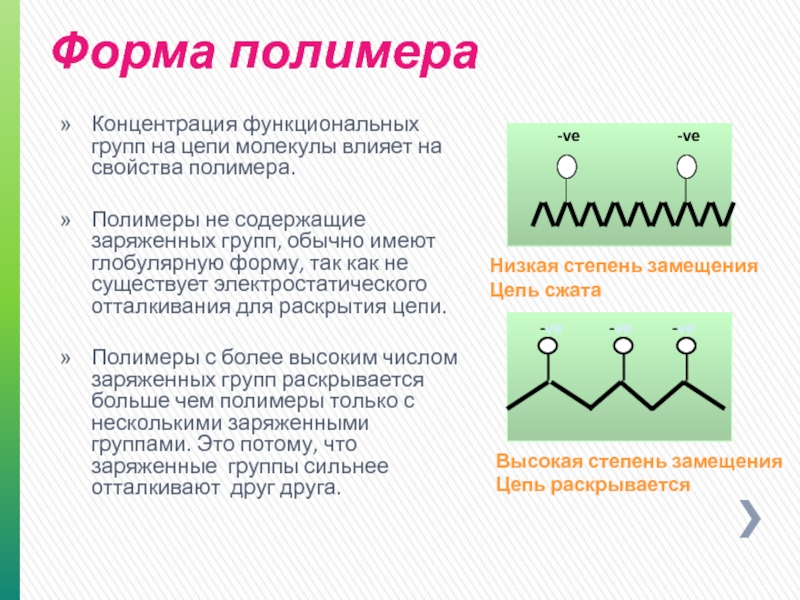
Слайд 22Концентрация функциональных групп на цепи молекулы влияет на свойства полимера.
Полимеры не содержащие заряженных групп, обычно имеют глобулярную форму, так как не существует электростатического отталкивания для раскрытия цепи.
Полимеры с более высоким числом заряженных групп раскрывается больше чем полимеры только с несколькими заряженными группами. Это потому, что заряженные группы сильнее отталкивают друг друга.
Высокая степень замещения
Цепь раскрывается
-ve
-ve
-ve
-ve
-ve
Низкая степень замещения
Цепь сжата
Форма полимера
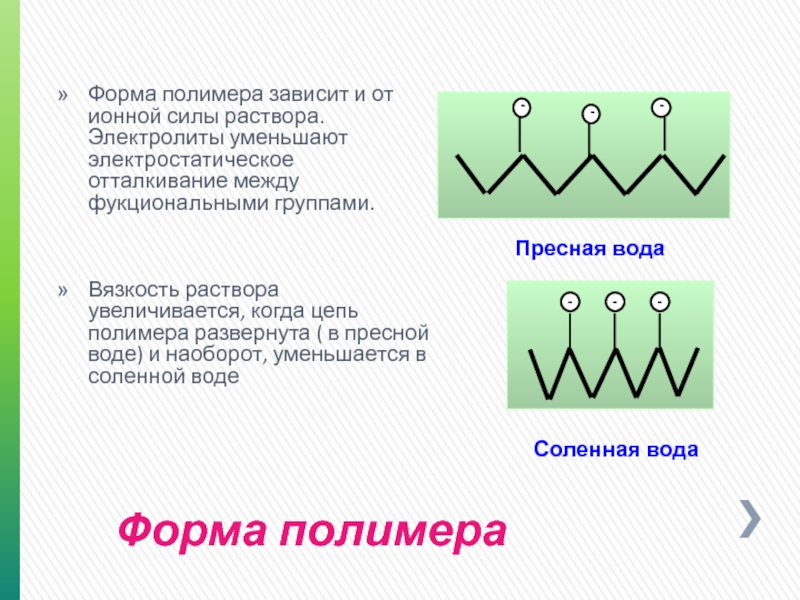
Слайд 23Форма полимера
Форма полимера зависит и от ионной силы раствора. Электролиты уменьшают
Вязкость раствора увеличивается, когда цепь полимера развернута ( в пресной воде) и наоборот, уменьшается в соленной воде
Пресная вода
Соленная вода
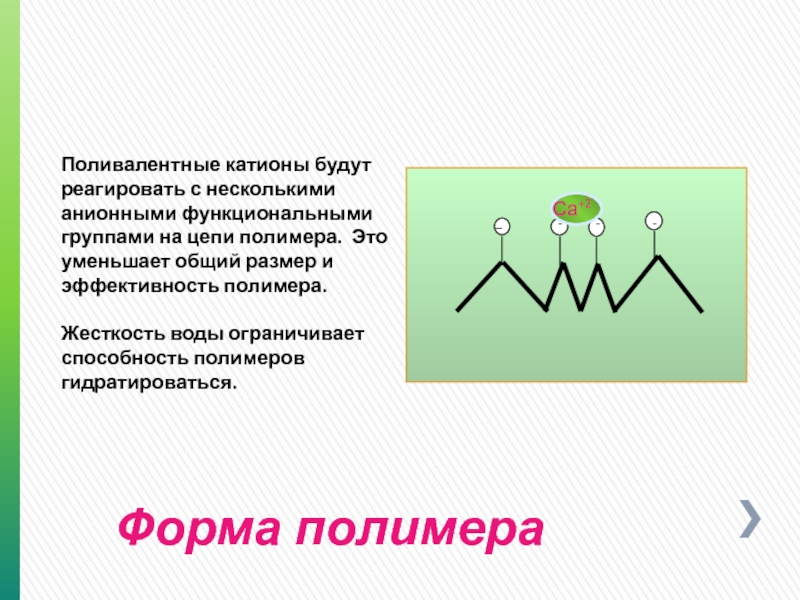
Слайд 24Форма полимера
_
-
-
-
Поливалентные катионы будут реагировать с несколькими анионными функциональными группами на
Жесткость воды ограничивает способность полимеров гидратироваться.
Са+2
Слайд 25
-
-
-
-
-
-
--
--
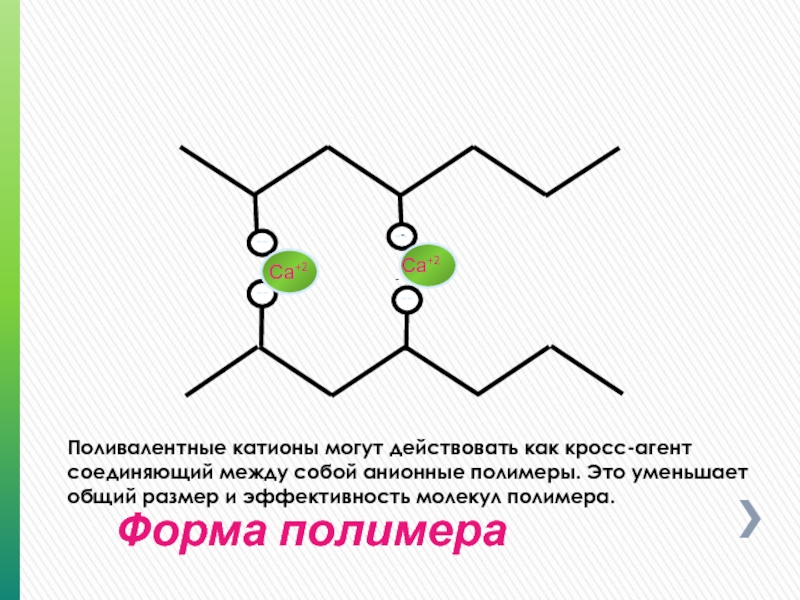
Форма полимера
Поливалентные катионы могут действовать как кросс-агент соединяющий между собой анионные
Са+2
Са+2
Слайд 26Форма большинства полимеров будет зависеть от pH среды. Например, полимеры, содержащие
Оптимальная растворимость анионных полимеров обычно находится в диапазоне pH 8 и 9.5. Выше pH может разрушить некоторые полимеры или привести к частичной дегидратации
Форма полимера
Слайд 27ФАКТОРЫ ВОЗДЕЙСТВУЮЩИЕ НА ЭФФЕКТИВНОСТЬ ПОЛИМЕРА
Концентрация полимера
Химия воды
Минерализация
Жесткость
pH
Содержание твердых частиц
Температура
Бактерии
Слайд 29ПРИРОДНЫЕ ПОЛИМЕРЫ
К природным полимерам относятся
кукурузный крахмал
картофельный крахмал
Биополимеры
Бактерии Xanthamonas Campestri выделяют полимер
Слайд 33
Применение
Контроль фильтрации
Пресная вода
Пластовая вода
Морская вода
Соленасыщенная вода
Полимерные системы
Обработка
11-22 кг/м3
Слайд 34Факторы, ограничивающие применение
Ферментация
Высокий уровень кальция, высокий показатель pH
Сохранение свойств при температурах
Проблемы контроля качества
Слайд 35
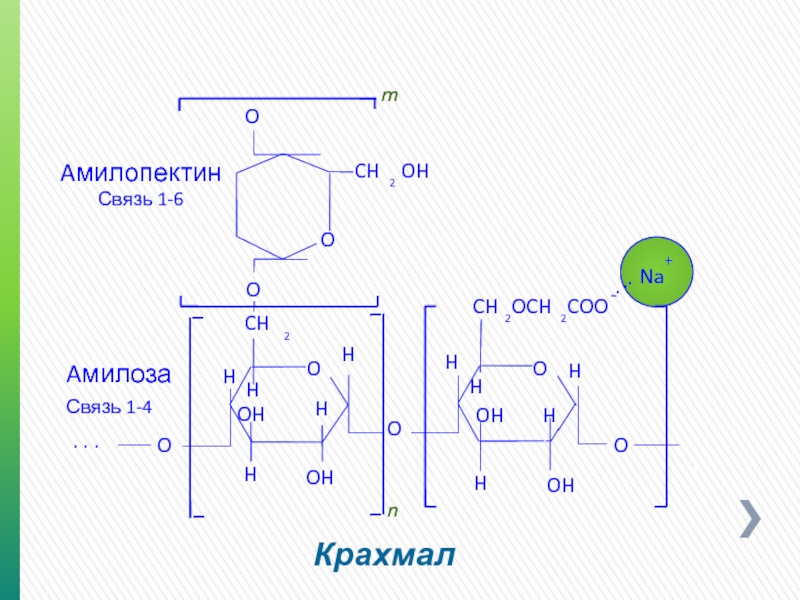
Крахмал
O
H
H
H
OH
OH
H
H
O
H
O
H
CH
2
H
H
O
OH
H
n
O
OH
O
O
O
m
Aмилопектин
Aмилоза
. . .
. . .
CH
2
OCH
2
COO
+
-
Na
.
.
.
CH
2
OH
Связь 1-6
Связь 1-4
Слайд 36XC POLYMER
Биополимер - Xanthamonas Campestri
Тип: неионный - анионный
Средняя молекулярная масса >
Комплексный разветвленный полимер
Слайд 38XC / XCD - ПОЛИМЕР
Применение
Загуститель
Увеличение вязкости при низкой скорости сдвига
Поддерживает твердую
Придает раствору псевдопластические свойства
Эффективен при использовании как в пресной, соленной воде, так и в рассолах солей
Обработка - 1-6 кг/м3
Слайд 39XC / XCD - ПОЛИМЕР
Факторы, ограничивающие применение
Сохраняет свойства при температурах до
Является дорогостоящим продуктом
Слайд 40МОДИФИЦИРОВАННЫЕ ПОЛИМЕРЫ
МОДИФИЦИРОВАННЫЕ ЭФИРЫ ЦЕЛЛЮЛОЗЫ:
КМЦ (СМС) - Карбоксиметилцеллюлоза
ПАЦ (РАС)– Полианионная целлюлоза
ГЭЦ (HEC)
КМК (CMS) – Карбоксиметилированный крахмал
Слайд 41
ПОЛИМЕРЫ СМС (КМЦ) И РАС (ПАЦ)
Анионные (группы – СН2СОО- )
Средняя
200 000 – 225 000 (Высоковязкие)
140 000 – 175 000 (Низковязкие)
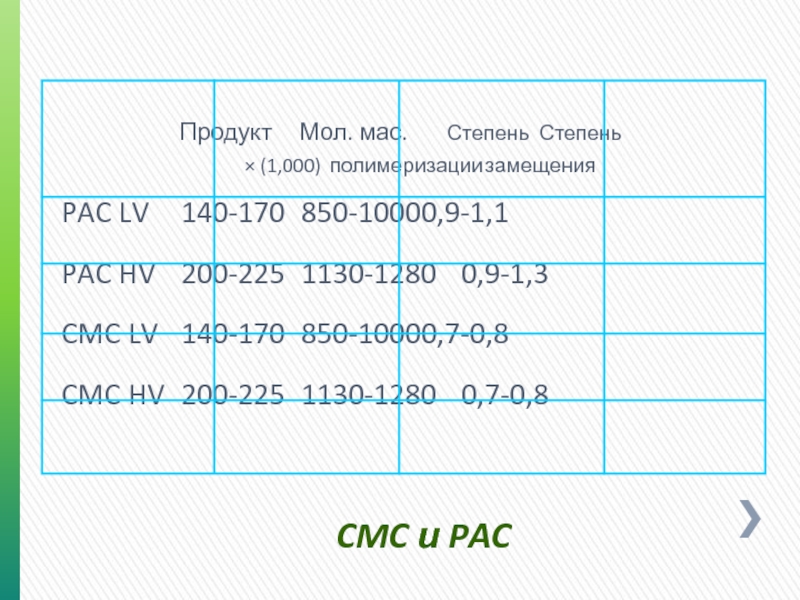
Слайд 42CMC и PAC
Продукт Мол. мас. Степень Степень
× (1,000) полимеризации замещения
PAC LV 140-170 850-1000 0,9-1,1
PAC HV 200-225 1130-1280 0,9-1,3
CMC
CMC HV 200-225 1130-1280 0,7-0,8
Слайд 43CMC и PAC
ФАКТОРЫ, ОГРАНИЧИВАЮЩИЕ ПРИМЕНЕНИЕ
Продукт Хлориды Жесткость Темп. ОС
PAC LV Насыщ. 1,000 155
PAC HV Насыщ. 1,000 160
CMC LV 20,000 500 150
CMC
Слайд 44КАРБОКСИМЕТИЛИРОВАННЫЙ КРАХМАЛ (КМК)
Модифицированный природный
Анионный (группы – СН2СОО- )
Mолекулярная масса 140 000
Слайд 45НЕС (ГЭЦ - ГИДРОКСИЭТИЛЦЕЛЛЮЛОЗА)
Модифицированный природный
Moлекулярная масса 200 000 – 225 000
Неионный
Слайд 47НЕС (ГЭЦ - ГИДРОКСИЭТИЛЦЕЛЛЮЛОЗА)
Применение
Контроль фильтрации
Повышение вязкости
Пресная вода, морская вода, рассолы солей
Слайд 48НЕС (ГЭЦ) ПОЛИМЕР
ФАКТОРЫ ОГРАНИЧИВАЮЩИЕ ПРИМЕНЕНИЕ
Устойчив до 105О С
Эффективность снижается при рН
Эффективность снижается в крепких рассолах
Недостаток тиксотропных свойств
Слайд 50СИНТЕТИЧЕСКИЕ ПОЛИМЕРЫ:
Полиакрилат натрия - SP-101
Частичногидролизованный полиакриламид
Различные сополимеры
Слайд 53
SP-101 (70% AКРИАЛАТ (n)- 30% AКРИЛАМИД (m)
Mолекулярная масса = 300000-500000)
+
-
Na
.
CH
2
CH
CH
CH
2
CH
CH
2
CH
CH
2
n
CONH
2
COO
CONH
2
CH
.
.
+
-
Na
.
COO
.
.
+
-
Na
.
COO
.
.
m
CH
2
Слайд 54 (SP-101) - ПОЛИАКРИЛАТ НАТРИЯ
СО СРЕДНЕЙ МОЛЕКУЛЯРНОЙ МАССОЙ
Факторы, ограничивающие применение
Хлориды –
Кальций - 400 мг/л
Высокое содержание твердых частиц низкой плотности
Температура 205-230 ОС
Слайд 56Чaстично Гидролизованный Пoлиакриламид (PHPA)
Moлекулярная масса - 2 – 15 млн.
Aнионный
Поставляется в
Слайд 57Чaстично Гидролизованный Пoлиакриламид (PHPA)
Получается в результате:
щелочного гидролиза полиакриламида
Сополимеризации акриламида с акрилатом
Слайд 60Применение
Флокуляция твердой фазы
Селиктивная
Общая
Стабилизация/ингибирование глин
Адсорбция на поверхности
Загущение водной фазы
Адсорбция свободной воды
Чaстично Гидролизованный
Слайд 62ГУАРОВАЯ СМОЛА
Натуральный водный коллоид полисахаридной природы. Добывают из семян тропических растений
В настоящее время растения культивируется и в других странах.
Образует вязкие растворы при концентрации около 1% и формирует гелеобразную структуру при рН около 7.
Используется для загущения пресных, минерализованных, соленасыщенных и калиевых буровых растворов.
Слайд 64Танины
(соединение 5 молекул дигалловой кислоты с глюкозой)
OH
CO
C
O
5 молекул
O
CH
2
OH
OH
HO
HO
O
рН >11,5
+
OH
OH
OH
O
HO
Слайд 65Таннины
Таннины содержатся в коре, древесине, листьях, плодах (иногда семенах, корнях, клубнях)
Таннины являются исходным продуктом для производства дефлокулянтов – Desco и др.
Слайд 67Гуминовые кислоты
Гуминовые кислоты являются составной частью бурых углей, торфа и т.п.
Гуминовые кислоты входят в состав органической массы торфов (25-50%), бурых углей (45-60 %), окисленных каменных углей (до 60%), некоторых почв (до 10%)
В результате экстракции из исходного сырья водной вытяжки получают гуминовые кислоты в промышленных масштабах
Слайд 68Гуминовые кислоты
По химической структуре гуминовые кислоты высокомолекулярные (мол. масса 1300-1500) конденсированные
Гуминовые кислоты являются исходным продуктом для производства реагента TANNATHIN
Слайд 69TANNATHIN
Реагент может использоваться в качестве понизителя водоотдачи и разжижителя в любых
Рекомендуемая концентрация реагента в растворе – от 3 до 23 кг/м3. Ввиду кислой природы реагента, рекомендуется сочетать обработку «Таннатином» с добавлением каустика (или альтернативного щелочного реагента) для поддержания рН раствора и увеличения растворимости реагента. Рекомендуется добавлять 1 мешок каустика на каждые 4 мешка «Таннатина».
При обработке соленасыщенных систем рекомендуется прегидратировать реагент в отдельной емкости в пресной или слабоминерализованной воде (нормальной или высокой щелочности).
Максимальная эффективность реагента достигается в растворах с рН=9-11.
Слайд 71Лигнин
(лигносульфонаты)
Молекула лигнина состоит из продуктов полимеризации ароматических спиртов; основной мономер — конифериловый
Древесина лиственных пород содержит
20—30 % лигнина, хвойных — до 50 %.
Лигнин — ценное химическое сырьё, используемое во многих производствах, в том числе для получения реагентов SPERSENE, SPERSENE СF
Слайд 72SPERSENE
«SPERSENE» может использоваться в качестве дефлокулянта и понизителя водоотдачи во всех
Лабораторные и промысловые испытания показали очень высокую разжижающую эффективность продукта в присутствии различных примесей и загрязнителей.
Рекомендуемая концентрация «SPERSENE» колеблется от 3 до 34 кг/м3 в зависимости от применяемой системы, содержания твердой фазы и рекомендуемых параметров раствора.
Для максимальной эффективности продукта уровень рН необходимо поддерживать на уровне 9-11. Щелочность регулируется каустической содой.
Слайд 78РЕЗЮМЕ
Функции зависят от:
Степени замещения
Степени полимеризации
Факторы, ограничивающие применение
Температура
Наличие ионов в растворе
pH
Твердая фаза
Слайд 79Твердая фаза
Растворимая твердая фаза, которую невозможно отфильтровать или механически удалить из
Соль
Сахар
Твердые частицы (нерастворимые), удаляемые механически или в процессе фильтрации
Глины
Песок
Слайд 80Глинистые твердые частицы
Обеспечивают вязкость и регулируют фильтрацию
Термоустойчивы
Пластовые глины являются загрязителями
При наличии
Требуется разбавление раствора
Слайд 81Классификация глин
Физические свойства
Размер частиц
Тип породы / Минералогия
Кристаллическая структура
Химический состав
Слайд 82Классификация глин по кристалической структуре
Слоистые силикаты
Смектит
и буренная порода
Иллит Выбуренная порода
(до 1998 г относился к гидрослюдам)
Хлорит Выбуренная порода
Каолинит Выбуренная порода
Игольчатые
Аттапульгит Солестойкие растворы
Сепиолит Солестойкие и термостойкие растворы
Слайд 83Слоистые силикатные глины
Глины:
Двухслойные
Слой кремнезема
Слой глинозема
Трехслойные (например: натриевый бентонит)
Слой кремнезема
Слой глинозема
Слой
Слайд 86Слоистые силикатные глины
Глины:
Четырехслойные (хлорит)
Слой кремнезема
Слой глинозема
Слой кремнезема
Слой брусита
(гидроксид магния)
Слайд 87Кристаллы слоистых силикатных глин
Диаметр: ~1 микрон (1 милионная метра)
Tолщина: ~10 Å
Диаметр : Толщина: 1,000 : 1
Площадь поверхности / Вес: ~ 800 м2 / г
Кристаллические пластинки расположены поверхность к поверхности в виде пачки
Расстояние между кристаллами от 7 дo 17 Å
Заряды на основной поверхности в большинстве отрицательные
Заряды на краях кристаллов в основном положительные
Слайд 89
В данное семейство входят:
Монтмориллониты
Гекториты
Сапониты
Нонтрониты
Фемонтмориллониты
Смектитовые глины
Слайд 90Монтмориллониты
В октаэдрическом слое атомы алюминия частично замещены на атомы магния
Поверхность имеет
В обменном комплексе присутствуют ионы Na+, K+, Ca+2, Mg+2, Fe+3
Между кристаллами прочносвязанная вода
Слайд 91Монтмориллониты
Включает:
Монтмориллонит натрия (Вайомингский бентонит)
Кальциевый/магниевый монтмориллонит.
Для придания
Монтмориллониты смешанного состава
Форма частиц – правильные плитки
Размером до 2 мкм
Слайд 94
Бентонит является в основном глиной монтмориллонитового вида (не менее 70 %)
Обладает
Увеличивается в объеме от 4 до 10 раз после гидратации
Бентонит
Слайд 95
ТРЕХСЛОЙНАЯ СТРУКТУРА
Относится к слюдистым минералам
В тетраэдрическом слое атомы кремния частично
Замещение кремния на алюминий меньше, чем у настоящих слюд
В обменном комплексе присутствуют в основном ионы K+ , но могут находиться ионы водорода, магния, натрия
Иллит
Слайд 97
ДВУХСЛОЙНАЯ СТРУКТУРА
Форма частиц – шестиугольная плитка размером до 5 мкм.
Заряды внутри
Между слоями сильная водородная связь
Kaолинит
Слайд 98
Природный кристалл состоит из 100 слоев (пластинок)
Набухания в пресной воде почти
При интенсивном перемешивании увеличивается содержание мелких частиц в растворе
Kaолинит
Слайд 100Глинистые пластинки
Положительные заряды на краях
Отрицательные заряды на поверхностях
+
+
+
+
+
+
+
+
+
+
+
+
Обмен катионов в растворе
Слайд 101Факторы, влияющие на ионообмен
Тип глин
Порядок замещения катионов
Размер/Тип катионов
Разность зарядов
Концентрация катионов
Слайд 102Ионный обмен
Порядок замещения
Литий
Натрий
Калий
Mагний
Кальций
Алюминий
Водород
Легкий ионный обмен
Более тяжелый
Слайд 103Катионообменная емкость
Глины Катионообменная емкость
Мг-экв / 100 г
Монтмориллонит 70 – 130
Иллит 10 – 40
Каолинит 3
Аттапульгит 10 - 35
Слайд 104Катионообменная емкость
Катионообменная емкость глины – способность глины адсорбировать на своей поверхности
Катионообменная емкость показывает, насколько данная глина реакционно-активна
Слайд 105Слоистые глины подразделяются
Набухающие глины
Смектит
Не набухающий глины
Иллит *
Каолинит
Хлорит
*
Слайд 106Взаимодействие глин и воды
Глины, поглощающие воду, называются НАБУХАЮЩИМИ
Смектиты
Остальные глины не набухающие
Механика
Осмос
Капиллярное действие
Расклинивающее давление
Образование водородной связи
Слайд 107Осмотическое давление
Р = С*М-1*R*T , где
М – масса 1 моля
С – весовая концентрация
R – универсальная газовая постоянная;
Т – абсолютная температура
Слайд 111
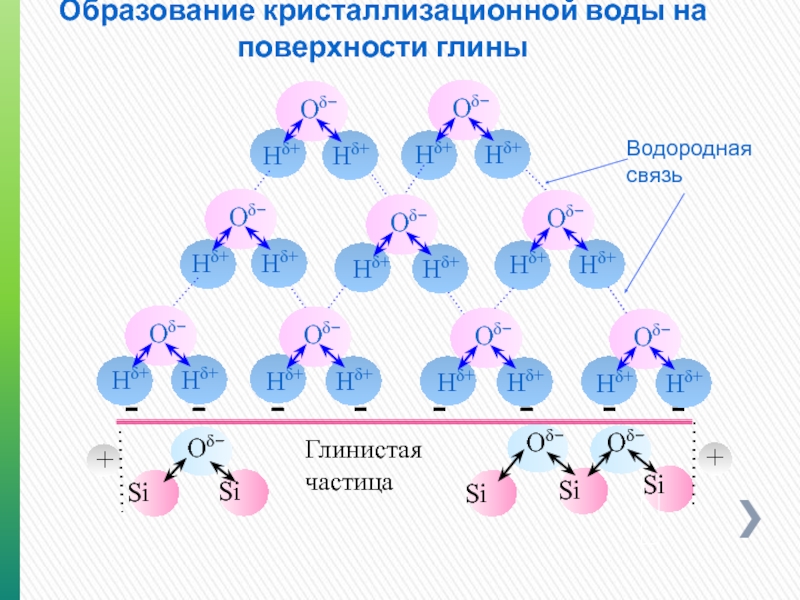
Образование кристаллизационной воды на поверхности глины
-
-
-
-
-
-
-
-
Глинистая частица
+
+
Oδ−
Oδ−
Oδ−
Si
Si
Si
Si
Si
Водородная связь
Слайд 112Типы связей глинистых частиц
АГГРЕГИРОВАННЫЕ
Поверхность к поверхности
ДИСПЕРГИРОВАННЫЕ
Хаотично расположены
ФЛОКУЛИРОВАННЫЕ
Поверхность к торцу
ДЕФЛОКУЛИРОВАННЫЕ
Слайд 113Агрегация
Поверхность к поверхностям
Число пластин в пачке варьируется
Естественное состояние глин
Слайд 115Дисперсия глин
Частицы не осаждаются
Причины:
Броуновское движение
Размер частиц очень мал
Отрицательные заряды в основном
Осаждаются при флокуляции, когда увеличивается размер флокул
Слайд 116Флокуляции (коагуляция)
Поверхность к торцу или торец к торцу
Обычное состояние глинистых пластин
Степень флокуляции возрастает за счет примесей: соли, кальция, магния, цемента, и т.п.
Слайд 117Ключевые термины
Коагуляция - уменьшение электростатического заряда твердых частиц, позволяющее частицам сближаться
Флокуляция – физико-химические связи, формируемые между двумя или большим количеством частиц, заставляют частицы слипаться в крупные «флокулы»
Слайд 118Механизм коагуляции
Снижение электрического заряда на поверхности частиц способствует сближению частиц
Вероятность столкновения
На близком расстоянии вступают в действие Ван-дер-Ваальсовы силы (межмолекулярное взаимодействие)
Слайд 119
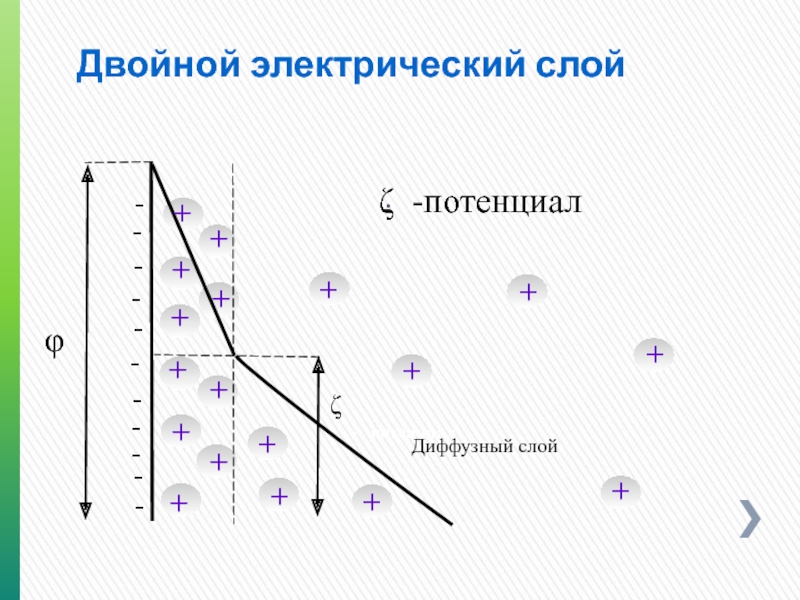
Двойной электрический слой
.
-
-
-
-
-
-
-
-
-
-
-
+
+
+
+
+
+
+
+
+
+
+
+
+
φ
ζ
- потенциал
ζ -потенциал
Диффузный слой
+
+
+
+
+
Слайд 120
-
-
-
-
-
-
-
-
-
-
+
+
+
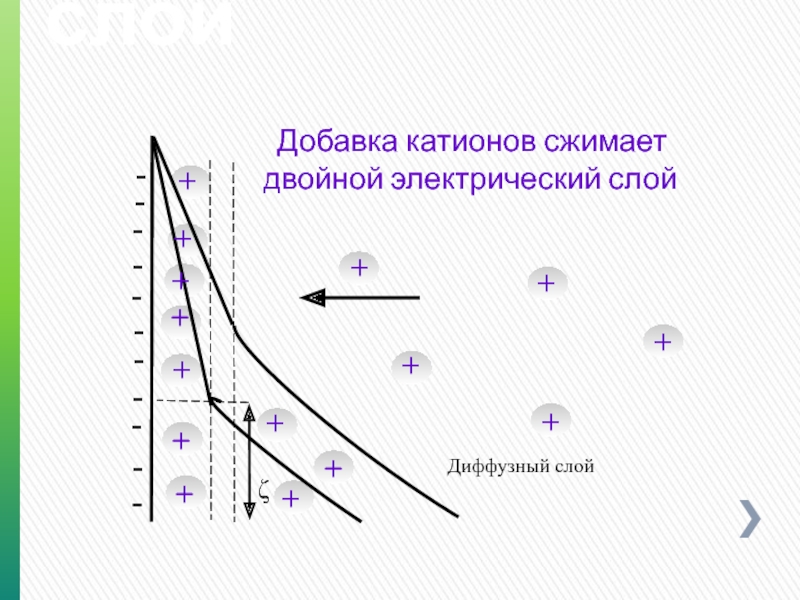
Двойной электрический слой
Добавка катионов сжимает
ζ
+
+
+
+
+
+
+
+
+
+
-
+
+
Диффузный слой
Слайд 121
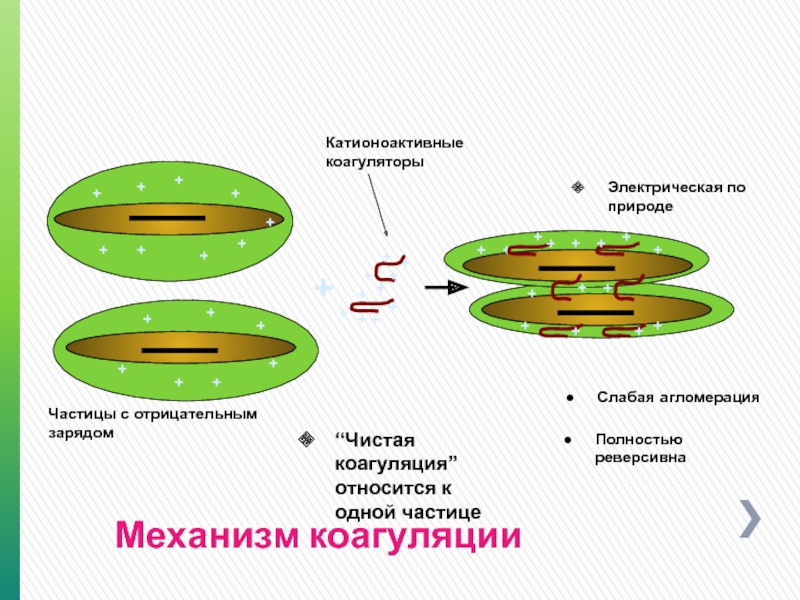
Механизм коагуляции
+
+
+
Частицы с отрицательным зарядом
“Чистая коагуляция” относится к одной частице
+
+
+
+
+
+
+
+
Катионоактивные коагуляторы
Электрическая
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
Слабая агломерация
Полностью реверсивна
+
Слайд 122Флокуляция
Слипание частиц в рыхлые и пористые трехмерные структуры произвольной формы, с
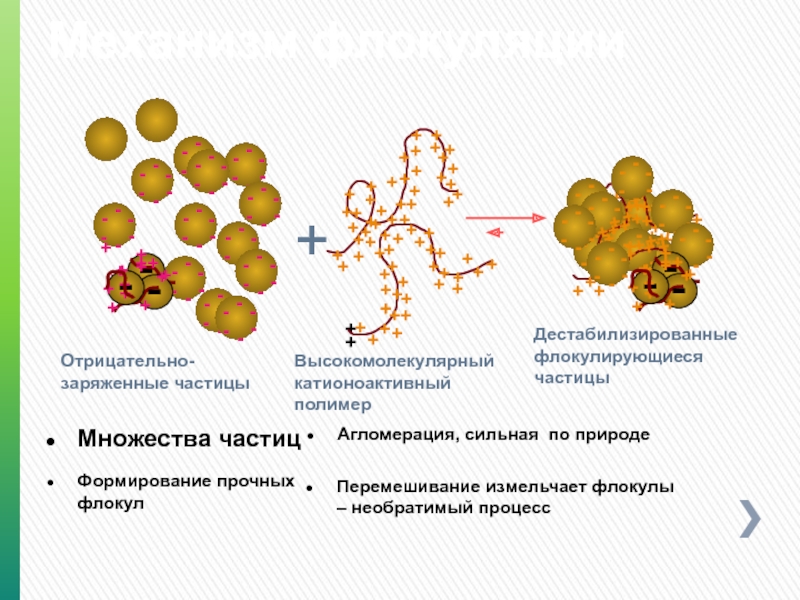
Слайд 123Механизм флокуляции
Отрицательно-заряженные частицы
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Множества частиц
Высокомолекулярный катионоактивный полимер
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
Агломерация, сильная по природе
Дестабилизированные
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Формирование прочных флокул
+
+
+
+
+
+
+
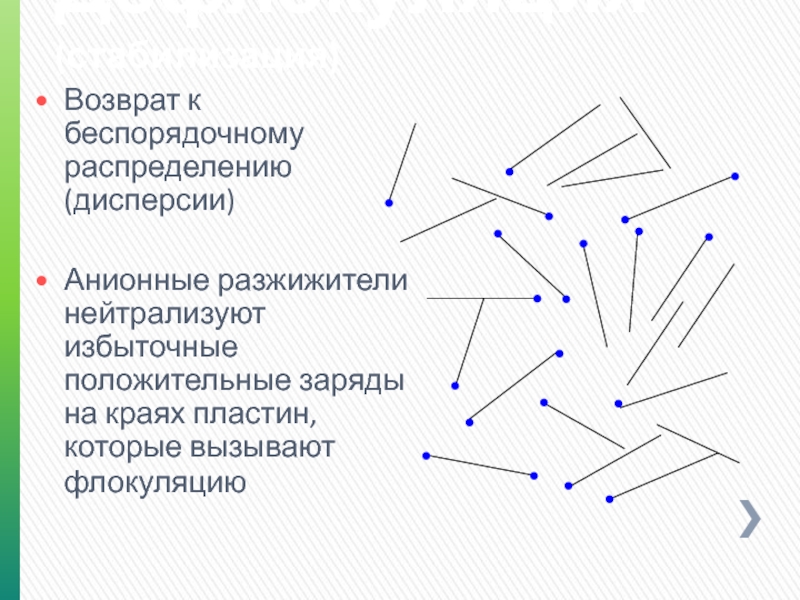
Слайд 124Дефлокуляция (стабилизация)
Возврат к беспорядочному распределению (дисперсии)
Анионные разжижители нейтрализуют избыточные положительные заряды
Слайд 126Типы связей глин
Агрегация: Снижение вязкости
Дисперсия: Возрастание вязкости
Флокуляция: Возрастание вязкости
Дефлокуляция:
Слайд 127Бентонит АНИ
Монтмориллонит натрия
Бентонит АНИ: Обработанный (Обогащенный или Модифицированный)
Используется в массовом
Бентонит природный или необработанный
Удовлетворяет требованиям АНИ без обогащения
Используется для бурения высокотемпературных скважин
Слайд 129Выход раствора
Выход – объем (м3) раствора (с вязкостью 15,0 сПз), получаемый
Выход бентонита АНИ - около 16 м3 р-ра ( 15,0 сПз) с одной тонны.
Один кубометр подобного раствора будет :
Содержать 2½% объема твердой фазы
Содержать 5½ % массы твердой фазы
Плотностью 1,03 г/см³
Слайд 130Факторы, воздействующие на выход раствора
Двухвалентные катионы:
Кальций
Магний
Соли
pH
Температура
Полимеры
Слайд 134Выход раствора
Выход раствора снижается в любой ингибированной системе раствора
Полимерной
Калиевой
Кальциевой
Силикатной
Гликолиевой
Предварительная гидратация
Слайд 136Предварительно гидратированный бентонит
По возможности необходимо предвари-тельно прогидратировать бентонит в пресной
Перед тем, как добавить в емкость воду, емкость следует очистить, удалив все остатки химических реагентов и «старого раствора»
Довести общую жесткость воды затворения (содержание Ca2++Mg2+) до 100,0 мг/л и менее
Добавить бентонит (80 –100 кг/м3)
Добавить каустическую соду (0,5 кг/м3)
Тщательно перемешать и хорошо продиспергировать
Перед поступлением в активную циркуляционную систему, прогидратированный бентонит может быть разбавлен до необходимой вязкости