- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Класифікація органічних сполук за будовою вуглецевого скелету та природою функціональних груп презентация
Содержание
- 1. Класифікація органічних сполук за будовою вуглецевого скелету та природою функціональних груп
- 2. Класифікація органічних сполук за будовою вуглецевого скелету
- 3. ПРЕДМЕТ ОРГАНІЧНОЇ ХІМІЇ Органічна хімія — це
- 4. ОСНОВНІ ПОЛОЖЕННЯ ТЕОРІЇ БУДОВИ ОРГАНІЧНИХ СПОЛУК (1861)
- 5. Основні положення теорії будови органічних сполук (1861)
- 6. 3. Атоми або групи атомів, які утворюють
- 7. СКЛАД – БУДОВА – ВЛАСТИВОСТІ Сучасне трактування:
- 8. Особливості органічних сполук Особливості органічних сполук
- 9. Основні положення теорії будови органічних сполук (1861)
- 10. Структурні формули н-бутан Етанол, етиловий спирт
- 11. Класифікація органічних сполук
- 12. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 13. Функціональна група Функціональна група – це атом
- 14. Классификация органических соединений
- 15. Классификация органических соединений
- 16. Класифікація органічних сполук Сполуки можуть містити не
- 17. Сполуки, що містять різні функціональні групи, називаються
- 18. Основи номенклатури органічних сполук Тривіальна номенклатура мурашина кислота деревний спирт щавлева кислота піровиноградна кислота
- 19. Барбітурова кислота Іоганн Фрідріх Вільгельм Адольф фон
- 20. Раціональна номенклатура диметилацетилен диметилетилен етилпропілізопропілкарбінол триметилоцтова кислота Основи номенклатури органічних сполук
- 21. Систематична номенклатура ІЮПАК ІЮПАК [від англійської назви
- 23. Номенклатура ИЮПАК органических соединений
- 24. Систематична номенклатура ІЮПАК Основи номенклатури органічних сполук
- 25. У випадку наявності в сполуці декількох функціональних
- 26. Номенклатура ИЮПАК органических соединений
- 27. Ізомерія ОС Ізомери — це речовини, які
- 28. ІЗОМЕРІЯ ОС
- 29. ІЗОМЕРІЯ
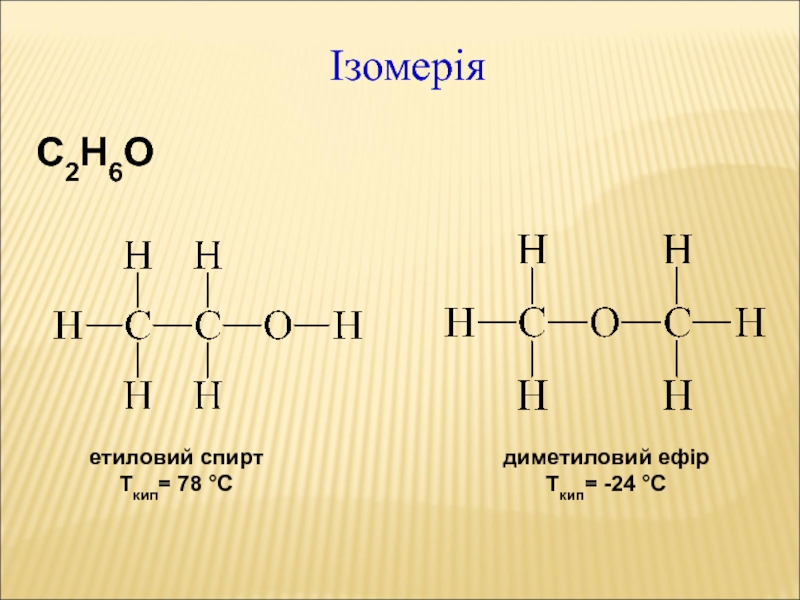
- 30. Ізомерія С2Н6О етиловий спирт Ткип= 78 °С диметиловий ефір Ткип= -24 °С
- 31. Ізомерія С4Н10 н-бутан Ткип= -0,5°С ізобутан Ткип= -11,7°С
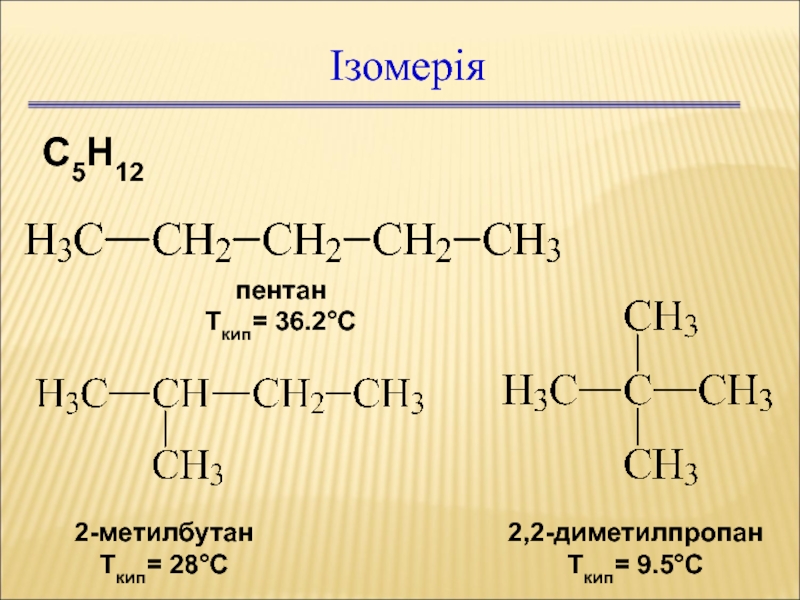
- 32. Ізомерія С5Н12 пентан Ткип= 36.2°С 2-метилбутан Ткип= 28°С 2,2-диметилпропан Ткип= 9.5°С
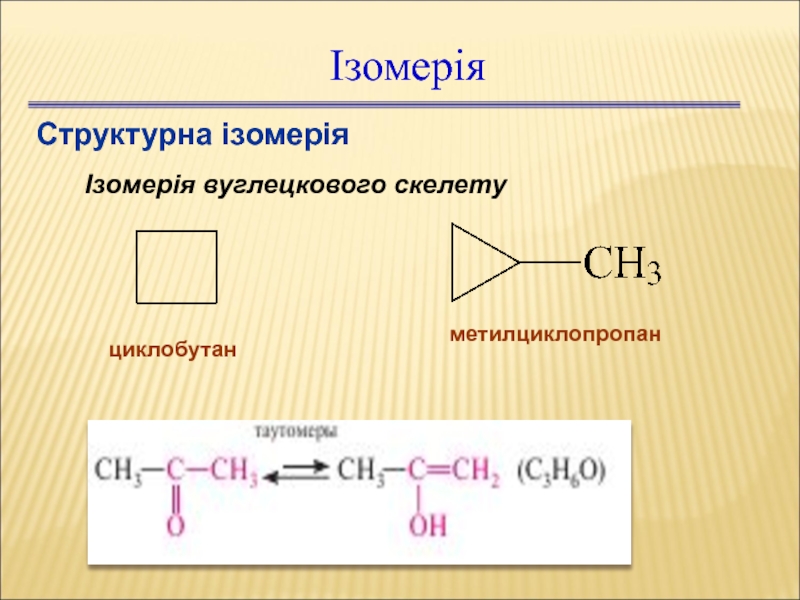
- 33. Ізомерія Структурна ізомерія Ізомерія вуглецкового скелету циклобутан метилциклопропан
- 34. Ізомерія Структурна ізомерія Ізомерія положення функціональної групи
- 35. Ізомерія Структурна ізомерія Ізомерія положення функціональної групи
- 36. Гомологи Групи органічних сполук однотипної структури з
- 37. Гомологи Гомологічний ряд ізобутану Гомологічний ряд метанолу
- 38. ЕЛЕКТРОННА СТРУКТУРА АТОМА КАРБОНУ В ОРГАНІЧНИХ СПОЛУКАХ
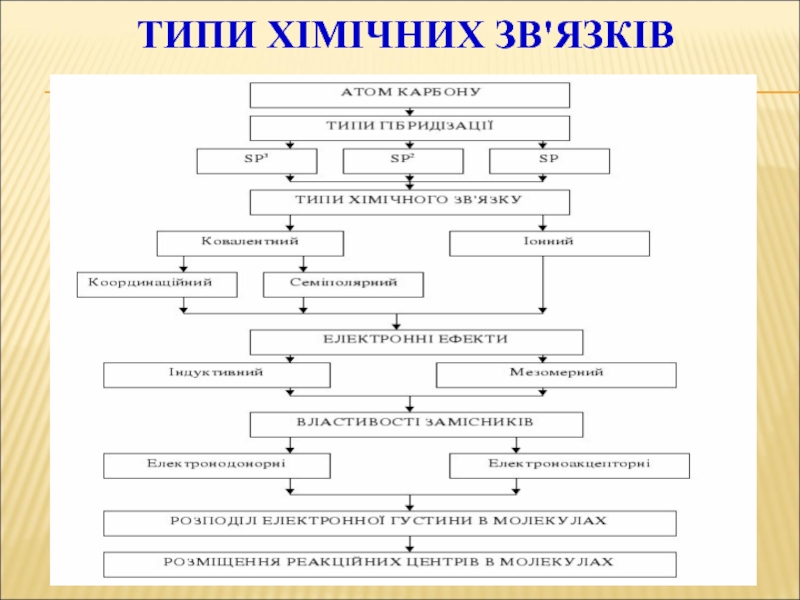
- 39. ТИПИ ХІМІЧНИХ ЗВ'ЯЗКІВ
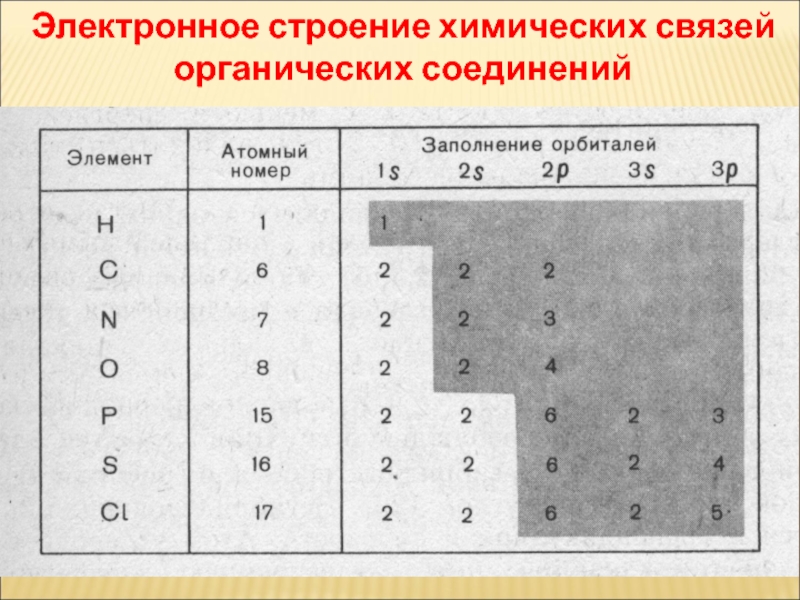
- 40. Электронное строение химических связей органических соединений
- 41. ГІБРИДИЗАЦІЯ Атомна орбіталь — це
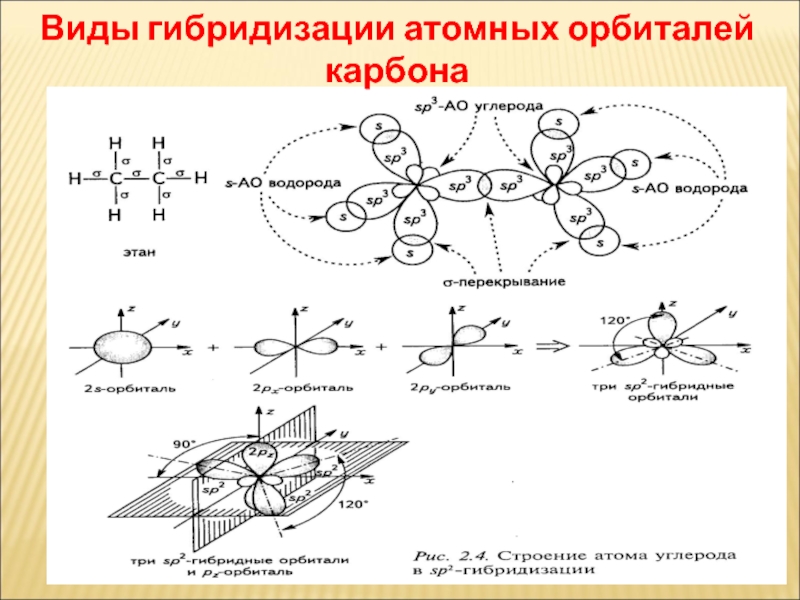
- 42. Виды гибридизации атомных орбиталей карбона
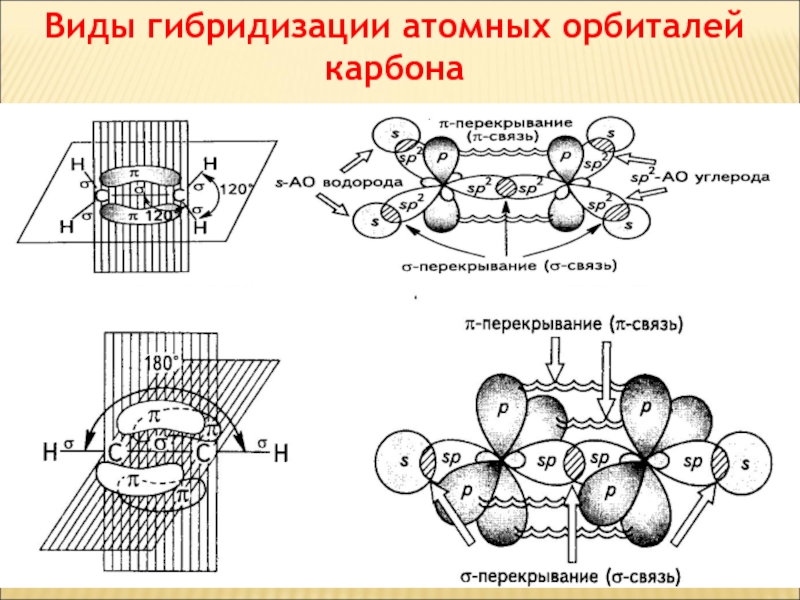
- 43. Виды гибридизации атомных орбиталей карбона
- 44. ГІБРИДИЗАЦІЯ Гібридні орбіталі і характер атомів Карбону
- 45. РІЗНІ ВИДИ ПЕРЕКРИВАННЯ ОРБІТАЛЕЙ σ-зв'язок
- 46. РІЗНІ ВИДИ ПЕРЕКРИВАННЯ ОРБІТАЛЕЙ π-
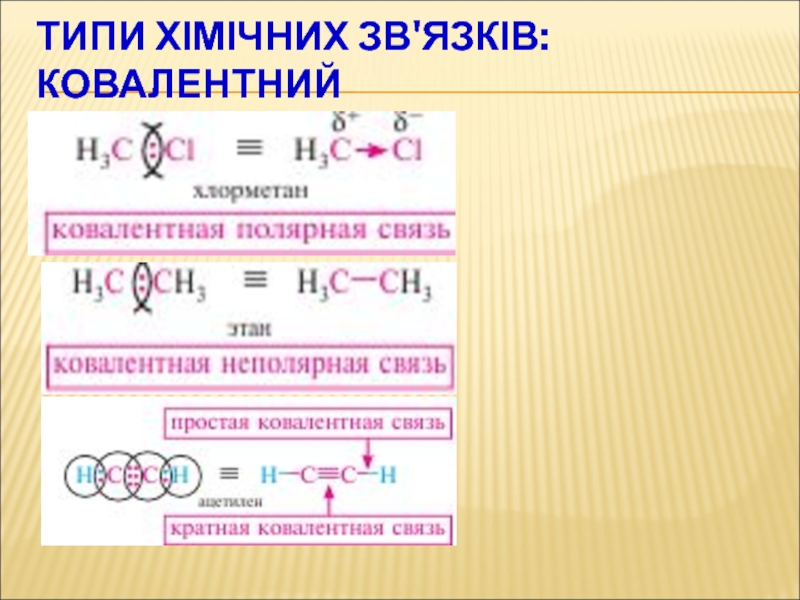
- 47. ТИПИ ХІМІЧНИХ ЗВ'ЯЗКІВ:КОВАЛЕНТНИЙ
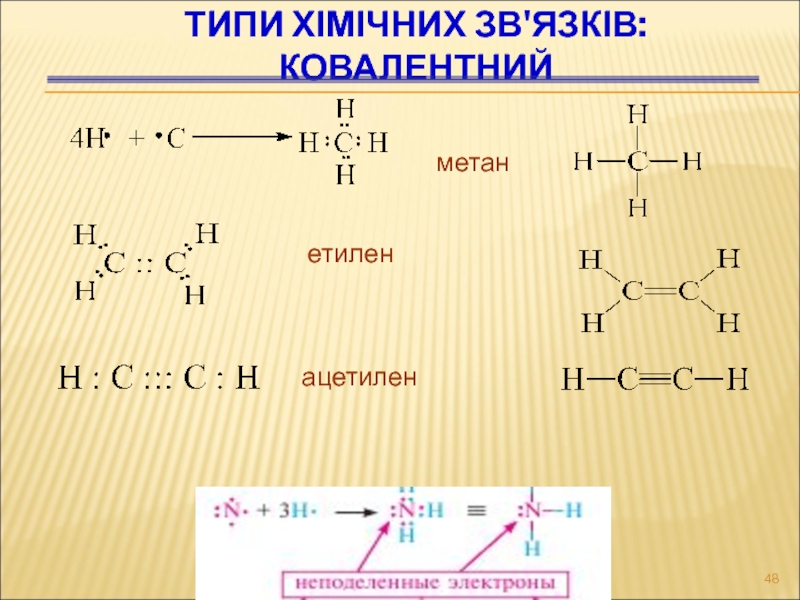
- 48. ТИПИ ХІМІЧНИХ ЗВ'ЯЗКІВ: КОВАЛЕНТНИЙ метан етилен ацетилен
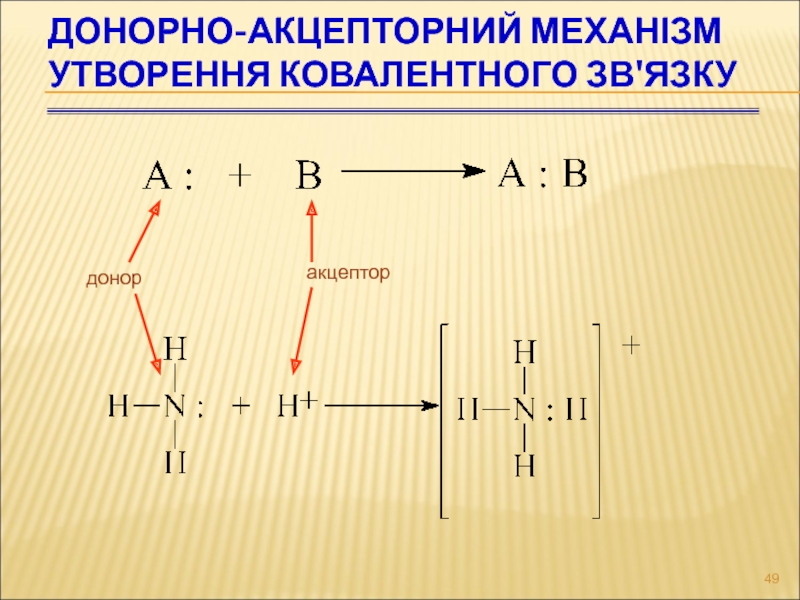
- 49. ДОНОРНО-АКЦЕПТОРНИЙ МЕХАНІЗМ УТВОРЕННЯ КОВАЛЕНТНОГО ЗВ'ЯЗКУ донор акцептор
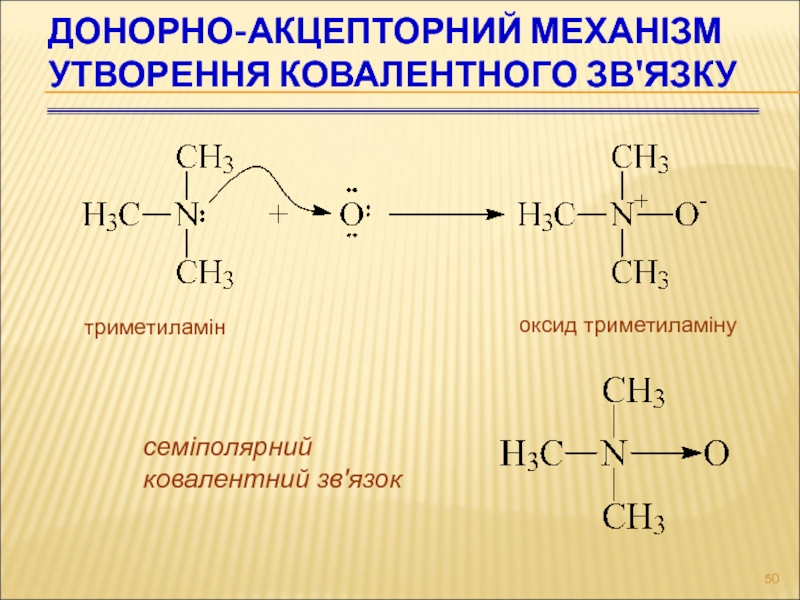
- 50. ДОНОРНО-АКЦЕПТОРНИЙ МЕХАНІЗМ УТВОРЕННЯ КОВАЛЕНТНОГО ЗВ'ЯЗКУ триметиламін оксид триметиламіну семіполярний ковалентний зв'язок
- 51. ВЛАСТИВОСТІ КОВАЛЕНТНОГО ЗВ'ЯЗКУ Ковалентний зв'язок
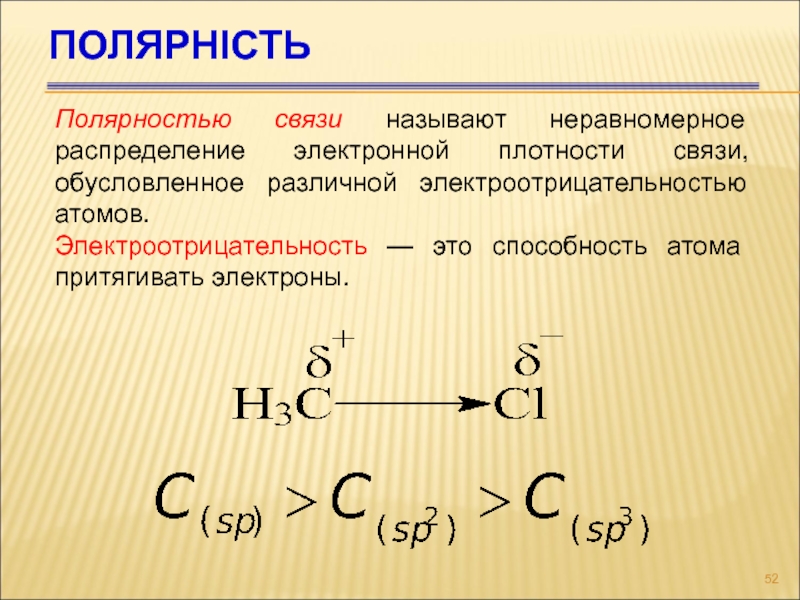
- 52. ПОЛЯРНІСТЬ Полярностью связи называют неравномерное
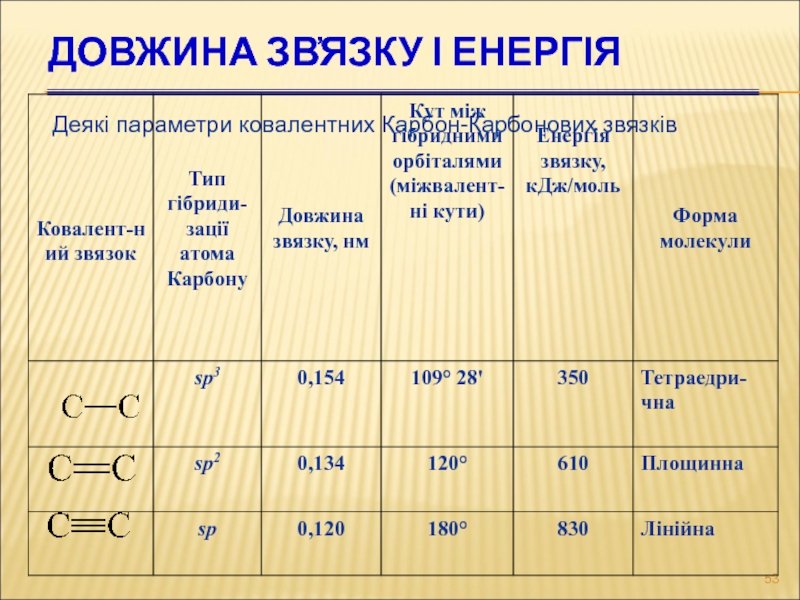
- 53. ДОВЖИНА ЗВ҆ЯЗКУ І ЕНЕРГІЯ Деякі параметри ковалентних Карбон-Карбонових звязків
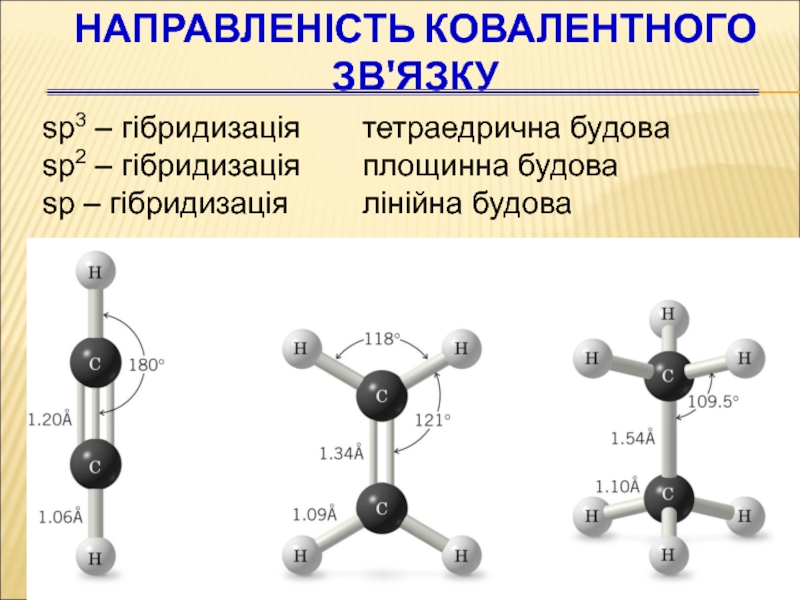
- 54. НАПРАВЛЕНІСТЬ КОВАЛЕНТНОГО ЗВ'ЯЗКУ sp3 – гібридизація
- 55. ТИПИ ХІМІЧНИХ ЗВ'ЯЗКІВ: ВОДНЕВИЙ ЗВ'ЯЗОК 12,5—20
- 56. Вчення про взаємний вплив атомів у молекулі
- 57. ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ Індуктивний
- 58. ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ Індуктивний ефект
- 59. ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ Індуктивний ефект
- 60. ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ Індуктивний ефект
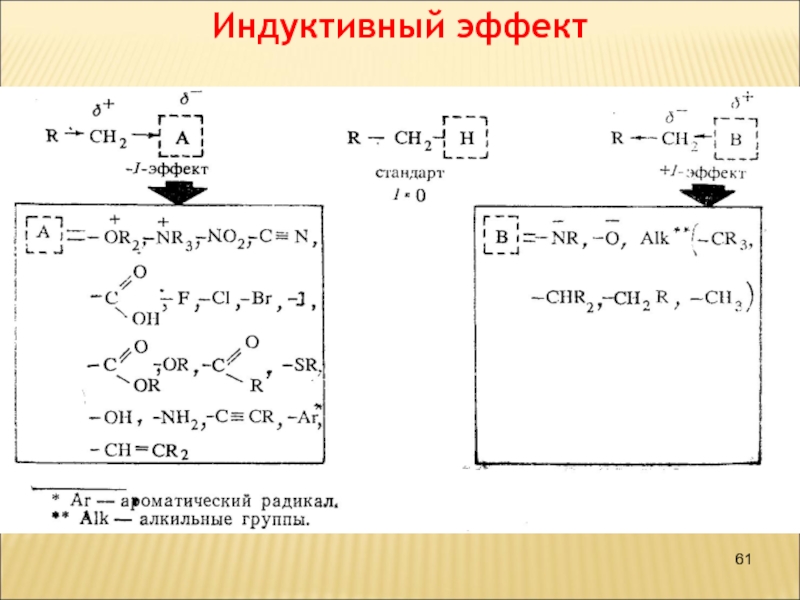
- 61. Индуктивный эффект
- 62. ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ Мезомерний ефект
- 63. Виды сопряжения
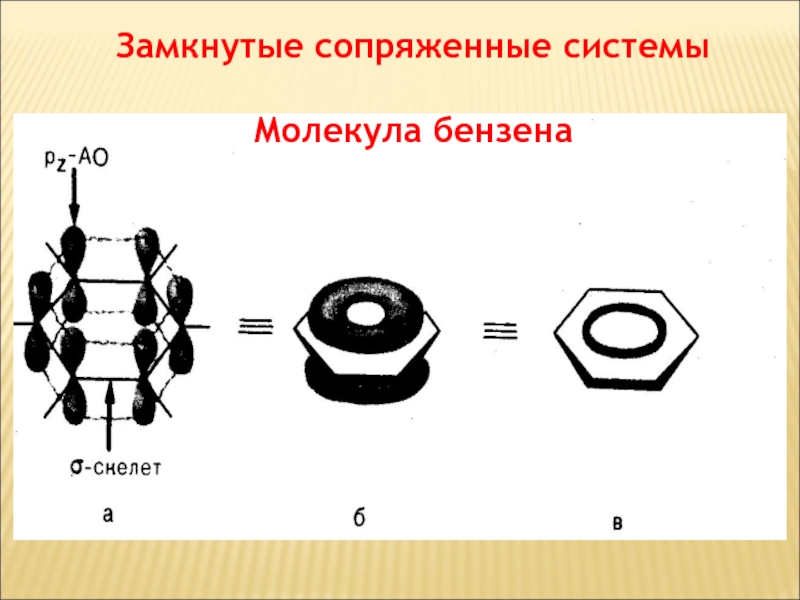
- 64. Замкнутые сопряженные системы Молекула бензена
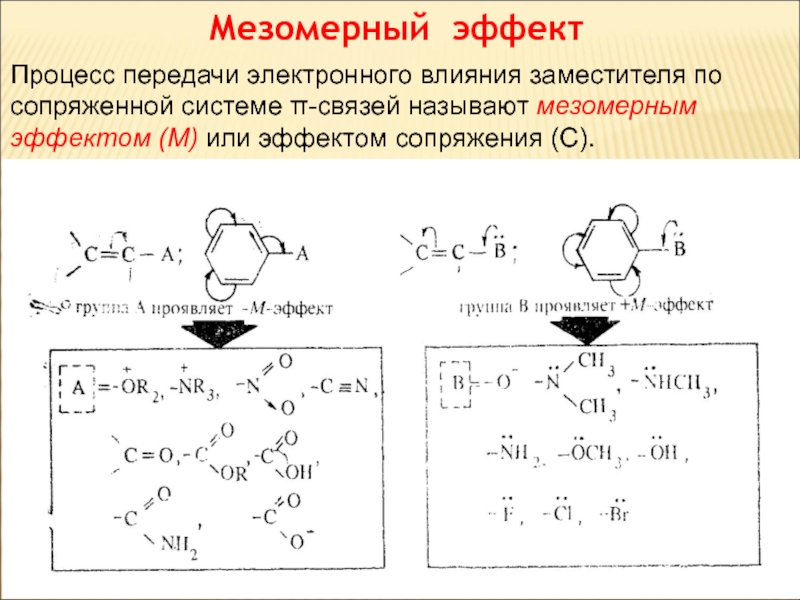
- 65. Мезомерный эффект Процесс передачи электронного влияния заместителя
- 66. ДЯКУЮ ЗА УВАГУ!
- 67. Кислоти та основи по Бренстеду-Лоурі Кислотність і
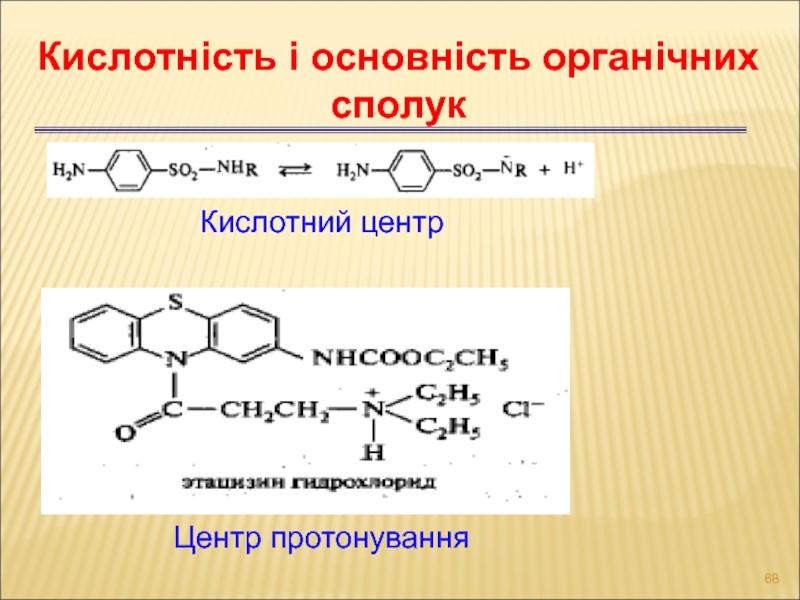
- 68. Центр протонування Кислотність і основність органічних сполук Кислотний центр
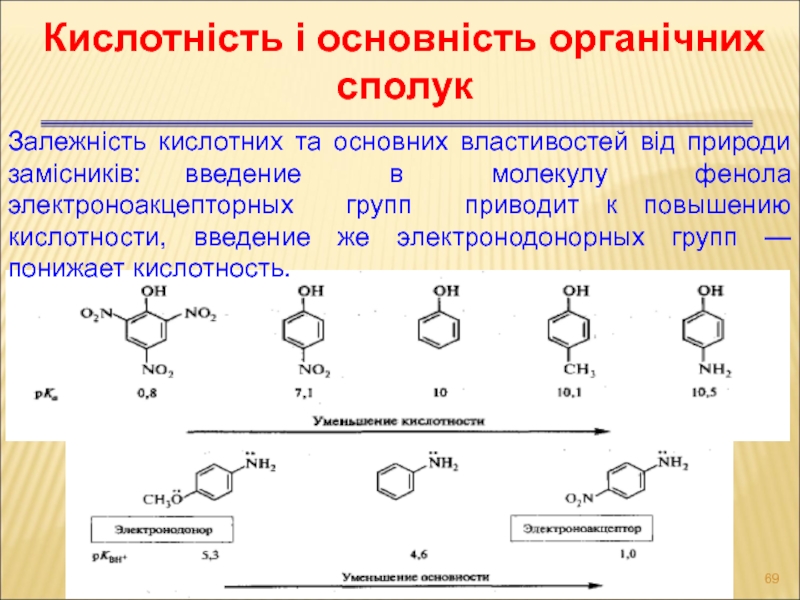
- 69. Кислотність і основність органічних сполук Залежність кислотних
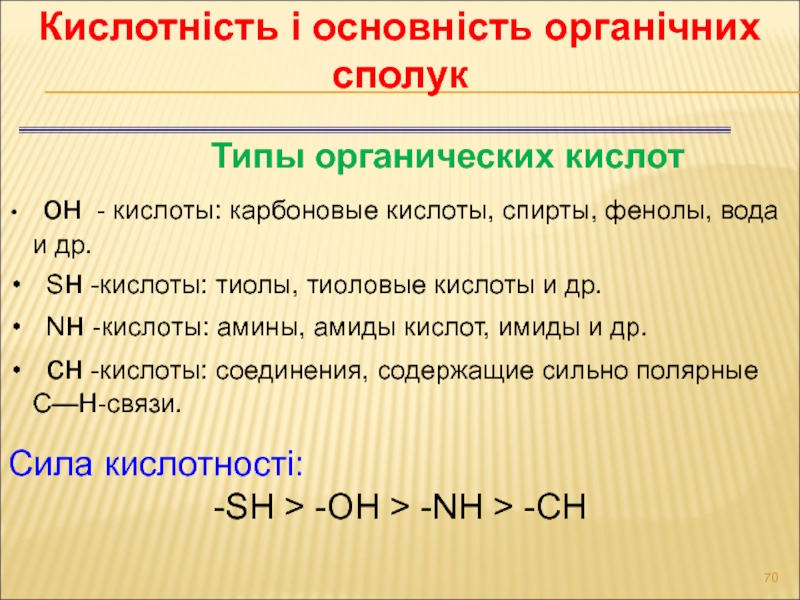
- 70. Кислотність і основність органічних сполук Сила кислотності:
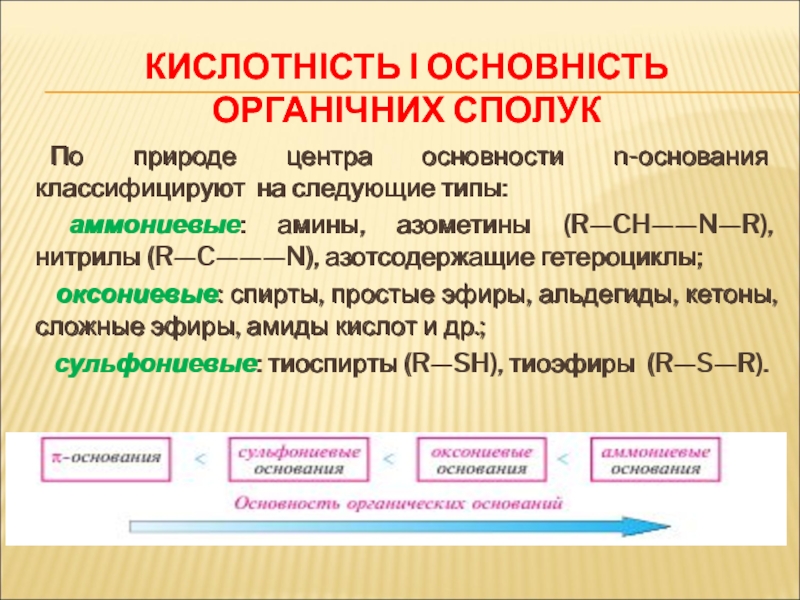
- 71. КИСЛОТНІСТЬ І ОСНОВНІСТЬ ОРГАНІЧНИХ СПОЛУК По
- 72. Кислотність і основність органічних сполук Кислоти та
- 73. Основание по теории Льюиса является донором, а кислота — акцептором пары электронов
- 74. Кислотність і основність органічних сполук Легкость протекания
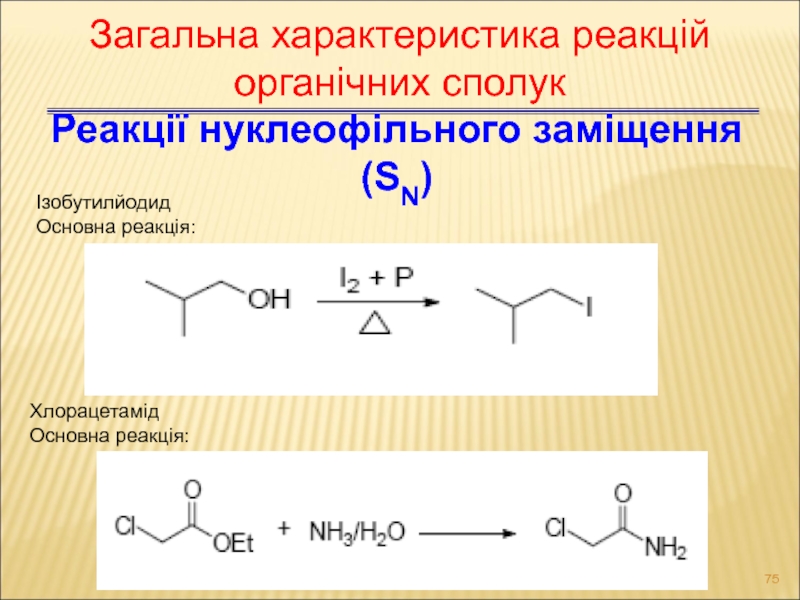
- 75. Реакції нуклеофільного заміщення (SN) Ізобутилйодид Основна
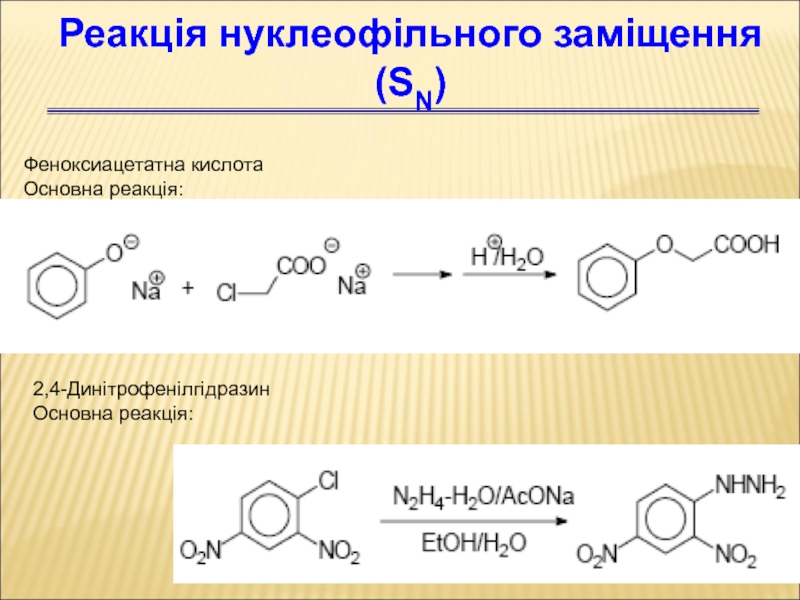
- 76. Феноксиацетатна кислота Основна реакція: Реакція нуклеофільного заміщення (SN) 2,4-Динітрофенілгідразин Основна реакція:
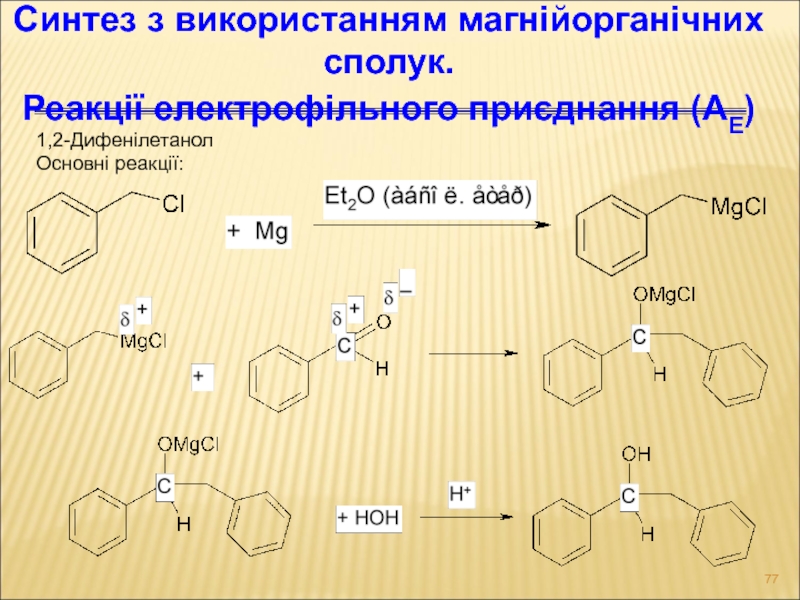
- 77. 1,2-Дифенілетанол Основні реакції: Синтез з використанням магнійорганічних сполук. Реакції електрофільного приєднання (АЕ)
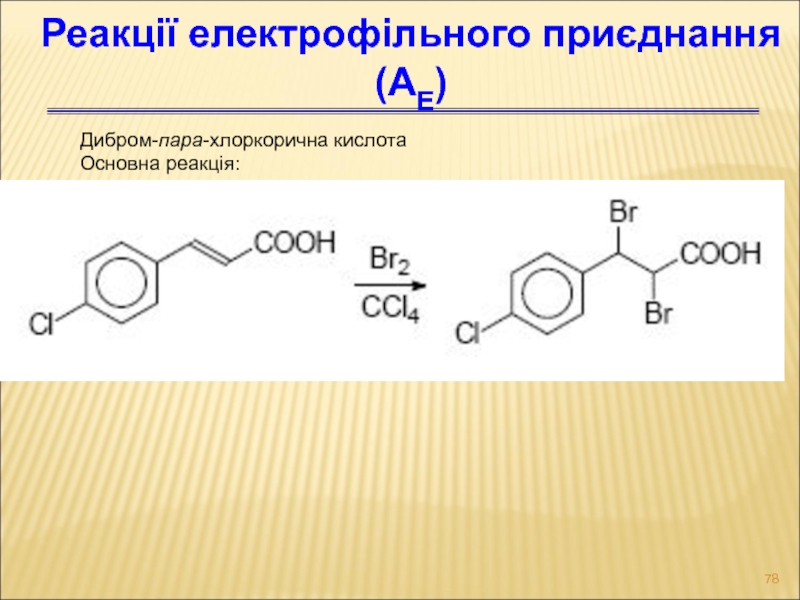
- 78. Дибром-пара-хлоркорична кислота Основна реакція: Реакції електрофільного приєднання (АЕ)
- 79. пара-Ксиленсульфокислота Основна реакція: Реакції електрофільного заміщення (SЕ) 4-Бром-трет-бутилбензен Основна реакція: мета-Нітроацетофенон Основна реакція:
- 80. пара-Бромацетанілід і пара-броманілін Основна реакція: Реакції електрофільного
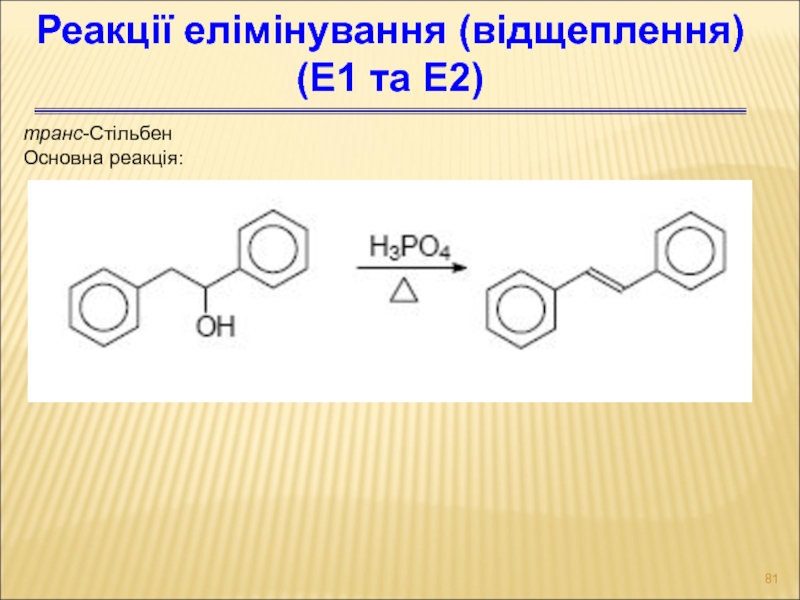
- 81. транс-Стільбен Основна реакція: Реакції елімінування (відщеплення) (Е1 та Е2)
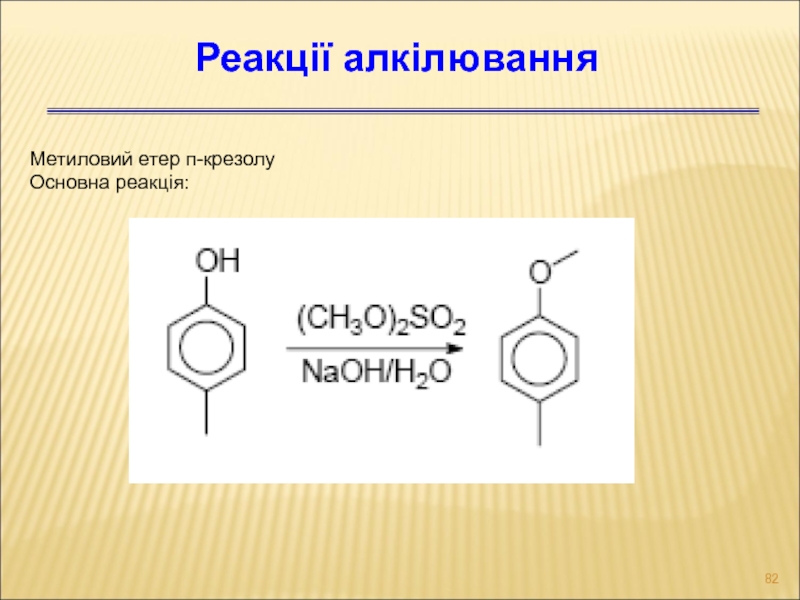
- 82. Метиловий етер п-крезолу Основна реакція: Реакції алкілювання
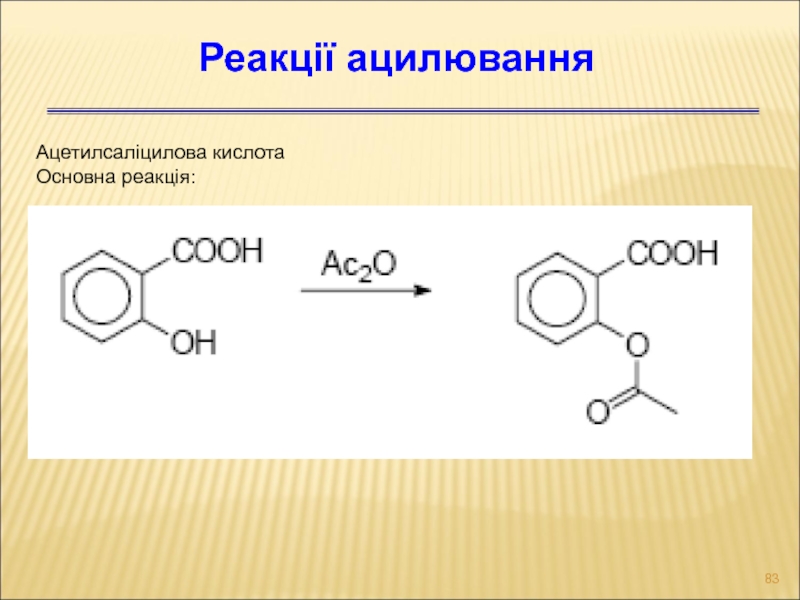
- 83. Ацетилсаліцилова кислота Основна реакція: Реакції ацилювання
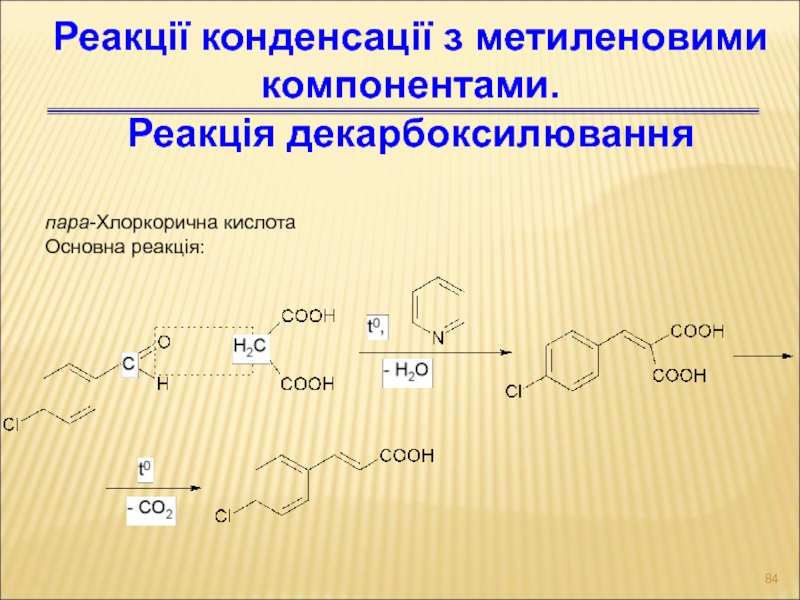
- 84. пара-Хлоркорична кислота Основна реакція: Реакції конденсації з метиленовими компонентами. Реакція декарбоксилювання
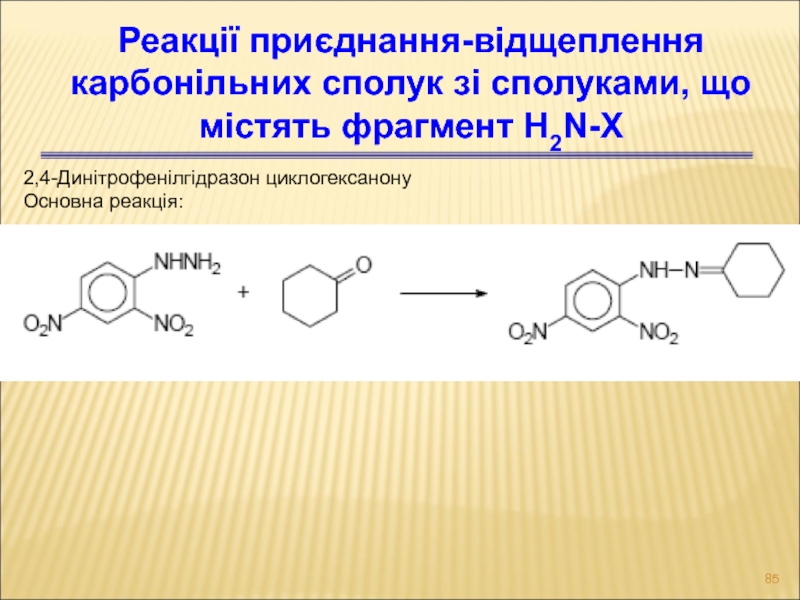
- 85. 2,4-Динітрофенілгідразон циклогексанону Основна реакція: Реакції приєднання-відщеплення карбонільних сполук зі сполуками, що містять фрагмент H2N-X
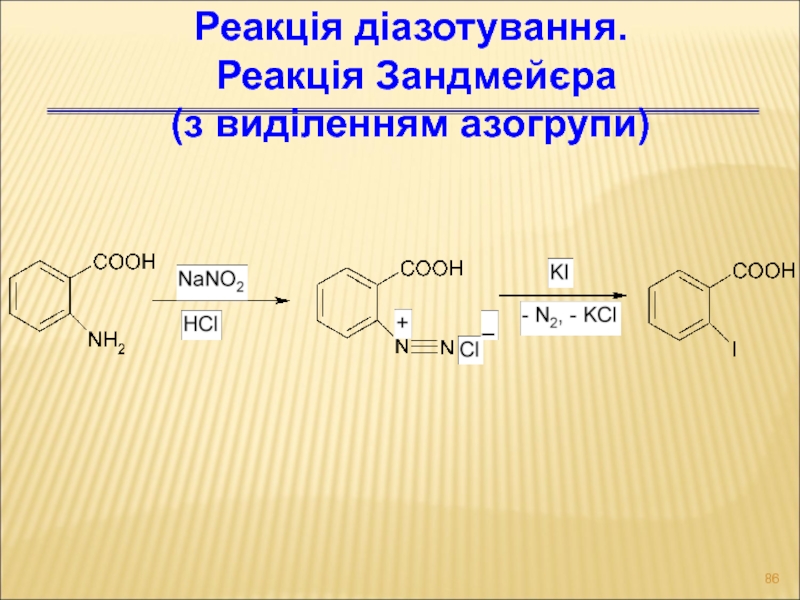
- 86. Реакція діазотування. Реакція Зандмейєра (з виділенням азогрупи)
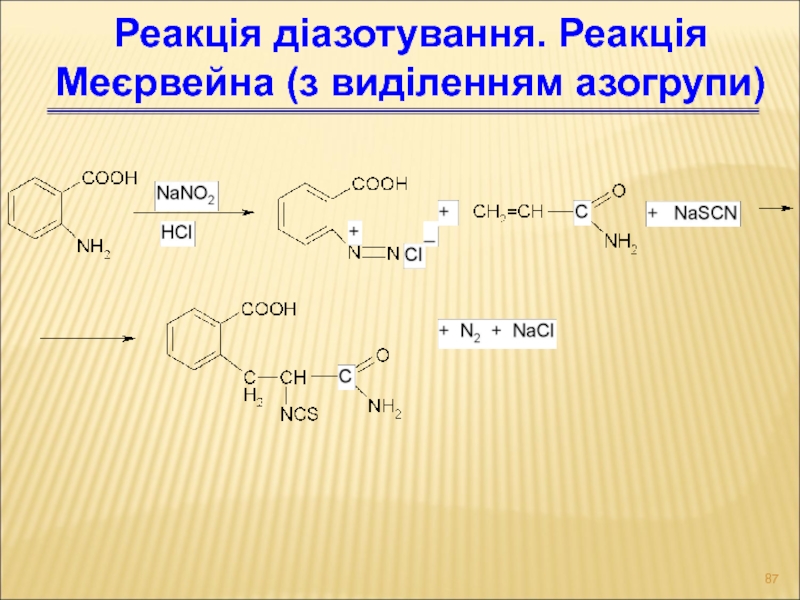
- 87. Реакція діазотування. Реакція Меєрвейна (з виділенням азогрупи)
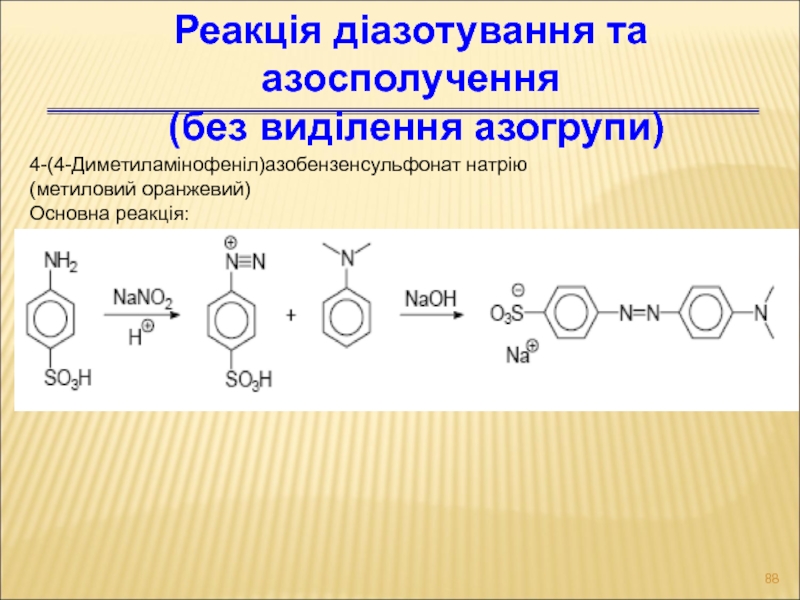
- 88. 4-(4-Диметиламінофеніл)азобензенсульфонат натрію (метиловий оранжевий) Основна реакція: Реакція діазотування та азосполучення (без виділення азогрупи)
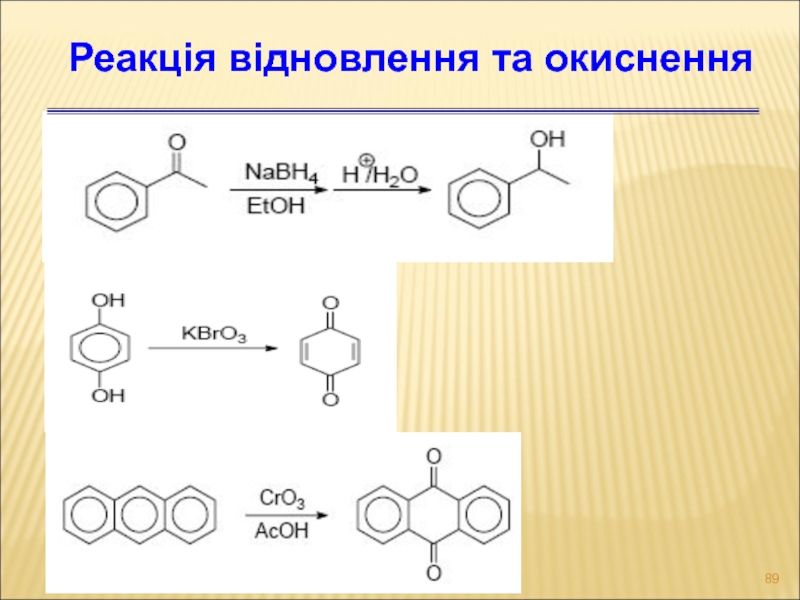
- 89. Реакція відновлення та окиснення
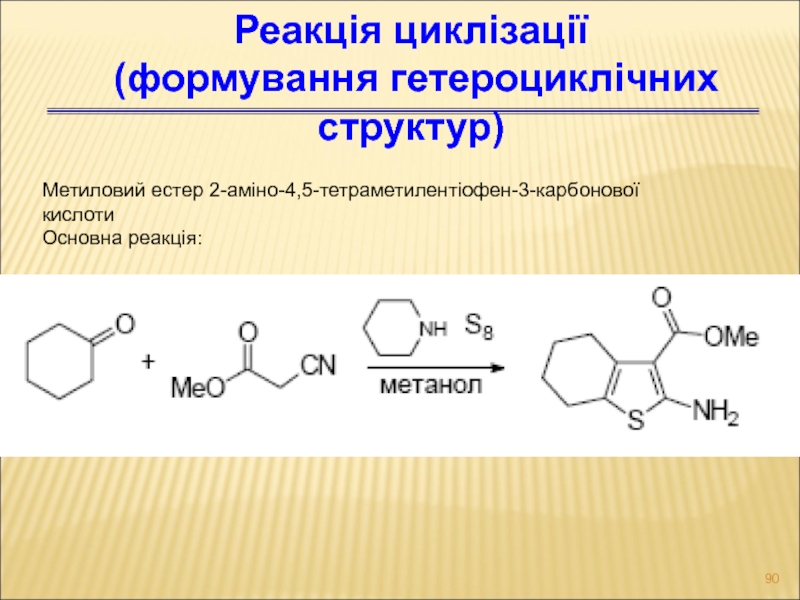
- 90. Реакція циклізації (формування гетероциклічних структур) Метиловий естер 2-аміно-4,5-тетраметилентіофен-3-карбонової кислоти Основна реакція:
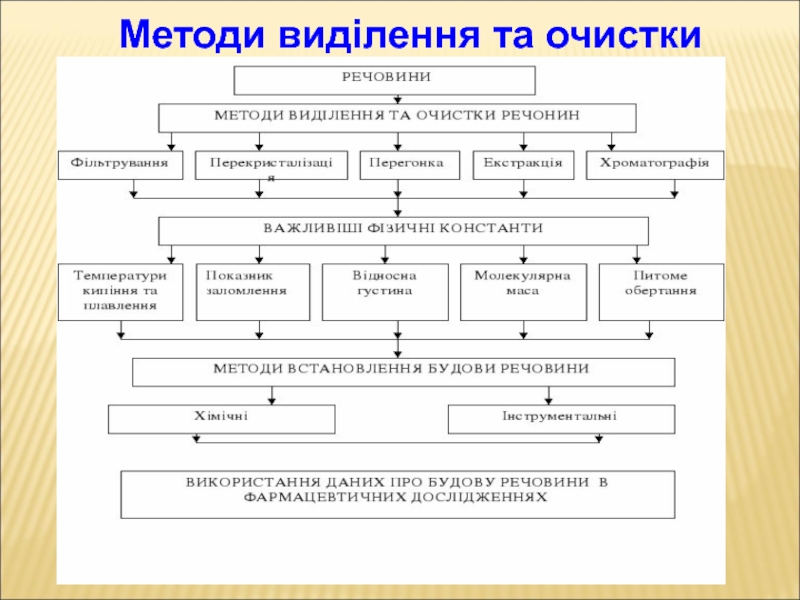
- 91. Методи виділення та очистки
- 92. ДЯКУЮ ЗА УВАГУ!
Слайд 2Класифікація органічних сполук за будовою вуглецевого скелету та природою функціональних груп.
Електронна будова хімічних зв’язків. Типи хімічних зв’язків в органічних сполуках. Види гібридизації атомних орбіталей вуглецю. Важливі характеристики σ- та π - зв’язків (довжина, енергія, помірність, здатність до поляризації).
Взаємний вплив атомів в органічних сполуках. Індуктивний ефект. Супряжені системи з відкритими та замкненими ланцюгами, види супряжень
Електронодонорні і електроноакцепторні замісники.
Загальна характеристика реакцій органічних сполук.
ПЛАН
Слайд 3ПРЕДМЕТ ОРГАНІЧНОЇ ХІМІЇ
Органічна хімія — це хімія сполук атома Карбону та
Елементи Н, О, N, S, галогени – називають органогенами.
Органічна хімія — це хімія вуглеводнів і їх похідних
Слайд 4ОСНОВНІ ПОЛОЖЕННЯ ТЕОРІЇ БУДОВИ ОРГАНІЧНИХ СПОЛУК (1861)
БУТЛЕРОВ
Олександр Михайлович
3(15) вересня 1828 р.
Слайд 5Основні положення теорії будови органічних сполук (1861)
Атоми, що входять до складу
Властивості речовини залежать не тільки від того, які атоми і в якій кількості входять до складу її молекули, але й від того, в якій послідовності вони зв’язані між собою, тобто від хімічної будови молекули.
Слайд 63. Атоми або групи атомів, які утворюють молекулу, як зв’язані безпосередньо,
4. Вивчаючи реакційну здатність речовини, можна встановити її будову, і навпаки, за будовою речовини можна судити про її властивості.
Основні положення теорії будови органічних сполук (1861)
Слайд 7СКЛАД – БУДОВА – ВЛАСТИВОСТІ
Сучасне трактування:
Властивості складних речовин залежать від якісного
Значення теорії будови органічних сполук
Зв’язок між будовою і властивостями стверджує пізнаваність органічних речовин і відкриває широку дорогу до вивчення синтезу і структури речовин. Дійсно, з основного положення теорії випливає, що вивчення властивостей речовин дає можливість знати будову і навпаки.
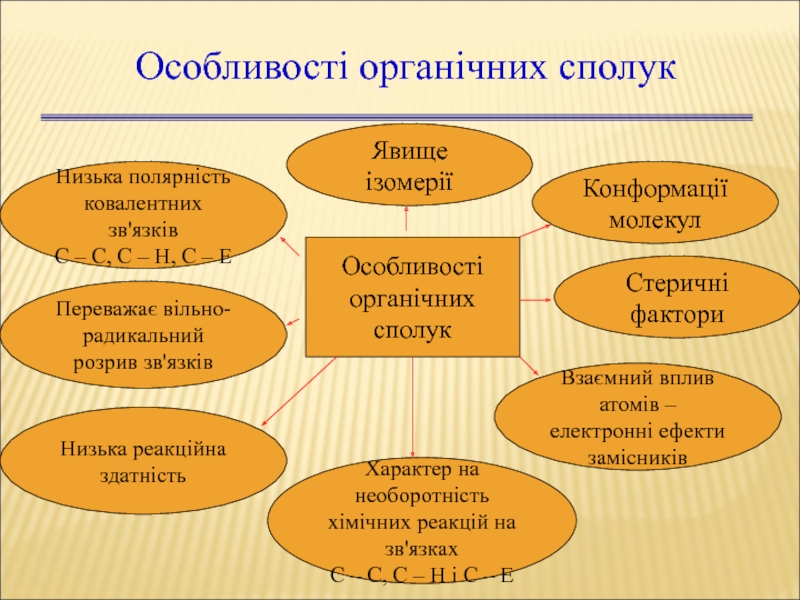
Слайд 8Особливості органічних сполук
Особливості
органічних сполук
Явище ізомерії
Конформації
молекул
Низька полярність
ковалентних зв'язків
С
Переважає вільно-
радикальний розрив зв'язків
Низька реакційна
здатність
Стеричні фактори
Характер на необоротність
хімічних реакцій на зв'язках
С – С, С – Н і С – Е
Взаємний вплив атомів –
електронні ефекти
замісників
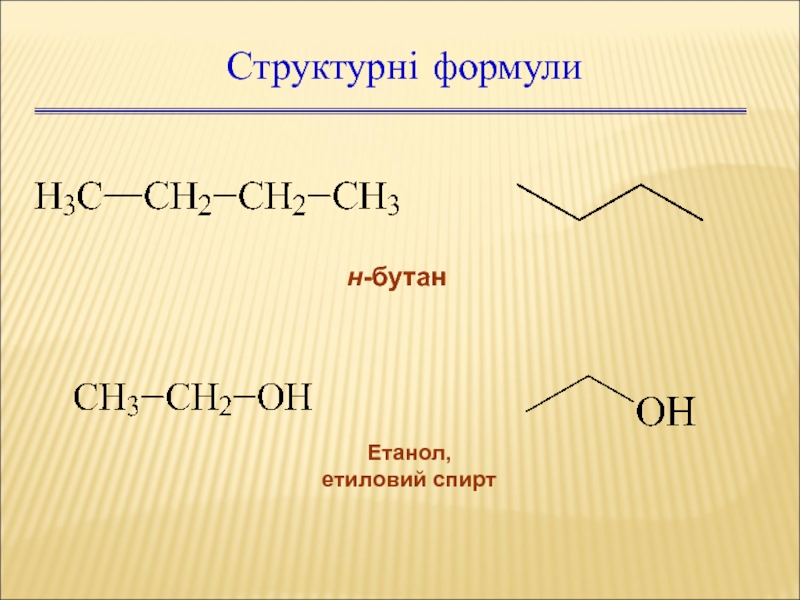
Слайд 9Основні положення теорії будови органічних сполук (1861)
Структурна формула — це зображення
Брутто-формула – СН4О або CH3OH
Структурна формула
Спрощені формули будови іноді називають раціональними
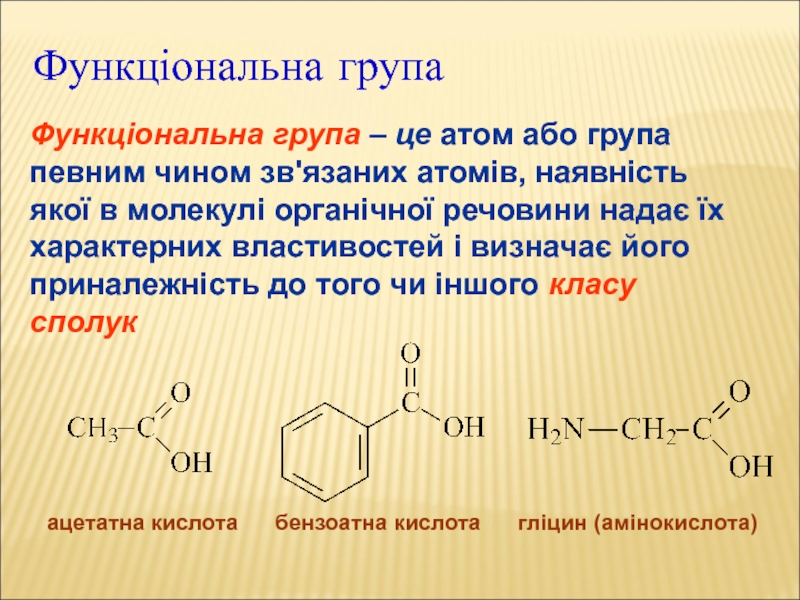
Слайд 13Функціональна група
Функціональна група – це атом або група певним чином зв'язаних
ацетатна кислота бензоатна кислота гліцин (амінокислота)
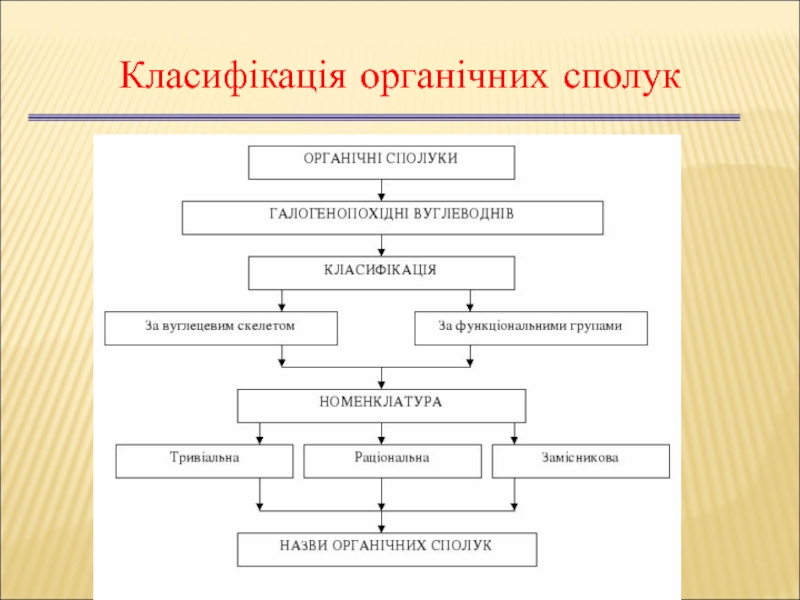
Слайд 16Класифікація органічних сполук
Сполуки можуть містити не одну, а декілька функціональних груп.
хлороформ
гліцерин
Слайд 17Сполуки, що містять різні функціональні групи, називаються гетерофункціональними.
молочна кислота
коламін
Класифікація органічних сполук
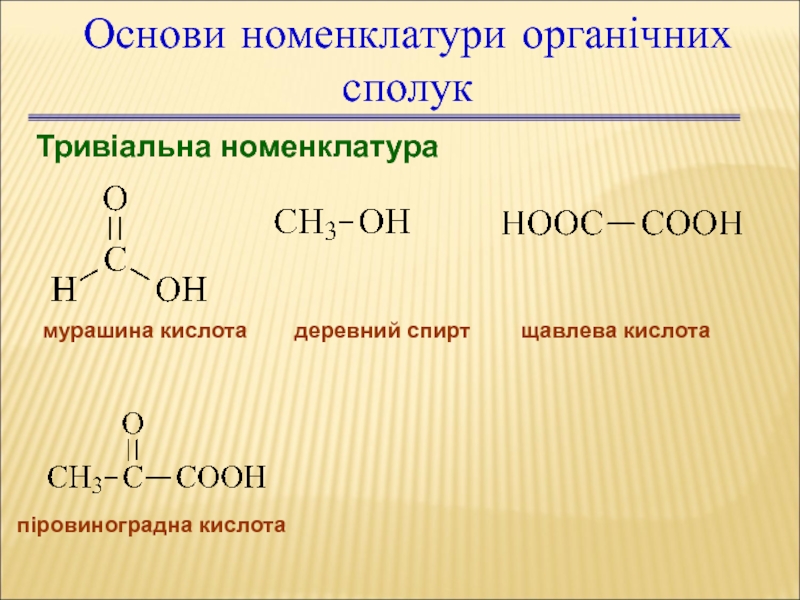
Слайд 18Основи номенклатури органічних сполук
Тривіальна номенклатура
мурашина кислота
деревний спирт
щавлева кислота
піровиноградна кислота
Слайд 19Барбітурова кислота
Іоганн Фрідріх Вільгельм Адольф фон Байєр
31.10.1835 – 20.08.1917
Основи номенклатури органічних
Тривіальна номенклатура
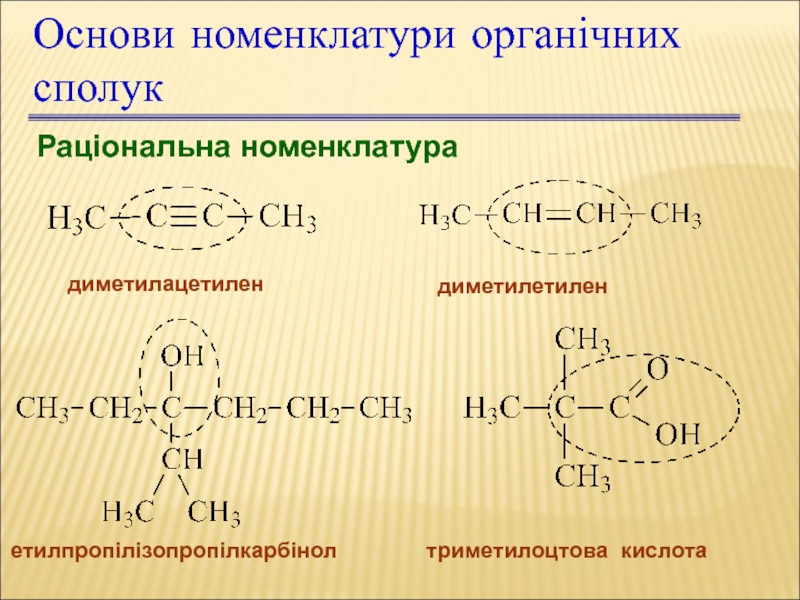
Слайд 20Раціональна номенклатура
диметилацетилен
диметилетилен
етилпропілізопропілкарбінол
триметилоцтова кислота
Основи номенклатури органічних сполук
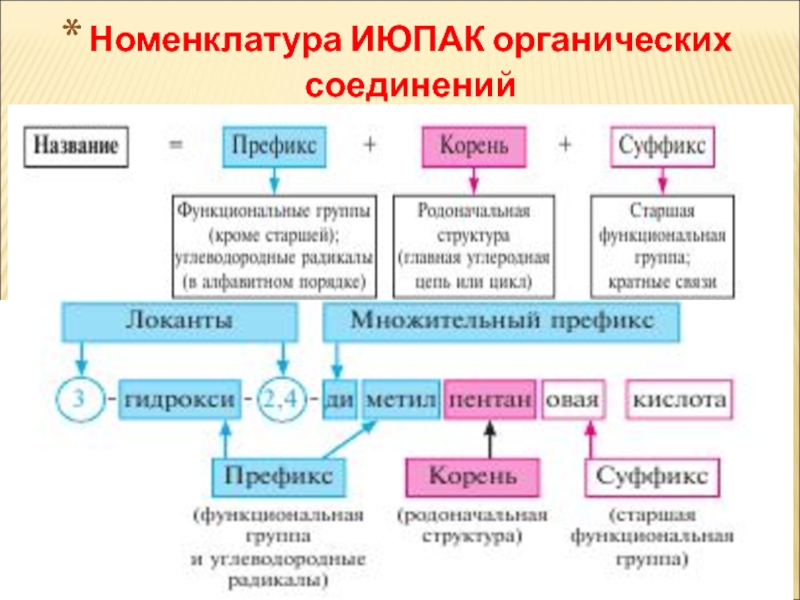
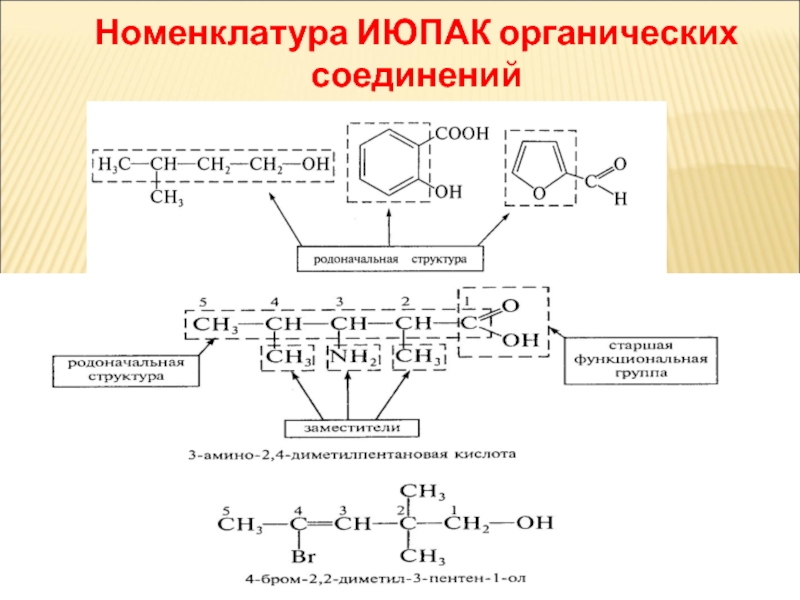
Слайд 21Систематична номенклатура ІЮПАК
ІЮПАК [від англійської назви Міжнародного союзу чистої і прикладної
Систематичні назви складені
зі слів, спеціально створених або вибраних для опису структурних особливостей сполук.
замісникова та радикально-функціональна
Основи номенклатури органічних сполук
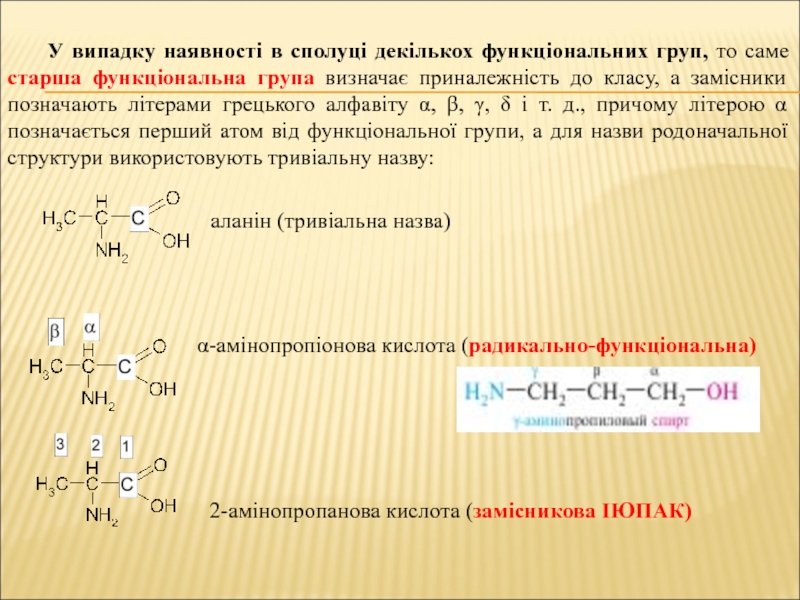
Слайд 25У випадку наявності в сполуці декількох функціональних груп, то саме старша
аланін (тривіальна назва)
α-амінопропіонова кислота (радикально-функціональна)
2-амінопропанова кислота (замісникова ІЮПАК)
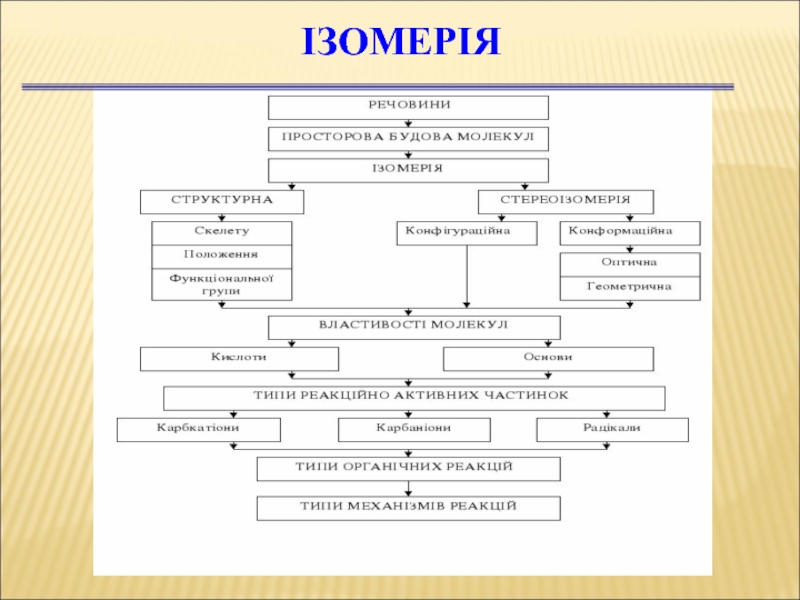
Слайд 27Ізомерія ОС
Ізомери — це речовини, які мають однаковий якісний і кількісний
Слайд 34Ізомерія
Структурна ізомерія
Ізомерія положення функціональної групи
бутанол-1
бутанол-2
бутен-1
бутен-2
Слайд 35Ізомерія
Структурна ізомерія
Ізомерія положення функціональної групи
дивінілацетилен
бензен
α-амінопропіонова кислота
β-амінопропіонова кислота
Слайд 36Гомологи
Групи органічних сполук однотипної структури з однаковими функціональними групами, що відрізняються
Гомологічний ряд метана
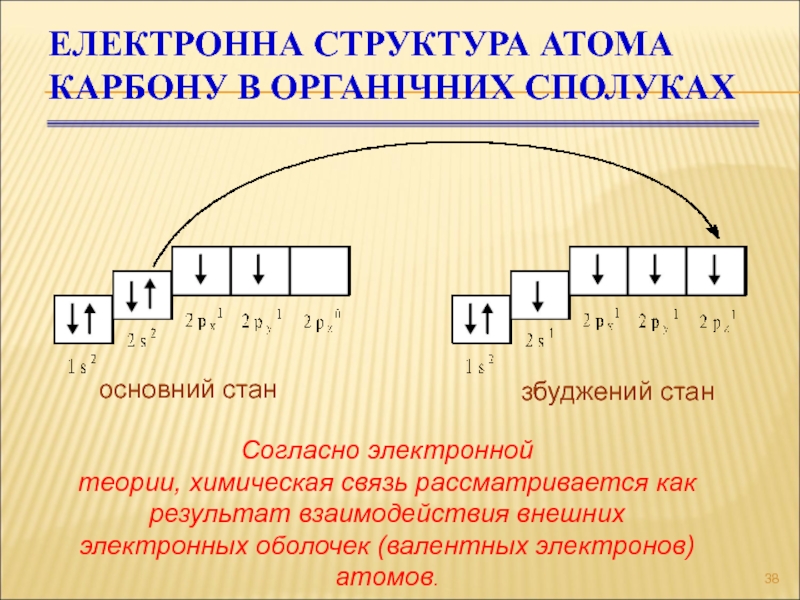
Слайд 38ЕЛЕКТРОННА СТРУКТУРА АТОМА КАРБОНУ В ОРГАНІЧНИХ СПОЛУКАХ
основний стан
збуджений стан
Согласно электронной
теории, химическая связь рассматривается как результат взаимодействия внешних
электронных оболочек (валентных электронов) атомов.
Слайд 41ГІБРИДИЗАЦІЯ
Атомна орбіталь — це частина простору, в якій ймовірність знаходження
Сущность гибридизации заключается в том, что из нескольких различных по форме и близких по энергии атомных орбиталей образуется такое же число одинаковых по форме и энергии гибридных орбиталей. Например, при взаимодействии одной s- и трех р-атомных орбиталей образуются четыре гибридные орбитали.
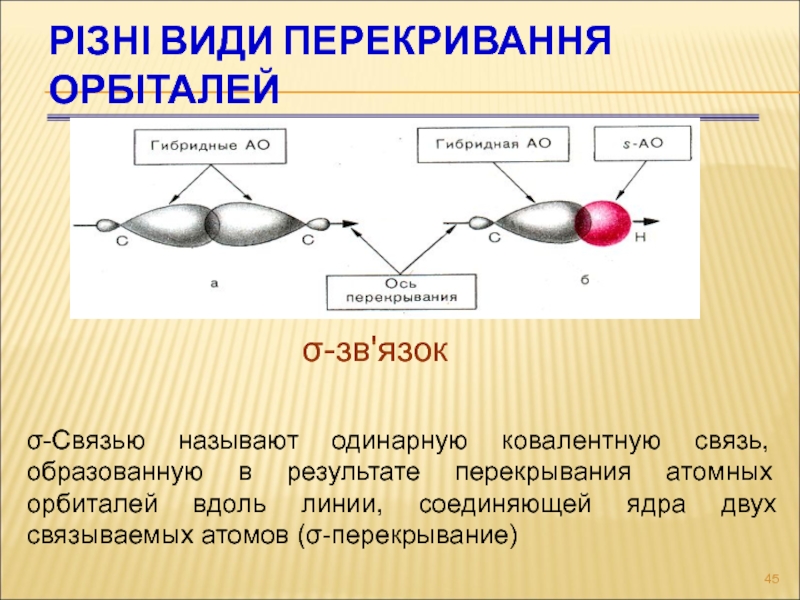
Слайд 45РІЗНІ ВИДИ ПЕРЕКРИВАННЯ ОРБІТАЛЕЙ
σ-зв'язок
σ-Связью называют одинарную ковалентную связь, образованную в
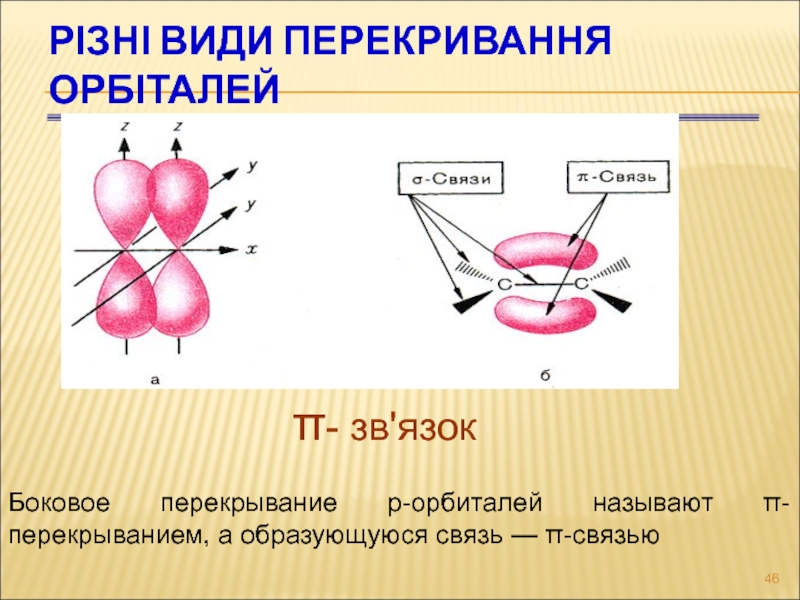
Слайд 46РІЗНІ ВИДИ ПЕРЕКРИВАННЯ ОРБІТАЛЕЙ
π- зв'язок
Боковое перекрывание р-орбиталей называют π-перекрыванием, а
Слайд 50ДОНОРНО-АКЦЕПТОРНИЙ МЕХАНІЗМ УТВОРЕННЯ КОВАЛЕНТНОГО ЗВ'ЯЗКУ
триметиламін
оксид триметиламіну
семіполярний
ковалентний зв'язок
Слайд 51ВЛАСТИВОСТІ КОВАЛЕНТНОГО ЗВ'ЯЗКУ
Ковалентний зв'язок характеризується такими параметрами: насиченістю, полярністю, поляризованістю, довжиною,
Слайд 52ПОЛЯРНІСТЬ
Полярностью связи называют неравномерное распределение электронной плотности связи, обусловленное различной электроотрицательностью
Электроотрицательность — это способность атома притягивать электроны.
Слайд 54НАПРАВЛЕНІСТЬ КОВАЛЕНТНОГО ЗВ'ЯЗКУ
sp3 – гібридизація тетраедрична будова
sp2 – гібридизація
sp – гібридизація лінійна будова
Слайд 55ТИПИ ХІМІЧНИХ ЗВ'ЯЗКІВ:
ВОДНЕВИЙ ЗВ'ЯЗОК
12,5—20 кДж/моль
Водородная связь образуется в результате электростатического
Активными называют атомы водорода, связанные в молекуле сильно полярной ковалентной связью,
Слайд 56Вчення про взаємний вплив атомів у молекулі
Бутлеров Олександр Михайлович
1828–1886
В органических соединениях
смещение электронной плотности по цепи σ-связей — индуктивный эффект;
смещение по системе π-связей — мезомерный эффект.
Слайд 57ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ
Індуктивний ефект
Зміщення електронної густини по
Слайд 58ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ
Індуктивний ефект
Електроноакцепторні замісники – це атом або
Електронодонорні замісники – це атом або група атомів, що зміщують електронну густину σ-звязку до атома Карбону, проявляють позитивний індуктивний ефект (+I-ефект).
Слайд 59ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ
Індуктивний ефект
1. Индуктивный эффект проявляется всегда при
с различной электроотрицательностью.
2. Индуктивный эффект распространяется только через σ-связи и всегда
в одном направлении.
3. Индуктивный эффект затухает в цепи через 3—4 σ-связи.
Слайд 60ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ
Індуктивний ефект
+I-Ефект проявляють аліфатичні вуглеводневі радикали,
Більшість функціональних груп проявляють -I-ефект: –Hal, –NH2, –OH, >С=O, –COOH.
пропен
Слайд 62ВЗАЄМНИЙ ВПЛИВ АТОМІВ В МОЛЕКУЛІ
Мезомерний ефект (ефект спряження)
Делокалізований зв'язок
Сопряженной
Сопряжение связей обусловливает образование единого делокализованного электронного облака.
Слайд 65Мезомерный эффект
Процесс передачи электронного влияния заместителя по сопряженной системе π-связей называют
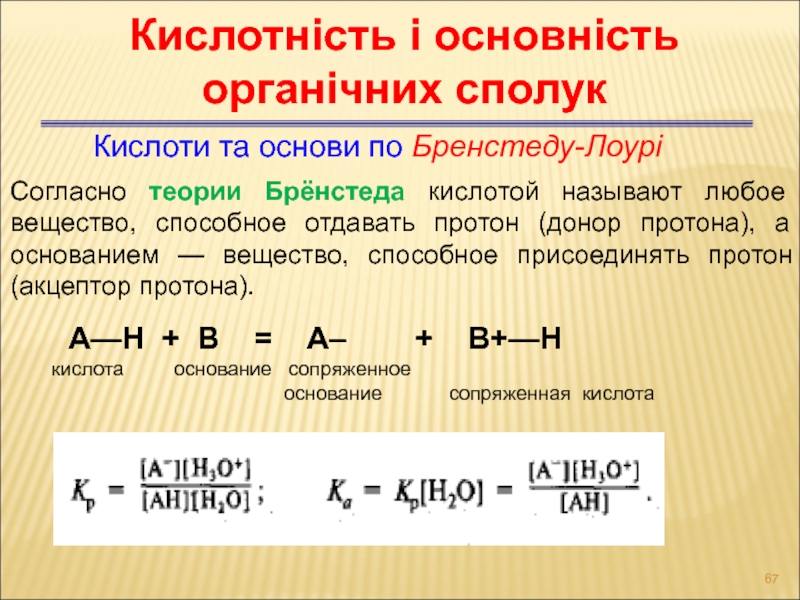
Слайд 67Кислоти та основи по Бренстеду-Лоурі
Кислотність і основність органічних сполук
Согласно теории Брёнстеда
А—Н + B = А– + В+—Н
кислота основание cопряженное
основание сопряженная кислота
Слайд 69Кислотність і основність органічних сполук
Залежність кислотних та основних властивостей від природи
Слайд 70Кислотність і основність органічних сполук
Сила кислотності:
-SH > -OH > -NH
Типы органических кислот
он - кислоты: карбоновые кислоты, спирты, фенолы, вода и др.
Sн -кислоты: тиолы, тиоловые кислоты и др.
Nн -кислоты: амины, амиды кислот, имиды и др.
сн -кислоты: соединения, содержащие сильно полярные С—Н-связи.
Слайд 71КИСЛОТНІСТЬ І ОСНОВНІСТЬ ОРГАНІЧНИХ СПОЛУК
По природе центра основности n-основания классифицируют
аммониевые: амины, азометины (R—CH——N—R), нитрилы (R—C———N), азотсодержащие гетероциклы;
оксониевые: спирты, простые эфиры, альдегиды, кетоны, сложные эфиры, амиды кислот и др.;
сульфониевые: тиоспирты (R—SH), тиоэфиры (R—S—R).
По природе центра основности n-основания классифицируют на следующие типы:
аммониевые: амины, азометины (R—CH——N—R), нитрилы (R—C———N), азотсодержащие гетероциклы;
оксониевые: спирты, простые эфиры, альдегиды, кетоны, сложные эфиры, амиды кислот и др.;
сульфониевые: тиоспирты (R—SH), тиоэфиры (R—S—R).
Слайд 72Кислотність і основність органічних сполук
Кислоти та основи Льюїса
основание —
Слайд 74Кислотність і основність органічних сполук
Легкость протекания кислотно-основной реакции определяется силой кислоты
Слайд 75Реакції нуклеофільного заміщення (SN)
Ізобутилйодид
Основна реакція:
Хлорацетамід
Основна реакція:
Загальна характеристика реакцій органічних
Слайд 76Феноксиацетатна кислота
Основна реакція:
Реакція нуклеофільного заміщення (SN)
2,4-Динітрофенілгідразин
Основна реакція:
Слайд 771,2-Дифенілетанол
Основні реакції:
Синтез з використанням магнійорганічних сполук.
Реакції електрофільного приєднання (АЕ)
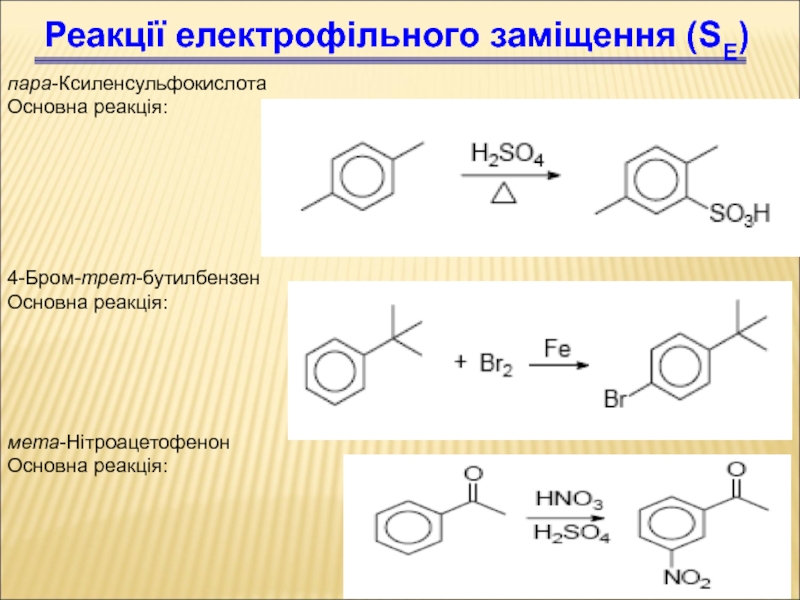
Слайд 79пара-Ксиленсульфокислота
Основна реакція:
Реакції електрофільного заміщення (SЕ)
4-Бром-трет-бутилбензен
Основна реакція:
мета-Нітроацетофенон
Основна реакція:
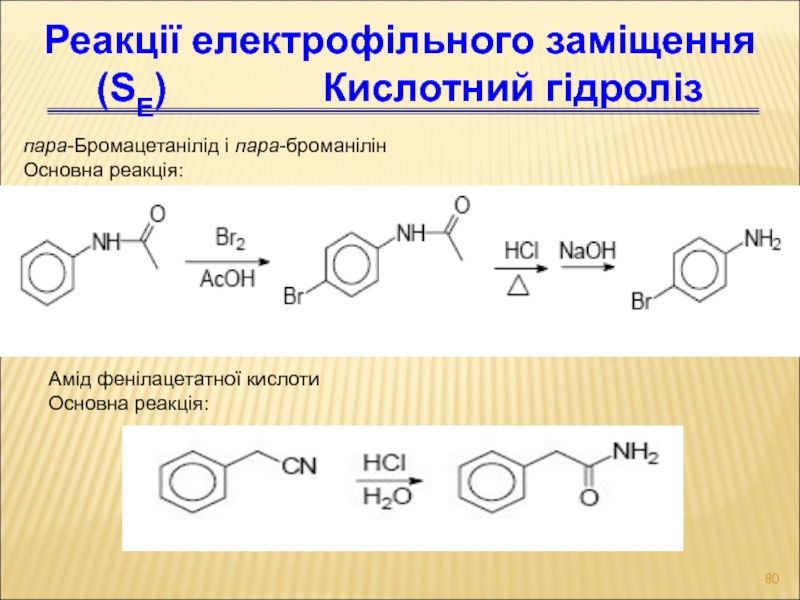
Слайд 80пара-Бромацетанілід і пара-броманілін
Основна реакція:
Реакції електрофільного заміщення (SЕ)
Амід фенілацетатної кислоти
Основна реакція: