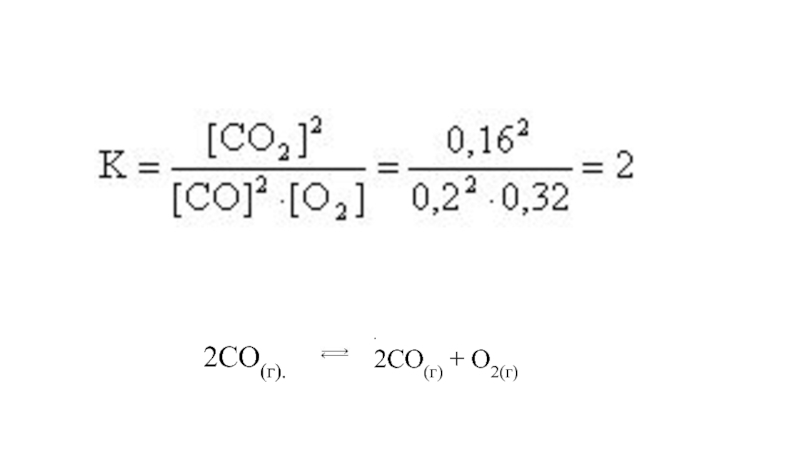- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химиялық формула презентация
Содержание
- 1. Химиялық формула
- 2. Химиялық формула –заттың құрамын
- 4. Зат массасының сақталу заңы - реакцияға қатысқан
- 5. Химиялық теңдеудің сол жағына әрекеттесуші заттардың формуласын,
- 6. Зат массасының сақталу заңының ашылуы
- 8. Теңдеу бойынша қандай мәліметтер алуға болады Сапалық
- 9. Коэффициенттер қою ережелері: 1. Коэффициенттерді
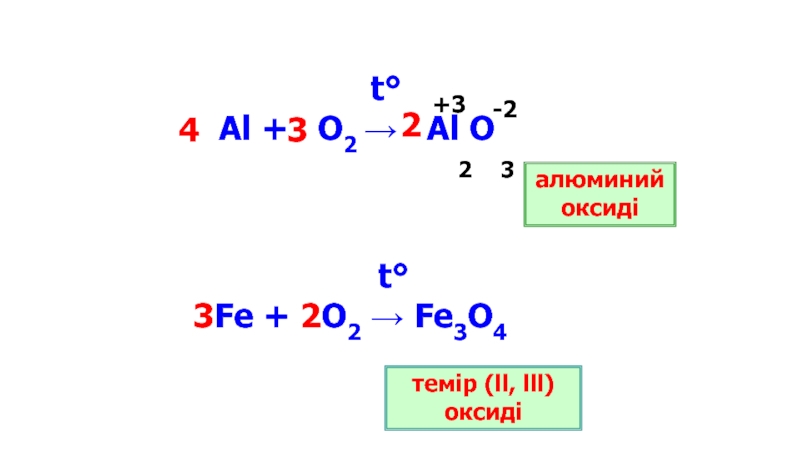
- 10. t° Al + O2 →
- 11. t° S +
- 12. Химиялық реакция теңдеуін құрастыру Үш кезеңді қамтиды:
- 13. Химиялық теңдеулер бойынша есептеулер (алгаритмі)
- 14. Химиялық реакциялар Қайтымсыз
- 15. Қайтымсыз реакциялар жану Кейбір
- 16. С моль/л t (сек)
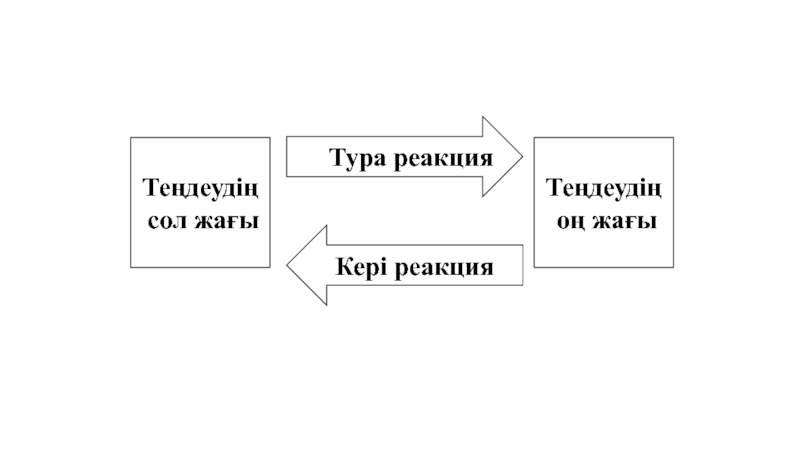
- 17. Тура реакция Кері реакция
- 18. Қайтымсыз реакциялар АgNO3 + NaCl →
- 19. Қайтымды реакциялар N2 + 3H2 ↔
- 20. N2 + 3H2 ↔ 2NH3 СО +
- 22. Кез-келген қайтымды реакция реакция үшін бастапқы сәтте
- 23. Химиялық тепе-теңдік Тура және кері реакциялардың
- 24. Ле -Шателье принципі химиялық тепе –теңдікте
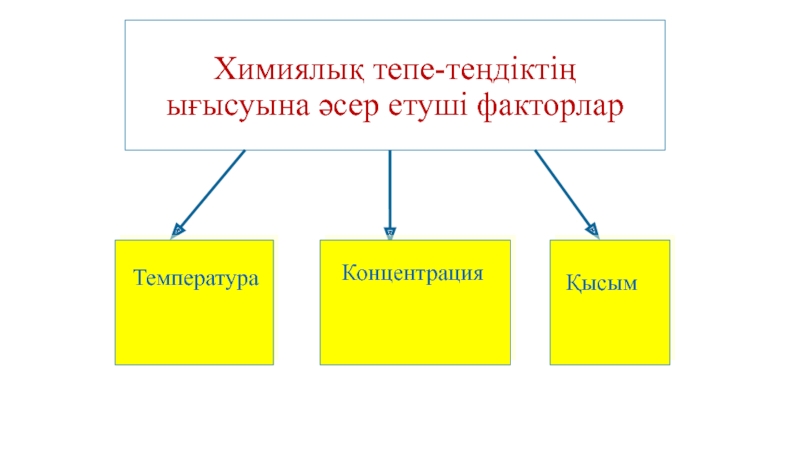
- 25. Химиялық тепе-теңдіктің ығысуына әсер етуші факторлар
- 29. Тура және кері реакцияның жылдамдық қатынастарының қатынасы
- 30. N2 + 3H2 ↔ 2NH3 Химиялық кинетиканың
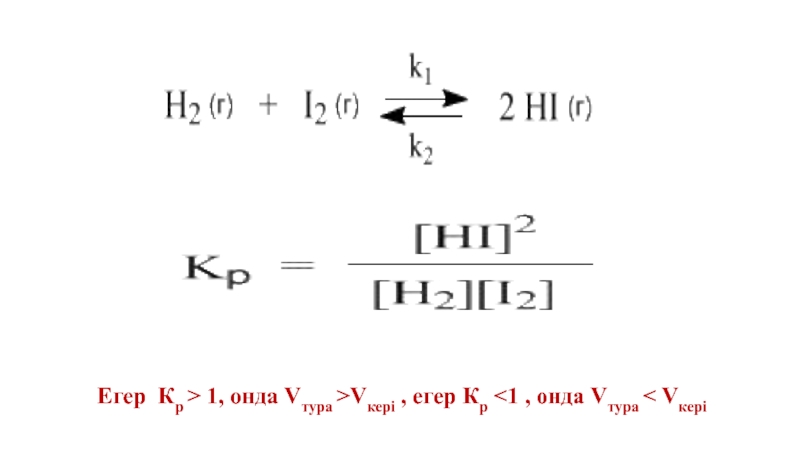
- 31. Егер Кр ˃ 1, онда Vтура ˃Vкері , егер Кр ˂1 , онда Vтура ˂ Vкері
- 32. Есеп 1. Белгілі бір температурада тепе-теңдік концентрациясы жүйеде
- 33. . 2CO(г) + O2(г) 2CO(г).
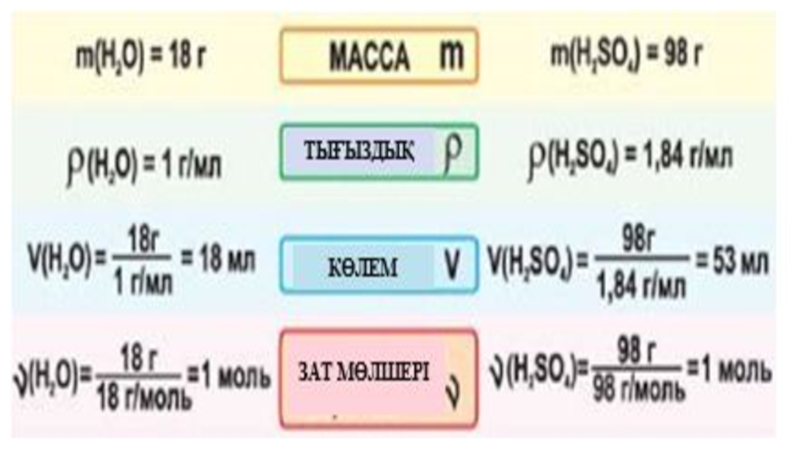
- 34. Зат мөлшері –
- 35. Моль дегеніміз не? Моль – берілген заттың
- 36. Заттың керекті мөлшерін қалай өлшеп алуға болады?
- 37. Молярлы
- 38. Авагадро саны Зат мөлшері мен бөлшек (атом,
- 39. Зат мөлшері ұғымын қолданып есептер шығару Зат мөлшері
- 40. Бер: m(CO2) = 88 г
- 41. Бер: n(N2) = 10 моль
- 42. Бер: m (S) = 6,2 г
- 43. Газдың молярлық көлемі:
- 44. Авогадро заңының салдары: Әртүрлі газдардың бірдей молекулалар
Слайд 2 Химиялық формула –заттың құрамын химиялық элемент таңбалары және
Индекс - затттың құрамындағы элементтердің атом санын көрсетеді.
Коэффициент - бір-бірімен бойланыспаған бөлшектер санын көрсетеді.
5Н2SO4
Коэффициент
Химиялық формула
Индекс
Осы заңның негізінде химиялық формулалар, коэффициенттері мен математикалық символдарды пайдаланып химиялық реакциялар теңестіріледі.
Слайд 4Зат массасының сақталу заңы - реакцияға қатысқан заттардың массасы реакция нәтижесінде
Химиялық теңдеулер – химиялық реакциялардың теңдеулері деп химиялық таңбалар мен формулаларды қолданып заттардың өзара әрекеттесуін шартты түрде жазуды айтамыз.
Слайд 5Химиялық теңдеудің сол жағына әрекеттесуші заттардың формуласын, ал оң жағына жаңадан
Слайд 6Зат массасының сақталу заңының ашылуы
1789г.
Роберт Бойль
1673г.
1756г.
М. В. Ломоносов
Антуан Лавуазье
Слайд 8Теңдеу бойынша қандай мәліметтер алуға болады
Сапалық және сандық кұрамы туралы мәлімет
Реакцияға катысқан жөне оның нәтижесінде түзілген зат мөлшерлерінің қатынасын табуға болады
Осы заттардын массаларының катынастарын табуға болады.
Химиялық реакцияның түрі
Реакцияның жүру жағдайы
Слайд 9Коэффициенттер қою ережелері: 1. Коэффициенттерді орналастырып қою үшін құрамы жағынан ең
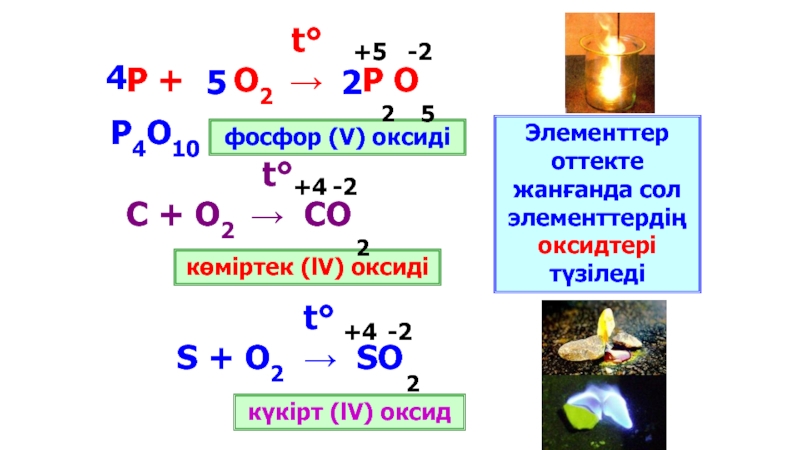
Слайд 11
t°
S + O2 → SO
t°
С + О2 → СО
Элементтер оттекте жанғанда сол элементтердің оксидтері түзіледі
фосфор (V) оксиді
көміртек (lV) оксиді
күкірт (lV) оксид
-2
-2
-2
+4
+4
+5
2
2
2
5
4
5
2
P4O10
Слайд 12Химиялық реакция теңдеуін құрастыру
Үш кезеңді қамтиды:
Бастапқыда реакцияға қатысқан(сол жақ) және реакция
Р + O2? Р2O5
2. Химиялық реакция теңдеуіндегі сол және оң бөлігіндегі атомдар саны тең болу үшін коэффициенттерді қоямыз:
4Р + 5O2?2 Р2O5
3. Химиялық реакция теңдеуіндегі сол және оң бөлігіндегі атомдар санын тексеру:
4 Р + 10 O = 4 Р және 10 O
Слайд 13Химиялық теңдеулер бойынша есептеулер (алгаритмі)
Химиялық теңдеулер бойынша
Мысал 1
Массасы 100г кальций карбонатын қыздырған кезде 56г кальций оксиді түзілді. Бөлінген көмірқышқыл газының массасын есептеңіз.
Шығару жолы: СаСО3=СаО + СО2
Егер реакция нәтижесінде 56 г кальций оксиді түзілсе, онда түзілген газдың массасы мынаған тең:
100г -56г = 44г.
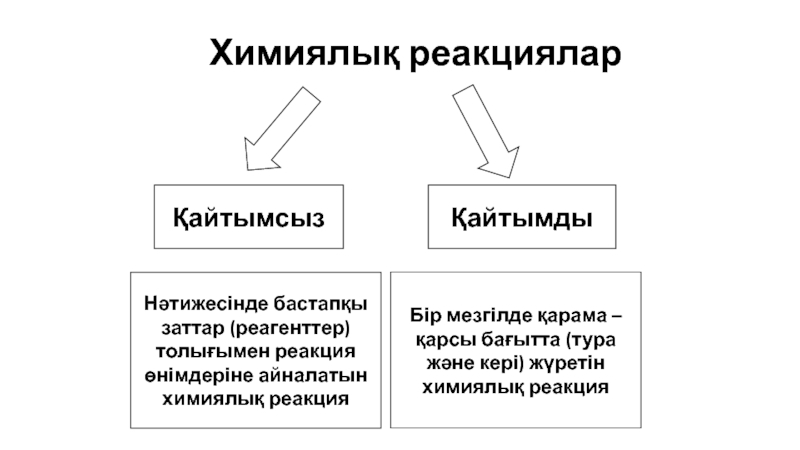
Слайд 14Химиялық реакциялар
Қайтымсыз
Қайтымды
Нәтижесінде бастапқы заттар (реагенттер) толығымен реакция өнімдеріне
Бір мезгілде қарама – қарсы бағытта (тура және кері) жүретін химиялық реакция
Слайд 15Қайтымсыз реакциялар
жану
Кейбір қосылыстардың ыдырауы
1. Тұнбаның түсуі
2. Газ бөліну
3. Өте аз диссоцияланатын
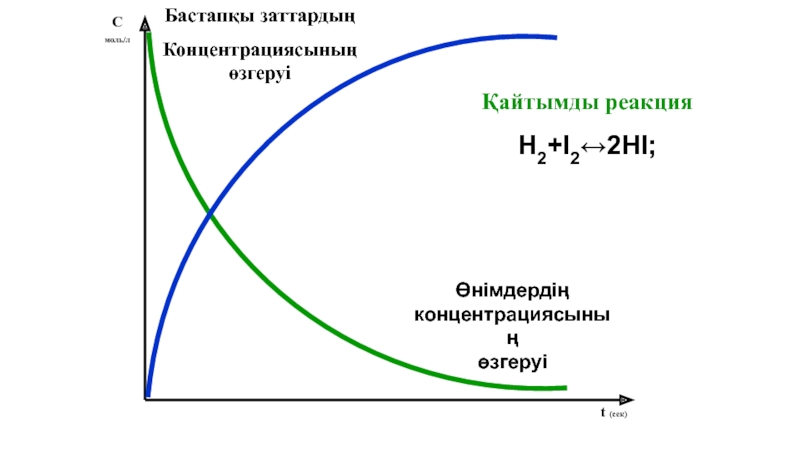
Слайд 16
С
моль/л
t (сек)
Қайтымды реакция
H2+І2↔2HІ;
Бастапқы заттардың
Концентрациясының өзгеруі
Өнімдердің концентрациясының
өзгеруі
Слайд 18Қайтымсыз реакциялар
АgNO3 + NaCl → AgCl↓+NaNO3
2LiOH + H2SO4 →
K2CO3 + 2HCl → 2KCl + CO2↑+ H2O
Слайд 19Қайтымды реакциялар
N2 + 3H2 ↔ 2NH3
N2 + O2 ↔
FeCl3 + 3KCNS ↔ Fe(CNS)3+ 3KCl
сары түссіз қызыл түссіз
Слайд 20N2 + 3H2 ↔ 2NH3
СО + 2Н2 ↔ СН3ОН
Al2O3 + 6HCl
3NaOH + H3РО4 = Na3РО4 + 3H2O
N2 + O2 ↔ 2NO
Na2SO4 + BaCl2 = BaSО4↓ + 2NaCl
2SO2 + O2 ↔ 2SO3
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
H2 + S ↔ H2S
NaCl + AgNO3 = NaNО3 + AgCl↓
С + СО2 ↔ 2СО
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
Слайд 22Кез-келген қайтымды реакция реакция үшін бастапқы сәтте әрекеттесуші массалар заңына сәйкес
Слайд 23Химиялық тепе-теңдік
Тура және кері реакциялардың жылдамдықтары тең болғандағы жүйенің күйін химиялық
Слайд 24Ле -Шателье принципі
химиялық тепе –теңдікте тұрған жүйе күйіне сыртқы факторлардың
Анри Луи Ле Шателье (1850–1936)
Слайд 29Тура және кері реакцияның жылдамдық қатынастарының қатынасы да тұрақты болады және
aA+bB=cC+dD,
K=k1/k2.
K = [C]c[D]d/[A]a[B]b
Слайд 30N2 + 3H2 ↔ 2NH3
Химиялық кинетиканың заңы бойынша тура және кері
U1 = K1*[N2][H3]3
U2 = K2*[ NH3]2
Химиялық тепе-теңдік кезінде тура және кері реакциялардың жылдамдықтары өзара тең болғандықтан теңдеуді былай жазуға болады:
K1*[N2][H3]3 = K2*[ NH3]2 немесе K1/ K2 = - [ NH3]2/[N2][H3]3
Слайд 32Есеп 1. Белгілі бір температурада тепе-теңдік концентрациясы жүйеде 2CO (г) + O2 (г)
Слайд 34
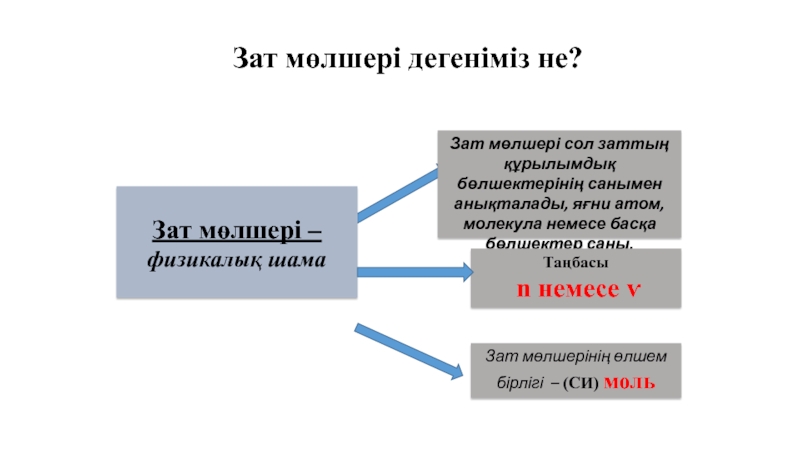
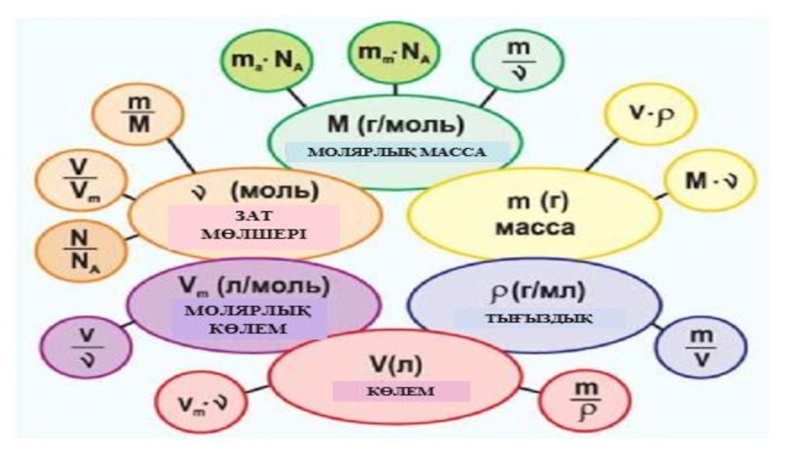
Зат мөлшері –
физикалық шама
Зат мөлшері сол заттың құрылымдық бөлшектерінің санымен
Таңбасы
n немесе ѵ
Зат мөлшерінің өлшем бірлігі – (СИ) моль
Зат мөлшері дегеніміз не?
Слайд 35Моль дегеніміз не?
Моль – берілген заттың құрылымдық бөлшектері 12г көміртегіндегі атом
Слайд 36Заттың керекті мөлшерін қалай өлшеп алуға болады?
Зат мөлшерін моль арқылы өрнектеген
М=m / ν
Мысалы: 1) M(H2)= 2 г/моль;
2) M(O2) =32 г/моль; 3) M(H2O) =18 г/моль
Слайд 37
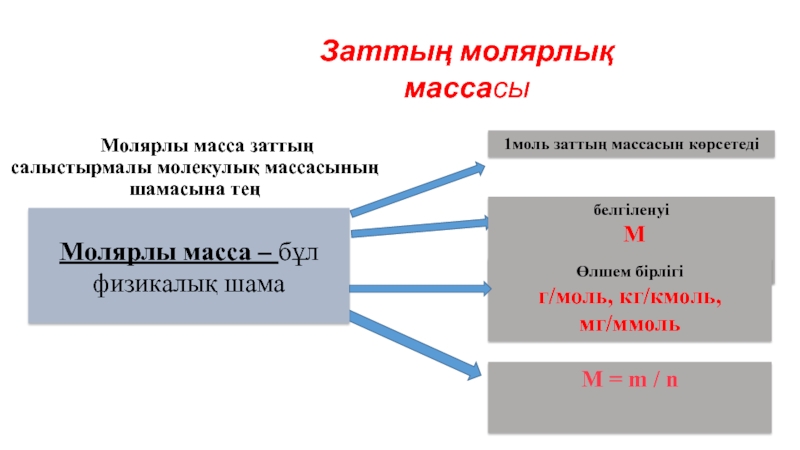
Молярлы масса заттың салыстырмалы молекулық массасының шамасына тең
Молярлы
1моль заттың массасын көрсетеді
белгіленуі
М
Өлшем бірлігі
г/моль, кг/кмоль, мг/ммоль
М = m / n
Заттың молярлық массасы
Слайд 38Авагадро саны
Зат мөлшері мен бөлшек (атом, молекула т.б) сандары арасында байланыс,
ѵ = N / NA
Формуласы арқылы өрнекеледі. Мұндағы N – бөлшек саны, NA – Авагадро тұрақтысы,
NА = 6,02∙1023 молекула, атом, құрылымдық бөлшек
Мысалы: 2,5 моль зат SO2 6,02∙1023 молекула құрайды, 15,05*1023 атом құрайды (өйткені 1 атом S және 2 атом O2 бар)
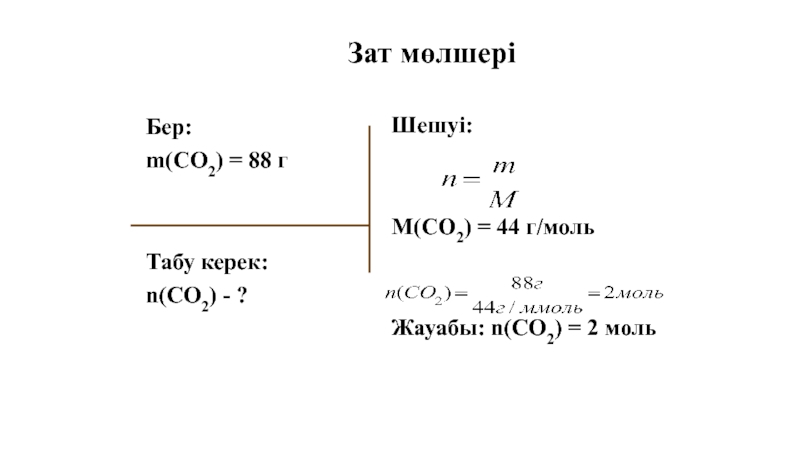
Слайд 40Бер:
m(CO2) = 88 г
Табу керек:
n(CO2) - ?
Шешуі:
M(CO2) = 44 г/моль
Жауабы: n(CO2) = 2 моль
Зат мөлшері
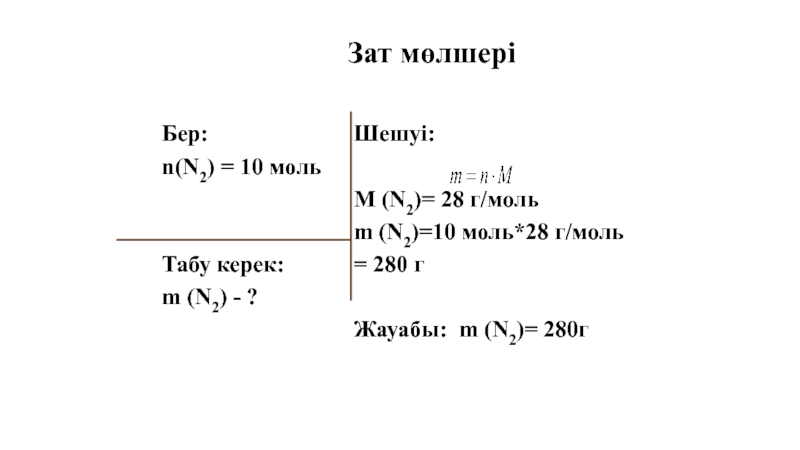
Слайд 41Бер:
n(N2) = 10 моль
Табу керек:
m (N2) - ?
Шешуі:
M (N2)= 28 г/моль
m
= 280 г
Жауабы: m (N2)= 280г
Зат мөлшері
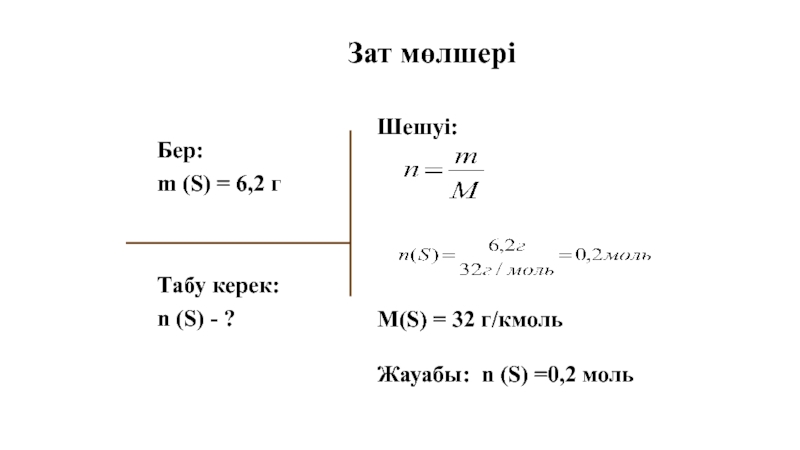
Слайд 42Бер:
m (S) = 6,2 г
Табу керек:
n (S) - ?
Шешуі:
M(S) = 32
Жауабы: n (S) =0,2 моль
Зат мөлшері
Слайд 43
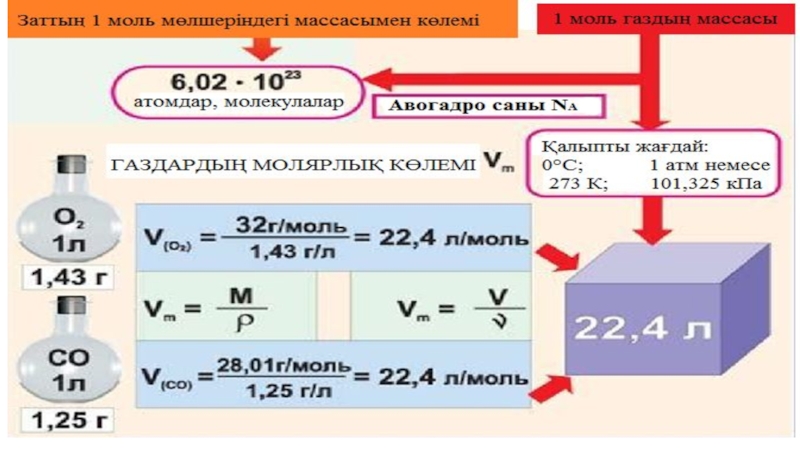
Газдың молярлық көлемі:
Газдың мольдік көлемі – берілген газ көлемінің оның
Слайд 44Авогадро заңының салдары: Әртүрлі газдардың бірдей молекулалар саны бірдей қысымда және температурада
Қалыпты жағдайда кез келген газдың мольдік көлемі:























![Есеп 1. Белгілі бір температурада тепе-теңдік концентрациясы жүйеде 2CO (г) + O2 (г) 2CO2(г)былай өзгерді: [CO] =](/img/tmb/4/390688/3f1990e0fdf573ca41ccb090831c1226-800x.jpg)