- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соединения галогенов презентация
Содержание
- 1. Соединения галогенов
- 2. Повторяем Вставьте пропущенные слова в предложения:
- 3. Задание Закончите уравнения возможных реакций: H2
- 4. Галогеноводороды Общая формула – НГ Физические свойства:
- 5. Видео-опыт «Растворение хлороводорода в воде» http://www.youtube.com/watch?v=_pPDa-1bKBY !
- 6. Галогеноводородные кислоты Водным растворам галогеноводородов присущи все
- 7. Соляная кислота Получение: В промышленности: H2
- 8. Видео-опыт «Получение соляной кислоты» http://cor.edu.27.ru/dlrstore/95f1a5f7-5a77-c952-4865-b3b0618b7571/index.htm 10.01.2018
- 9. Свойства соляной кислоты Физические свойства: бесцветная жидкость;
- 10. Соли галогеноводородных кислот 10.01.2018
- 11. Качественные реакции на хлорид-, бромид- и
- 12. Видео-опыт: http://cor.edu.27.ru/dlrstore/cabb0eeb-0751-b19b-e602-5c9acbec92b2/index.htm Реакция с нитратом серебра – качественная реакция на хлорид-, бромид- и иодид-ионы. 10.01.2018
- 13. Качественная реакция на фторид-ион Для доказательства наличия
- 14. Галогены в природе Галогены в природе существуют
- 15. Домашнее задание: §23 Упр. 3,4 на с.173 учебника. 10.01.2018
- 16. Оцени свое настроение после нашего урока 1 2 3 10.01.2018
- 17. 10.01.2018 Спасибо за внимание!
- 18. Источники: О.С. Габриелян. Химия. 9 класс –
Слайд 2Повторяем
Вставьте пропущенные слова в предложения:
Галогены – это элементы … группы,
В атомах галогенов на внешнем энергетическом уровне … электронов.
Отличаются атомы галогенов числом … …
Вступая в химические реакции, галогены … электрон на внешний энергетический уровень и, следовательно, являются …
Галогены взаимодействуют с …
10.01.2018
Слайд 3Задание
Закончите уравнения возможных реакций:
H2 + Br2 →
Al + Cl2
KCl + I2 →
NaI + Cl2 →
Назовите продукты реакций.
К каким классам соединений они относятся?
10.01.2018
Слайд 4Галогеноводороды
Общая формула – НГ
Физические свойства:
Газы, Ц , резкий запах.
Хорошо
Например, в 1 объеме воды при 0°С растворяется до 507 объемов хлороводорода и 612 объемов бромоводорода.
Дымят на воздухе.
Токсичны.
10.01.2018
Слайд 5Видео-опыт «Растворение хлороводорода в воде»
http://www.youtube.com/watch?v=_pPDa-1bKBY
! При растворении хлороводорода в воде образуется
10.01.2018
Слайд 6Галогеноводородные кислоты
Водным растворам галогеноводородов присущи все свойства кислот.
HF – HCl
Сила кислот возрастает
что объясняется
уменьшением в этом же направлении энергии связи;
увеличением межъядерного расстояния.
10.01.2018
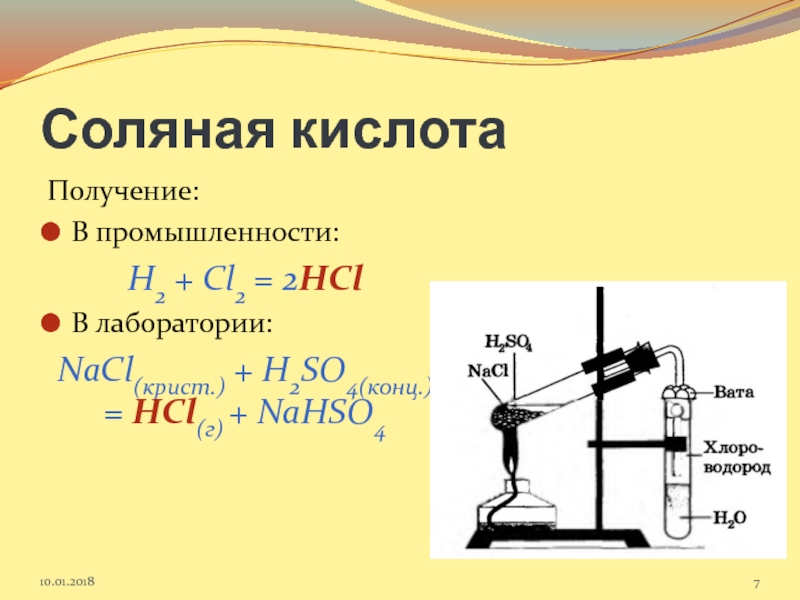
Слайд 7Соляная кислота
Получение:
В промышленности:
H2 + Cl2 = 2HCl
В лаборатории:
NaCl(крист.) + H2SO4(конц.)
10.01.2018
Слайд 8Видео-опыт «Получение соляной кислоты»
http://cor.edu.27.ru/dlrstore/95f1a5f7-5a77-c952-4865-b3b0618b7571/index.htm
10.01.2018
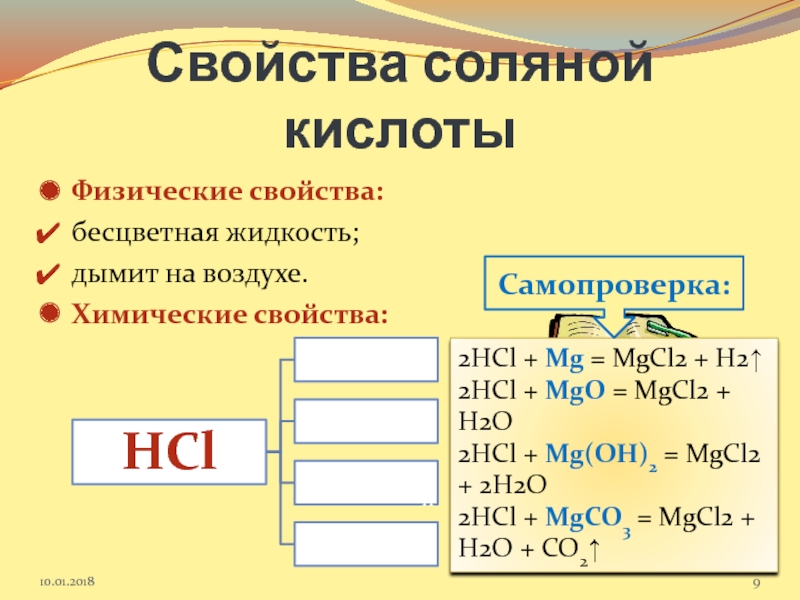
Слайд 9Свойства соляной кислоты
Физические свойства:
бесцветная жидкость;
дымит на воздухе.
Химические свойства:
Задание: составьте соответствующие уравнения
2HCl + Mg = MgCl2 + H2↑
2HCl + MgO = MgCl2 + H2O
2HCl + Mg(OH)2 = MgCl2 + 2H2O
2HCl + MgCO3 = MgCl2 + H2O + CO2↑
Самопроверка:
10.01.2018
Слайд 11Качественные реакции
на хлорид-, бромид- и иодид-ионы
Галогенид-ионы можно определить с помощью
Осадок хлорида серебра - белого цвета
NaCl + AgNO3 = AgCl↓ + NaNO3
Осадок бромида серебра -бледно-желтого цвета
NaBr + AgNO3 = AgBr↓+ NaNO3
Осадок иодида серебра - желтого цвета.
KI + AgNO3 = AgI↓+ KNO3
10.01.2018
Слайд 12Видео-опыт:
http://cor.edu.27.ru/dlrstore/cabb0eeb-0751-b19b-e602-5c9acbec92b2/index.htm
Реакция с нитратом серебра – качественная реакция на хлорид-, бромид- и
10.01.2018
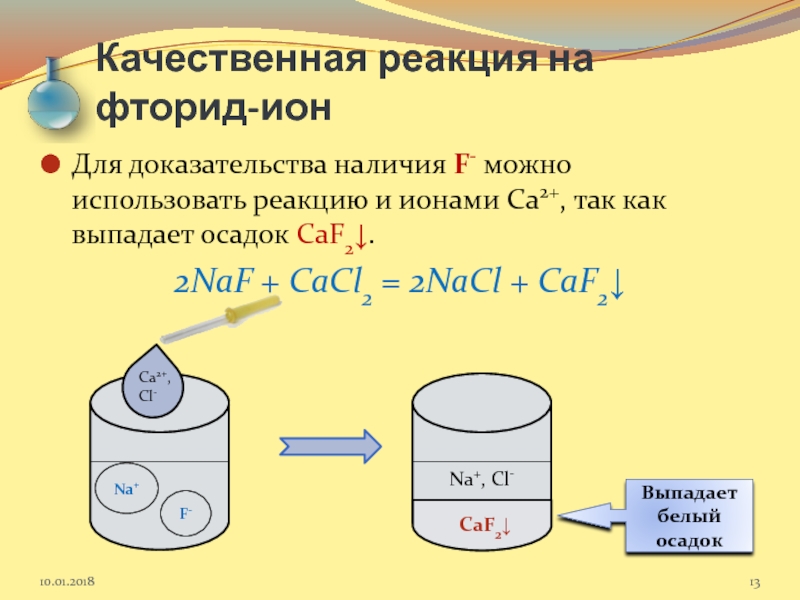
Слайд 13Качественная реакция на фторид-ион
Для доказательства наличия F- можно использовать реакцию и
2NaF + CaCl2 = 2NaCl + CaF2↓
Na+
F-
Ca2+, Cl-
CaF2↓
Na+, Cl-
Выпадает белый осадок
10.01.2018
Слайд 14Галогены в природе
Галогены в природе существуют только в связанном состоянии.
Задание:
Из текста
Соединения хлора: …
Соединения фтора: …
Бром и иод в природе: …
10.01.2018
Слайд 18Источники:
О.С. Габриелян. Химия. 9 класс – 16-е изд. – М.: Дрофа,
Фото и картинки: интернет-ресурсы.
Видео-опыты:
http://chemistry-olga.blogspot.ru/2013_09_01_archive.html
http://cor.edu.27.ru/dlrstore/95f1a5f7-5a77-c952-4865-b3b0618b7571/index.htm
10.01.2018