- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Формирование химического состава подземных вод презентация
Содержание
- 1. Формирование химического состава подземных вод
- 2. Cтроение молекулы воды а- диполь воды b – водородная связь обусловливают уникальные свойства воды
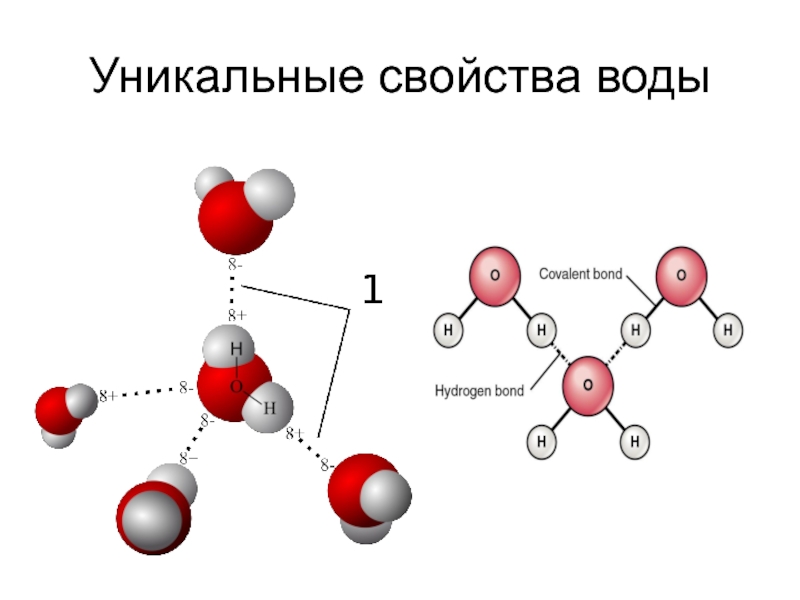
- 3. Уникальные свойства воды
- 4. Водородная связь Две поделенные электронные пары участвуют
- 5. Водородная связь Энергия водородной связи Н---О воды
- 6. Возникновение водородных связей Для возникновения водородных связей
- 7. Факторы формирования Факторы формирования - это естественные
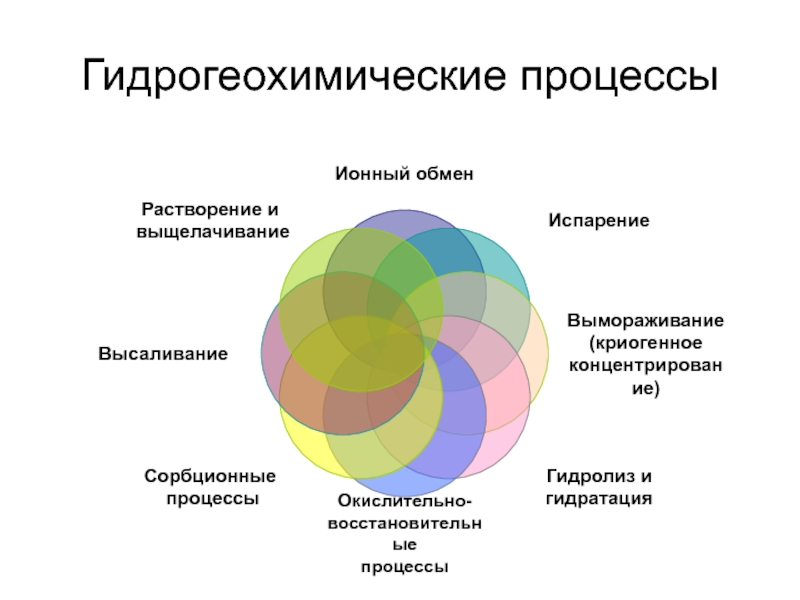
- 8. Гидрогеохимические процессы
- 9. Окислительно-восстановительные процессы ОКИСЛЕНИЕ – переход элементов с
- 10. Гидратация ГИДРАТАЦИЯ – химическое присоединение воды к
- 11. Гидролиз ГИДРОЛИЗ алюмосиликатов – обменное разложение вещества
- 12. О б о б щ е
- 13. Гидрогеохимические процессы
- 14. Гидробиохимические процессы Сульфофикация (аэробные условия) Сульфатредукция (анаэробные условия)
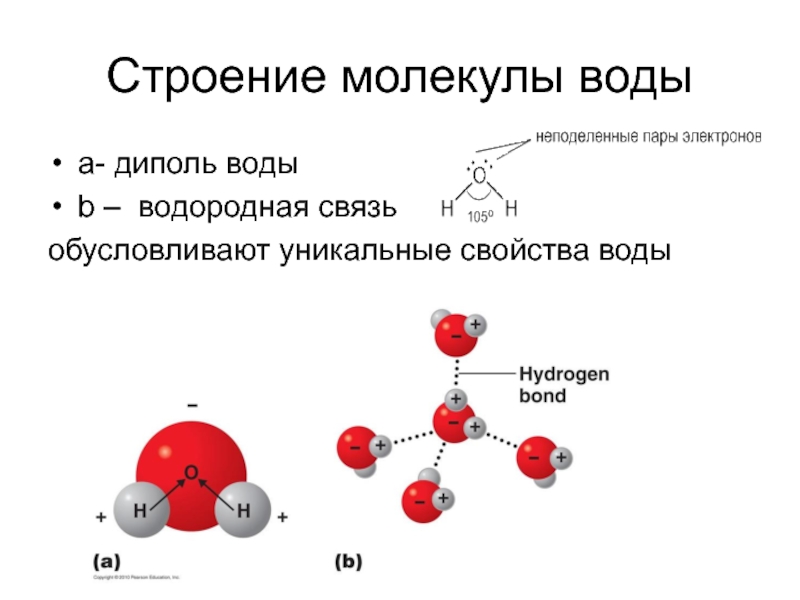
Слайд 2Cтроение молекулы воды
а- диполь воды
b – водородная связь
обусловливают уникальные свойства
воды
Слайд 4Водородная связь
Две поделенные электронные пары участвуют в образовании двух полярных ковалентных
связей, а оставшиеся две неподеленные пары электронов тоже играют важную роль в свойствах воды.
Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга. Это приводит к тому, что молекула приобретает форму искаженного тетраэдра с атомом кислорода в центре.
В четырех вершинах этого "тетраэдра" находятся два атома водорода и две неподеленные пары электронов.
Но если смотреть только по центрам атомов, то получается, что молекула воды имеет угловое строение, причем угол Н–О–Н составляет примерно 105 градусов.
Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга. Это приводит к тому, что молекула приобретает форму искаженного тетраэдра с атомом кислорода в центре.
В четырех вершинах этого "тетраэдра" находятся два атома водорода и две неподеленные пары электронов.
Но если смотреть только по центрам атомов, то получается, что молекула воды имеет угловое строение, причем угол Н–О–Н составляет примерно 105 градусов.
Слайд 5Водородная связь
Энергия водородной связи Н---О воды (H2O)2 составляет 21,5 кДж/моль, а
ее длина 2,04 А. Таким образом, эти связи более длинные и примерно в 10-20 раз менее прочные, чем обычные ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
В жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты – все крупнее. Наконец, образуется лед.
В кристалле льда между молекулами остаются пустоты. Объем пустот чуть больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности. Большинство же других веществ при замерзании увеличивает свою плотность.
В жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты – все крупнее. Наконец, образуется лед.
В кристалле льда между молекулами остаются пустоты. Объем пустот чуть больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности. Большинство же других веществ при замерзании увеличивает свою плотность.
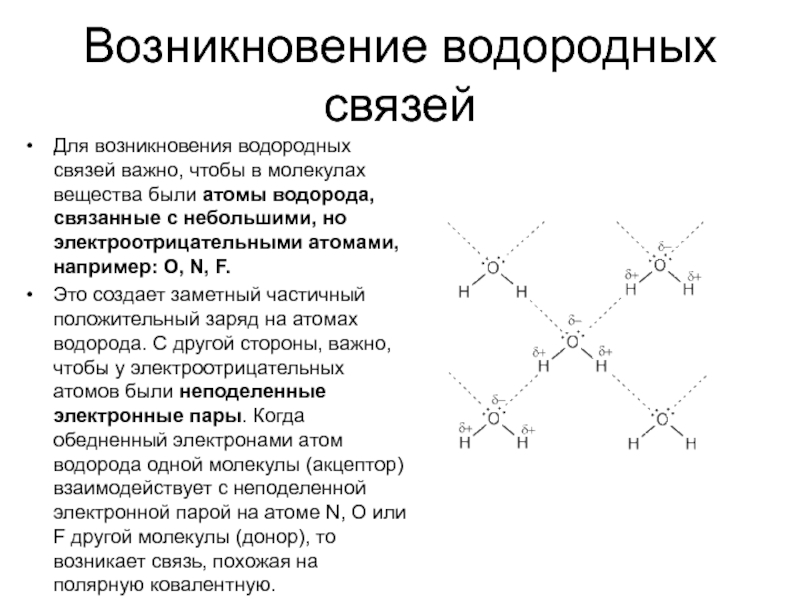
Слайд 6Возникновение водородных связей
Для возникновения водородных связей важно, чтобы в молекулах вещества
были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F.
Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.
Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.
Слайд 7Факторы формирования
Факторы формирования - это естественные или искусственные причины, определяющие возникновение
и протекание гидрогеохимических процессов в земной коре.
Физико-химические факторы:
свойства воды и водных растворов, химических элементов и их соединений;
Физические:
температура, давление, гравитация, радиоактивность;
Физико-географичекие:
климат (осадки и испарение, температура), рельеф, поверхностные воды, почвенно-растительный покров;
Геолого-гидрогеологические:
тектоника, магматизм и метаморфизм, состав пород, фильтрационные свойства пород;
Микробиологические: микрофлора и микрофауна;
Антропогенные (техногенные):
промышленные и с/х предприятия, коммунально-бытовые отходы и др.
Физико-химические факторы:
свойства воды и водных растворов, химических элементов и их соединений;
Физические:
температура, давление, гравитация, радиоактивность;
Физико-географичекие:
климат (осадки и испарение, температура), рельеф, поверхностные воды, почвенно-растительный покров;
Геолого-гидрогеологические:
тектоника, магматизм и метаморфизм, состав пород, фильтрационные свойства пород;
Микробиологические: микрофлора и микрофауна;
Антропогенные (техногенные):
промышленные и с/х предприятия, коммунально-бытовые отходы и др.
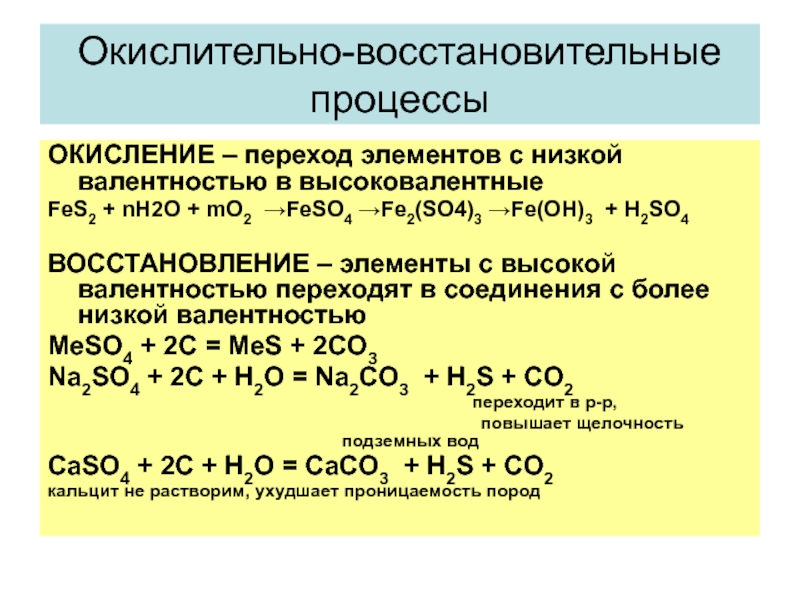
Слайд 9Окислительно-восстановительные процессы
ОКИСЛЕНИЕ – переход элементов с низкой валентностью в высоковалентные
FeS2 +
nH2O + mO2 →FeSO4 →Fe2(SO4)3 →Fe(OH)3 + H2SO4
ВОССТАНОВЛЕНИЕ – элементы с высокой валентностью переходят в соединения с более низкой валентностью
MeSO4 + 2C = MeS + 2CO3
Na2SO4 + 2C + H2O = Na2CO3 + H2S + CO2
переходит в р-р,
повышает щелочность подземных вод
CaSO4 + 2C + H2O = CaCO3 + H2S + CO2
кальцит не растворим, ухудшает проницаемость пород
ВОССТАНОВЛЕНИЕ – элементы с высокой валентностью переходят в соединения с более низкой валентностью
MeSO4 + 2C = MeS + 2CO3
Na2SO4 + 2C + H2O = Na2CO3 + H2S + CO2
переходит в р-р,
повышает щелочность подземных вод
CaSO4 + 2C + H2O = CaCO3 + H2S + CO2
кальцит не растворим, ухудшает проницаемость пород
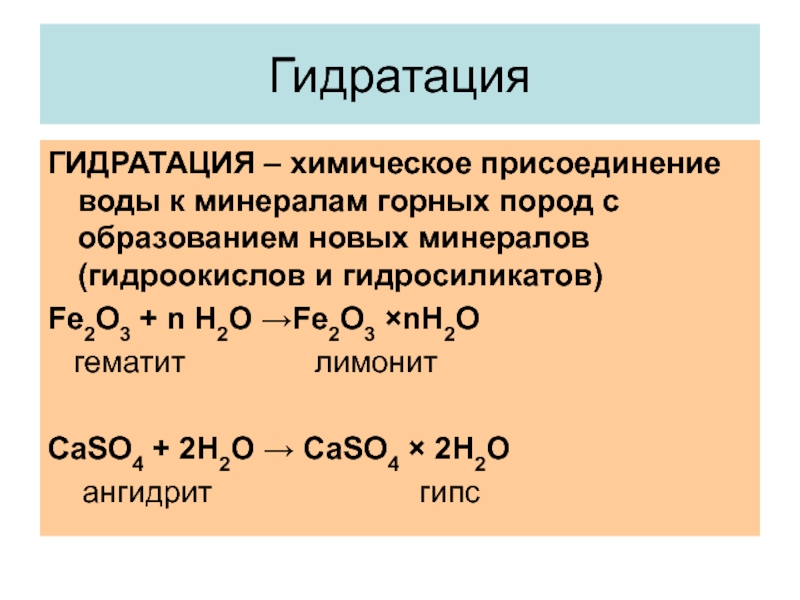
Слайд 10Гидратация
ГИДРАТАЦИЯ – химическое присоединение воды к минералам горных пород с образованием
новых минералов (гидроокислов и гидросиликатов)
Fe2O3 + n H2O →Fe2O3 ×nH2O
гематит лимонит
CаSO4 + 2H2O → CaSO4 × 2H2O
ангидрит гипс
Fe2O3 + n H2O →Fe2O3 ×nH2O
гематит лимонит
CаSO4 + 2H2O → CaSO4 × 2H2O
ангидрит гипс
Слайд 11Гидролиз
ГИДРОЛИЗ алюмосиликатов – обменное разложение вещества под влиянием гидролитической диссоциации воды,
сопровождающееся разрушением одних и образованием других минералов
K[AlSi3O8] + n H2O + CO2 →K2CO3 + Al4 [Si4O10](OH)8 +
в р-р каолинит
SiO2×nH2O
опал
Дальнейший гидролиз каолинита приводит к его полному разложению и образованию латерита
Al4 [Si4O10](OH)8 → H2Al2O4 + SiO2 + nH2O
каолинит латерит
K[AlSi3O8] + n H2O + CO2 →K2CO3 + Al4 [Si4O10](OH)8 +
в р-р каолинит
SiO2×nH2O
опал
Дальнейший гидролиз каолинита приводит к его полному разложению и образованию латерита
Al4 [Si4O10](OH)8 → H2Al2O4 + SiO2 + nH2O
каолинит латерит
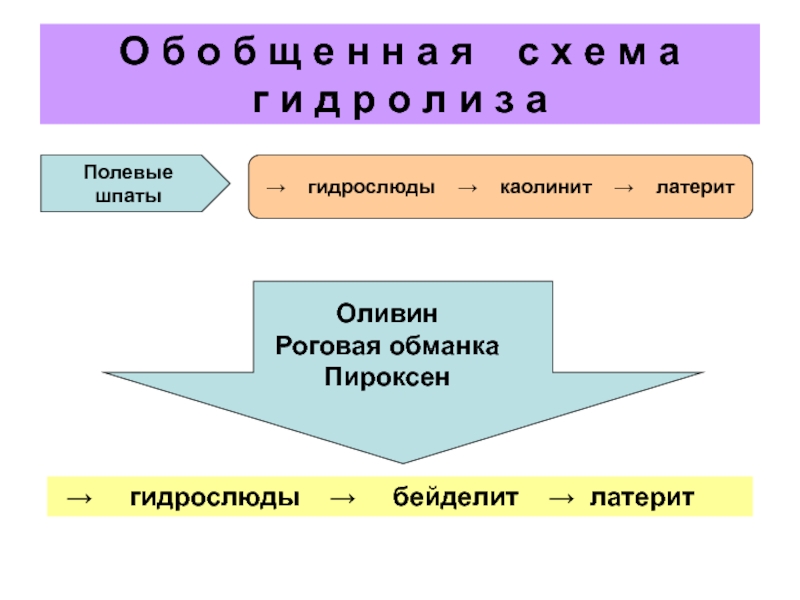
Слайд 12
О б о б щ е н н а я
с х е м а
г и д р о л и з а
Оливин
Роговая обманка
Пироксен
→ гидрослюды → бейделит → латерит
Полевые шпаты
→ гидрослюды → каолинит → латерит