- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Амфотерность презентация
Содержание
- 1. Амфотерность
- 2. СПЛАВЫ (без воды) 2KOH(тв.) + H2ZnO2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O Be(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→
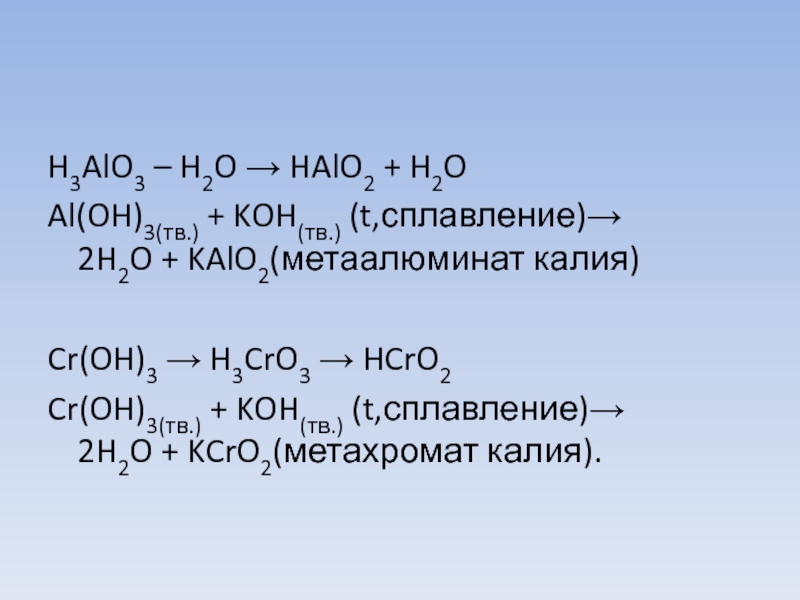
- 3. H3AlO3 – H2O → HAlO2 + H2O Al(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2H2O + KAlO2(метаалюминат калия) Cr(OH)3 → H3CrO3 → HCrO2 Cr(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2H2O + KCrO2(метахромат калия).
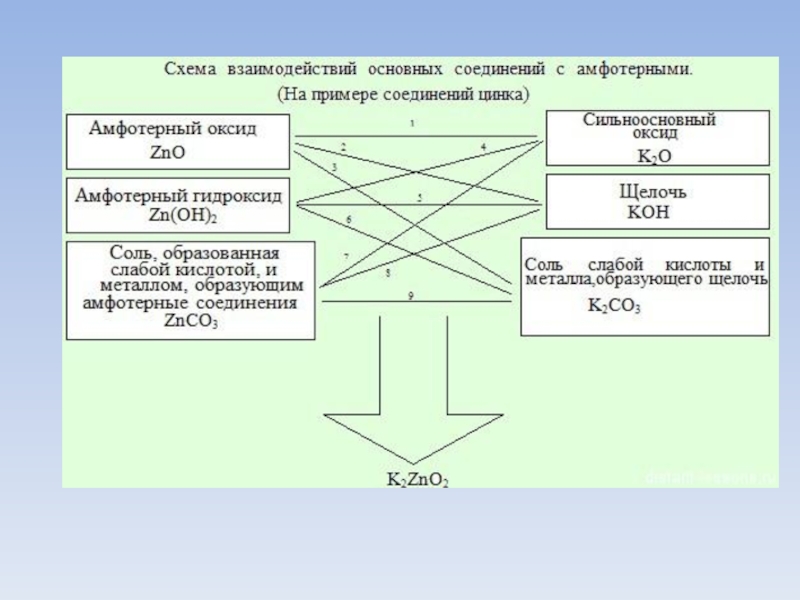
- 6. СПЛАВЛЕНИЕ!!! 1. Амфотерного оксида с сильноосновным оксидом:
- 7. РАСТВОРЫ!! Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
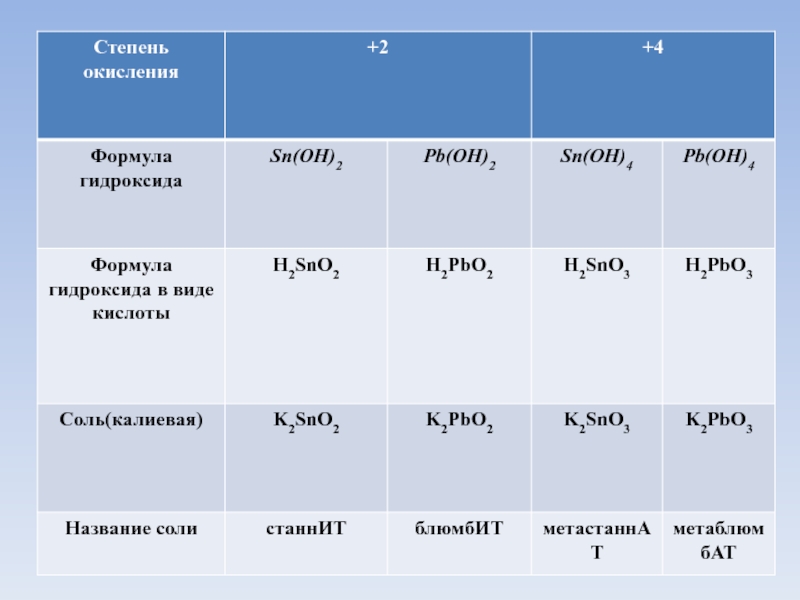
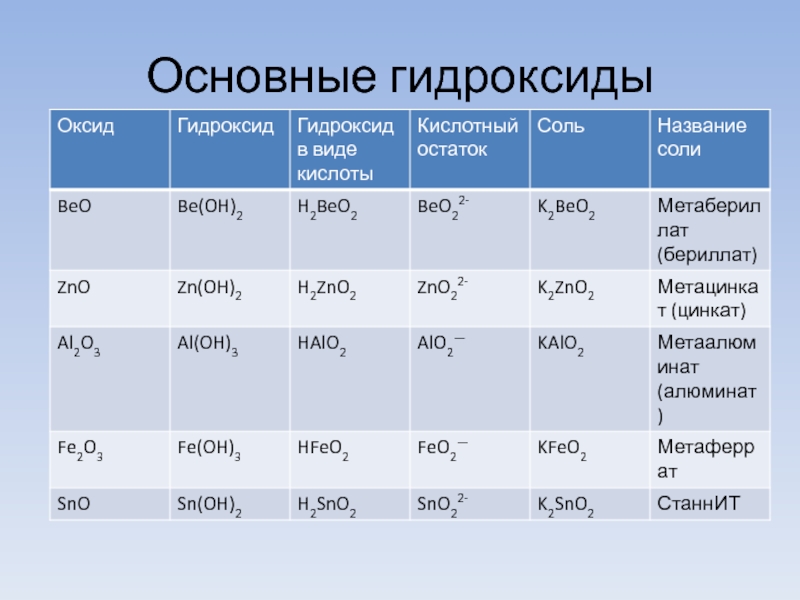
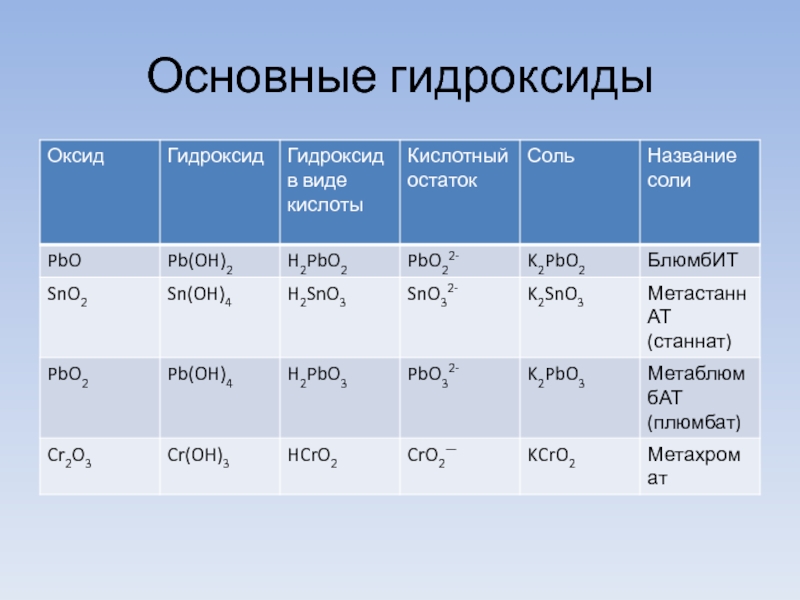
- 8. Основные гидроксиды
- 9. Основные гидроксиды
- 10. 1. Na[Al(OH)4] - Тетрагидроксоалюминат натрия Al(OH)3 +
- 11. 3. K2[Zn(OH)4] -тетрагидроксоцинкат натрия Zn(OH)2 + 2NaOH
- 12. 5. Li2[Be(OH)4] -тетрагидроксобериллат лития Be(OH)2 + 2LiOH
- 13. 7. Na[Cr(OH)4] -тетрагидроксохромат натрия Cr(OH)3 + NaOH
- 14. Полученные в этих взаимодействиях соли реагируют
Слайд 2СПЛАВЫ (без воды)
2KOH(тв.) + H2ZnO2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O
Be(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2BeO2 (метабериллат натрия, или бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2PbO2 (метаплюмбат
натрия, или плюмбат)
Слайд 3
H3AlO3 – H2O → HAlO2 + H2O
Al(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2H2O + KAlO2(метаалюминат калия)
Cr(OH)3 → H3CrO3 → HCrO2
Cr(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2H2O + KCrO2(метахромат калия).
Слайд 6СПЛАВЛЕНИЕ!!!
1. Амфотерного оксида с сильноосновным оксидом:
ZnO(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 (метацинкат калия/цинкат калия)
2. Амфотерного оксида со
щелочью:
ZnO(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
3. Амфотерного оксида с солью слабой кислоты и металла, образующего щелочь:
ZnO(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
4. Амфотерного гидроксида с сильноосновным оксидом:
Zn(OH)2(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
5. Амфотерного гидроксида со щелочью:
Zn(OH)2(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + 2H2O↑
6. Амфотерного гидроксида с солью слабой кислоты и металла, образующего щелочь:
Zn(OH)2(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
7. Соли слабой кислоты и металла, образующего амфотерные соединение с сильноосновным оксидом:
ZnCO3(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
8. Соли слабой кислоты и металла, образующего амфотерные соединение со щелочью:
ZnCO3(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
9. Соли слабой кислоты и металла, образующего амфотерные соединение с солью слабой кислоты и металла, образующего щелочь:
ZnCO3(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
ZnO(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
3. Амфотерного оксида с солью слабой кислоты и металла, образующего щелочь:
ZnO(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
4. Амфотерного гидроксида с сильноосновным оксидом:
Zn(OH)2(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
5. Амфотерного гидроксида со щелочью:
Zn(OH)2(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + 2H2O↑
6. Амфотерного гидроксида с солью слабой кислоты и металла, образующего щелочь:
Zn(OH)2(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
7. Соли слабой кислоты и металла, образующего амфотерные соединение с сильноосновным оксидом:
ZnCO3(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
8. Соли слабой кислоты и металла, образующего амфотерные соединение со щелочью:
ZnCO3(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
9. Соли слабой кислоты и металла, образующего амфотерные соединение с солью слабой кислоты и металла, образующего щелочь:
ZnCO3(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
Слайд 7РАСТВОРЫ!!
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6]
2Al
+ 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
Слайд 10
1. Na[Al(OH)4] - Тетрагидроксоалюминат натрия
Al(OH)3 + NaOH → Na[Al(OH)4]
Al2O3 + 2NaOH + 3H2O
→ 2Na[Al(OH)4]
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
2. Na3[Al(OH)6] -Гексагидроксоалюминат натрия
Al(OH)3 + 3NaOH → Na3[Al(OH)6]
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6]
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
2. Na3[Al(OH)6] -Гексагидроксоалюминат натрия
Al(OH)3 + 3NaOH → Na3[Al(OH)6]
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6]
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
Слайд 11
3. K2[Zn(OH)4] -тетрагидроксоцинкат натрия
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
ZnO + 2NaOH + H2O
→ Na2[Zn(OH)4]
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4]+ H2↑
4. K4[Zn(OH)6] -гексагидроксоцинкат натрия
Zn(OH)2 + 4NaOH → Na4[Zn(OH)6]
ZnO + 4NaOH + H2O → Na4[Zn(OH)6]
Zn + 4NaOH + 2H2O → Na4[Zn(OH)6]+ H2↑
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4]+ H2↑
4. K4[Zn(OH)6] -гексагидроксоцинкат натрия
Zn(OH)2 + 4NaOH → Na4[Zn(OH)6]
ZnO + 4NaOH + H2O → Na4[Zn(OH)6]
Zn + 4NaOH + 2H2O → Na4[Zn(OH)6]+ H2↑
Слайд 12
5. Li2[Be(OH)4] -тетрагидроксобериллат лития
Be(OH)2 + 2LiOH → Li2[Be(OH)4]
BeO + 2LiOH + H2O
→ Li2[Be(OH)4]
Be + 2LiOH + 2H2O → Li2[Be(OH)4]+ H2↑
6. Li4[Be(OH)6] -гексагидроксобериллат лития
Be(OH)2 + 4LiOH → Li4[Be(OH)6]
BeO + 4LiOH + H2O → Li4[Be(OH)6]
Be + 4LiOH + 2H2O → Li4[Be(OH)6]+ H2↑
Be + 2LiOH + 2H2O → Li2[Be(OH)4]+ H2↑
6. Li4[Be(OH)6] -гексагидроксобериллат лития
Be(OH)2 + 4LiOH → Li4[Be(OH)6]
BeO + 4LiOH + H2O → Li4[Be(OH)6]
Be + 4LiOH + 2H2O → Li4[Be(OH)6]+ H2↑
Слайд 13
7. Na[Cr(OH)4] -тетрагидроксохромат натрия
Cr(OH)3 + NaOH → Na[Cr(OH)4]
Cr2O3 + 2NaOH + 3H2O →
2Na[Cr(OH)4]
8. Na3[Cr(OH)6] - гексагидроксохромат натрия
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
Cr2O3 + 6NaOH + 3H2O → 2Na3[Cr(OH)6]
9. Na[Fe(OH)4] - тетрагидроксоферрат натрия
Fe(OH)3 + NaOH → Na[Fe(OH)4]
Fe2O3 + 2NaOH + 3H2O → 2Na[Fe(OH)4]
10. Na3[Fe(OH)6] -гексагидроксоферрат натрия
Fe(OH)3 + 3NaOH → Na3[Fe(OH)6]
Fe2O3 + 6NaOH + 3H2O → 2Na3[Fe(OH)6]
8. Na3[Cr(OH)6] - гексагидроксохромат натрия
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
Cr2O3 + 6NaOH + 3H2O → 2Na3[Cr(OH)6]
9. Na[Fe(OH)4] - тетрагидроксоферрат натрия
Fe(OH)3 + NaOH → Na[Fe(OH)4]
Fe2O3 + 2NaOH + 3H2O → 2Na[Fe(OH)4]
10. Na3[Fe(OH)6] -гексагидроксоферрат натрия
Fe(OH)3 + 3NaOH → Na3[Fe(OH)6]
Fe2O3 + 6NaOH + 3H2O → 2Na3[Fe(OH)6]
Слайд 14
Полученные в этих взаимодействиях соли реагируют с кислотами, образуя две другие
соли (соли данной кислоты и двух металлов):
2Na3[Al(OH)6] + 6H2SO4 → 3Na2SO4 + Al2(SO4)3 + 12H2O
2Na3[Al(OH)6] + 6H2SO4 → 3Na2SO4 + Al2(SO4)3 + 12H2O



![РАСТВОРЫ!!Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6]2Al + 2NaOH + 6H2O](/img/tmb/4/319913/7960d998cf8026deebc970243087fcb1-800x.jpg)
![1. Na[Al(OH)4] - Тетрагидроксоалюминат натрияAl(OH)3 + NaOH → Na[Al(OH)4]Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]2Al + 2NaOH](/img/tmb/4/319913/5c6bc5c4791f0220f9a5f1bd3242f9e5-800x.jpg)
![3. K2[Zn(OH)4] -тетрагидроксоцинкат натрияZn(OH)2 + 2NaOH → Na2[Zn(OH)4]ZnO + 2NaOH + H2O → Na2[Zn(OH)4]Zn + 2NaOH](/img/tmb/4/319913/55325f3918bc25c6f9031b079f56fe7c-800x.jpg)
![5. Li2[Be(OH)4] -тетрагидроксобериллат литияBe(OH)2 + 2LiOH → Li2[Be(OH)4]BeO + 2LiOH + H2O → Li2[Be(OH)4]Be + 2LiOH](/img/tmb/4/319913/f279d802e3403942fc211b45be2e499d-800x.jpg)
![7. Na[Cr(OH)4] -тетрагидроксохромат натрияCr(OH)3 + NaOH → Na[Cr(OH)4]Cr2O3 + 2NaOH + 3H2O → 2Na[Cr(OH)4]8. Na3[Cr(OH)6] - гексагидроксохромат](/img/tmb/4/319913/e6689548c87783484e49a6d8bf8957a0-800x.jpg)






