- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферум. Залізо. Будова атома, фізичні і хімічні властивості презентация
Содержание
- 1. Ферум. Залізо. Будова атома, фізичні і хімічні властивості
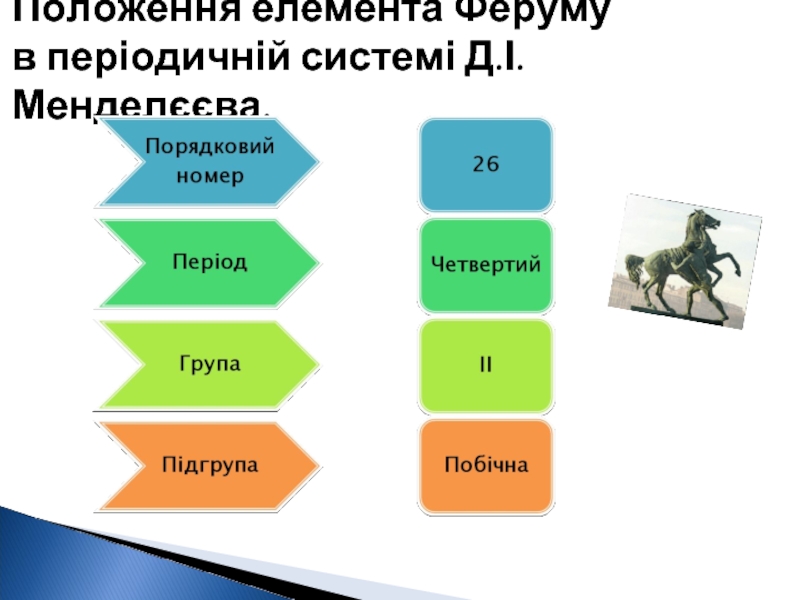
- 2. Положення елемента Феруму в періодичній системі Д.І. Менделєєва.
- 3. Дописати електронну формулу 1s2 2s2 2р6 3s2 3р6…. Будова атома Феруму
- 4. Які електрони для елементів головних підгруп
- 5. Валентні електрони атомів елементів побічних підгруп
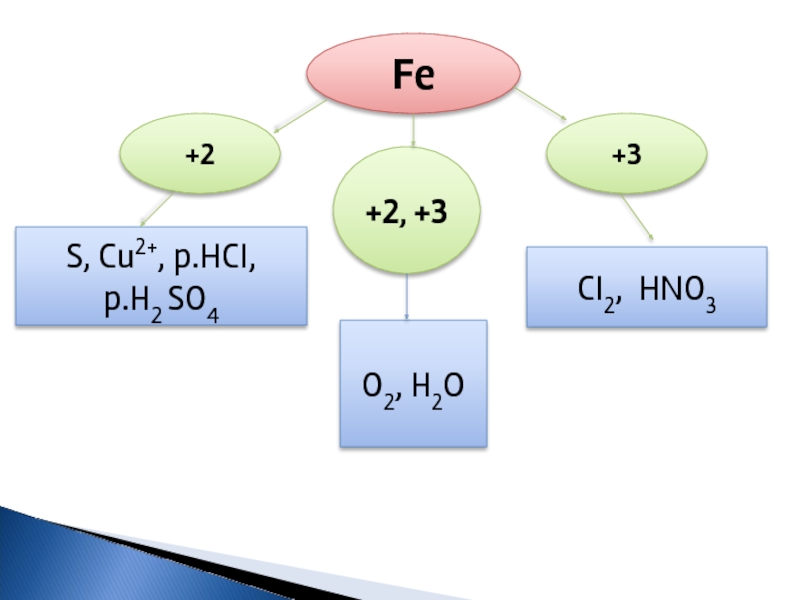
- 6. Для Феруму характерні два основні ступені
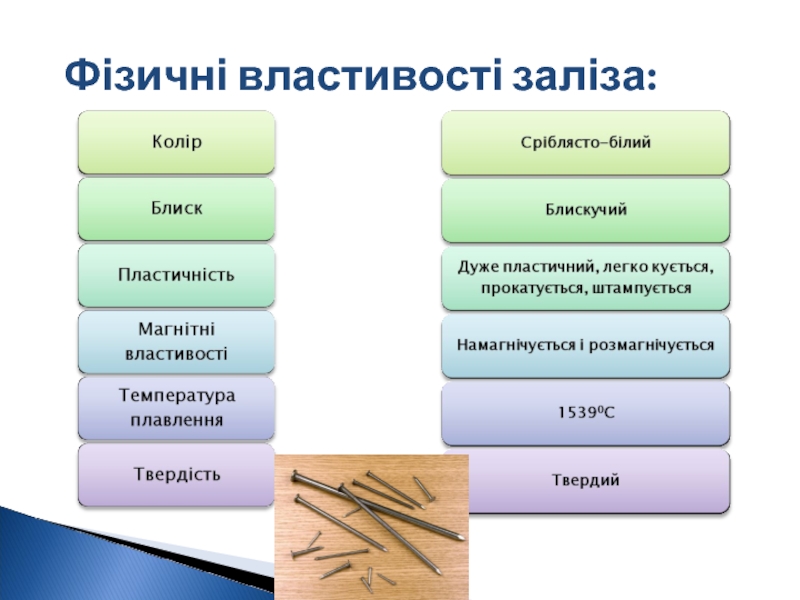
- 7. Фізичні властивості заліза:
- 8. Fe +3 +2 +2, +3
- 9. Fe + CI2 = Fe
- 10. Взаємодія з простими речовинами -неметалами 1)
- 11. 0 0
- 12. Хімічні властивості заліза Взаємодія з складними речовинами
- 13. Метали Взаємодіють з кислотами коли:
- 14. 3) З солями. Дослід: здійснити реакцію між
- 15. Метали Взаємодіють з розчинами солей коли:
- 16. Сполуки Феруму :
- 17. +2
- 18. 1) 2FeCI2 + CI2 = 2FeCI3
- 19. На йони Fe2+ +2
- 20. Вариант 1: Fe —> FeCl2 —> Fe(OH)2
Слайд 1Ферум. Залізо: будова атома, фізичні і хімічні властивості. Генетичні ряди Феруму (II)
Слайд 4
Які електрони для елементів головних підгруп являються валентними?
А які електрони для
Запам’ятай!
Особливістю електронної будови елементів побічних підгруп являється заповнення електронами не останнього, а передостаннього рівня.
1s2 2s2 2р6 3s2 3р6 3d6 4s2
Валентні електрони
Слайд 5 Валентні електрони атомів елементів побічних підгруп розприділяються на останньому і
Запам’ятай!
Слайд 9Fe + CI2 =
Fe + S =
Fe + HCI
Fe + O2 =
Fe + CuSO4 =
Fe + H2O =
Fe + O2 + H2O =
Закінчити рівняння хімічних реакцій:
Слайд 10Взаємодія з простими речовинами -неметалами
1) З киснем.
0
3Fe + 2O2 —>Fe3O4 (FeO • Fe2O3)
Хімічні властивості заліза
2) З сіркою і хлором.
Запишіть рівняння реакції і складіть електронний баланс.
Слайд 110 0 +2 -2
Fe + S —>FeS
електронний баланс
Fe0 – 2e- —> Fe2+
S0 + 2e- —> S2-
+3 -1
2Fe0 + 3Cl20 —> 2FeCl3
електронний баланс
Fe0 – 3e- —> Fe3+
Cl20 +2e- —> 2Cl1-
Чому залізо являється відновником?
Слайд 12Хімічні властивості заліза
Взаємодія з складними речовинами
1) З водою.
3Fe0 + 4H2O —> Fe3O4 + 4H20
при t =7000 - 9000
2) З кислотами.
Дослід: здійснити реакцію між порошком заліза і хлоридною кислотою.
В якому випадку можливі реакції між металом і кислотою?
Скласти рівняння реакції.
Зробити висновок.
Слайд 13
Метали
Взаємодіють з кислотами коли:
1. Метал знаходиться в ряду активності металів до
2. Повинні одержати розчинну сіль.
3. Реакція характерна для розчинів кислот.
4. Метал + кислота → сіль + водень
Fe + 2HCl —>FeCl2 + H2
Слайд 143) З солями.
Дослід: здійснити реакцію між порошком заліза і розчином купрум
В якому випадку можливі реакції між металом і розчином солі?
Скласти рівняння реакції.
Зробити висновок.
Хімічні властивості заліза
Слайд 15Метали
Взаємодіють з розчинами солей коли:
1. Кожний метал витісняє із розчинів солей
2. Обидві солі (і реагуюча і утворена в результаті реакції) повинні бути розчинні.
Fe + CuCl2 —> FeCl2 + Cu
Слайд 17+2 +2
FeO —>Fe(OH)2
Які реакції підтверджують основний характер оксидів?
+3 +3
Fe2O3 —> Fe(OH)3
Які сполуки називають амфотерними?
Ступінь окиснення металу в оксиді повинна відповідати ступеню окиснення металу у відповідному гідроксиді
Слайд 18
1) 2FeCI2 + CI2 = 2FeCI3
2) FeCI3 + 3NaOH = Fe(OH)3
3) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Які реакції відповідають схемі Fe+2 =>Fe+3 ?
Слайд 19На йони Fe2+
+2
FeCl2 + K3[Fe(CN)6] —> KFe[Fe(CN)6]+2KCL
червона кровяна сіль синій осад
-----------------------------------------------------------------------------------------------------------
На йони Fe3+
+3 +3 +2
FeCl3 + K4[Fe(CN)6] —> KFe[Fe(CN)6]+3KCL
жовта кровяна сіль синій осад
+3 +3
FeCl3 + KCNS —> Fe(CNS)3 + 3KCl
роданід калію розчин червоного кольору
Якісні реаукції на йони Феруму Fe2+ і Fe3+
Слайд 20Вариант 1:
Fe —> FeCl2 —> Fe(OH)2 —> FeO
Вариант 2:
Fe —> FeCl3
Лабораторний дослід
Здійснити практично ланцюг хімічних перетворень .
Скласти рівняння хімічних реакцій .