- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Спирты презентация
Содержание
- 1. Спирты
- 2. Содержание
- 3. СПИРТЫ CxHy (OH)n Спиртами называются
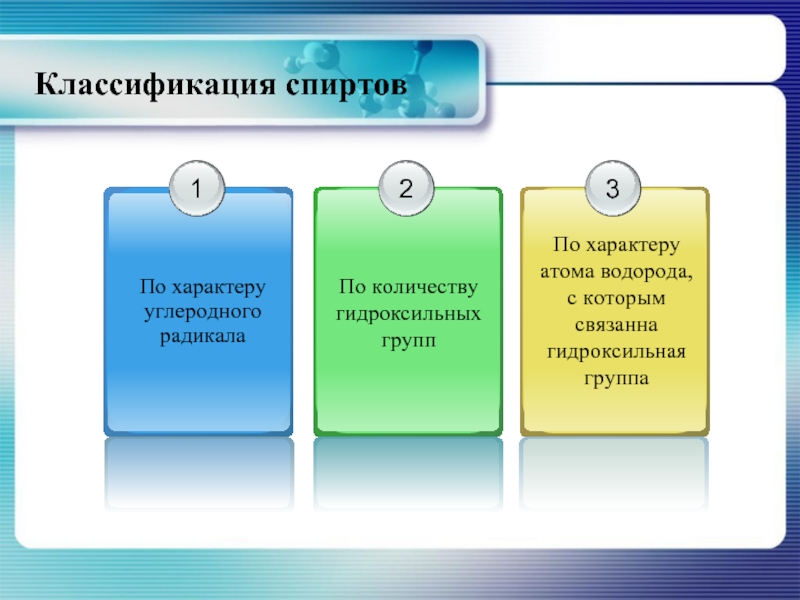
- 4. Классификация спиртов
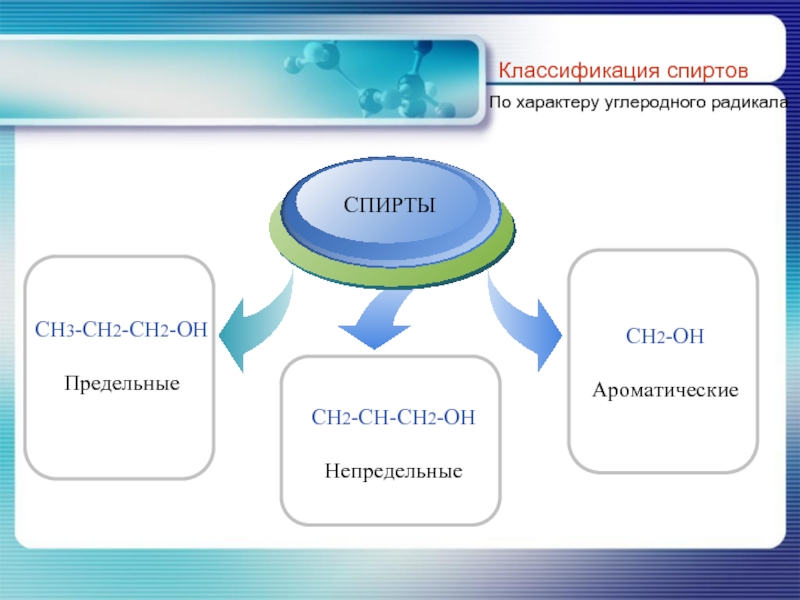
- 5. Классификация спиртов По характеру углеродного радикала
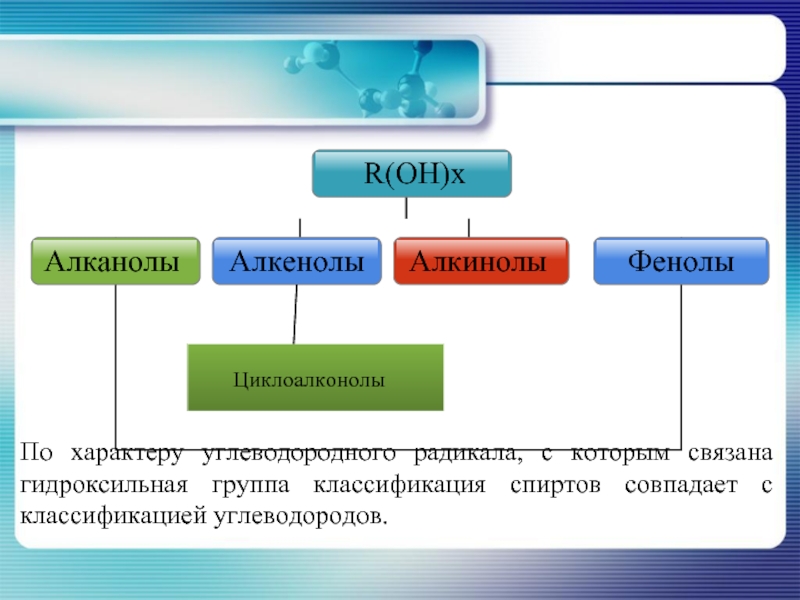
- 6. По характеру углеводородного радикала, с которым связана гидроксильная группа классификация спиртов совпадает с классификацией углеводородов.
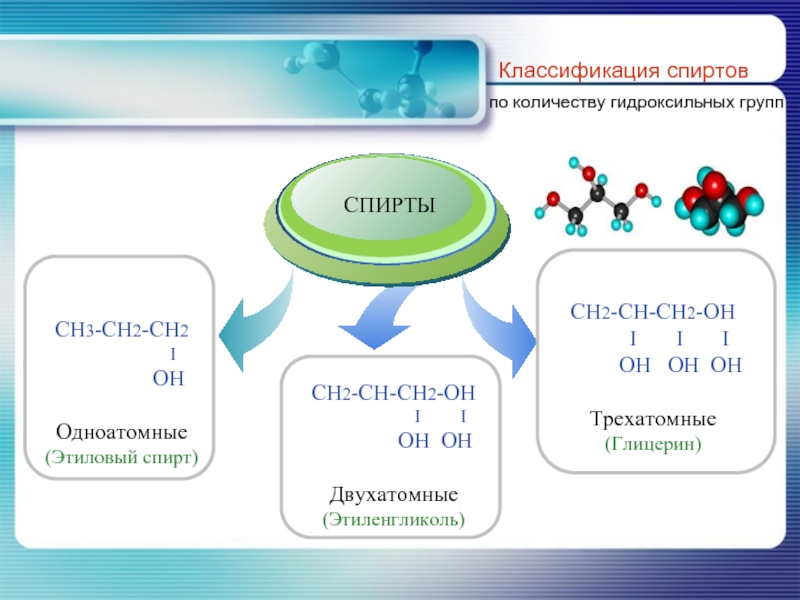
- 7. Классификация спиртов по количеству гидроксильных групп
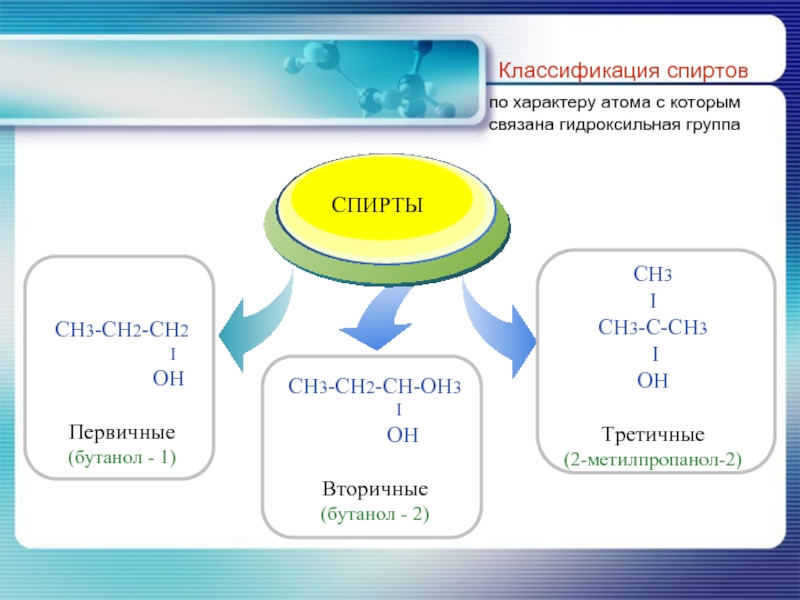
- 8. Классификация спиртов по характеру атома с которым связана гидроксильная группа
- 9. Алканолы образуют гомологический ряд общей формулы
- 10. CH3-OH - метанол C2H5-OH - этанол
- 11. Изомерия спиртов Для алканолов характерны два вида изомерии:
- 12. Изомерия положения гидроксильной группы в углеродной цепи
- 13. CH3-CH2-CH2-CH2-OH бутанол-1 (н-бутиловый спирт) CH3-CH-CH2-OH l
- 14. Физические свойства спиртов Алканолы являются бесцветными
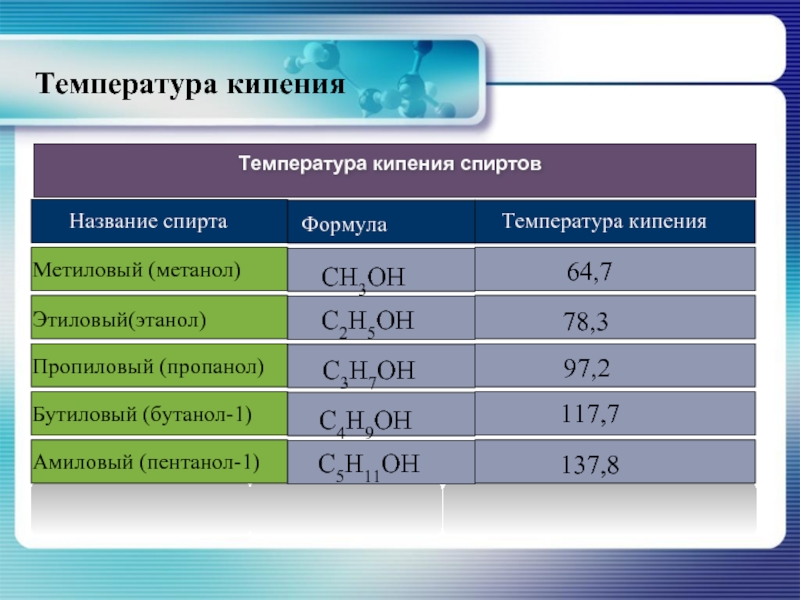
- 15. Температура кипения
- 16. Высокая температура кипения спиртов объясняется значительным
- 17. Строение молекулы этанола В молекуле этанола атомы
- 18. Химические свойства спиртов Реакционная способность спиртов обусловлена
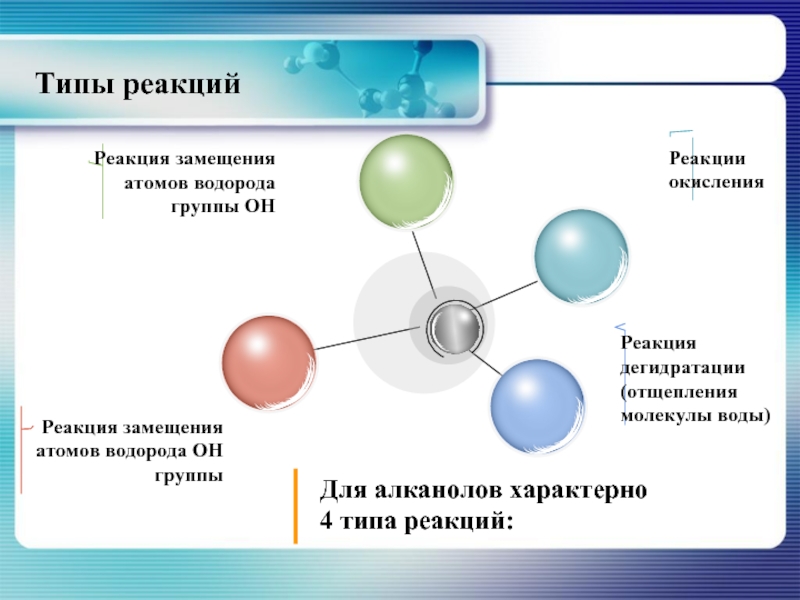
- 19. Типы реакций
- 20. Реакция замещения водорода -ОН группы С2Н5ОН +
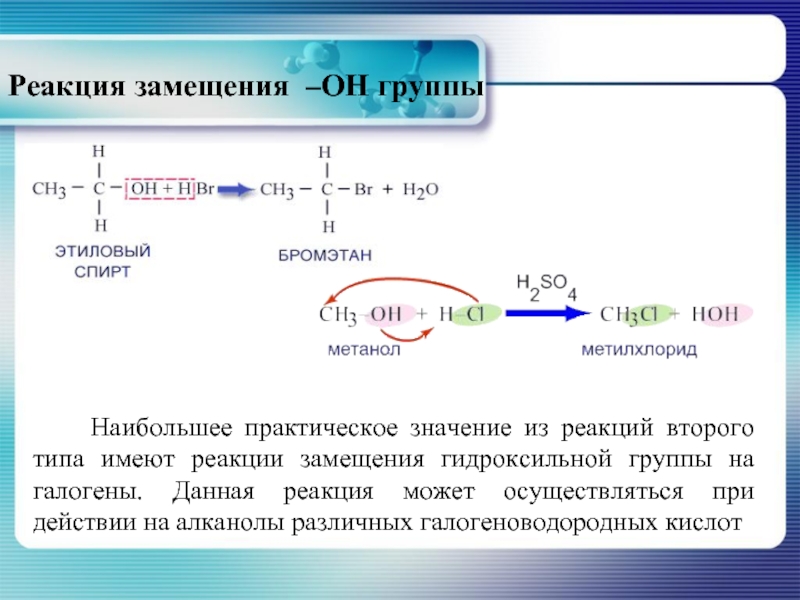
- 21. Реакция замещения –ОН группы
- 22. R – OH + H – X
- 23. Проведение реакций опытным путем
- 24. Реакция дегидратации Для алканолов
- 25. Внутримолекулярная дегидратация алканолов
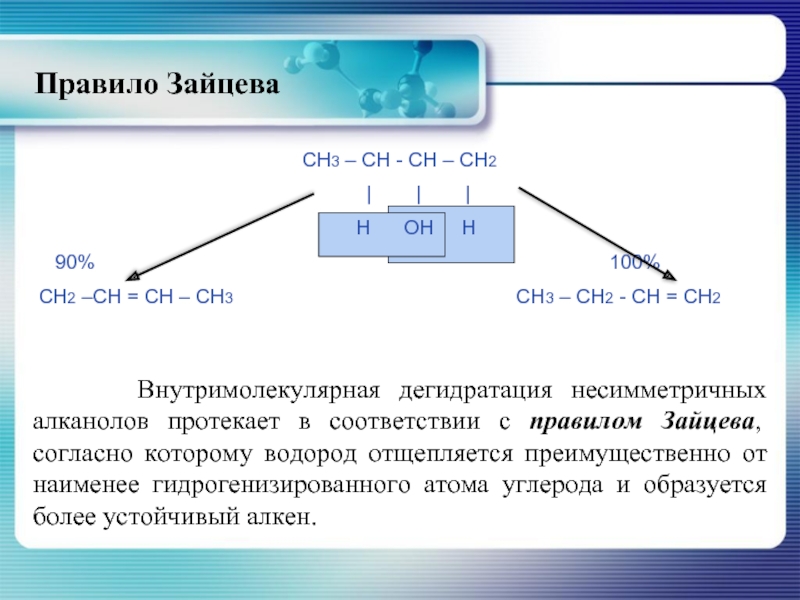
- 26. Правило Зайцева Внутримолекулярная дегидратация
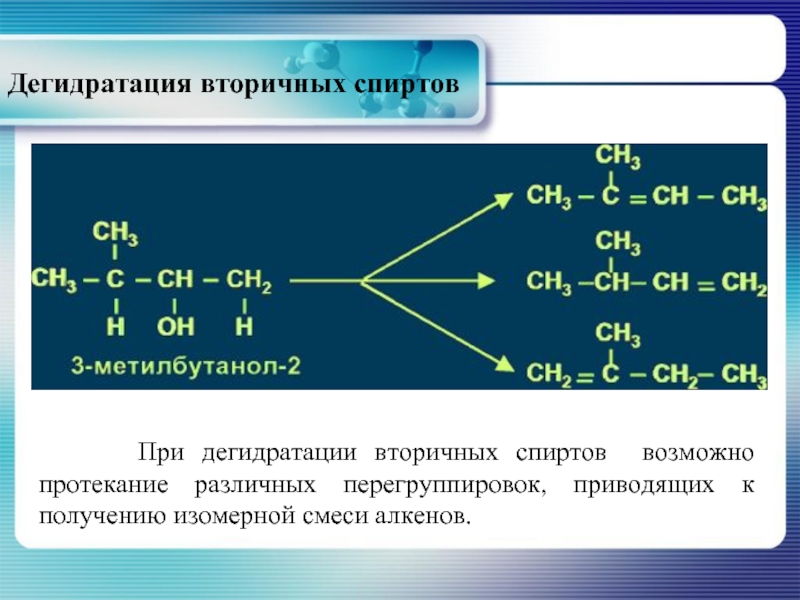
- 27. Дегидратация вторичных спиртов При
- 28. При более слабом
- 29. Реакции окисления Окисление спиртов проис-ходит и под
- 31. Окисление первичных спиртов до карбоновых кислот протекает
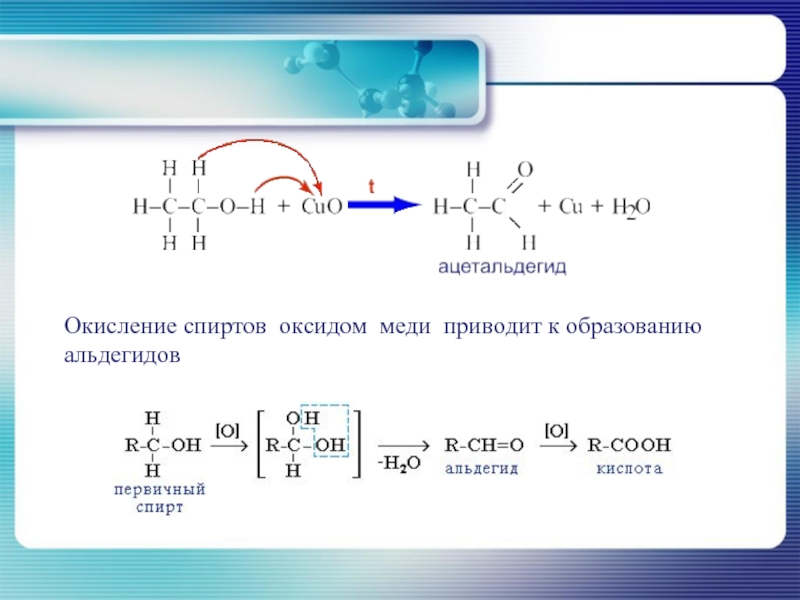
- 32. Окисление спиртов оксидом меди приводит к образованию альдегидов
- 34. Третичные спирты могут окисляться только в
- 35. Метанол и этанол Метанол получают гидрированием оксида
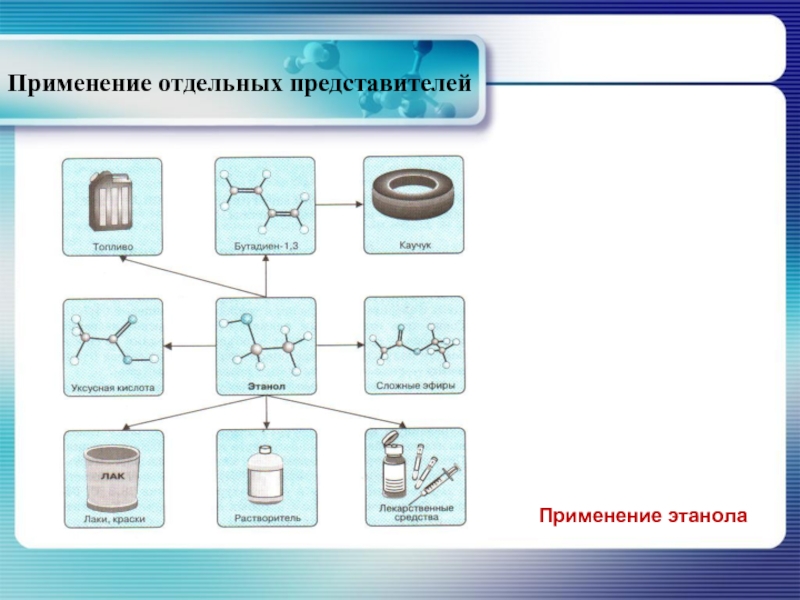
- 36. Применение отдельных представителей Применение этанола
- 37. Наиболее распространённым методом получения этанола является ферментативное расщепление моносахаридов.
- 38. Мировое производство мета-нола составляет около 10
- 39. Запомни Водородная связь – это связь между
- 40. Спасибо за внимание !
Слайд 3СПИРТЫ
CxHy (OH)n
Спиртами называются органические вещест-ва, молекулы которых содержат одну или несколько
Слайд 6По характеру углеводородного радикала, с которым связана гидроксильная группа классификация спиртов
Слайд 9
Алканолы образуют гомологический ряд общей формулы CnH2n+1OH (n=1,2,3,:N). Названия алканолов по
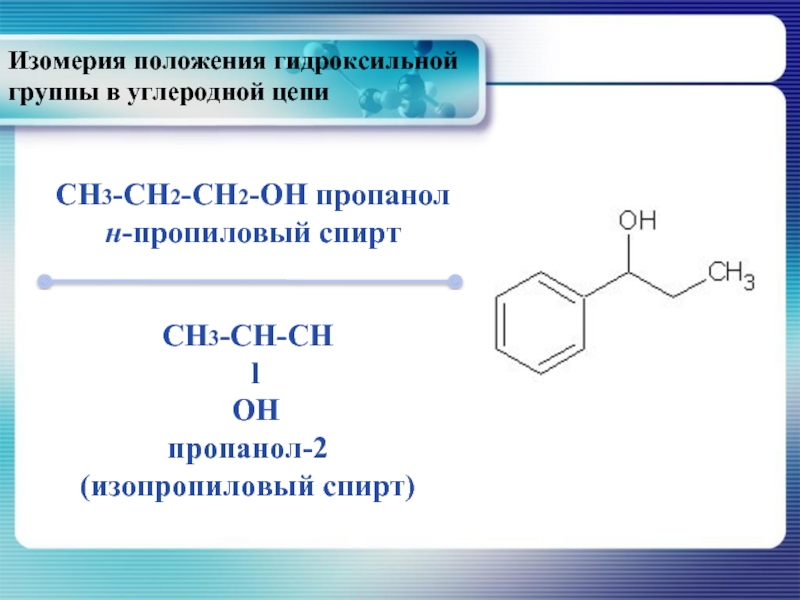
Слайд 12Изомерия положения гидроксильной группы в углеродной цепи
CH3-CH2-CH2-OH пропанол
н-пропиловый спирт
CH3-CH-CH
l
OH
пропанол-2
(изопропиловый
Слайд 13CH3-CH2-CH2-CH2-OH
бутанол-1
(н-бутиловый спирт)
CH3-CH-CH2-OH
l
CH3
2-метилпропанол-1
(изобутиловый спирт)
Первым из спиртов,
Изомерия углеродного скелета
Слайд 14Физические свойства спиртов
Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным
Слайд 16
Высокая температура кипения спиртов объясняется значительным межмолекулярным взаимодействием – ассоциацией молекул,
Слайд 17Строение молекулы этанола
В молекуле этанола атомы углерода, водорода и кислорода связаны
Слайд 18Химические свойства спиртов
Реакционная способность спиртов обусловлена наличием в их молекулах полярных
Спирты проявляют слабые кислотно – основные свойства
Слайд 20Реакция замещения водорода -ОН группы
С2Н5ОН + Na → C2H5ONa + H2
C2H5ONa
Как слабые кислоты алканолы могут реагировать со щелочными металлами. Образующиеся при этом металлические производные спиртов называются алкоголятами.
Слайд 21Реакция замещения –ОН группы
Наибольшее практическое значение из реакций
Слайд 22R – OH + H – X ↔ R – X
Реакционная способность алканолов
R3С – OH > R2CH – OH > RCH2 – OH
Реакционная способность HX
HI > HBr > HCl >> HF
Реакция алканолов с галогеноводородными кислотами является обратимой. Эффективность её протекания зависит от строения алканола, природы галогеноводорода и условий проведения. Наиболее активными в данной реакции являются третичные алканолы и иодоводородная кислота
Реакции алканолов
Слайд 24Реакция дегидратации
Для алканолов характерно два типа реакции
- внутримолекулярная
и
- межмолекулярная
При внутримолекулярной дегидратации обра- зуются алкены, при межмолекулярной - простые эфиры.
Слайд 25
Внутримолекулярная дегидратация алканолов может осуществляться при нагревании их
Слайд 26Правило Зайцева
Внутримолекулярная дегидратация несимметричных алканолов протекает в соответствии
Слайд 27Дегидратация вторичных спиртов
При дегидратации вторичных спиртов возможно протекание
Слайд 28
При более слабом нагревании этилового спирта с серной
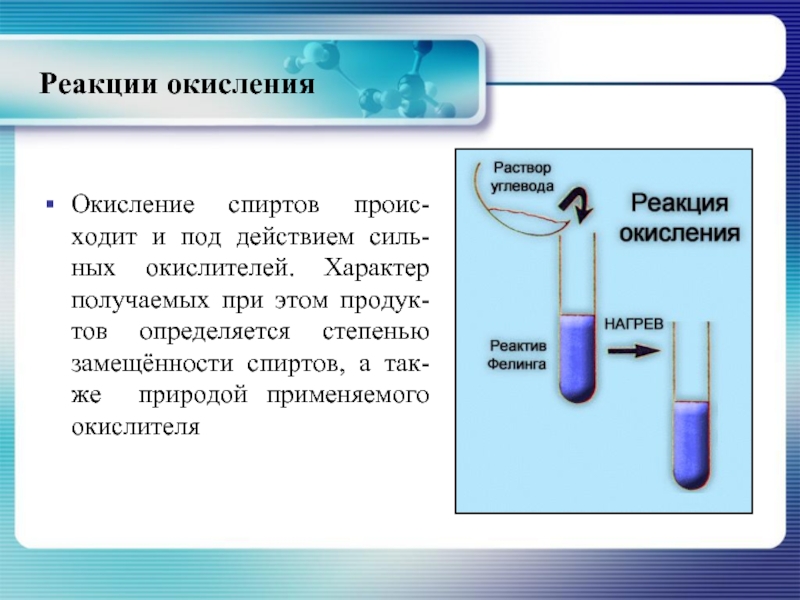
Слайд 29Реакции окисления
Окисление спиртов проис-ходит и под действием силь-ных окислителей. Характер получаемых
Слайд 31Окисление первичных спиртов до карбоновых кислот протекает при действии HNO3 или
Окисление вторичных спиртов приводит к образованию соответствующих кетонов.
Слайд 34
Третичные спирты могут окисляться только в жёстких условиях, при действии сильных
Слайд 35Метанол и этанол
Метанол получают гидрированием оксида углерода (II) СО. В настоящее
Слайд 37
Наиболее распространённым методом получения этанола является ферментативное расщепление моносахаридов.
Слайд 38
Мировое производство мета-нола составляет около 10 мил-лионов тонн в год, этанола
Слайд 39Запомни
Водородная связь – это связь между атомом водорода одной молекулы и
Реакция этерификации – взаимодействие спир-тов с органическими и неорганическими кислотами с образованием сложных эфиров.