Концентраційні межі поширення полум’я
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Виникнення процесу горіння. Пожежовибухонебезпечні горючі суміші. Концентраційні межі поширення полум’я. (Розділ 2.3.4) презентация
Содержание
- 1. Виникнення процесу горіння. Пожежовибухонебезпечні горючі суміші. Концентраційні межі поширення полум’я. (Розділ 2.3.4)
- 2. План лекції 1. Умови виникнення горіння
- 3. 1. Умови виникнення горіння Виникнення горіння -
- 4. Реакції горіння відносяться до автокаталітичних, особливістю яких
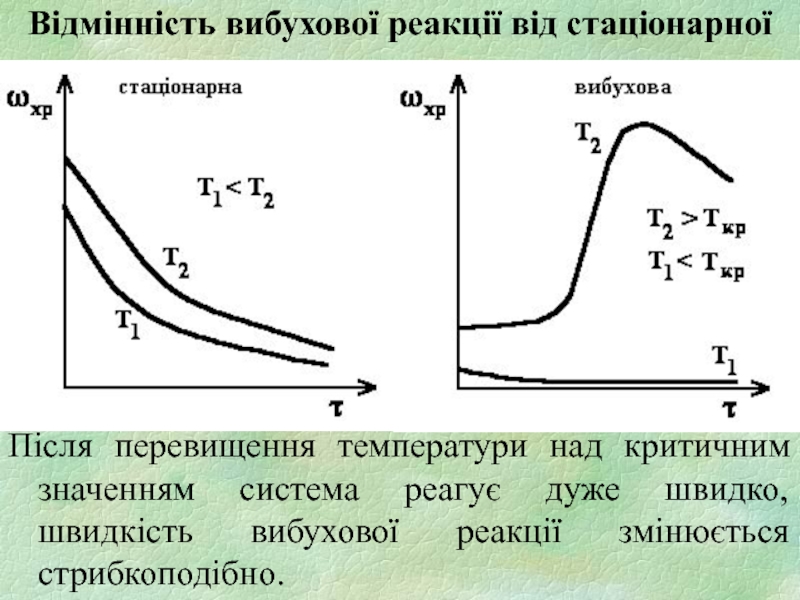
- 5. Відмінність вибухової реакції від стаціонарної
- 6. Реакції окислення ідуть з виділенням тепла, отже,
- 7. Загальні ознаки процесу виникнення горіння: утворення горючої
- 8. Залежно від природи теплового імпульсу розрізняють три
- 9. 2. Умови утворення горючого середовища Горючим
- 10. НКМПП (ϕн)
- 11. 2.2. Методи визначення КМПП 1. НКМПП розраховують,
- 12. 3. За емпіричною формулою
- 13. 5. КМПП суміші горючих газів Правило Ле-Шательє:
- 14. Склад суміші: СН4 – 30%; С2Н4 –
- 15. 3. Чинники, що впливають на КМПП Чинники,
- 16. При збільшенні молекулярної маси вуглеводнів концентраційні межі
- 17. Концентрація кисню в окислювальному середовищі φО2 ↑
- 18. Концентрація негорючих домішок в газовій суміші φнг↑
- 19. Вплив хімічно-активних домішок φкат↑ ωхр ↑
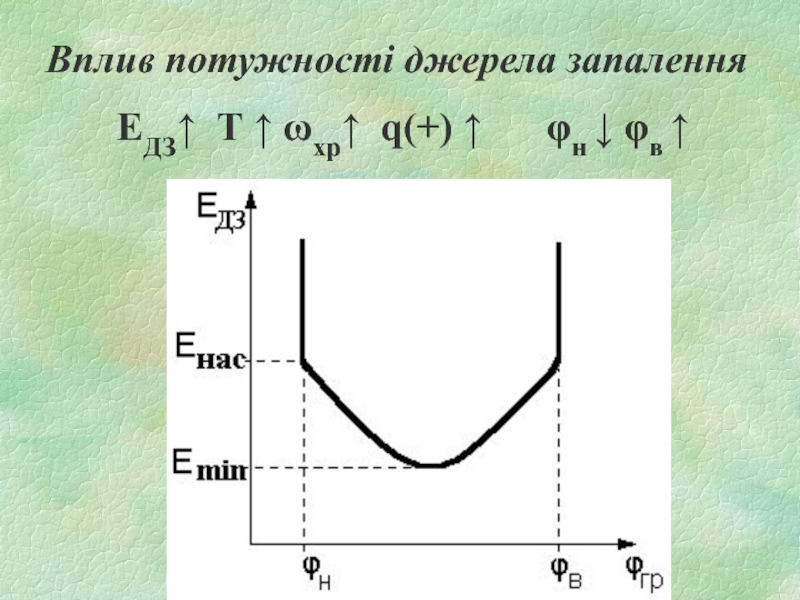
- 20. Вплив початкової температури Т↑ ωхр↑ q(+)↑
- 21. Вплив тиску ω хр ~ [kгр]n [kок]m,
- 22. Вплив швидкості руху газової суміші Vгс↑ q(-) ↑ φн ↑ φв ↓
- 23. Вплив потужності джерела запалення ЕДЗ↑ Т ↑
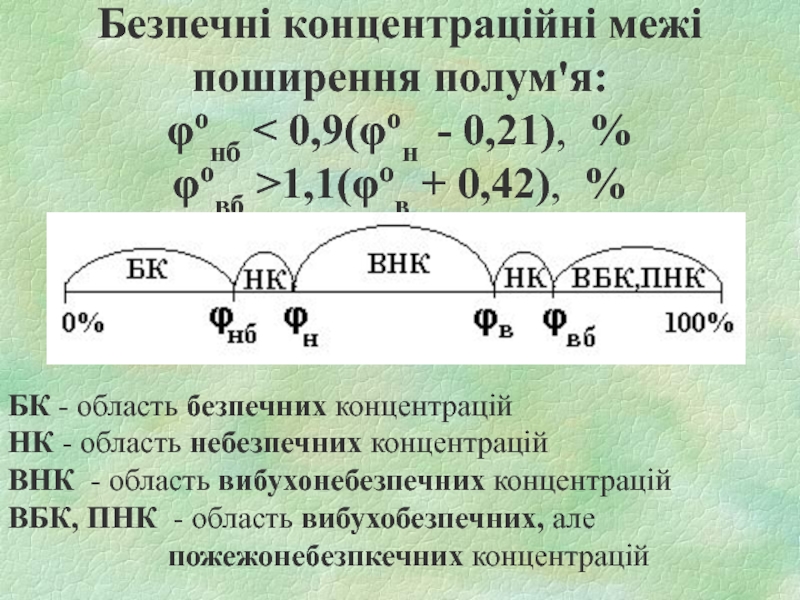
- 24. Безпечні концентраційні межі поширення полум'я: φонб <
- 25. 4. Практичне значення КМПП 1. Для порівняльної
- 26. 3. Для визначення вибухобезпечних робочих концентрацій горючої
- 27. Завдання на самопідготовку: Вивчити матеріал 1.
Слайд 1Розділ II.
ВИНИКНЕННЯ ПРОЦЕСУ ГОРІННЯ
Тема 3. ГОРЮЧІ СИСТЕМИ.
Лекція 4
Пожежовибухонебезпечні горючі суміші.
Слайд 2План лекції
1. Умови виникнення горіння
2. Умови утворення горючого середовища.
3. Чинники,
що впливають на КМПП
4. Практичне значення КМПП
4. Практичне значення КМПП
Слайд 31. Умови виникнення горіння
Виникнення горіння - це швидкий перехід від повільної
реакції до миттєвого перетворення, що є підсумком самоприскорення реакції і супро-воджується несподіваним перетворенням в системі: спалахом або звуковим ефектом.
Виникнення горіння пов'язано з утворенням горючої системи, яка складається з горючої речовини та окисника у певному співвідношенні, та накопиченням в такій системі тепла або каталізуючих активних продуктів реакції (активних центрів).
У першому випадку кажуть про тепловий механізм виникнення горіння, а у другому – про ланцюговий.
Виникнення горіння пов'язано з утворенням горючої системи, яка складається з горючої речовини та окисника у певному співвідношенні, та накопиченням в такій системі тепла або каталізуючих активних продуктів реакції (активних центрів).
У першому випадку кажуть про тепловий механізм виникнення горіння, а у другому – про ланцюговий.
Слайд 4Реакції горіння відносяться до автокаталітичних, особливістю яких є те, що швидкість
перетворення збільшується за умови зменшення концентрації реагуючих речовин. Саморозгін реакції відбувається внаслідок зміни інших параметрів системи лише при досягненні критичного стану в системі.
За тепловим механізмом вплив теплового імпульсу призводить до підвищення температури в горючій системі, внаслідок чого відбувається збільшення швидкості реакції окислення за законом Арреніуса.
За ланцюговим механізмом швидкість реакції окислення збільшується з часом за рахунок накопичення каталізуючих продуктів реакції - активних центрів.
За тепловим механізмом вплив теплового імпульсу призводить до підвищення температури в горючій системі, внаслідок чого відбувається збільшення швидкості реакції окислення за законом Арреніуса.
За ланцюговим механізмом швидкість реакції окислення збільшується з часом за рахунок накопичення каталізуючих продуктів реакції - активних центрів.
Слайд 5Відмінність вибухової реакції від стаціонарної
Після перевищення температури над критичним значенням система
реагує дуже швидко, швидкість вибухової реакції змінюється стрибкоподібно.
Слайд 6Реакції окислення ідуть з виділенням тепла, отже, в системі відбудеться додатковий
розігрів і зростання температури.
Інтенсивність тепловиділення: q(+) =QгVгсωхр
Поява різниці температур викликає віддачу тепла від системи в середовище за рахунок конвекції.
Інтенсивність тепловіддачі: q(–) = α S (Т – То).
Якщо q(–)>q(+) - зона реакції охолоджується, реакція окислення гальмується;
q(–)Період часу з початку перевищення температури горючої системи над температурою навколишнього середовища до моменту виникнення горіння називається періодом індукції або часом індукції.
Інтенсивність тепловиділення: q(+) =QгVгсωхр
Поява різниці температур викликає віддачу тепла від системи в середовище за рахунок конвекції.
Інтенсивність тепловіддачі: q(–) = α S (Т – То).
Якщо q(–)>q(+) - зона реакції охолоджується, реакція окислення гальмується;
q(–)
Слайд 7Загальні ознаки процесу виникнення горіння:
утворення горючої системи, яка складається з горючої
речовини та окисника у певному співвідношенні,
температура системи досягає критичного значення;
тепловиділення в горючій системі за рахунок хімічної реакції окислення q(+) перевищує тепловіддачу q(–) від системи в навколишній простір;
перехід від повільної реакції окислення до горіння відбувається за певний час - період індукції.
температура системи досягає критичного значення;
тепловиділення в горючій системі за рахунок хімічної реакції окислення q(+) перевищує тепловіддачу q(–) від системи в навколишній простір;
перехід від повільної реакції окислення до горіння відбувається за певний час - період індукції.
Слайд 8Залежно від природи теплового імпульсу розрізняють три види виникнення горіння:
самоспалахування,
самозаймання,
вимушене запалювання.
Самоспалахування – виникнення горіння під впливом зовнішнього нагріву всієї горючої системи до критичної температури.
Самозаймання – виникнення горіння внаслідок накопичення тепла в горючій системі за рахунок протікання внутрішніх екзотермічних процесів.
Вимушене запалювання – виникнення горіння внаслідок дії високотемпературного джерела запалювання на невелику частку холодної горючої системи.
Слайд 92. Умови утворення горючого середовища
Горючим є середовище, яке здатне самостійно
горіти після усунення джерела запалювання.
2.1. Поняття концентраційних меж поширення полум'я (КМПП)
Швидкість хімічної реакції залежить від концентрації компонентів та температури системи:
ωхр = ϕгрnϕокm kоexp (-Eакт/RT).
Якщо концентрація одного з компонентів горючої суміші (ϕгр або ϕок) стане менше ніж критичне значення, швидкість реакції зменшується на стільки, що інтенсивність тепловиділення q(+) стає меншою, ніж інтенсивність тепловтрат q(-), зона реакції охолоджується, система переходить у стан повільної реакції окислення, горіння не виникає або припиняється.
2.1. Поняття концентраційних меж поширення полум'я (КМПП)
Швидкість хімічної реакції залежить від концентрації компонентів та температури системи:
ωхр = ϕгрnϕокm kоexp (-Eакт/RT).
Якщо концентрація одного з компонентів горючої суміші (ϕгр або ϕок) стане менше ніж критичне значення, швидкість реакції зменшується на стільки, що інтенсивність тепловиділення q(+) стає меншою, ніж інтенсивність тепловтрат q(-), зона реакції охолоджується, система переходить у стан повільної реакції окислення, горіння не виникає або припиняється.
Слайд 10
НКМПП (ϕн) - найменша концентрація горючої речовини в суміші з повітрям,
при якій вже можливе виникнення та поширення горіння.
ВКМПП (ϕв) - найбільша концентрація горючої речовини в суміші з повітрям, при якій ще можливе виникнення та поширення горіння.
ВКМПП (ϕв) - найбільша концентрація горючої речовини в суміші з повітрям, при якій ще можливе виникнення та поширення горіння.
Слайд 112.2. Методи визначення КМПП
1. НКМПП розраховують, виходячи з нижчої теплоти згоряння
ГР:
Qн - 100%
Qкр - φн %
2. НКМПП розраховують, виходячи зі складу ГР:
де hf = 0,0246 - параметр теплоти утворення ГР;
∆Hof - стандартна теплота утворення ГР;
hj - параметр j-го елемента в молекулі ГР;
mj - число атомів j-го елемента в молекулі ГР.
Qн - 100%
Qкр - φн %
2. НКМПП розраховують, виходячи зі складу ГР:
де hf = 0,0246 - параметр теплоти утворення ГР;
∆Hof - стандартна теплота утворення ГР;
hj - параметр j-го елемента в молекулі ГР;
mj - число атомів j-го елемента в молекулі ГР.
Слайд 123. За емпіричною формулою
4. За структурною будовою горючої речовини
де hs
- вклад s-ої структурної групи,
ls - число s-их структурних груп у будові ГР.
ls - число s-их структурних груп у будові ГР.
Слайд 135. КМПП суміші горючих газів
Правило Ле-Шательє: багатокомпонентна систе-ма, яка складається із
декількох бінарних сумішей граничного складу, взятих у довільному співвідношенні, також є граничною.
де ϕон(в)I - нижня або верхня КМПП i-го горючого компоненту,
ϕоi - процентний вміст i-го компоненту в суміші.
де ϕон(в)I - нижня або верхня КМПП i-го горючого компоненту,
ϕоi - процентний вміст i-го компоненту в суміші.
Слайд 14Склад суміші: СН4 – 30%; С2Н4 – 70%.
ϕно СН4 = 5,3%;
ϕно С2Н4 = 2,7%
Для перерахунку об'ємної концентрації ϕо у масову ϕ/ та назад можна користуватися формулою:
Для перерахунку об'ємної концентрації ϕо у масову ϕ/ та назад можна користуватися формулою:
Слайд 153. Чинники, що впливають на КМПП
Чинники, які збільшують тепловиділення в системі
q(+)↑, розширюють КМПП (φн↓, φв↑), а чинники, які збільшують тепловтрати від системи в навколишнє середовище q(-)↑, звужують область запалення (φн↑, φв↓).
Найбільший вплив на зміну КМПП мають:
1) вид горючої речовини;
2) склад горючої суміші:
концентрації кисню в окислювальному середовищі;
домішки негорючих газів;
добавки каталізаторів або інгібіторів.
3) умови, в яких знаходиться суміш:
температура і тиск системи;
міра турбулізації газового потоку;
потужність впливу ДЗ.
Найбільший вплив на зміну КМПП мають:
1) вид горючої речовини;
2) склад горючої суміші:
концентрації кисню в окислювальному середовищі;
домішки негорючих газів;
добавки каталізаторів або інгібіторів.
3) умови, в яких знаходиться суміш:
температура і тиск системи;
міра турбулізації газового потоку;
потужність впливу ДЗ.
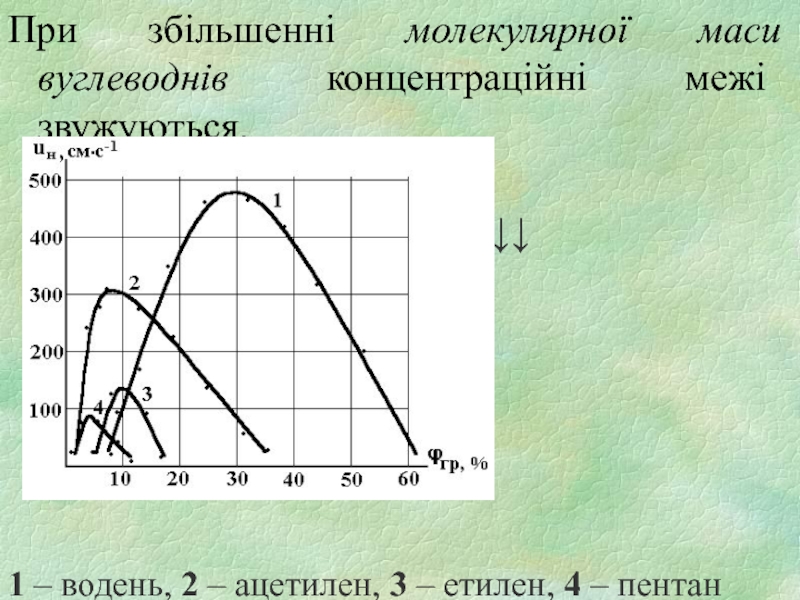
Слайд 16При збільшенні молекулярної маси вуглеводнів концентраційні межі звужуються.
µгр↑
φн↓ φв↓↓
1 – водень, 2 – ацетилен, 3 – етилен, 4 – пентан
1 – водень, 2 – ацетилен, 3 – етилен, 4 – пентан
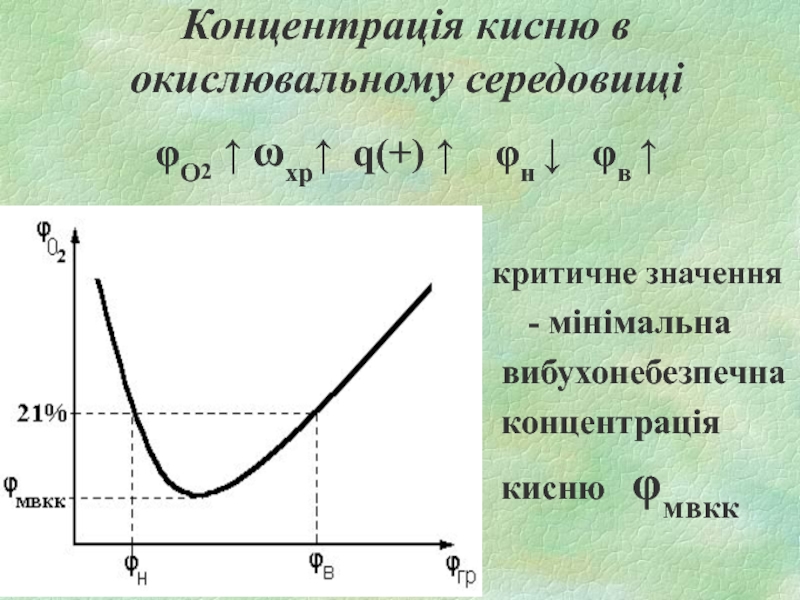
Слайд 17Концентрація кисню в окислювальному середовищі
φО2 ↑ ωхр↑ q(+) ↑ φн
↓ φв ↑
критичне значення
- мінімальна
вибухонебезпечна
концентрація
кисню φмвкк
критичне значення
- мінімальна
вибухонебезпечна
концентрація
кисню φмвкк
Слайд 18Концентрація негорючих домішок в газовій суміші
φнг↑ ωхр↓ q(+)↓ q(-)↑
φн ↑ φв ↓
критичне
значення –
флегматизуюча
концентрація НГ
φфл
критичне
значення –
флегматизуюча
концентрація НГ
φфл
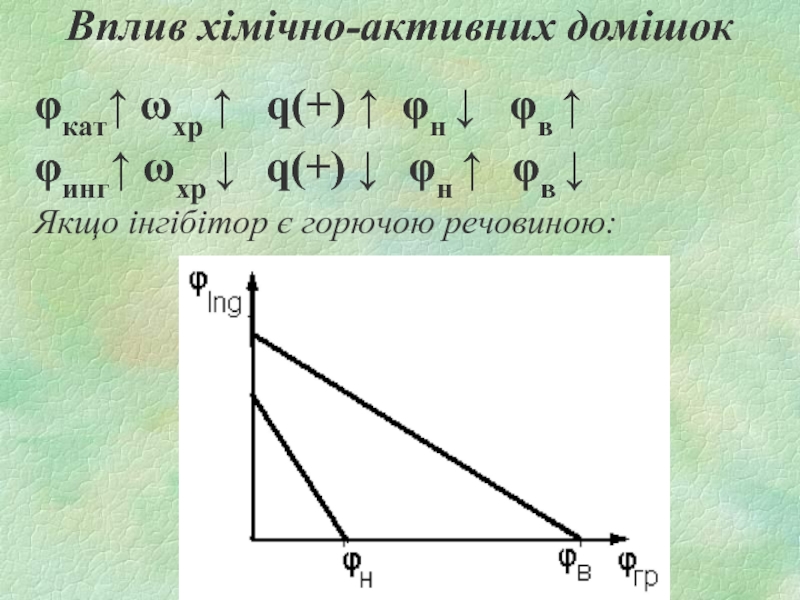
Слайд 19Вплив хімічно-активних домішок
φкат↑ ωхр ↑ q(+) ↑ φн ↓
φв ↑
φинг↑ ωхр ↓ q(+) ↓ φн ↑ φв ↓
Якщо інгібітор є горючою речовиною:
φинг↑ ωхр ↓ q(+) ↓ φн ↑ φв ↓
Якщо інгібітор є горючою речовиною:
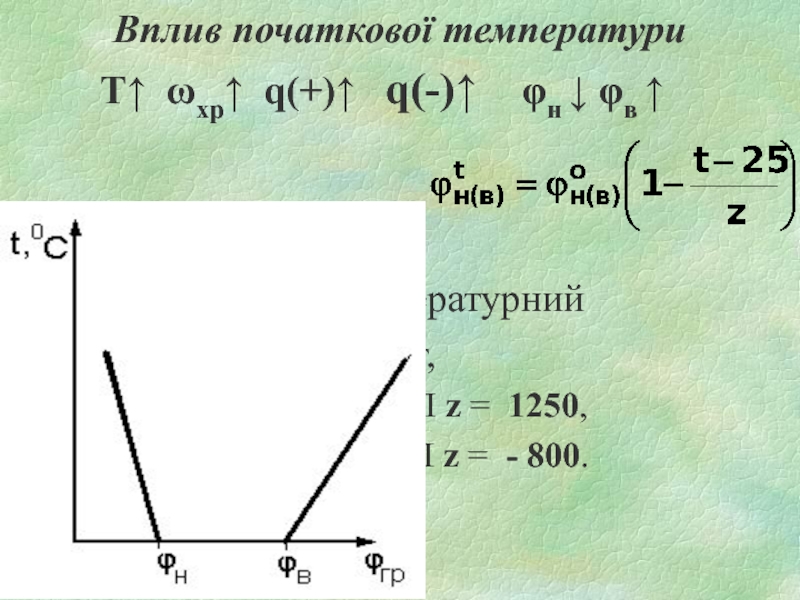
Слайд 20Вплив початкової температури
Т↑ ωхр↑ q(+)↑ q(-)↑ φн ↓
φв ↑
z – температурний
коефіцієнт,
для НКМПП z = 1250,
для ВКМПП z = - 800.
z – температурний
коефіцієнт,
для НКМПП z = 1250,
для ВКМПП z = - 800.
Слайд 24Безпечні концентраційні межі поширення полум'я: φонб < 0,9(φон - 0,21), % φовб >1,1(φов
+ 0,42), %
БК - область безпечних концентрацій
НК - область небезпечних концентрацій
ВНК - область вибухонебезпечних концентрацій
ВБК, ПНК - область вибухобезпечних, але
пожежонебезпкечних концентрацій
Слайд 254. Практичне значення КМПП
1. Для порівняльної оцінки пожежної небезпеки декількох речовин.
Найбільш пожежо- та вибухонебезпечними є речовини, які мають більш широкий діапазон вибухонебезпечних концентрацій.
2. Для оцінки пожежної небезпеки фактичної концентрації горючої речовини.
φфакт< φнб - безпечна концентрація
φнб< φфакт< φн - небезпечна концентрація
φн< φфакт< φв - вибухонебезпечна конц-ція
φв< φфакт< φвб - небезпечна концентрація
φфакт > φв - вибухобезпечна, але пожежонебезпечна концентрація
Слайд 263. Для визначення вибухобезпечних робочих концентрацій горючої речовини всередині технологічного обладнання:
φроб< φнб, φроб > φвб .
4. При розробці заходів щодо забезпечення пожежної небезпеки вентиляційних систем, для розрахунку гранично допустимих безпечних концентрацій газів:
φбез< φнб.
Слайд 27Завдання на самопідготовку:
Вивчити матеріал
1. Демидов, Шандыба, Щеглов. - Горение и свойства
горючих веществ, стор. 85-104.
2. Демидов, Саушев. - Горение и свойства горючих веществ, стор. 152-181.
2. Демидов, Саушев. - Горение и свойства горючих веществ, стор. 152-181.















![Вплив тискуω хр ~ [kгр]n [kок]m, де k=р2/р1Р ↑ ωхр↑ q(+) ↑ φн ↓ φв ↑](/img/tmb/4/317588/f3f0cdf3ba58ae666568e7619a1a6326-800x.jpg)