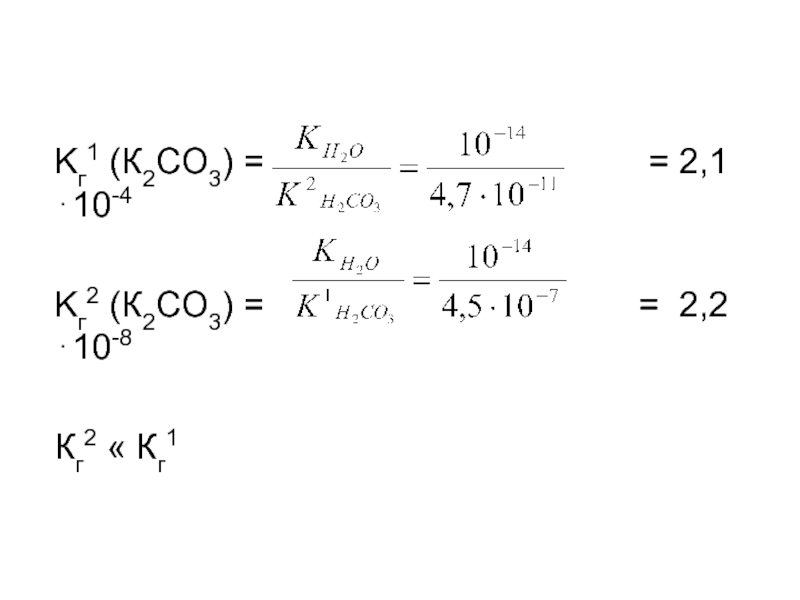- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фото презентация
Содержание
- 1. Фото
- 2. РАСТВОРЫ СОСТОЯНИЕ ОТДЕЛЬНЫХ КОМПОНЕНТОВ ГОРНЫХ ПОРОД В РАСТВОРАХ
- 3. Классификация дисперсных систем. Растворы, их характеристики. Вода.
- 4. Дисперсные системы Дисперсные системы – гетерогенные системы,
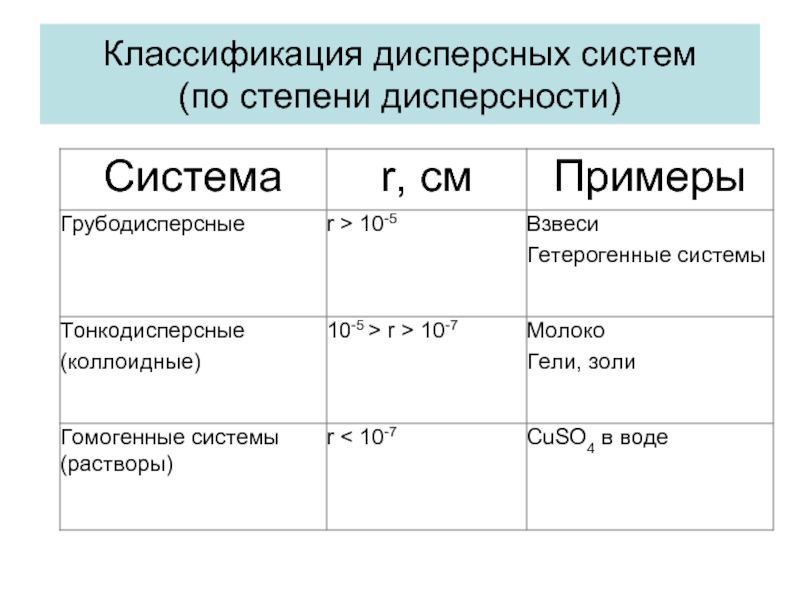
- 5. Классификация дисперсных систем (по степени дисперсности)
- 6. Классификация дисперсных систем (по агрегатному состоянию)
- 7. Туман (Ж-Г)
- 8. Истинные растворы в природе (Т-Ж)
- 9. Растворы Растворы - однофазные системы переменного состава, состоящие из двух и более компонентов
- 10. Растворитель - компонент, агрегатное состояние которого не
- 11. Вода как растворитель Н2О Покрывает примерно
- 12. Вода в атмосфере (облака)
- 13. Вода (лед) в атмосфере
- 14. Ледники
- 15. Реки, озера
- 16. Мировой океан
- 17. Вода – хороший растворитель для многих веществ.
- 18. Взаимная растворимость веществ
- 19. Растворимость газа в жидкости Г + Ж
- 20. Растворимость жидкости в жидкости Ж1 + Ж2
- 21. Растворимость твердого в-ва в жидкости Растворение -
- 23. Растворимость твердого в-ва в жидкости Опыт.
- 24. Растворимость твердого в-ва в жидкости ,
- 25. Растворимость твердого в-ва в жидкости ΔG =
- 26. Растворимость твердого в-ва в жидкости
- 27. Растворимость твердого в-ва в жидкости
- 28. Растворимость твердого в-ва в двух несмешивающихся жидкостях.
- 29. Характеристики растворов Ненасыщенные и насыщенные растворы Концентрированные
- 30. СВОЙСТВА РАСТВОРОВ
- 31. При изучении свойств растворов было открыто несколько
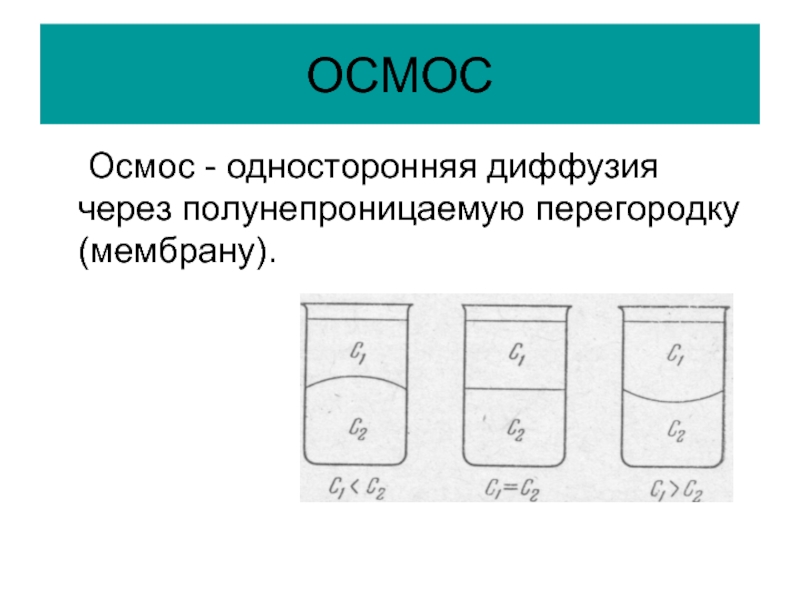
- 32. ОСМОС Осмос - односторонняя диффузия через полунепроницаемую перегородку (мембрану).
- 33. ОСМОС 1 – Сосуд с
- 34. ОСМОС Росм = ƒ(С,
- 35. Понижение давления пара растворителя над раствором
- 36. Понижение давления пара растворителя над раствором
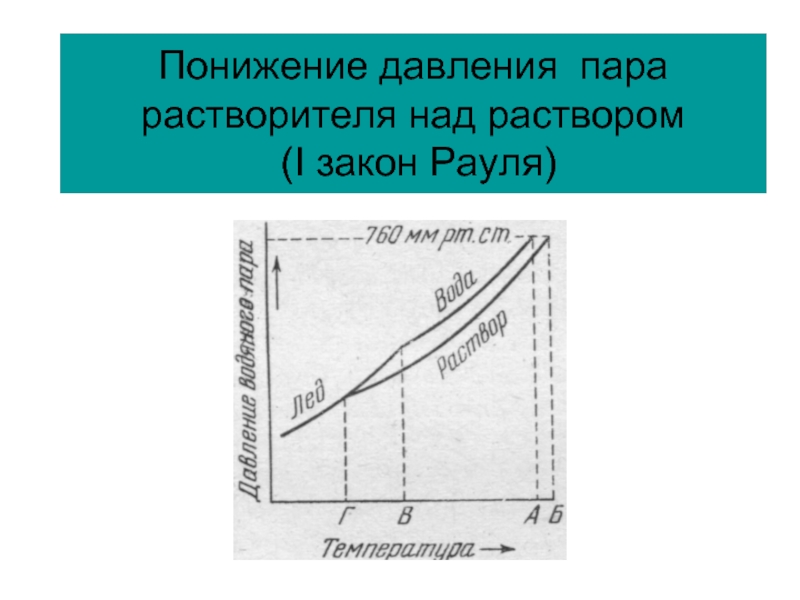
- 37. Понижение давления пара растворителя над раствором (I закон Рауля)
- 38. Понижение температуры замерзания и повышение температуры кипения
- 39. 1 моль вещества в 1000 г воды повышает tкип на 0,52К. Пример
- 40. Вывод Величины осмотического давления (Росм), понижения давления
- 41. Вещества по своим свойствам в растворах делятся
- 42. Поведение электролитов в растворах описывается теорией электролитической
- 43. НЕКОТОРЫЕ ХИМИЧЕСКИЕ И ФАЗОВЫЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- 44. Диссоциация и ионизация кислот и оснований
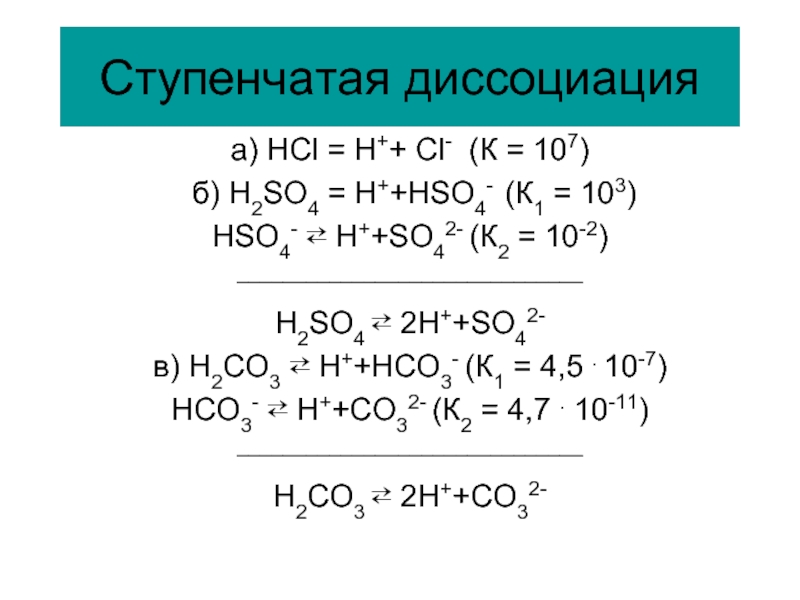
- 45. Ступенчатая диссоциация a) HCl = H++ Cl-
- 46. степень диссоциации электролитов α
- 47. степень диссоциации электролитов = 1 -
- 48. Пример HCl = H+ + Cl-
- 49. Кд слабых электролитов CH3COOH ⇄ H+
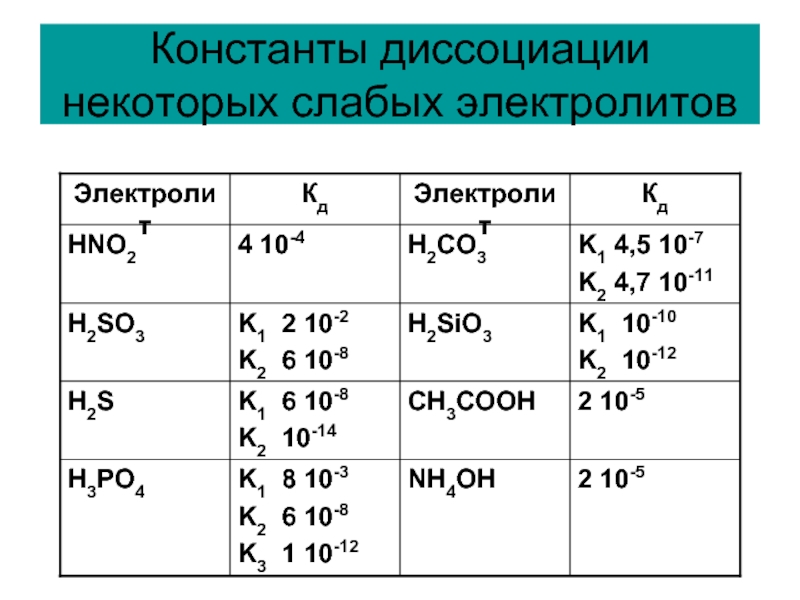
- 50. Константы диссоциации некоторых слабых электролитов
- 51. Состояние сильных электролитов в растворе Для
- 52. Состояние сильных электролитов в растворе
- 53. Состояние сильных электролитов в растворе Ионная
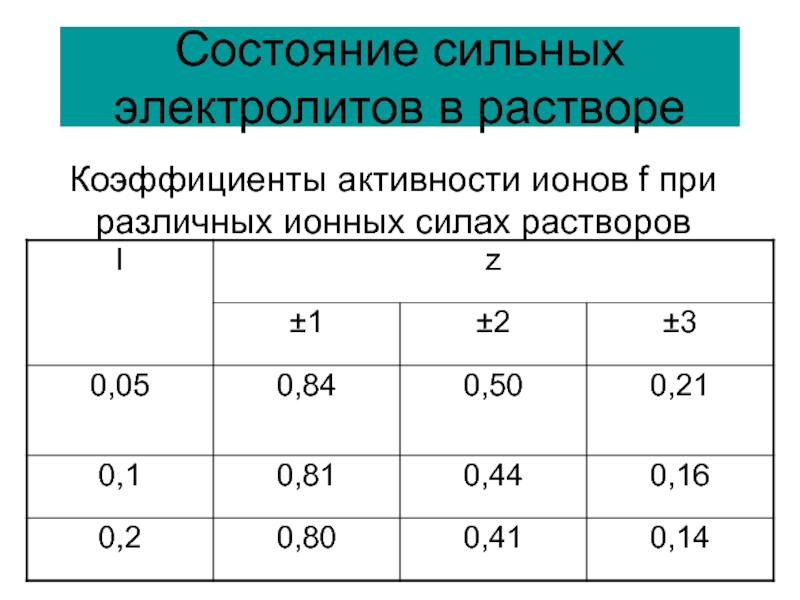
- 54. Состояние сильных электролитов в растворе Коэффициенты
- 55. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР). РАСТВОРЕНИЕ ГОРНЫХ ПОРОД
- 56. ПОНЯТИЕ О ПР
- 57. ПОНЯТИЕ О ПР
- 58. УСЛОВИЯ ОБРАЗОВАНИЯ И РАСТВОРЕНИЯ ОСАДКОВ В насыщенном
- 59. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ Для создания условий растворения
- 60. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ Опыт 1а «Связывание»
- 61. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ Опыт 1б «Связывание»
- 62. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ Опыт 2 «Связывание»
- 63. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ «Связывание» одного из ионов
- 64. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ Опыт 3 «Связывание» одного
- 65. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ Опыт 4a «Связывание» одного
- 66. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ Опыт 4б «Связывание» одного
- 67. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ Опыт 4в «Связывание» одного
- 68. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ Опыт 4в «Связывание» одного
- 69. УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВ Осадок образуется при создании условия перенасыщенного раствора
- 70. УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВ Пример 1. Имеется смесь
- 71. УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВ Пример 1. 1) Найдем
- 72. УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВ Пример 1. 2) Найдем
- 73. УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВ Пример 1. Вывод Так
- 74. Определение растворимости (s, моль/л) из величины
- 75. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН)
- 76. Вода - слабый электролит НОН ⇄
- 77. Вода - слабый электролит В воде
- 78. рН + рОН = 14
- 79. Индикаторы - вещества, изменяющие цвет при изменении среды (рН) раствора
- 80. ГИДРОЛИЗ СОЛЕЙ
- 81. Гидролиз - взаимодействие катионов или анионов соли
- 82. 1) HCl + NaOH ⇄ NaCl +
- 83. «Правила» гидролиза При гидролизе соли: на гидролиз
- 84. ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА Соль образована сильным
- 85. ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА 2. Соль
- 86. ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА 2. Соль
- 87. ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА 3. Соль
- 88. ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА 4. Соль
- 89. ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА Соль образована слабым
- 90. ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА Соль образована слабым
- 91. Особые случаи гидролиза 1) SbCl3 + HOH
- 92. Особые случаи гидролиза 1) 2Na2SiO3 + 2HOH
- 93. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ГИДРОЛИЗА Степень гидролиза h =
- 94. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ГИДРОЛИЗА Константа гидролиза
- 95. Связь между степенью гидролиза и константой гидролиза
- 96. Kг1 (К2СО3) =
- 97. Усиление гидролиза Na2CO3 + HOH ⇄ NaHCO3
- 98. Ослабление гидролиза Na2CO3 + HOH ⇄ NaHCO3
- 99. Взаимное усиление гидролиза 3Na2S + 2AlCl3 + 6HOH = 2Al(OH)3 + 3H2S + 6NaCl
Слайд 3Классификация дисперсных систем. Растворы, их характеристики. Вода. Растворение как физико-химический процесс.
Свойства растворов. Осмос, законы Рауля. Электролиты и неэлектролиты.
Теория электролитической диссоциации. Закон разбавления Оствальда. Состояние сильных электролитов в растворах.
Произведение растворимости, растворение горных пород. Водородный показатель. Гидролиз солей
План
Слайд 4Дисперсные системы
Дисперсные системы – гетерогенные системы, в которых в одном веществе
Слайд 9Растворы
Растворы - однофазные системы переменного состава, состоящие из двух и более
Слайд 10Растворитель - компонент, агрегатное состояние которого не меняется при образовании раствора.
В
Определения
Слайд 11Вода как растворитель
Н2О
Покрывает примерно ¾ поверхности Земли (примерно 1018 т),
90% вещества растений.
Слайд 17Вода – хороший растворитель для многих веществ.
Свойства воды:
уголковая молекула с ковалентными
полярные; ρ = 1 г/см3; Тпл = 00 С; Ткип=1000 С; молекулы
образуют межмолекулярные Н-связи.
Слайд 19Растворимость газа в жидкости
Г + Ж ⇄ раствор + Q
Принцип Ле Шателье:
увеличение р →; увеличение t ←
С = kp (закон Генри),
где C - концентрация газа в растворе; p - парциальное давление газа; k - коэффициент.
Слайд 20Растворимость жидкости в жидкости
Ж1 + Ж2 ⇄ раствор
Принцип Ле Шателье:
р – не влияет на равновесие; увеличение t → (как правило)
ограниченная и неограниченная р-римость,
несмешивающиеся жидкости,
«Подобное растворяется в подобном»
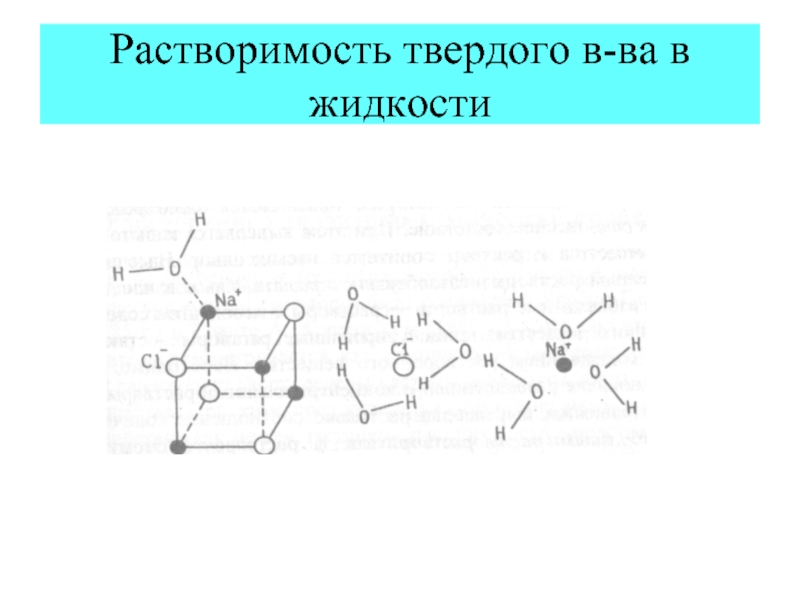
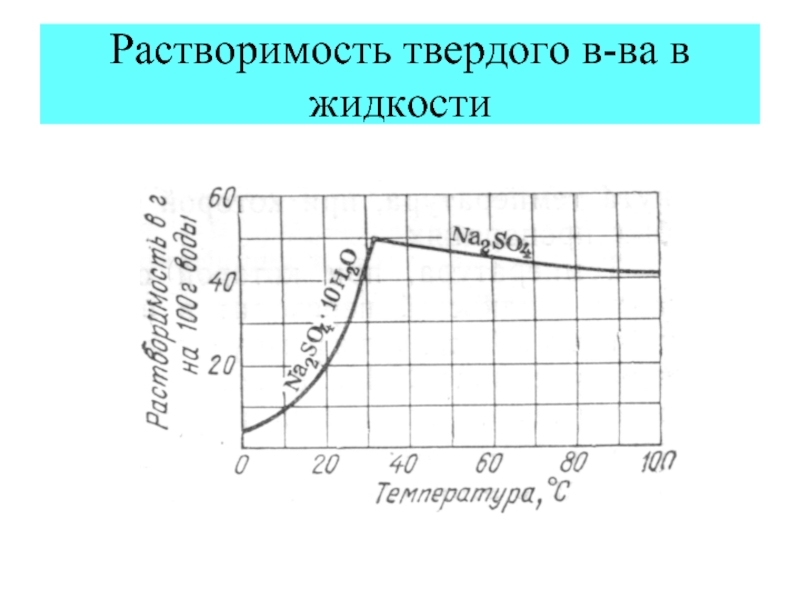
Слайд 21Растворимость твердого в-ва в жидкости
Растворение - физико-химический процесс, включающий в себя:
1)
2) сольватацию (гидратацию);
3) диффузию.
Слайд 23Растворимость твердого в-ва в жидкости
Опыт.
Образование кристаллогидрата сульфата меди(II)
CuSO4 – бесцветный;
CuSO4•5Н2О
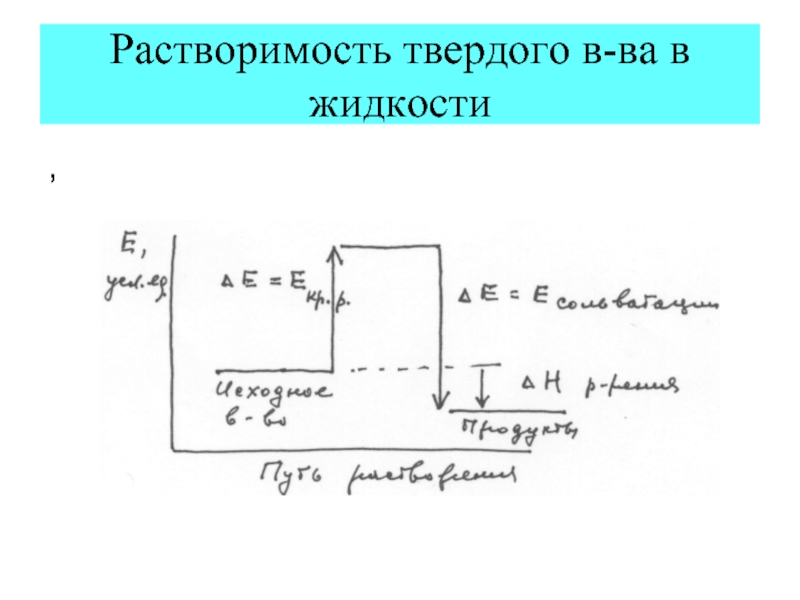
Слайд 25Растворимость твердого в-ва в жидкости
ΔG = ΔH - TΔS
При растворении ΔS
ΔH может быть или >0 или <0.
Чтобы растворение шло самопроизвольно (ΔG < 0), необходимо:
или (а) ΔH < 0, или (б) ΔH > 0, но при этом ⏐TΔS⏐ > ⏐ΔH⏐
Слайд 28Растворимость твердого в-ва в двух несмешивающихся жидкостях. Экстракция
K = С1/С2 (при
где К - коэффициент распределения
Опыт. Экстракция йода хлороформом
I2 - вода - хлороформ. К =130.
Следовательно, хлороформом можно экстрагировать йод из воды
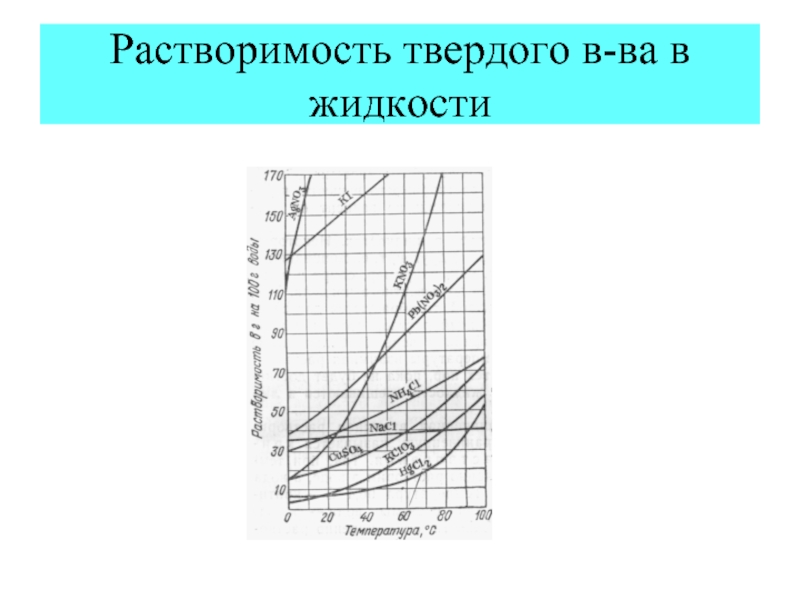
Слайд 29Характеристики растворов
Ненасыщенные и насыщенные растворы
Концентрированные и разбавленные растворы
Форма выражения концентрации:
Массовая доля
Молярная концентрация (М, См, моль/л)
Моляльная концентрация (m, моль/1000 г растворителя)
Нормальная концентрация (N, Сн, моль экв/л)
Мольная доля
Коэффициент растворимости (растворимость) (г/100 г воды)
Слайд 31При изучении свойств растворов было открыто несколько законов: осмотического давления, законы
Слайд 34
ОСМОС
Росм = ƒ(С, t0), Росм ≠ ƒ(природы в-ва и природы
Вант-Гофф (1886, Голландия)
для разбавленных растворов неэлектролитов
Росм = СМRT или РосмV = RT,
где СМ - мольная концентрация (моль/л);
R = 8,31 Дж/моль⋅К;
Т - температура, К;
Р - давление, кПа.
Слайд 35Понижение давления пара растворителя над раствором
(I закон Рауля)
р1 =
где
р1 - давление насыщ. пара над р-ром;
N1 - мольная доля р-рителя;
p0 - давление насыщ. пара над чистым р-рителем.
Слайд 36Понижение давления пара растворителя над раствором
(I закон Рауля)
Δр =
= N2p0 = р0
где: n1 - количество р-рителя; n2 - количество р-ренного в-ва; N2 - мольная доля в-ва
Слайд 38Понижение температуры замерзания и повышение температуры кипения раствора по сравнению с
tк(р-ль) - tк(р-р) = Δtкрист = Km
K - криоскопическая постоянная;
m - моляльная концентрация раствора (моль/1000 г р-рителя);
Δtкип = Em
E - эбулиоскопическая постоянная
Слайд 40Вывод
Величины осмотического давления (Росм), понижения давления насыщенного пара р-рителя над р-ром
Слайд 41Вещества по своим свойствам в растворах делятся на 2 группы:
а) вещества
б) вещества (электролиты), для растворов которых не выполняются законы Вант-Гоффа и Рауля; их растворы проводят электрический ток.
Слайд 42Поведение электролитов в растворах описывается теорией электролитической диссоциации
(повторить самостоятельно, Н.Л.Глинка.
Слайд 45Ступенчатая диссоциация
a) HCl = H++ Cl- (К = 107)
б) H2SO4
HSO4- ⇄ H++SO42- (К2 = 10-2)
______________________________
H2SO4 ⇄ 2H++SO42-
в) H2СO3 ⇄ H++HСO3- (К1 = 4,5 . 10-7)
HСO3- ⇄ H++СO32- (К2 = 4,7 . 10-11)
______________________________
H2СO3 ⇄ 2H++СO32-
Слайд 46степень диссоциации электролитов
α - степень диссоциации;
n - число диссоциированных молекул;
N
0<α<1
Слайд 47степень диссоциации электролитов
= 1 - сильные электролиты (щелочи, HCl, HNO3,
α < 1 - слабые электролиты (HNO2, H2SO3, H2S, H3PO4, органические кислоты, HCN, NH4OH).
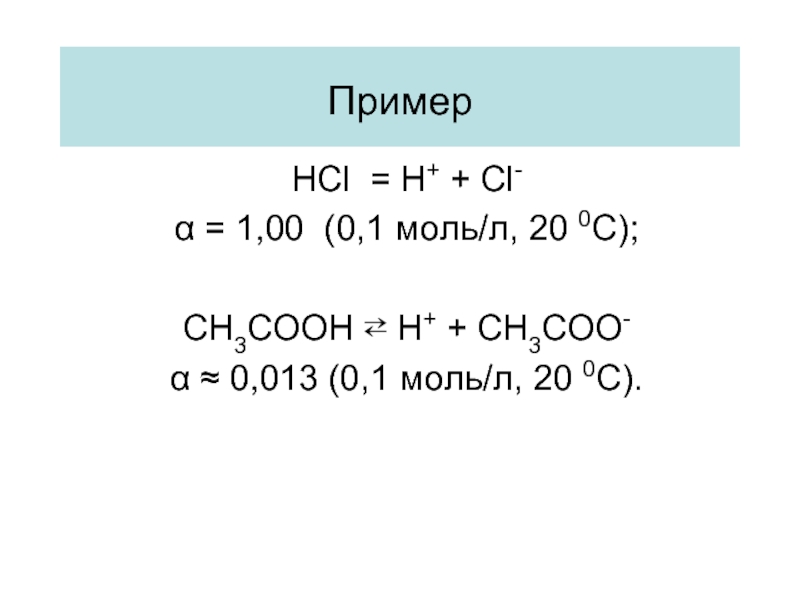
Слайд 48Пример
HCl = H+ + Cl-
α = 1,00 (0,1 моль/л, 20
CH3COOH ⇄ H+ + CH3COO-
α ≈ 0,013 (0,1 моль/л, 20 0С).
Слайд 51Состояние сильных электролитов в растворе
Для сильных электролитов αэкс • 1.
Причина - взаимное влияние (тормозящее действие) положительно и отрицательно заряженных ионов.
Слайд 52
Состояние сильных электролитов в растворе
Активность - эффективная (условная) концентрация электролита,
а = ƒС
а - активность; ƒ - коэффициент активности.
Коэффициент активности f зависит от ионной
силы раствора (I) и заряда ионов (z).
Слайд 53Состояние сильных электролитов в растворе
Ионная сила раствора
I = 0,5 (С1z12
Пример. Ионная сила раствора, содержащего 0,1 моль/л NaCl и 0,1 моль/л ВaCl2.
I = 0,5 (0,1• 12 + 0,1 • 22 + 0,3 • (-1)2) = 0,4
Слайд 54Состояние сильных электролитов в растворе
Коэффициенты активности ионов f при различных
Слайд 57
ПОНЯТИЕ О ПР
AgCl(тв) ⇄ Ag+ (р-р) + Cl- (р-р)
По
Кр = ;
[AgCl] ≈ Const ⇒ ПР(AgCl) = Кр [AgCl] = [Ag+][Cl-]
В общем виде:
АаВв (тв) ⇄ аАв+ (р-р) + вВа- (р-р)
ПР(АаВв) = [Ав+]а[Ва-]в
Слайд 58УСЛОВИЯ ОБРАЗОВАНИЯ И РАСТВОРЕНИЯ ОСАДКОВ
В насыщенном р-ре: [Ag+][Cl-] =
В ненасыщенном р-ре: [Ag+][Cl-] < ПР(AgCl)
В пересыщенном р-ре: [Ag+][Cl-] > ПР(AgCl)
Слайд 59УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
Для создания условий растворения осадка (получения ненасыщенного раствора) необходимо
Слайд 60УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
Опыт 1а
«Связывание» одного из ионов в слабый электролит
Mg(OH)2(тв)
Mg(OH)2↓ + 2NH4+ + 2Cl- → Mg2+ + 2Cl- + 2NH4OH
Слайд 61УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
Опыт 1б
«Связывание» одного из ионов в слабый электролит
Fe(OH)3↓
Fe(OH)3↓ + 3Н+ + 3Сl- → Fe3+ + 3Cl- + 3H2O
Слайд 62УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
Опыт 2
«Связывание» одного из ионов в газообразное вещество
CaCO3
CO32- + 2H+ → CO2↑ + H2O
CaCO3↓ + 2HCl → CaCl2 + CO2↑ + H2O
Слайд 63УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
«Связывание» одного из ионов в газообразное вещество
FeS ⇄ Fe2+
S2- + 2H+ → H2S↑
FeS↓ + 2HCl → FeCl2 + H2S↑
Слайд 64УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
Опыт 3
«Связывание» одного из ионов в комплексное соединение с
AgCl ⇄ Ag+ + Cl-
Ag+ + 2NH3 → [Ag(NH3)2]+
AgCl↓ + 2NH3 → [Ag(NH3)2]Cl
Раствор
Слайд 65УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
Опыт 4a
«Связывание» одного из ионов в менее растворимое соединение
Ag2CrO4 ⇄ 2Ag+ + CrO42-;
коричневый
ПР(Аg2CrO4) = 4,4⋅10-12;
[Аg+]* = 2s = ≈ 2⋅10-4 моль/л
ПР = (2s)2⋅s = 4s3; s = .
Слайд 66УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
Опыт 4б
«Связывание» одного из ионов в менее растворимое соединение
AgCl ⇄ Ag+ + Cl-;
белый
ПР(AgCl) = 1,73⋅10-10;
[Аg+] = = 1,3⋅10-5 моль/л
Слайд 67УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
Опыт 4в
«Связывание» одного из ионов в менее растворимое соединение
Ag2S ⇄ 2Ag+ + S2-;
черный
ПР(Ag2S) = 6⋅10-50;
[Аg+] = 2s ≈ 2⋅10-17 моль/л
Слайд 68УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
Опыт 4в
«Связывание» одного из ионов в менее растворимое соединение
Результат:
Ag2CrO4↓ → AgCl↓ → Ag2S↓
Слайд 70УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВ
Пример 1.
Имеется смесь BaCl2 и CaCl2 с концентрацией обеих
Слайд 71УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВ
Пример 1.
1) Найдем [SO42-], необходимую для образования осадка ВaSO4
ПР(BaSO4) • [Ba2+][SO42-].
[SO42-] > = ≈ 10-9 (моль/л)
Слайд 72УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВ
Пример 1.
2) Найдем [SO42-], необходимую для образования осадка СaSO4
ПР(СaSO4) • [Сa2+][SO42-]
[SO42-] > = = 1,3⋅10-3(моль/л)
Слайд 73УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВ
Пример 1.
Вывод
Так как [SO42-] для образования осадка СаSO4 должна
Слайд 74Определение растворимости
(s, моль/л) из величины ПР
1) AgCl ⇄ Ag+ +
s s s
ПР(AgCl ) = [Ag+][Cl-] = s⋅s = s2; s =
2) Ag2CrO4 ⇄ 2Ag+ + CrO42-
s 2s s
ПР(Ag2CrO4) = [Ag+]2[CrO42-] = (2s)2⋅s = 4s3;
s = .
Слайд 76Вода - слабый электролит
НОН ⇄ Н+ + ОН-
Кр =
[Н2О] ≈ С(Н2О) = = 55,55 моль/л
Кр⋅[Н2О] =Кw = [Н+][ОН-]
(ионное произведение воды);
= 1⋅10-14; = -lg = 14.
Слайд 77Вода - слабый электролит
В воде [Н+] = [ОН-] =
Водородный показатель:
рН = -lg [Н+] = -lg 10-7 = 7.
Слайд 81Гидролиз - взаимодействие катионов или анионов соли (или тех и других)
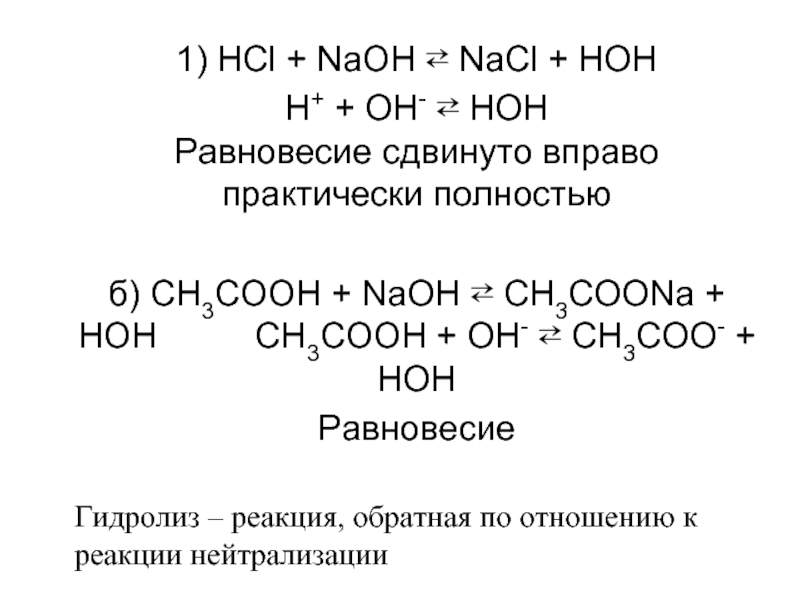
Слайд 821) HCl + NaOH ⇄ NaCl + HOH
H+ + OH- ⇄
б) CH3COOH + NaOH ⇄ CH3COONa + HOH CH3COOH + OH- ⇄ CH3COO- + HOH
Равновесие
Гидролиз – реакция, обратная по отношению к реакции нейтрализации
Слайд 83«Правила» гидролиза
При гидролизе соли:
на гидролиз одного иона приходится одна молекула воды;
в
Слайд 84ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА
Соль образована сильным основанием и сильной кислотой
Na2SO4 +
2Na+ + SO42- + HOH ⇄
Гидролиз не идет, слабый электролит не образуется.
Среда нейтральная, рН = 7
Слайд 85ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА
2. Соль образована слабым основанием и сильной
NH4Cl + HOH ⇄ NH4OH + HCl
NH4+ + Cl- + HOH ⇄ NH4OH + H+ + Cl-
NH4+ + HOH ⇄ NH4OH + H+
Гидролиз идет
Среда кислая, рН < 7
Слайд 86ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА
2. Соль образована слабым основанием и сильной
Al2(SO4)3 + HOH ⇄ 2AlOHSO4 + H2SO4
2Al3+ + 3SO42- + 2HOH ⇄ 2AlOH2+ + 2H+ + 3SO42-
Al3+ + HOH ⇄ AlOH2+ + H+
Гидролиз идет
Среда кислая, рН < 7
Слайд 87ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА
3. Соль образована сильным основанием и слабой
Na2CO3 + HOH ⇄ NaHCO3 + NaOH
2Na+ + CO32- + HOH ⇄ HCO3- + 2Na+ + OH-
CO32- + HOH ⇄ HCO3- + OH-
Гидролиз идет
Среда щелочная, рН > 7
Слайд 88ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА
4. Соль образована слабым основанием и слабой
4.1 Соль не растворима в воде
CuS + HOH ⇄
Гидролиз не идет
Слайд 89ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА
Соль образована слабым основанием и слабой кислотой
4.2 Соль
Al2S3 + 6HOH ⇄ 2Al(OH)3↓ + 3H2S↑
Гидролиз идет полностью, до конца
Слайд 90ЧЕТЫРЕ СЛУЧАЯ ГИДРОЛИЗА
Соль образована слабым основанием и слабой кислотой
4.3 Соль
(NH4)2CO3 + HOH ⇄ NH4HCO3 + NH4OH
2NH4+ + CO32- + HOH ⇄ HCO3- + NH4OH + NH4+
б) NH4HCO3 + HOH ⇄ H2CO3 + NH4OH
NH4+ + HCO3- + HOH ⇄ H2CO3 + NH4OH
Гидролиз идет по ступеням,полностью, до конца, среда примерно нейтральная, рН около 7
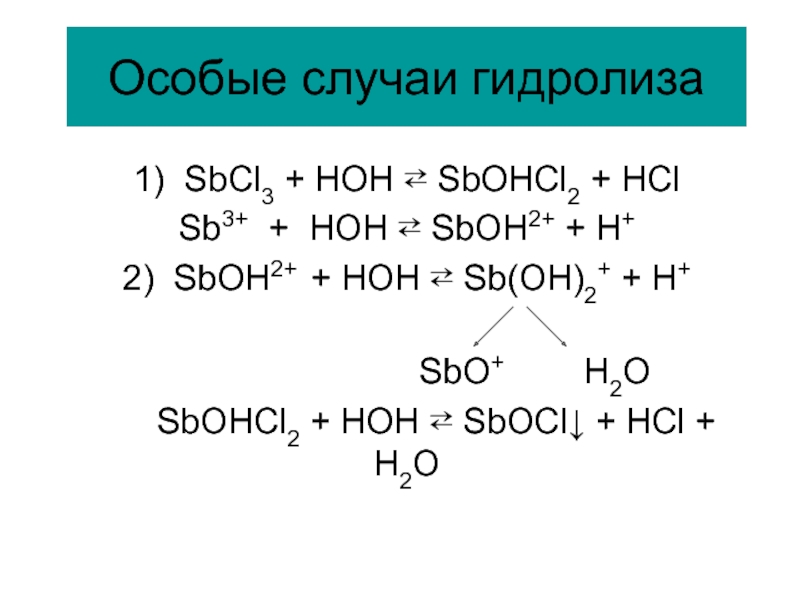
Слайд 91Особые случаи гидролиза
1) SbCl3 + HOH ⇄ SbOHCl2 + HCl
Sb3+ +
2) SbOH2+ + HOH ⇄ Sb(OH)2+ + H+
SbO+ H2O
SbOHCl2 + HOH ⇄ SbOCl↓ + HCl + H2O
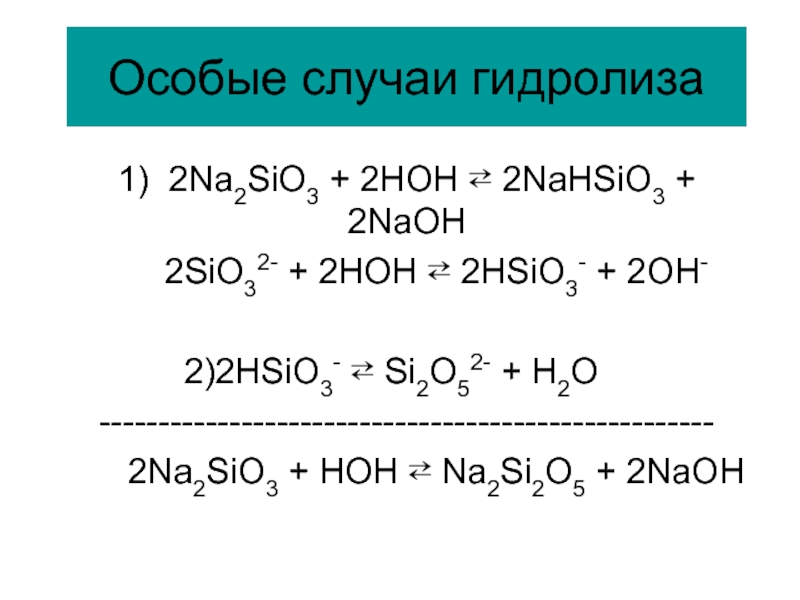
Слайд 92Особые случаи гидролиза
1) 2Na2SiO3 + 2HOH ⇄ 2NaHSiO3 + 2NaOH
2HSiO3- ⇄ Si2O52- + H2O
----------------------------------------------------
2Na2SiO3 + HOH ⇄ Na2Si2O5 + 2NaOH
Слайд 97Усиление гидролиза
Na2CO3 + HOH ⇄ NaHCO3 + NaOH
2Na+ + CO32- +
CO32- + HOH ⇄ HCO3- + OH-
- разбавление;
- нагревание
Опыт. Гидролиз FeCl3 при нагревании
Слайд 98Ослабление гидролиза
Na2CO3 + HOH ⇄ NaHCO3 + NaOH
2Na+ + CO32- +
CO32- + HOH ⇄ HCO3- + OH-
- добавление щелочи (кислоты)













































![УСЛОВИЯ ОБРАЗОВАНИЯ И РАСТВОРЕНИЯ ОСАДКОВВ насыщенном р-ре: [Ag+][Cl-] = ПР(AgCl) В ненасыщенном р-ре: [Ag+][Cl-]](/img/tmb/2/177479/c9fc1e066c17bb52ebfc284da09f8201-800x.jpg)












![УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВПример 1.1) Найдем [SO42-], необходимую для образования осадка ВaSO4 из 0,1М р-ра BaCl2. ПР(BaSO4)](/img/tmb/2/177479/f64dd28291c4ff1ce43817b74b1655db-800x.jpg)
![УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВПример 1.2) Найдем [SO42-], необходимую для образования осадка СaSO4 из 0,1М раствора СaCl2. ПР(СaSO4)](/img/tmb/2/177479/c1a3ae14fba5ba76a4a611029d6c81b5-800x.jpg)
![УСЛОВИЯ ОБРАЗОВАНИЯ ОСАДКОВПример 1.ВыводТак как [SO42-] для образования осадка СаSO4 должна быть в 106 раз](/img/tmb/2/177479/30c047e04d9b562426ef9ef25bbb0fbb-800x.jpg)



![Вода - слабый электролит В воде [Н+] = [ОН-] = = 10-7 моль/л. Водородный](/img/tmb/2/177479/2ef161e704834c47b8564c4344b4bffe-800x.jpg)