- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты. Использование ферментов человеком презентация
Содержание
- 1. Ферменты. Использование ферментов человеком
- 2. План лекции Ферменты – биологические катализаторы. Отличительные
- 3. Использование ферментов человеком Сыроварение Дубление кожи Хлебопечение
- 4. Значение брожения для приготовления и сохранения пищи
- 5. ХVII век Жан Баптист ван Гельмонт (Jan
- 6. XIX век. «Организованными ферментами» (от латинского fermentum — закваска)»
- 7. Эдуард Бухнер (20 мая 1860- 13
- 8. ХХ век Впервые высокоочищенный кристаллический фермент (уреазу)
- 9. Рибозимы Каталитическую активность РНК в 1980-х годах
- 10. Определение Катализаторы – это вещества, которые влияют
- 11. Общие свойства ферментов и небиологических катализаторов:
- 12. Отличительные признаки ферментативного катализа: Скорость ферментативного катализа
- 13. Специфичность действия Под субстратной специфичностью понимают способность
- 14. Процесс катализа можно представить следующим уравнением: E
- 15. Энергетический механизм ферментативной и неферментативной реакции Катализ
- 16. Природа катализа В реакцию вступают молекулы, преодолевшие
- 17. Теории ферментативного катализа Образование фермент-субстратного комплекса согласно
- 18. Индуцированное соответствие при функционировании гексокиназы (подтвеождение гипотезы Д. Кошланда)
- 19. Номенклатура и классификация ферментов была принята в
- 20. Название ферментов В соответствии с классификацией ферментов
- 21. Оксидоредуктазы катализируют реакции окисления-восстановления: Лактатдегидрогеназа
- 22. Трансферазы Катализируют реакции переноса групп с одной
- 23. Гидролазы (фосфатазы, эстеразы, фосфолипазы) Катализируют реакции
- 24. ЛИАЗЫ (альдолазы, гидратазы-дегидратазы, синтазы, декарбоксилазы)
- 25. ИЗОМЕРАЗЫ (рацемазы, эпимеразы, мутазы)
- 26. Лигазы Катализируют реакции присоединения с образованием ковалентной
- 27. Номенклатура ферментов По классификации ферментов (КФ- русскоязычная,
- 28. Подклассы ферментов Внутри каждого класса происходит разделение
- 29. Подподклассы ферментов Внутри каждого подкласса
- 30. Четвертая цифра – номер фермента Последнее
- 31. Строение ферментов По своему химическому строению почти
- 32. Активный центр Активный центр фермента – это
- 33. Контактная («якорная) площадка обеспечивает специфическое сродство к
- 34. В образовании фермент-субстратных комплексов участвуют водородные, электростатические
- 35. Активный центр в сериновых протеазах. В
- 36. Аллостерический центр («Аллос» – другой, «Steros» -
- 37. Конформационные перестройки аллостерических ферментов Аллостерические взаимодействия играют
- 38. Строение сложных белков-ферментов Белковая часть фермента, называется
- 39. Структура цитохрома Р450 Активный центр простетическая группа Апофермент
- 40. Кофермент – термостабильное низкомолекулярное соединение, небелковая часть
- 41. Функции коферментов Участие в акте катализа Осуществление
- 42. Химическая природа коферментов К коферментам относят следующие
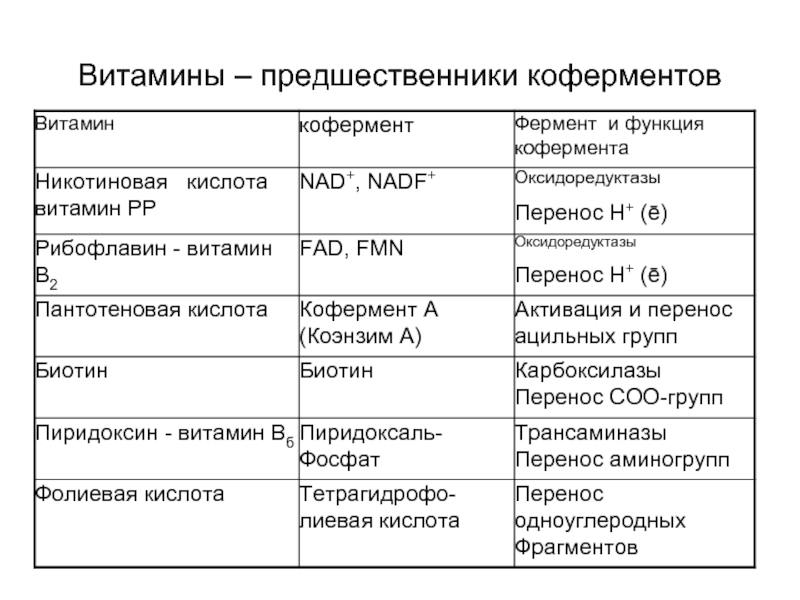
- 43. Витамины – предшественники коферментов
- 44. Изоферменты Изоферменты(изоэнзимы, изозимы) разные структурные формы ферментов,
- 45. Основы кинетики ферментативных реакций Кинетика ферментативных реакций
- 46. Единицы каталитической активности фермента Каталитическая активность
- 47. Полный математический анализ ферментативной реакции приводит к
- 48. Ферментативный процесс можно выразить следующим уравнением:
- 49. Зависимость скорости ферментативной реакции от концентрации субстрата
- 50. График уравнения Михаэлиса-Ментен График зависимости начальной скорости
- 51. Определение Vmax и Km При [S]
- 52. Определение Vmax затруднительно по асимптоте.
- 53. Термолабильность ферментов Температурный
- 54. Кислотность среды особенно важна для аминокислот активного
- 55. Зависимость активности ферментов от рН среды
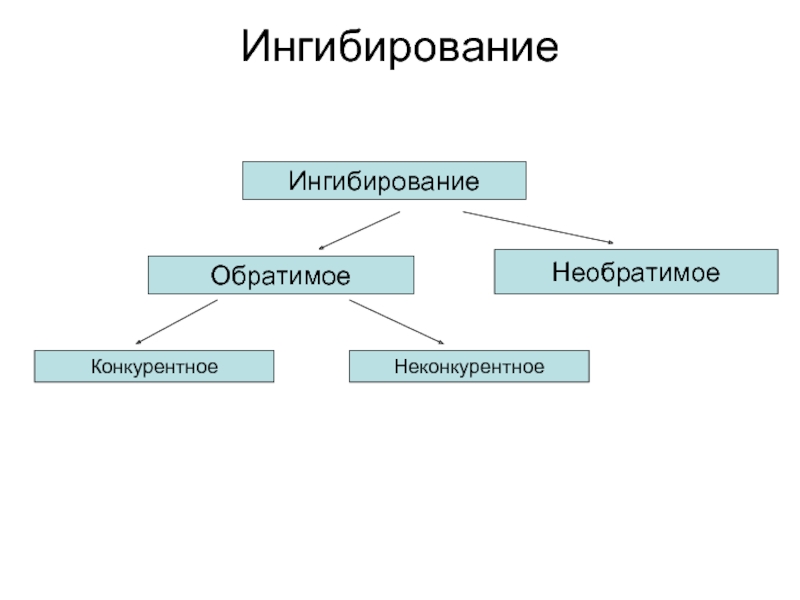
- 56. Ингибирование Ингибирование Обратимое Необратимое Конкурентное Неконкурентное
- 57. Необратимое ингибирование Ферменты являются белками, поэтому любые
- 58. Обратимое ингибирование Специфические ингибиторы вызывают обратимое ингибирование
- 59. Конкурентное ингибирование При конкурентном ингибировании ингибитор
- 60. Графики зависимости скорости ферментативной реакции от концентрации
- 61. Неконкурентное ингибирование Неконкурентное ингибирование вызывается веществами, не
- 62. Графики зависимости скорости ферментативной реакции от концентрации
- 63. Лекарственные препараты как ингибиторы Прозерин и
- 64. Регуляция активности ферментов Ковалентная модификация – частичный
- 65. Принципы энзимодиагностики Концентрация внутриклеточных (тканевых) ферментов в
- 66. Применение ферментных препаратов в медицине При заболеваниях
- 67. Будущее энзимологии Будущее энзимологии связано с развитием
Слайд 2План лекции
Ферменты – биологические катализаторы. Отличительные признаки ферментативного и химического катализа.
Природа катализа, теории ферментативного катализа
Классификация и номенклатура ферментов
Строение ферментов (активный и аллостерический центры)
Коферменты и кофакторы. Роль витаминов
Кинетика ферментативных реакций
Ингибирование ферментативных реакций
Регуляция активности ферментов
Принципы энзимодиагностики
Применение ферментов в медицине
Слайд 3Использование ферментов человеком
Сыроварение
Дубление кожи
Хлебопечение
Молочнокислые продукты
В Древнем Египте при строительстве пирамиды Хеопса
Слайд 4Значение брожения для приготовления и сохранения пищи
Обогащение пищи разнообразием вкусов,
Сохранение пищи с помощью молочной кислоты, алкоголя, уксусной кислоты и щелочного брожения
Биологическое обогащение пищи аминокислотами, жирными кислотами и витаминами
Детоксификация пищи в процессе брожения
Уменьшение времени и затрат на приготовление пищи
Слайд 5ХVII век
Жан Баптист ван Гельмонт (Jan Baptista van Helmont, 12 января
Слайд 6XIX век. «Организованными ферментами» (от латинского fermentum — закваска)» Луи Пастер называл живые
Луи Пастер (12 декабря 1822 – 28 сентября 1895)
Юстус Либих (1803—1873)
Слайд 7Эдуард Бухнер
(20 мая 1860-
13 августа 1917
Через два года после смерти
Слайд 8ХХ век
Впервые высокоочищенный кристаллический фермент (уреазу) выделил в 1926 году Джеймс
В 1930 г. Джон Нортроп получил кристаллический пепсин
В 1931 г. Нортроп и Кунитц получили кристаллический трипсин
В течение последующих 10 лет было выделено еще несколько ферментов, и белковая природа ферментов была окончательно доказана
В 1969 г. В лаборатории Б. Меррифилда был синтезирован первый фермент – рибонуклеаза, состоящая из 124 аминокислот. Искусственно синтезированный фермент не отличался от природной нуклеазы по химическим, каталитическим и иммунологическим тестам
Слайд 9Рибозимы
Каталитическую активность РНК в 1980-х годах впервые обнаружил Томас Роберт Чек
Удостоен Нобелевской премии (совместно с Сидни Олтменом) («for discovery of catalytic properties of RNA») в 1989 г.
Слайд 10Определение
Катализаторы – это вещества, которые влияют на скорость химической реакции, но
Ферменты, или энзимы, - это биологические катализаторы, образующиеся и функционирующие во всех живых организмах.
По своему химическому строению почти все ферменты являются белками.
Каталитически активные рибонуклеиновые кислоты называются рибозимами
Слайд 11
Общие свойства ферментов и небиологических катализаторов:
1) не входят в состав
2) ускоряют реакции, не противоречащие законам термодинамики.
3) не смещают положение равновесия, а лишь ускоряют его достижение.
Слайд 12Отличительные признаки ферментативного катализа:
Скорость ферментативного катализа выше, чем небиологического.
Ферменты обладают
3) Ферментативные процессы не дают побочных реакций, для них характерен 100% выход продукта.
4) Ферменты катализируют реакции в мягких условиях: при обычном давлении, небольшой температуре и значениях рН, близких к нейтральным.
5) Активность ферментов регулируется – они могут изменять свою скорость под воздействием ряда факторов, обеспечивая скоординированность всех метаболических процессов во времени.
Слайд 13Специфичность действия
Под субстратной специфичностью понимают способность фермента взаимодействовать с одним или
Различают:
абсолютную специфичность (глюкокиназа)
относительную (или групповую) специфичность (пепсин)
cтереохимическую специфичность: например, глюкозооксидаза окисляет только β-D-глюкозу
Слайд 14Процесс катализа можно представить следующим уравнением:
E + S ⇆ [ES] →
Стадии ферментативной реакции:
Сближение фермента и субстрата: E + S
Стабилизация переходного состояния: [ES]
Каталитическая реакция – превращение субстрата в продукт реакции –
[EР] → E + P
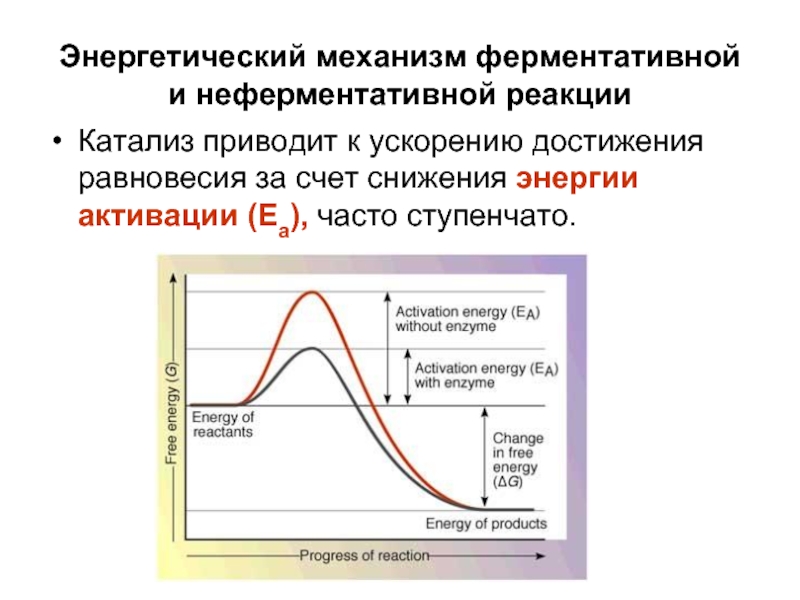
Слайд 15Энергетический механизм ферментативной и неферментативной реакции
Катализ приводит к ускорению достижения равновесия
Слайд 16Природа катализа
В реакцию вступают молекулы, преодолевшие энергетический барьер и обладающие энергией
В переходном состоянии [ES] происходит перераспределение химических связей и образование продуктов реакции.
Природа ферментативного катализа состоит в том, что ферменты с термодинамической точки зрения ускоряют химические реакции за счет снижения энергии активации.
Энергия активации – это та минимальная энергия, которая необходима для того, чтобы произошла химическая реакция, т.е. энергетический барьер преодолевают молекулы, обладающие энергией активации
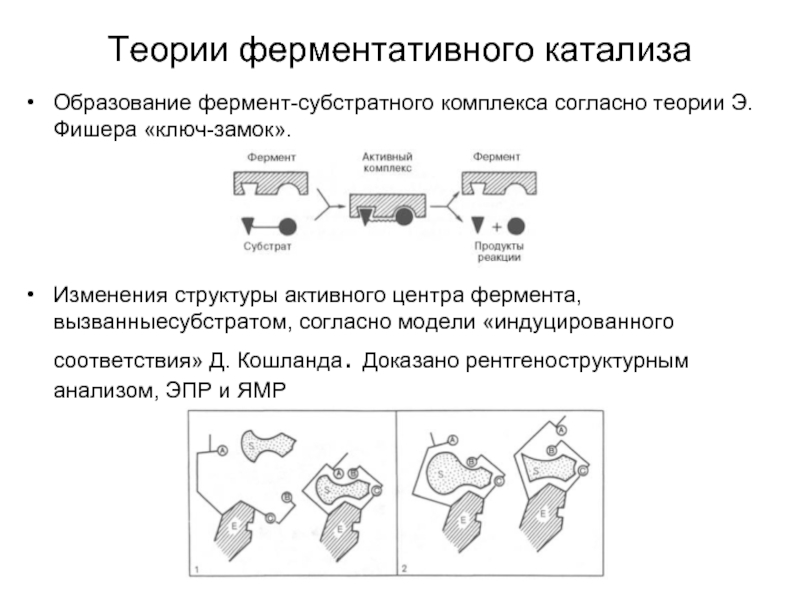
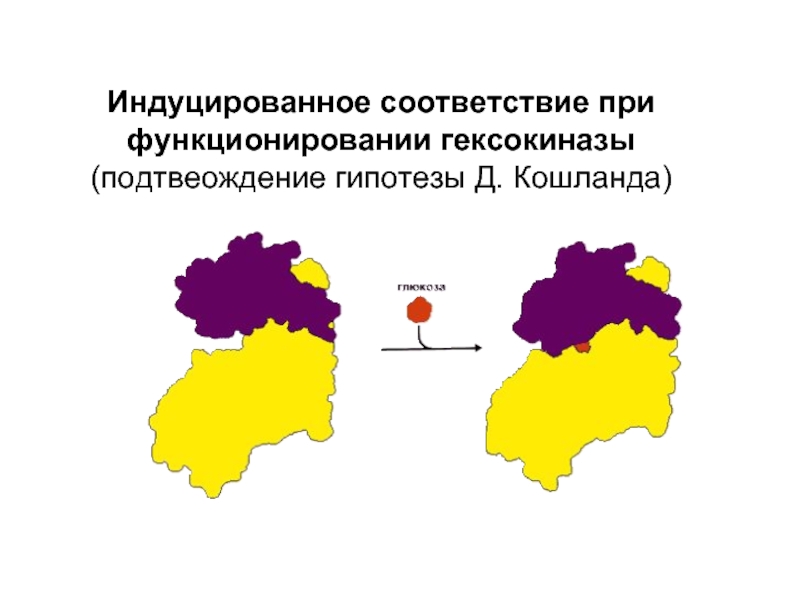
Слайд 17Теории ферментативного катализа
Образование фермент-субстратного комплекса согласно теории Э. Фишера «ключ-замок».
Изменения структуры
Слайд 18Индуцированное соответствие при функционировании гексокиназы (подтвеождение гипотезы Д. Кошланда)
Слайд 19Номенклатура и классификация ферментов была принята в 1961 г. после 6-летней
Оксидоредуктазы
Трансферазы
Гидролазы
Лиазы
Изомеразы
Лигазы
Слайд 20Название ферментов
В соответствии с классификацией ферментов каждый фермент получил систематической название:
название субстратов (через двоеточие), название типа химического превращения и окончания -аза). Например, лактатдегидрогеназа будет иметь систематическое название «L-лактат:NAD+ оксидоредуктаза»
На практике используют рабочие названия ферментов, которые состоят из названия субстрата, типа реакции и окончания «-аза». Например: ЛАКТАТ + ДЕГИДРОГЕНизация + АЗА = ЛАКТАТДЕГИДРОГЕНАЗА.
Некоторые ферменты сохранили исторически сложившиеся тривиальные названия, например УРЕАЗА, ПЕПСИН
Слайд 21Оксидоредуктазы
катализируют реакции окисления-восстановления:
Лактатдегидрогеназа (LDH, EC 1.1.1.27) катализирует превращение молочной
СН3СН(ОН)СООН + NAD+ ↔ CH3COCООH + NADH + H+
Слайд 22Трансферазы
Катализируют реакции переноса групп с одной молекулы на другую
Холинацетилтрансфераза, ЕС 2.3.1.6,
ацетил-КоА: холин О-ацетилтрансфераза)
СH3CO-S-KoA + HO-СН2-СН2-N+(CН3)3 → КоА-SH + СН3СОO-СН2-СН2-N+(CН3)3
Слайд 23Гидролазы (фосфатазы, эстеразы, фосфолипазы)
Катализируют реакции разрыва связей с присоединением воды
Дипептидаза расщепляет дипептид на две аминокислоты при участии воды:
H2N-CH(R)-CO-NH-CH(R')-COOH + H2O→H2N-CH(R)-COOH + NH2-CH(R')-COOH
Слайд 24ЛИАЗЫ (альдолазы, гидратазы-дегидратазы, синтазы, декарбоксилазы)
Катализируют реакции разрыва
Пируватдекарбоксилаза (ЕС 4.1.1.1, 2-кетокислоты карбокси-лиаза):
CH3COCООH → CH3COH + СО2
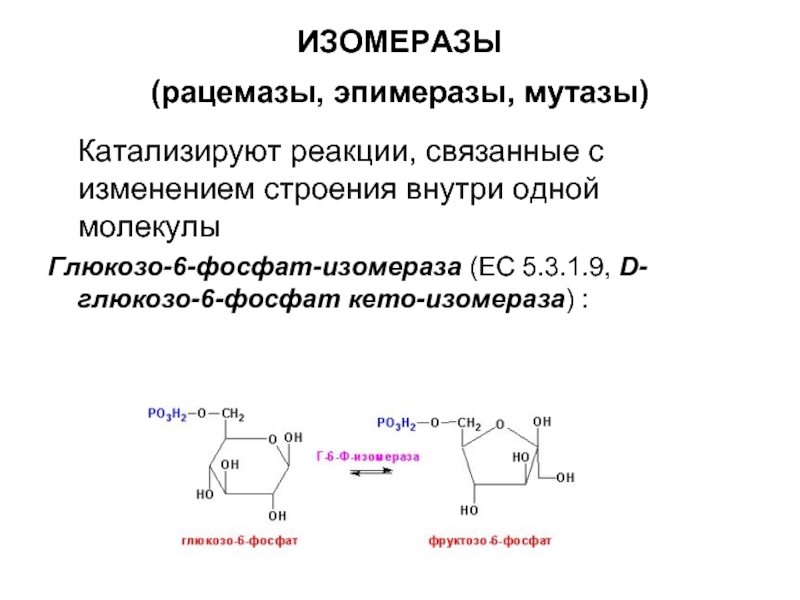
Слайд 25ИЗОМЕРАЗЫ
(рацемазы, эпимеразы, мутазы)
Катализируют реакции, связанные с изменением
Глюкозо-6-фосфат-изомераза (ЕС 5.3.1.9, D-глюкозо-6-фосфат кето-изомераза) :
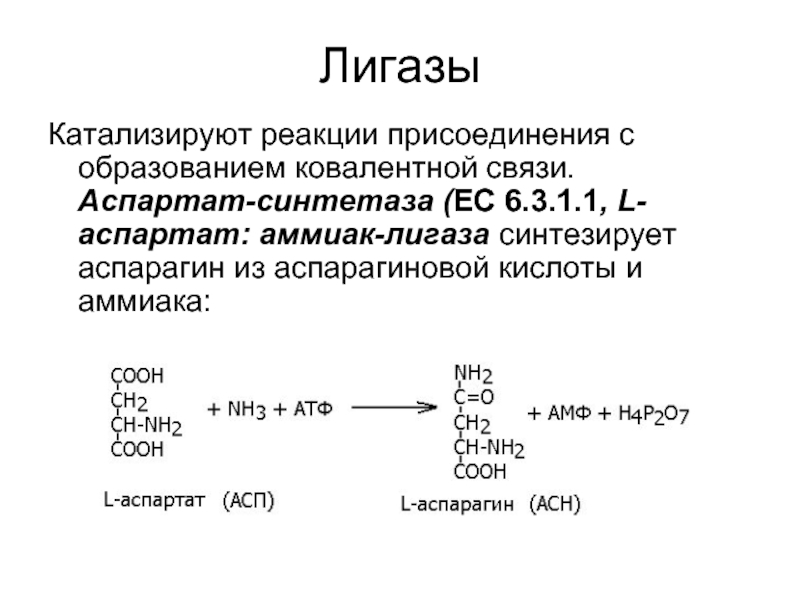
Слайд 26Лигазы
Катализируют реакции присоединения с образованием ковалентной связи. Аспартат-синтетаза (ЕС 6.3.1.1, L-аспартат:
Слайд 27Номенклатура ферментов
По классификации ферментов (КФ- русскоязычная, ЕС-англоязычная) каждый фермент (энзим) имеет
Слайд 28Подклассы ферментов
Внутри каждого класса происходит разделение на подклассы:
EC 1.1 Действующие на
EC 1.2 Действующие на альдегидные или оксо- группы донора
EC 1.3 Действующие на CH-СH группы донора
EC 1.4 Действующие на CH-NH2 группы донора
EC 1.5 Действующие на CH-NH группы донора
Фермент Лактатдегидрогеназа (LDH, EC 1.1.1.27) – это оксидоредуктаза окисляет гидроксильную группу в молекуле лактата, поэтому относится к 1 подклассу:
СН3СН(ОН)СООН + NAD+ → CH3COCООH + NADH + H+
Слайд 29Подподклассы ферментов
Внутри каждого подкласса происходит разделение на подподклассы:
EC 1.1.1
EC 1.1.2 Акцептор- цитохром
EC 1.1.3 Акцептор- кислород
EC 1.1.4 Акцептор- сульфид
EC 1.1.5 Акцептор- хинон или подобная группировка
Коферментом Лактатдегидрогеназы (LDH, EC 1.1.1.27) является НАД, поэтому этот фермент относится к 1 подподклассу:
СН3СН(ОН)СООН + NAD+ → CH3COCООH + NADH + H+
Слайд 30Четвертая цифра – номер фермента
Последнее число – номер конкретного фермента:
EC
EC 1.1.1.2 alcohol dehydrogenase (NADP+)
EC 1.1.1.3 homoserine dehydrogenase
EC 1.1.1.4 (R,R)-butanediol dehydrogenase
... и т. д.
У Лактатдегидрогеназы (LDH, EC 1.1.1.27) 27 порядковый номер в ряду ферментов 1 подподкласса
СН3СН(ОН)СООН + NAD+ → CH3COCООH + NADH + H+
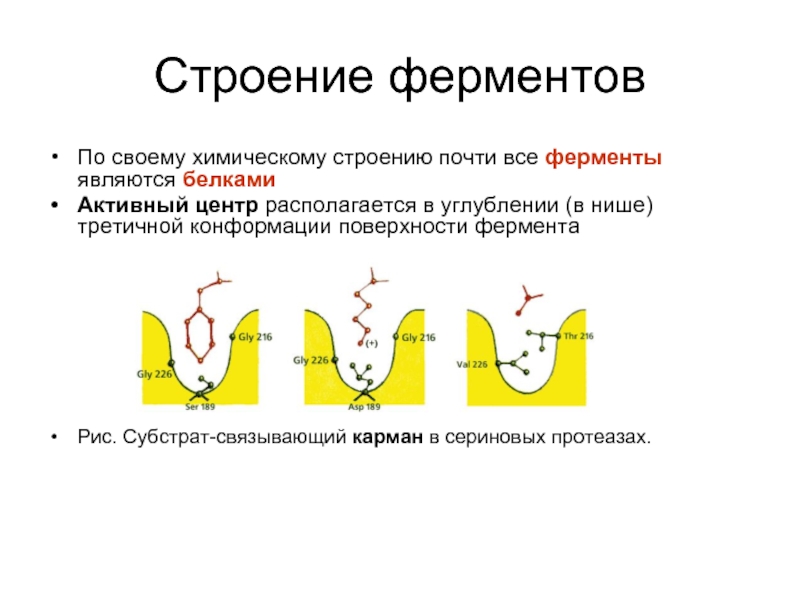
Слайд 31Строение ферментов
По своему химическому строению почти все ферменты являются белками
Активный
Рис. Субстрат-связывающий карман в сериновых протеазах.
Слайд 32Активный центр
Активный центр фермента – это уникальная комбинация аминокислот, благодаря которой
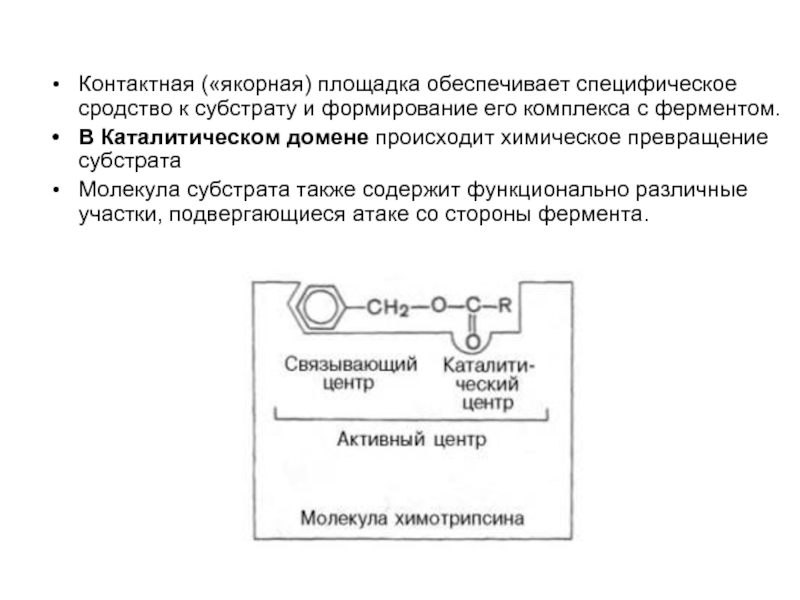
В активном центре выделяют 2 домена: «контактный», в котором происходит связывание и ориентация субстрата, и «каталитический», в котором происходит химическое превращение субстрата
Эти 2 домена могут перекрываться
У простых белков-ферментов активный центр образован радикалами аминокислот
У сложных белков-ферментов в активном центре находятся коферменты или кофакторы
Слайд 33Контактная («якорная) площадка обеспечивает специфическое сродство к субстрату и формирование его
В Каталитическом домене происходит химическое превращение субстрата
Молекула субстрата также содержит функционально различные участки, подвергающиеся атаке со стороны фермента.
Слайд 34В образовании фермент-субстратных комплексов участвуют водородные, электростатические (ионные) и гидрофобные взаимодействия,
Информация о природе связей между субстратом и связывающим участком активного центра фермента может быть получена методами ЭПР и ЯМР, а также методами УФ- и ИК-спектроскопии
Слайд 35
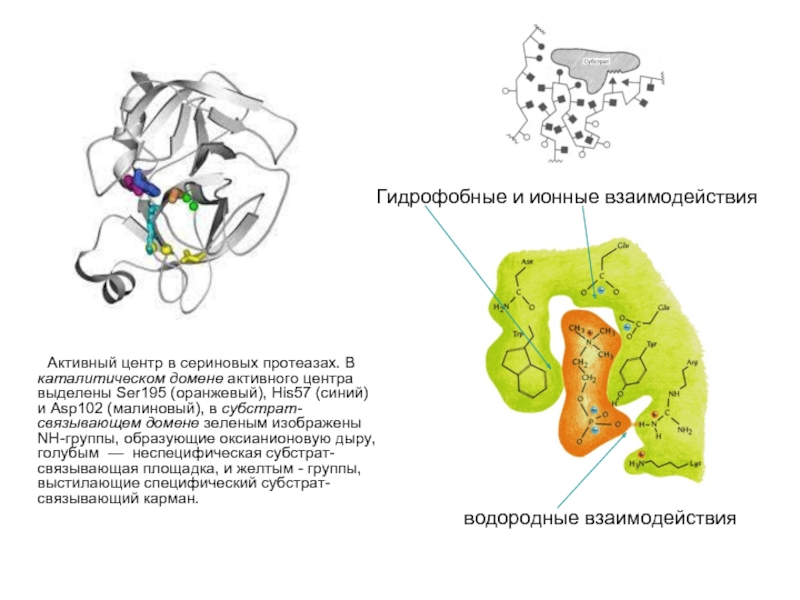
Активный центр в сериновых протеазах. В каталитическом домене активного центра выделены
Гидрофобные и ионные взаимодействия
водородные взаимодействия
Слайд 36Аллостерический центр («Аллос» – другой, «Steros» - пространственный), расположенный вдали от
Положительный эффектор ускоряет реакцию
Отрицательный эффектор замедляет реакцию
Ферменты, имеющие аллостерический центр, получили название аллостерических ферментов.
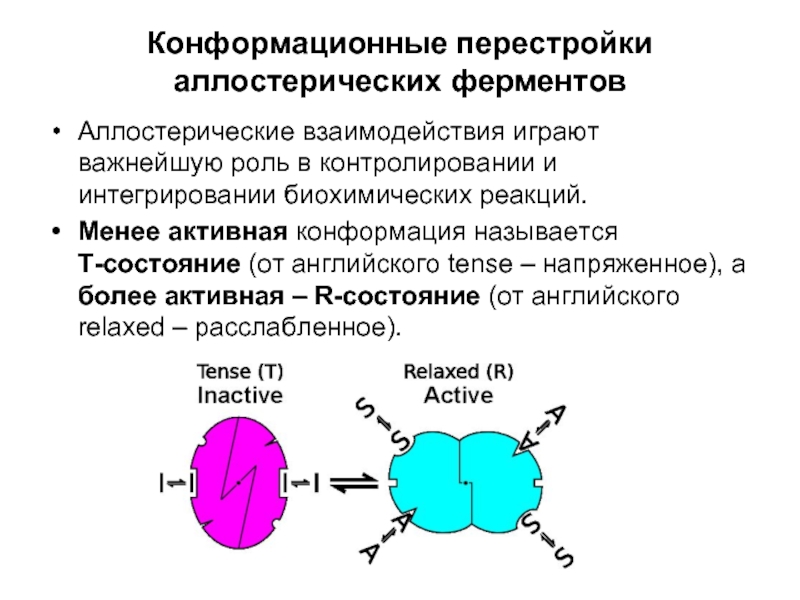
Слайд 37Конформационные перестройки аллостерических ферментов
Аллостерические взаимодействия играют важнейшую роль в контролировании и
Менее активная конформация называется Т-cостояние (от английского tense – напряженное), а более активная – R-состояние (от английского relaxed – расслабленное).
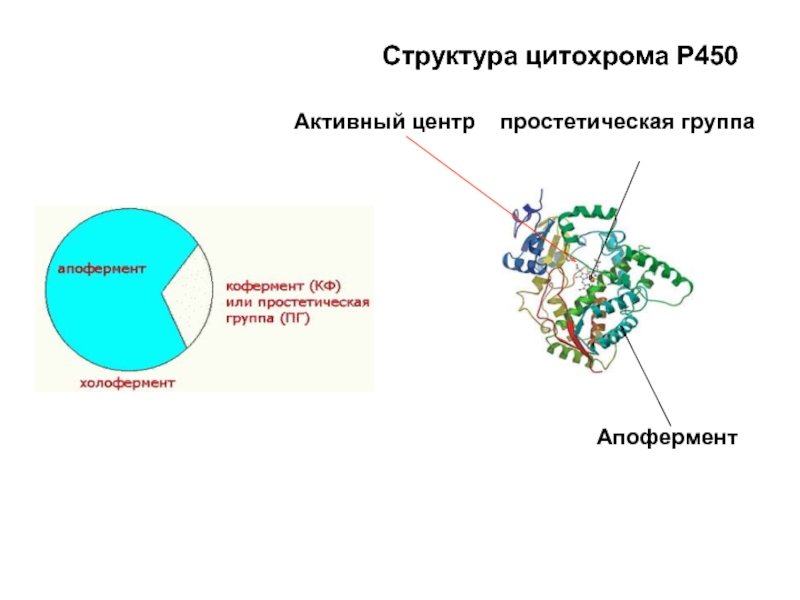
Слайд 38Строение сложных белков-ферментов
Белковая часть фермента, называется апоферментом
Небелковая часть сложного фермента, называется
Если КОФЕРМЕНТ прочно связан с апоферментом, его называют ПРОСТЕТИЧЕСКОЙ ГРУППОй
Природный комплекс апофермента с кофактором составляет ХОЛОФЕРМЕНТ, т. е. функционально действенный энзим. Соединение в ХОЛОФЕРМЕНТ осуществляется любыми типами связей, кроме ковалентных.
Апофермент синтезируется в организме
Большинство коферментов – это производные витаминов или содержат витамин в качестве компонента
Слайд 40Кофермент – термостабильное низкомолекулярное соединение, небелковая часть сложных белков-ферментов, без которых
Кофакторы - ионы некоторых металлов (Mg, Zn, Fe, Сu, Со, Mo и др.), прочно связанные с активным центром
Роль кофакторов – улучшение образования [ES]-комплекса, ориентация субстрата, стабилизация как субстрата, так и активного центра фермента
Слайд 41Функции коферментов
Участие в акте катализа
Осуществление связи между ферментом и субстратом
Стабилизация апофермента
Апофермент
Слайд 42Химическая природа коферментов
К коферментам относят следующие соединения:
Производные витаминов (пиридоксальфосфат)
Гемы, являющиеся простетической
Производные Нуклеотидов – доноры и акцепторы протона (Н+) – НАД, НАДН
Убихинон, или коQ
ФАФС – фосфоаденозилфосфосульфат донор сульфата
SAM – S-аденозилметионин донор метильной группы
Глутатион
Слайд 44Изоферменты
Изоферменты(изоэнзимы, изозимы) разные структурные формы ферментов, обладающие каталитической активностью одного типа;
Лактатдегидрогеназа имеет 5 изоформ; каждая форма (тетрамер) построена из 4 белковых субъединиц двух типов.
Слайд 45Основы кинетики ферментативных реакций
Кинетика ферментативных реакций – раздел энзимологии, который изучает
Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени
Кинетика ферментативных реакций определяется образованием фермент-субстратного комплекса:
E + S ⇆ [ES] → [ES] → E + P
Слайд 46Единицы каталитической активности фермента
Каталитическая активность ферментов выражается в каталах и международных
1 кат – это количество фермента, которое превращает в продукт 1 моль субстрата за 1 сек
МЕ фермента – это количество фермента, которое превращает в продукт 1 мкмоль субстрата за 1 мин
1 кат = 6 ∙ 107 МЕ или 1МЕ = 16,67 нкат
Удельная активность фермента – это количество единиц активности фермента в образце ткани, деленное на массу белка в этой ткани
Слайд 47Полный математический анализ ферментативной реакции приводит к сложным уравнениям, не пригодным
Наиболее удобной оказалась модель ферментативной реакции первого порядка (один субстрат), разработанная в 1913 году немецким химиком Леонором Михаэлисом (1875-1949) и канадским патологом Мо Ментеном (1879-1960)
E + S ⇆ [ES] → [ES] → E + P
Слайд 48Ферментативный процесс можно выразить следующим уравнением:
где k1 – константа скорости образования
k-1 – константа скорости обратной реакции
k2 – константа скорости образования продукта реакции
Соотношение констант скоростей называют константой Михаэлиса Кm:
km = (k-1 + k2)/k1 Скорость реакции пропорциональна концентрации [ES]
А скорость образования [ES] зависит от концентрации [S] и концентрации [Е]
Наибольшая скорость реакции наблюдается, когда все молекулы фермента находятся в комплексе с субстратом
Слайд 49Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое
V = Vmax•[S]/(Km+[S])
В этом уравнении Vmax и Km постоянные величиныны, т.е. константы и не зависят от концентрации субстрата – они являются кинетическими характеристиками эффективности фермента
Vmax – дает характеристику каталитической активности фермента, имеет размерность моль/л и определяет максимальную возможность образования продукта при данной концентрации фермента в условиях избытка субстрата
Km – характеризует сродство данного фермента к данному субстрату и является постоянной величиной.
Km равна концентрации фермента при половине максимальной скорости (Vmax)
Константа Михаэлиса измеряется в моль/л и бывает от 10-2 до 10-7, чем меньше Кm, тем активнее фермент.
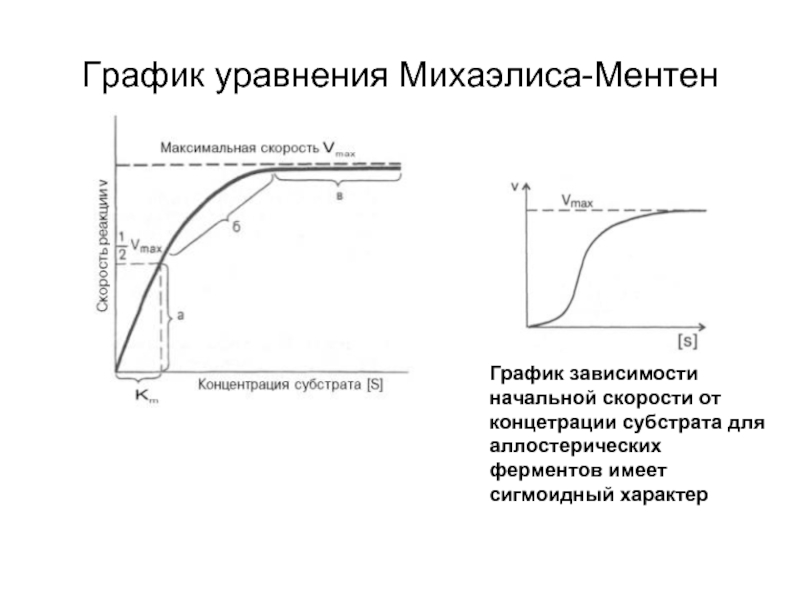
Слайд 50График уравнения Михаэлиса-Ментен
График зависимости начальной скорости от концетрации субстрата для аллостерических
Слайд 51Определение Vmax и Km
При [S] < < km
V = Vmax•[S]/km
скорость прямо пропорциональна концентрации субстрата
При [S] = km
V = Vmax•[S]/(•[S]+[S]) = Vmax/2, т.е. km равна
концентрации субстрата при половине
максимальной скорости
При [S] > > km V = Vmax•[S]/(Km+[S]) = Vmax•[S]/[S] = Vmax, т.е.
при очень высоких [S] скорость является
максимальной и не зависит от [S]
Слайд 52
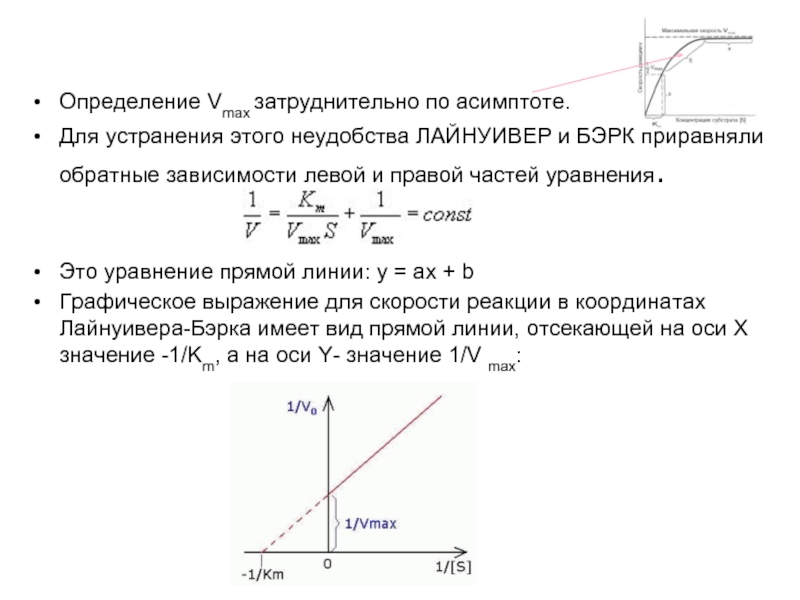
Определение Vmax затруднительно по асимптоте.
Для устранения этого неудобства ЛАЙНУИВЕР и
Это уравнение прямой линии: у = ах + b
Графическое выражение для скорости реакции в координатах Лайнуивера-Бэрка имеет вид прямой линии, отсекающей на оси Х значение -1/Km, а на оси Y- значение 1/V max:
Слайд 53
Термолабильность ферментов
Температурный коэффициент Q10 показывает во сколько раз ускоряется
При 1000С почти все ферменты утрачивают свою активность (исключение составляют, очевидно, только один фермент мышечной ткани - миокиназа, которая выдерживает нагревание до 1000С), так как происходит денатурация белка
При низких температурах (00С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля (снижается кинетическая энергия - ЕА).
На термолабильность ферментов определенное влияние оказывают концентрация субстрата, рН среды и другие факторы.
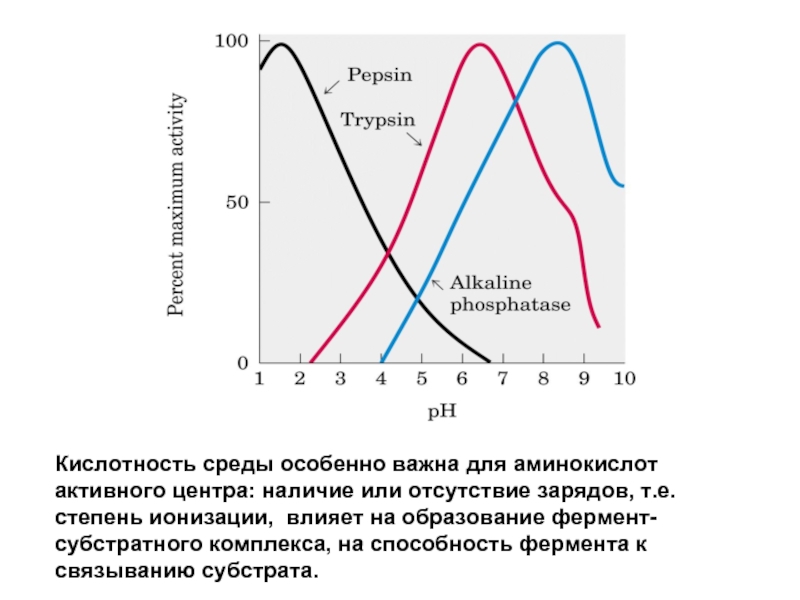
Слайд 54Кислотность среды особенно важна для аминокислот активного центра: наличие или отсутствие
Слайд 55Зависимость активности
ферментов от рН среды
рН-оптимум действия ферментов лежит в пределах
Влияние изменений рН среды на молекулы фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (СООН-группы дикарбоновых аминокислот, SH-группы цистеина, имидазольного азота гистидина и др.).
При разных значениях рН среды активный центр может находиться в частично ионизированной или в неионизированной форме, что сказывается на третичной структуре белка и соответственно формировании активного фермент-субстратного комплекса.
-СООН АСП или ГЛУ при рН<7 будет нейтральной, а при рН>7 имеет «-» заряд
-NH2 АРГ, ГИС, ЛИЗ при рН<7 будет имеет «+» заряд, а при рН>7 будет нейтральной
Кроме того, имеет значение и состояние ионизации субстратов и кофакторов.
Слайд 57Необратимое ингибирование
Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка (кислоты,
Необратимое ингибирование неспецифично, оно не связано с механизмами действия ферментов
С необратимым ингибированием связано действие многих токсинов и ядов на организм.
Слайд 58Обратимое ингибирование
Специфические ингибиторы вызывают обратимое ингибирование и поддаются количественному изучению на
Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
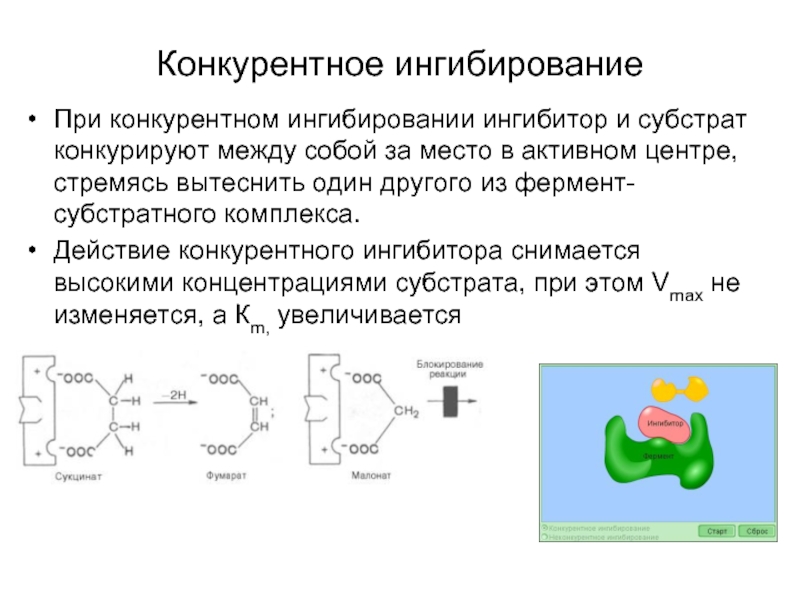
Слайд 59Конкурентное ингибирование
При конкурентном ингибировании ингибитор и субстрат конкурируют между собой
Действие конкурентного ингибитора снимается высокими концентрациями субстрата, при этом Vmax не изменяется, а Кm, увеличивается
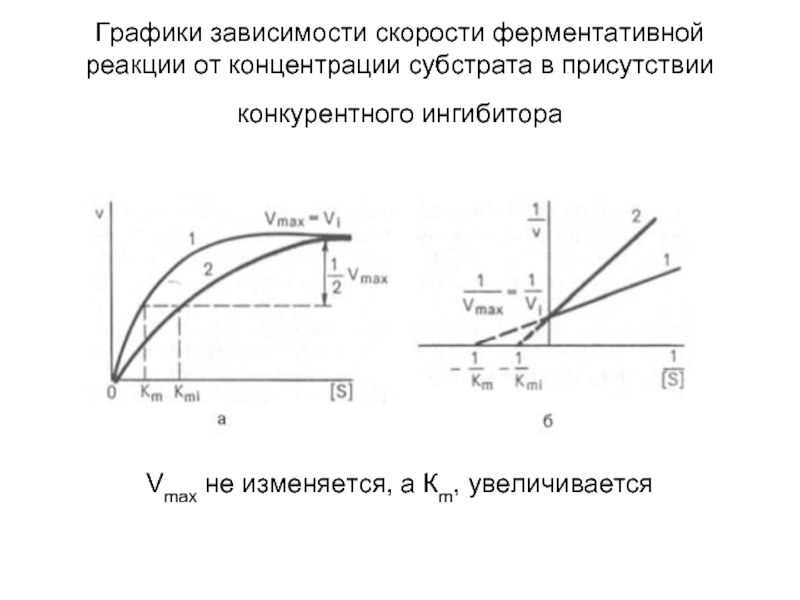
Слайд 60Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного
Vmax не изменяется, а Кm, увеличивается
Слайд 61Неконкурентное ингибирование
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами
Степень торможения определяется продолжительностью действия ингибитора на фермент.
Неконкурентное ингибирование может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр.
Примером необратимого ингибирования является действие йодацетата, диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов в молекуле фермента
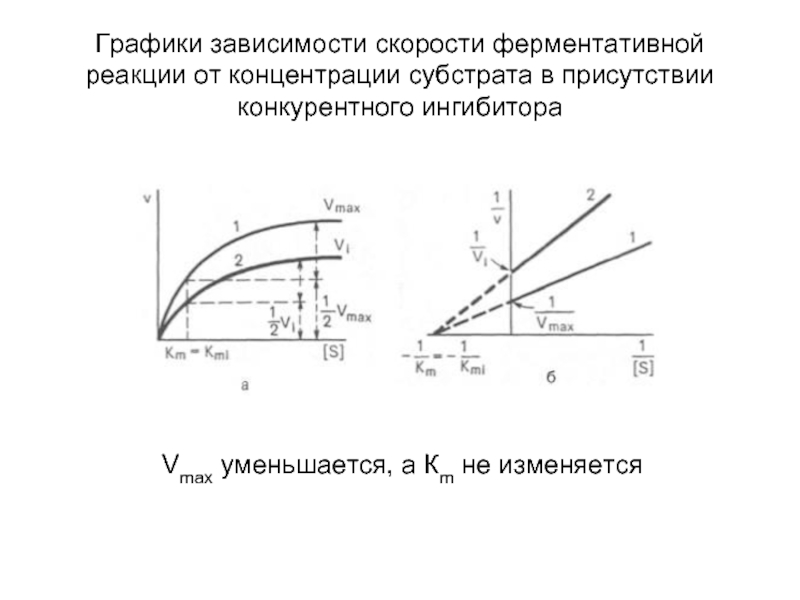
Слайд 62Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного
Vmax уменьшается, а Кm не изменяется
Слайд 63Лекарственные препараты как ингибиторы
Прозерин и эндрофоний – ингибиторы холинэстеразы используют
Сульфаниламиды – аналоги пара-аминобензойной кислоты являются антиметаболитами
Аспирин ингибирует циклооксигеназу
Слайд 64Регуляция активности ферментов
Ковалентная модификация – частичный протеолиз: зимогены - пепсиноген
Нековалентная модификация:
Ингибирование – регуляция по принципу обратной связи: конечный продукт ингибирует ключевой фермент: холестерин – ГМГКоА-редуктазу
Репрессия или индукция генов (изменение биосинтеза ферментов): тироксин взаимодействует с гормончувствительным участком ДНК
Компартментализация: ЖК синтезируются в цитоплазме, окисляются в митохондриях (ЦПЭ)
Аллостерическая регуляция
Слайд 65Принципы энзимодиагностики
Концентрация внутриклеточных (тканевых) ферментов в крови увеличивается при поврежден клеток:
Количество высвобождаемых ферментов достаточно для его обнаружения: АСТ в норме 2-25 МЕ, при гепатитах – 150-1000 МЕ
Активность высвобождаемых ферментов стабильна
Органоспецифичность: ЩФ Регана при раке легких
Слайд 66Применение ферментных препаратов в медицине
При заболеваниях ЖКТ: мезим-форте, фестал, энзистал, панкреатин
При
Протеолитические ферменты: трипсин, химотрипсин
При тромбозах: урокиназа, стрептолиаза
Для рассасывания рубцов ( при ожогах): лидаза (гиалуронидаза)
Слайд 67Будущее энзимологии
Будущее энзимологии связано с развитием медицинской и инженерной энзимологии.
Направления
Энзимопатология
Энзимодиагностика
Энзимотерапия
Направления инженерной энзимологии:
Создание синзимов – синтетических энзимов, обладающих всеми свойствами ферментов, но лишенных побочных антигенных свойств
создание «гибридных» катализаторов, сочетающих свойства ферментов, антител и рецепторов.
создание биотехнологических реакторов, содержащих иммобилизованные ферменты или полиферментные комплексы, обеспечивающие производство ценных материалов для народного хозяйства и медицины













![Процесс катализа можно представить следующим уравнением:E + S ⇆ [ES] → [EР] → E +](/img/tmb/1/81553/a230c09bea32593218dc9210d4496cf4-800x.jpg)






















![Ферментативный процесс можно выразить следующим уравнением:где k1 – константа скорости образования [ES] k-1 – константа](/img/tmb/1/81553/f66b880aecf4f8b9550ad0d43262c7a5-800x.jpg)

![Определение Vmax и Km При [S] < < kmV = Vmax•[S]/km = k •[S], т.е.](/img/tmb/1/81553/813642c2fc05cc698945a42a62b39e5e-800x.jpg)