- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Регуляция метаболизма. Гормоны презентация
Содержание
- 1. Регуляция метаболизма. Гормоны
- 2. План лекции 1. Определение гормонов 2. Принципы
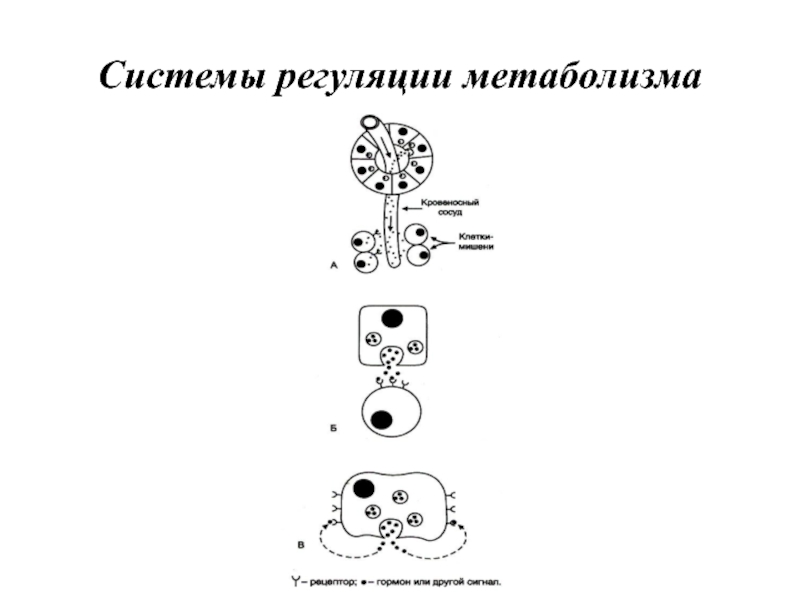
- 3. Основные системы регуляции метаболизма и межклеточной коммуникации
- 4. Системы регуляции метаболизма
- 5. Иерархия регуляторных систем Системы регуляции обмена веществ
- 6. Схема взаимосвязи регуляторных систем организма
- 7. Поддержание уровня гормонов в организме обеспечивает механизм
- 8. Гормоны – органические вещества дистанционного действия, вырабатываемые
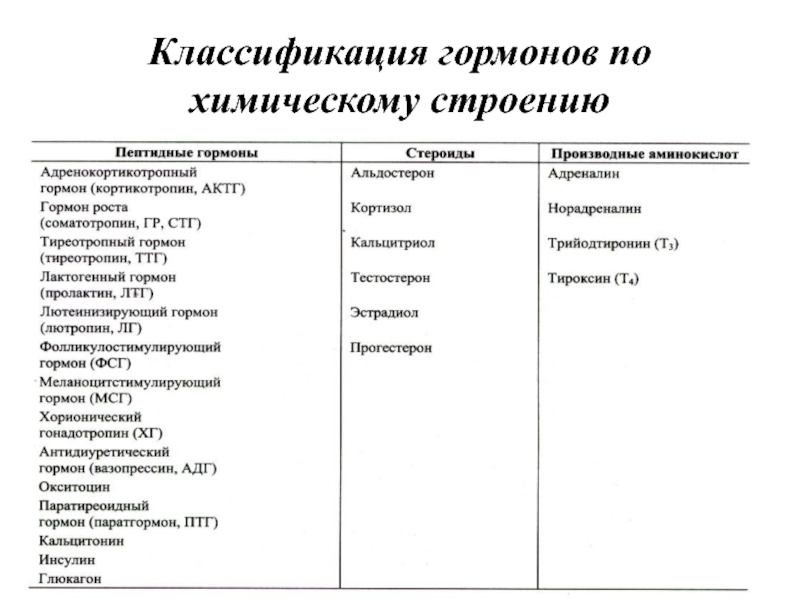
- 9. Химическая природа гормонов: А) Белки и полипептиды Б) Производные отдельных аминокислот В) Стероиды
- 10. Классификация гормонов по химическому строению
- 11. Классификация гормонов по биологическим функциям
- 12. Пути воздействия гормонов на обмен веществ: 1.
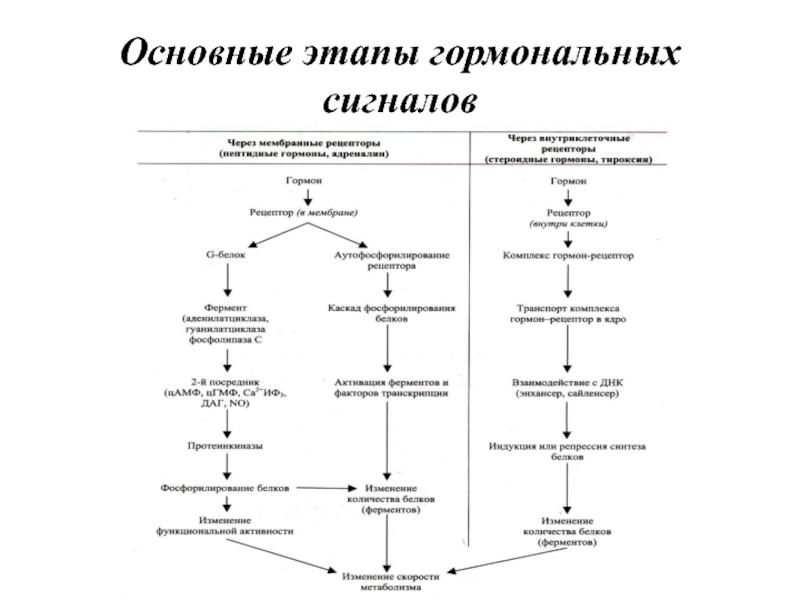
- 13. Основные этапы гормональных сигналов
- 14. Рецепторы гормонов Начальный этап в действии гормона
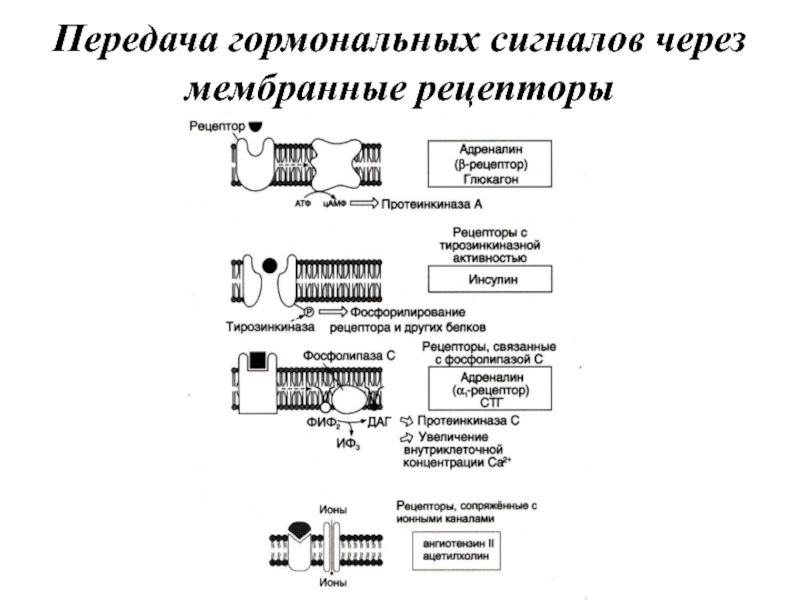
- 15. Передача гормональных сигналов через мембранные рецепторы
- 16. Активация и ингибирование аденилатциклазы гормонами
- 17. Передача гормональных сигналов через внутриклеточные рецепторы
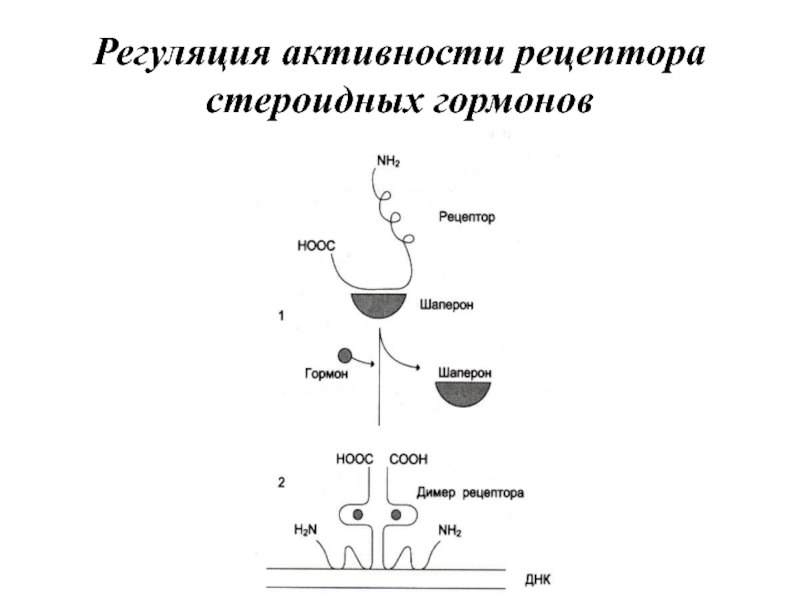
- 18. Регуляция активности рецептора стероидных гормонов
- 19. Рецепторы пептидных гормонов и адреналина располагаются на
- 20. В структуре мембранных рецепторов можно выделить 3
- 21. Рецепторы стероидных и тиреоидных гормонов содержат 3
- 22. Связывание гормона (первичного посредника) с рецептором приводит
- 23. В регуляции межклеточных взаимодействий участвуют также низкомолекулярные
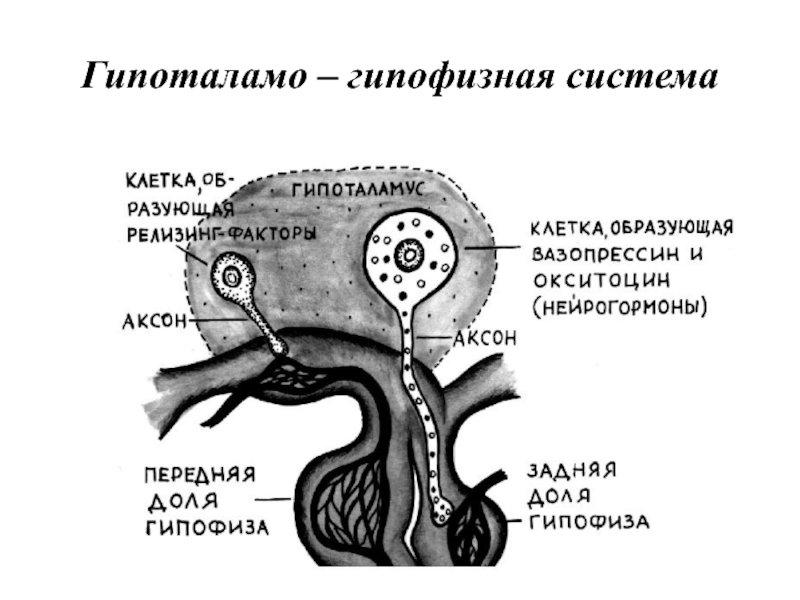
- 24. Гипоталамо – гипофизная система
- 25. Строение и функции гормонов гипоталамуса
- 26. Структура некоторых гормонов гипоталамуса
- 27. Тиреолиберин — трипептид, состоящий из пироглутаминовой кислоты,
- 28. Кортиколиберин — полипептид, содержащий 41 аминокислотный остаток.
- 29. Гонадолиберин - декапептид. Предшественник гонадолиберина человека состоит
- 30. Соматолиберин — полипептид, состоящий из 44 аминокислотных
- 31. Соматостатин первично был выделен из гипоталамуса, но
- 32. Строение и биологические функции гормонов передней доли гипофиза
- 33. Гормон роста человека
- 34. Гормон роста синтезируется в соматотрофных клетках, наиболее
- 35. Здоровий чоловік в 31 роки Гіпофізарний карлик в 31 роки
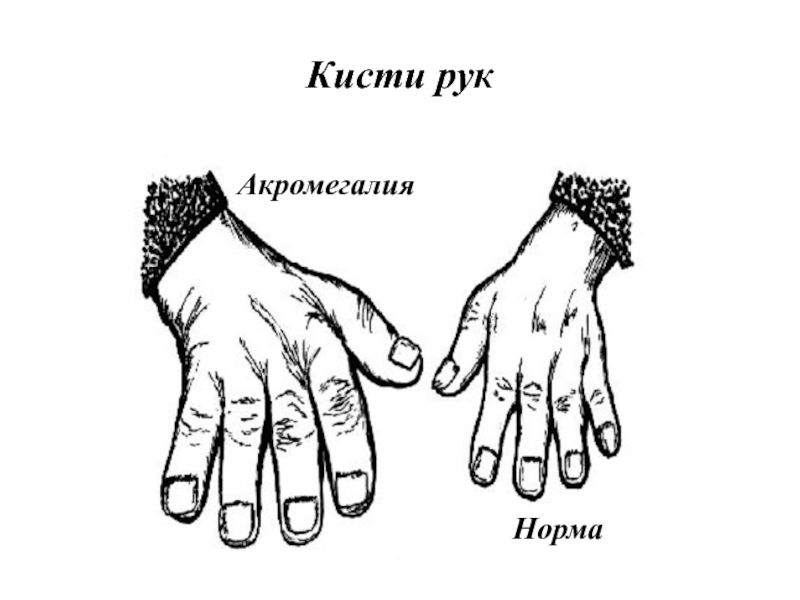
- 36. Акромегалия
- 37. Кисти рук Акромегалия Норма
- 39. Гіпофізарний карлик поросяти і його 4-місячний ровесник
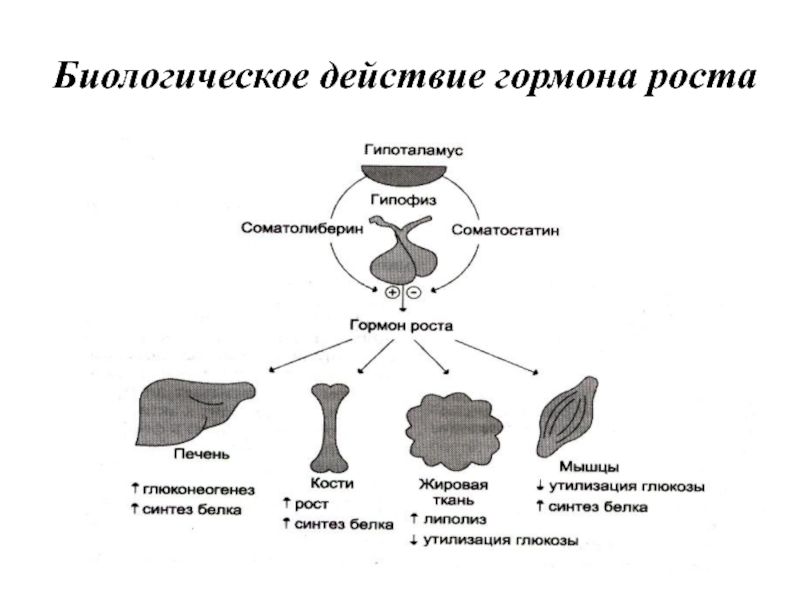
- 40. Биологическое действие гормона роста
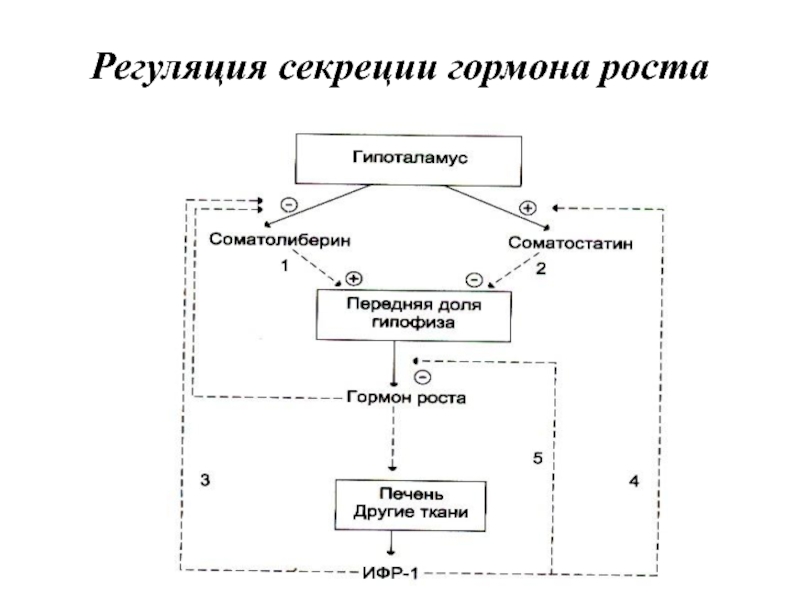
- 41. Регуляция секреции гормона роста
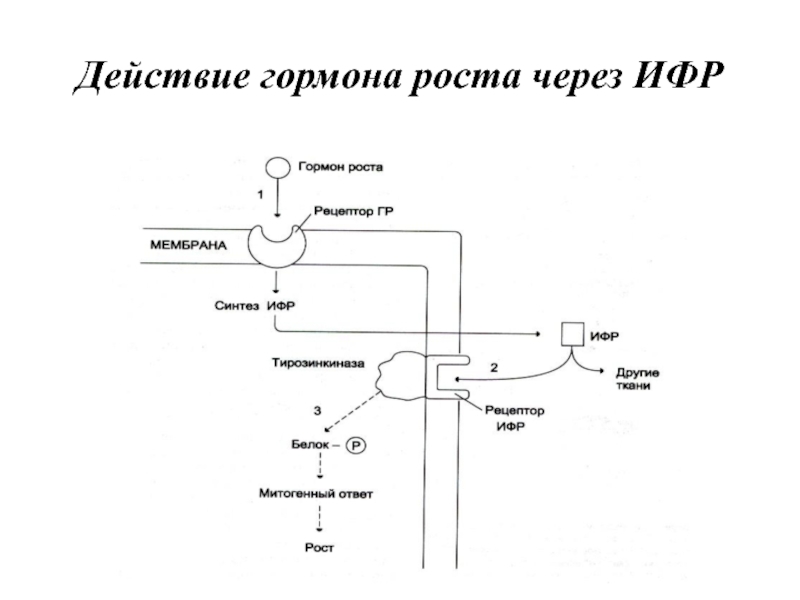
- 42. Действие гормона роста через ИФР
- 43. Строение гормонов передней доли гипофиза и хорионического гонадотропина
- 44. ГИПОФУНКЦИЯ – карликовый рост
- 45. Гипофизарный нанизм, или карликовость (от греч. nemos
- 46. Группа гормонов, образующихся из проопиомеланокортина Проопиомеланокортин (ПОМК)
- 47. Териотропный гормон (ТТГ) Гликопротеин, содержащий две
- 48. Лактотропный гормон (пролактин, ЛТГ) М ≈
- 49. Гормоны задней доли гипофиза: Окситоцин – нанопептид Вазопресин - нанопептид
- 50. Структура вазопрессина и окситоцина
- 51. Окситоцин – нанопептид Действие:
- 52. Вазопресин-нанопептид Действует на рецепторы кровеносных сосудов, повышает
- 53. Меланостимулирующий гормон (средняя доля) Полипептид -
- 54. Щитовидная железа ТИРЕОГЛОБУЛИН ТИРОКСИН
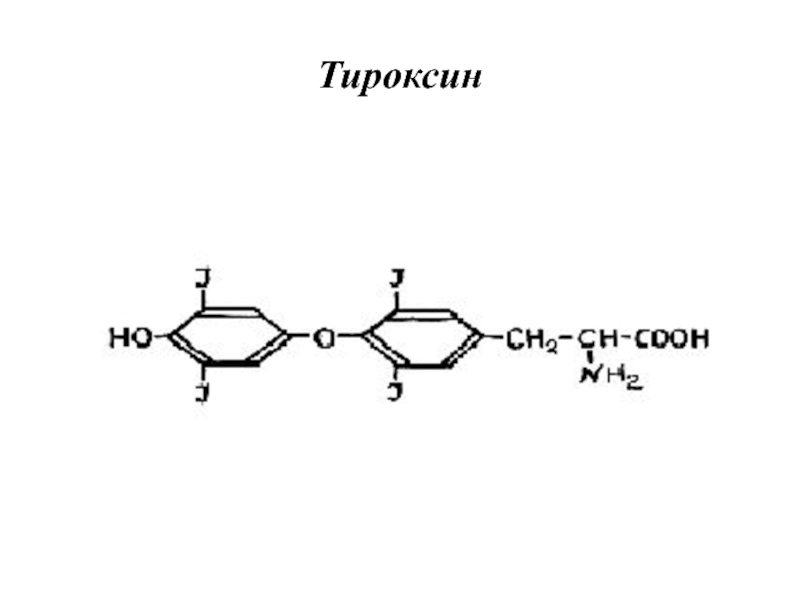
- 55. Тироксин
- 56. Йодтиронины синтезируются в составе белка тиреоглобулина (Тг)
- 57. Структура гормонов щитовидной железы
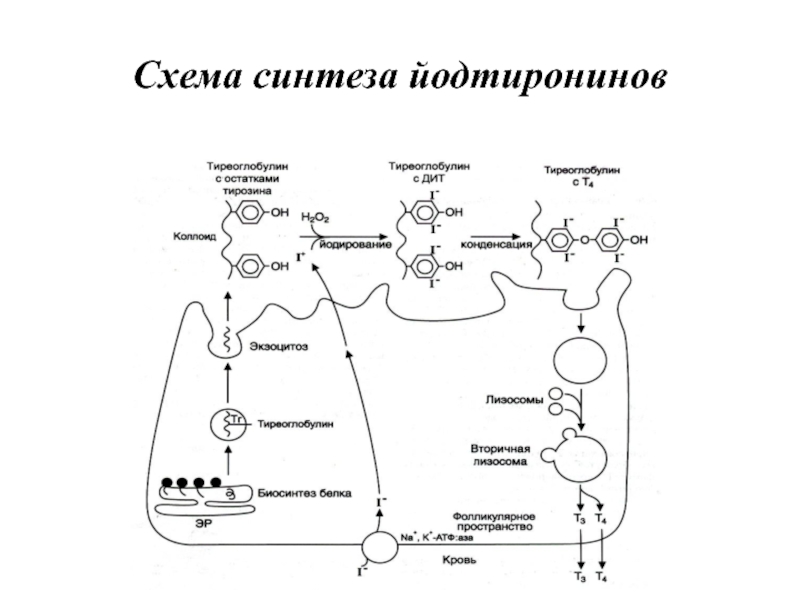
- 58. Схема синтеза йодтиронинов
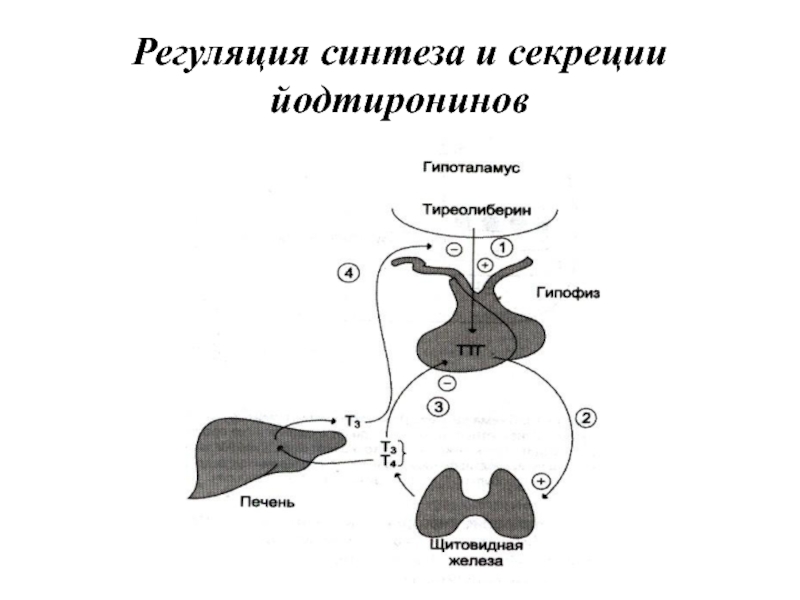
- 59. Регуляция синтеза и секреции йодтиронинов
- 60. Кретинизм
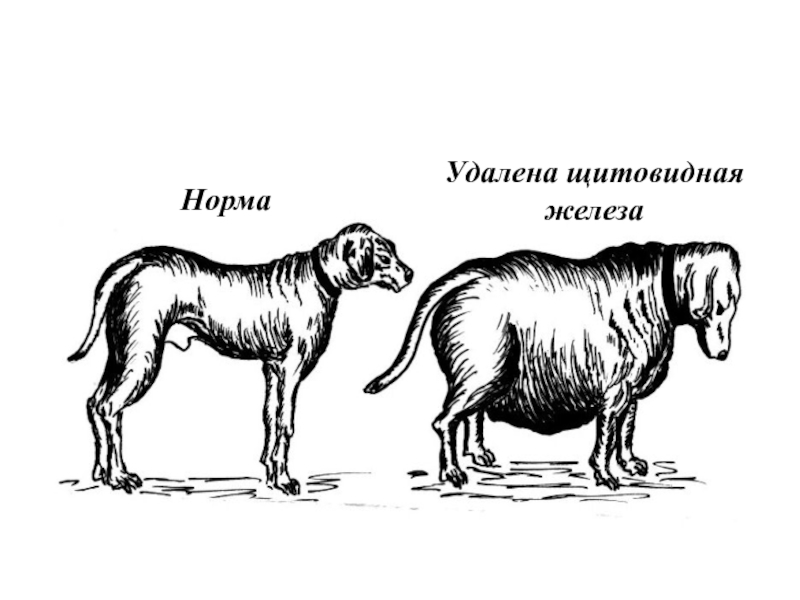
- 61. Норма Удалена щитовидная железа
- 62. Инсулин. Строение, синтез и секреция Инсулин —
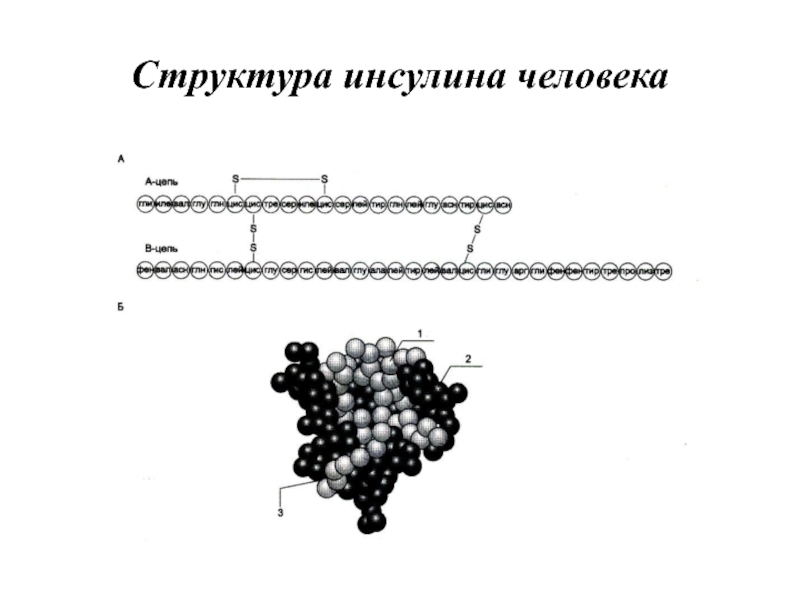
- 63. Структура инсулина человека
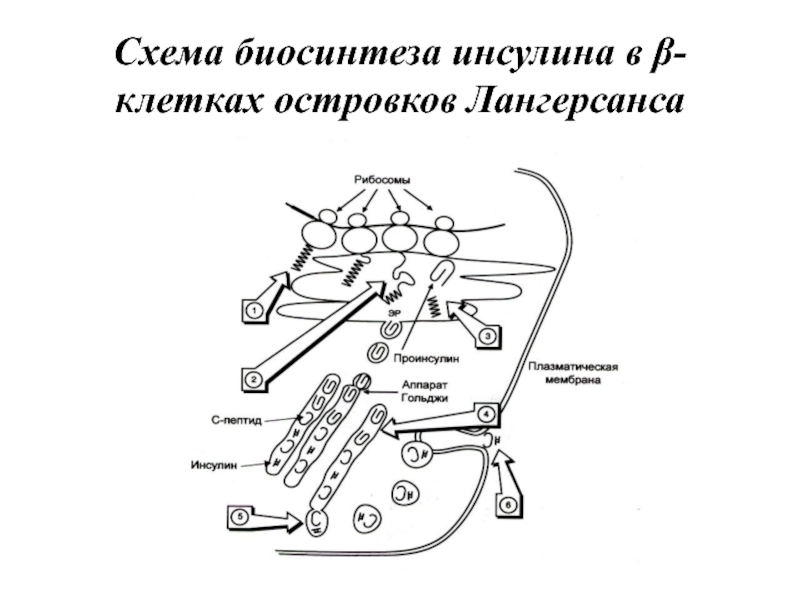
- 64. Схема биосинтеза инсулина в β-клетках островков Лангерсанса
- 65. Влияние инсулина на ключевые ферменты метаболизма
- 66. Глюкагон — одноцепочечный полипептид, состоящий из 29
- 67. Сахарный диабет — заболевание, возникающее вследствие абсолютного
- 68. Инсулинзависимый сахарный диабет — заболевание, вызываемое разрушением
- 69. Инсулинзависимый сахарный диабет — общее название нескольких
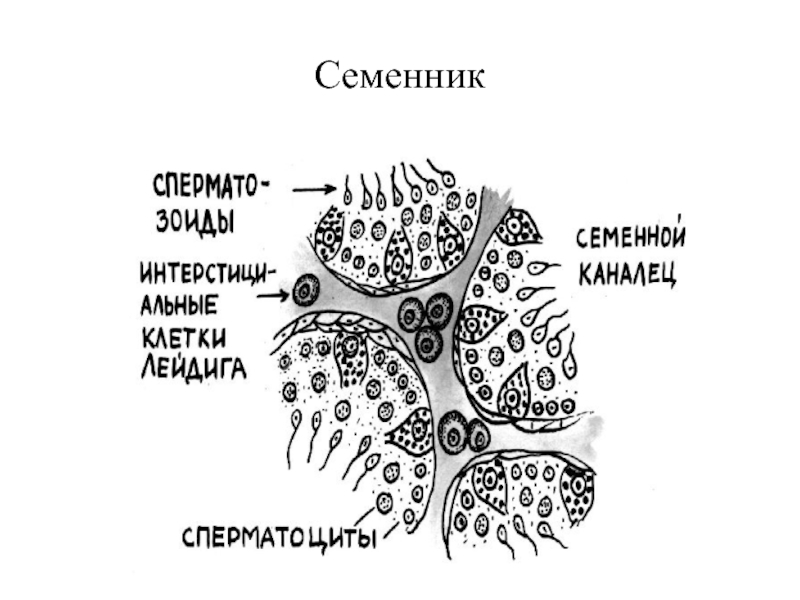
- 70. Семенник
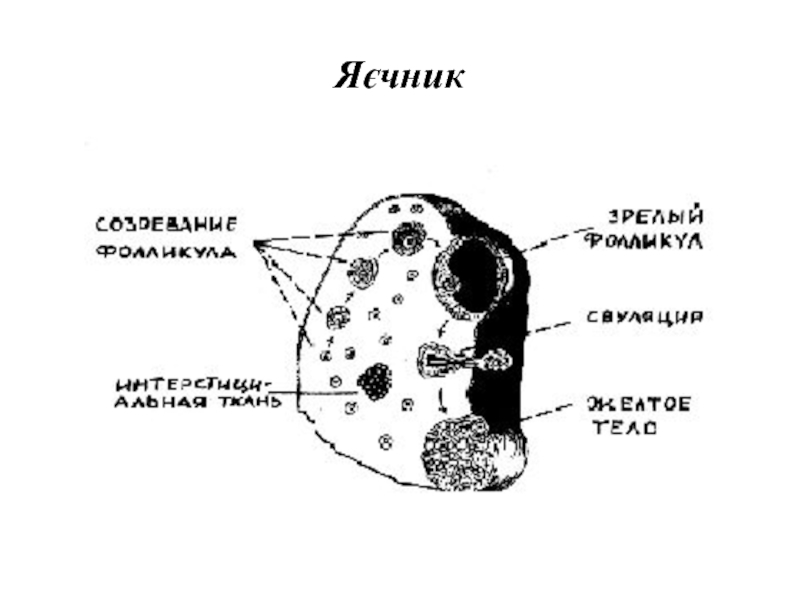
- 71. Яєчник
- 72. Півень після кастрації через 34 дні
- 73. Мужские половые гормоны
- 74. Регуляция синтеза и секреции мужских половых гормонов
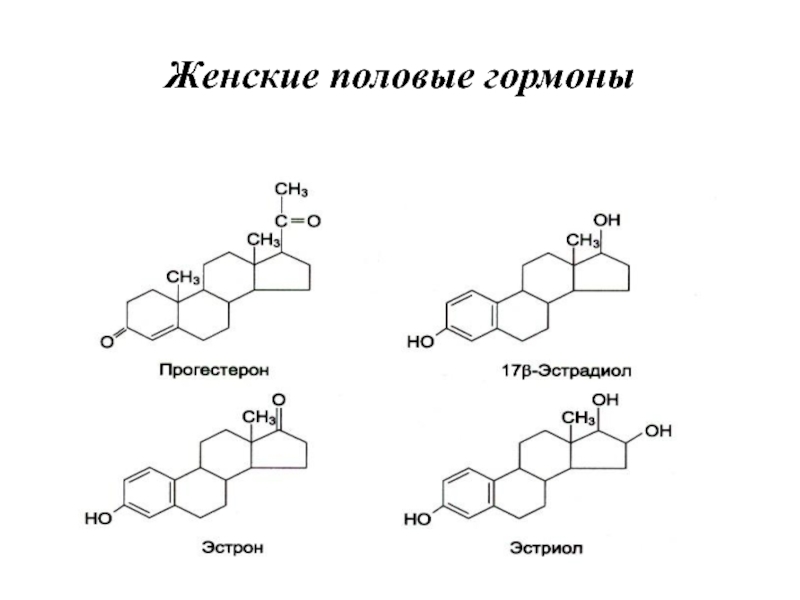
- 75. Женские половые гормоны
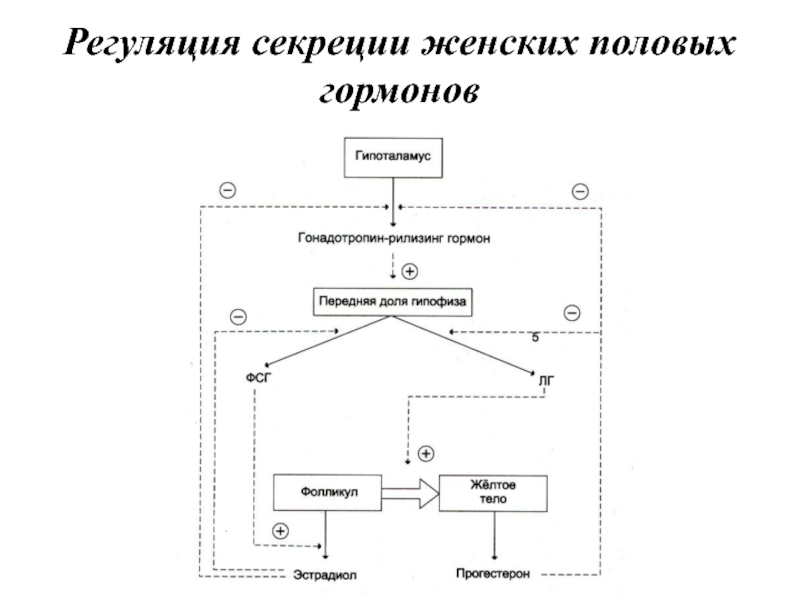
- 76. Регуляция секреции женских половых гормонов
- 77. Альдостерон — наиболее активный минералокортикостероид, синтезирующийся в
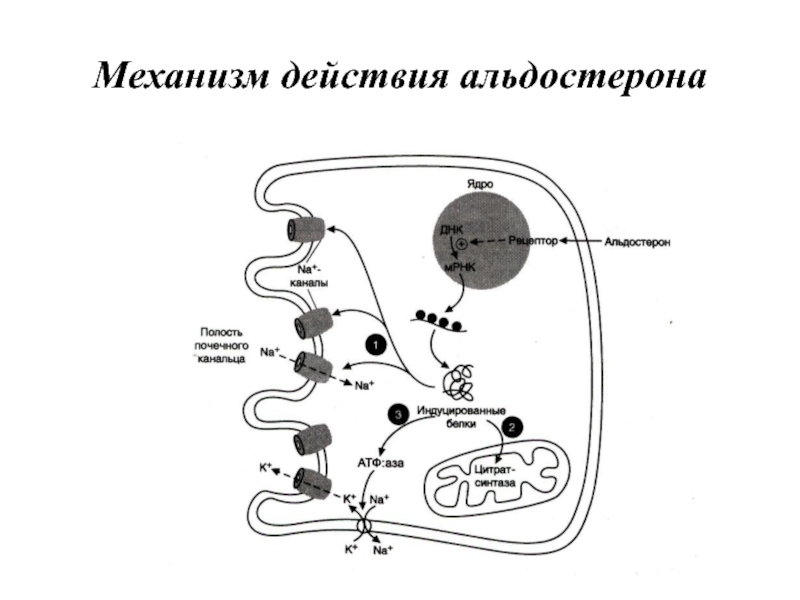
- 78. Механизм действия альдостерона
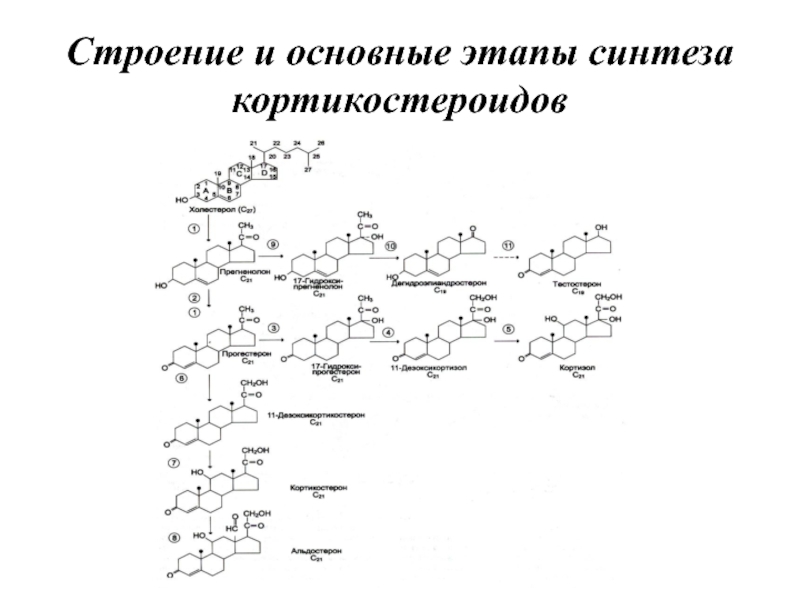
- 79. Строение и основные этапы синтеза кортикостероидов
- 80. В коре надпочечников синтезируется более 40 различных
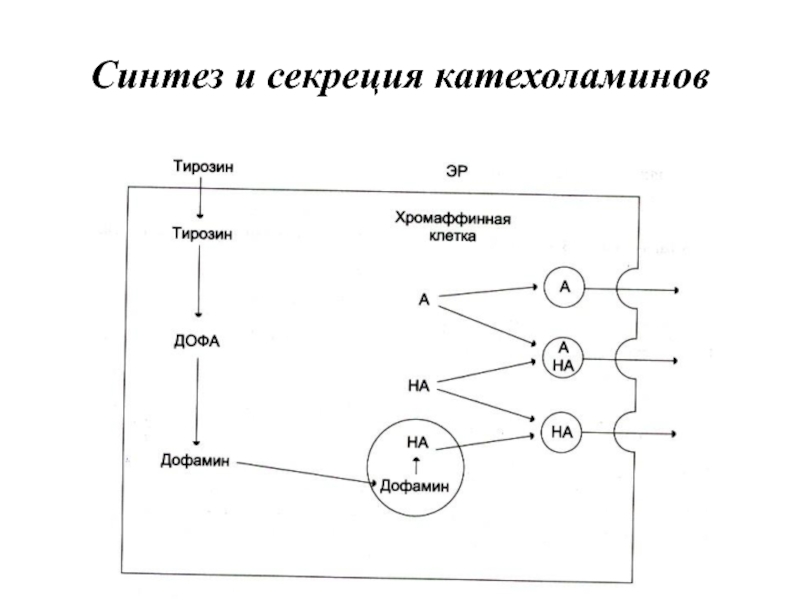
- 81. Синтез и секреция катехоламинов
- 82. Предсердный натрийуретический фактор (ПНФ) Это пептид, содержащий
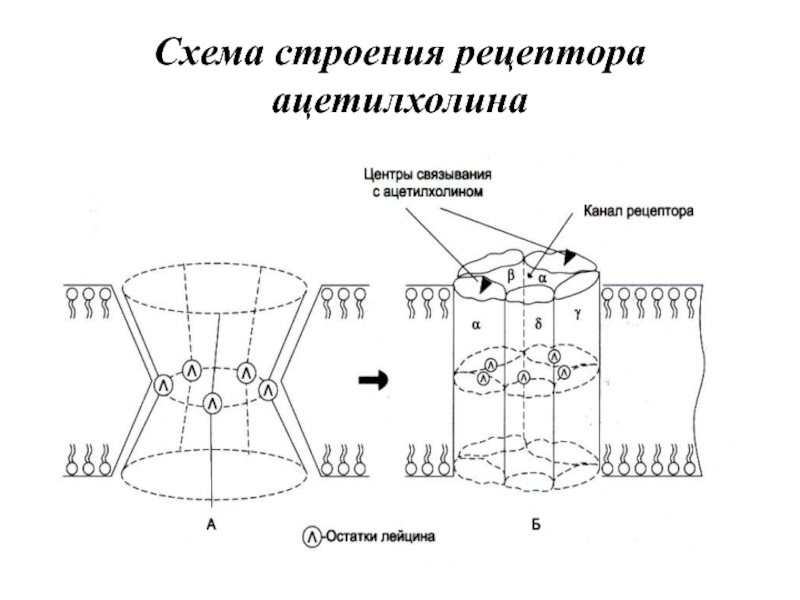
- 83. Схема строения рецептора ацетилхолина
- 84. Пептидные гормоны, образующиеся из ПОМК
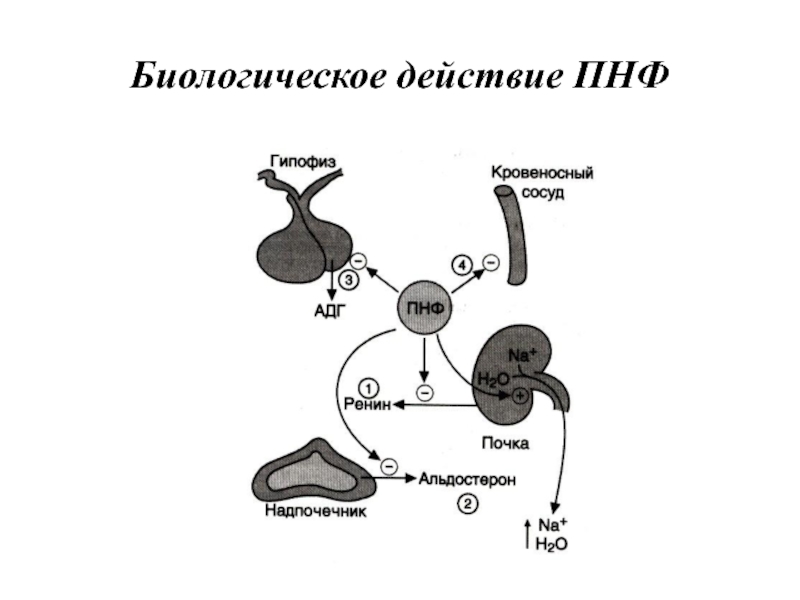
- 85. Биологическое действие ПНФ
- 86. Биологическое действие паратгормона
- 87. Все циклины делят на 2 подсемейства: G1-циклины
- 88. Эйкозаноиды Эйкозаноиды — биологически активные вещества, синтезируемые
- 89. Эйкозаноиды участвуют во многих процессах: регулируют тонус
- 90. Субстраты для синтеза эйкозаноидов Главный субстрат
- 91. Простагландины обозначают символами, например PG А, где
- 92. Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются
- 93. Лейкотриены также образуются из эйкозаноевых кислот, однако
- 94. Эйкозаноиды - гормоны местного действия по ряду
- 95. Эйкозаноиды действуют на клетки через специальные рецепторы.
- 96. Роль эйкозаноидов в развитии воспаления Воспаление —
- 97. Многие эйкозаноиды выполняют функцию медиаторов воспаления и
- 98. Аспирин — препарат, подавляющий основные признаки воспаления.
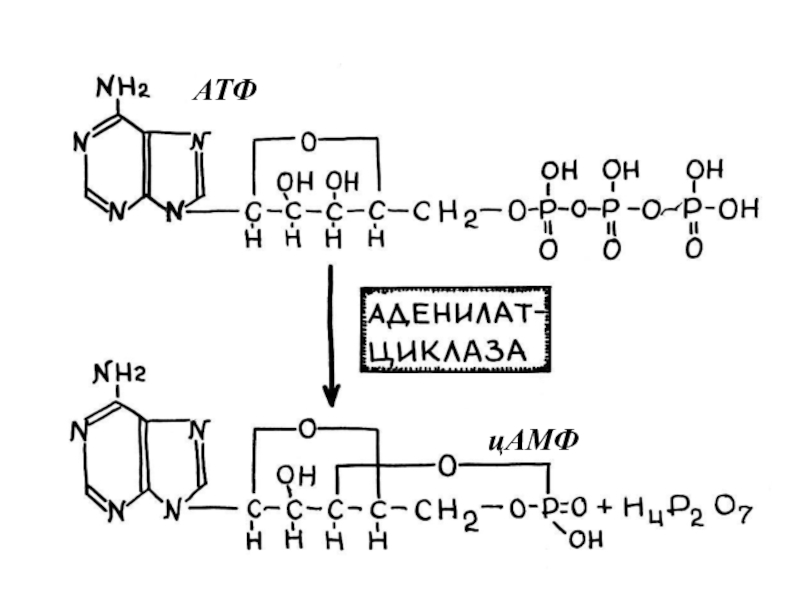
- 99. АТФ цАМФ
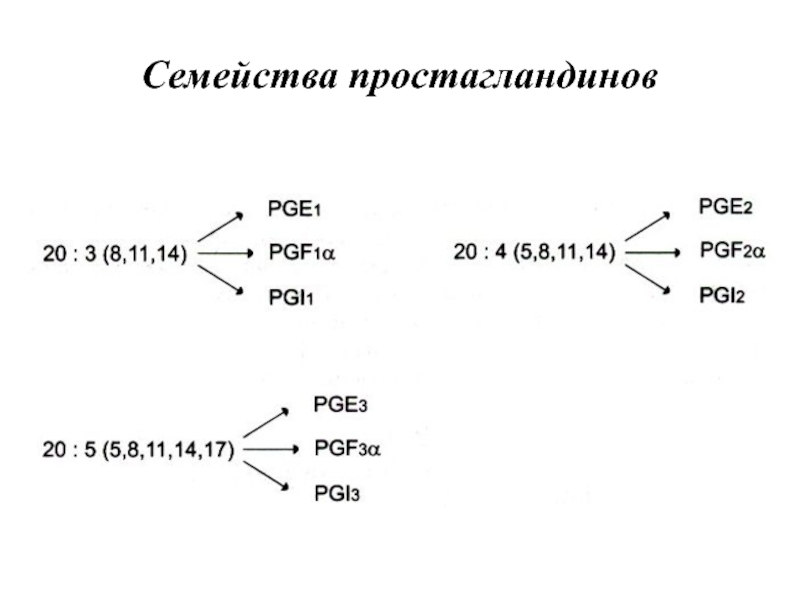
- 100. Семейства простагландинов
- 101. Структура тромбоксанов
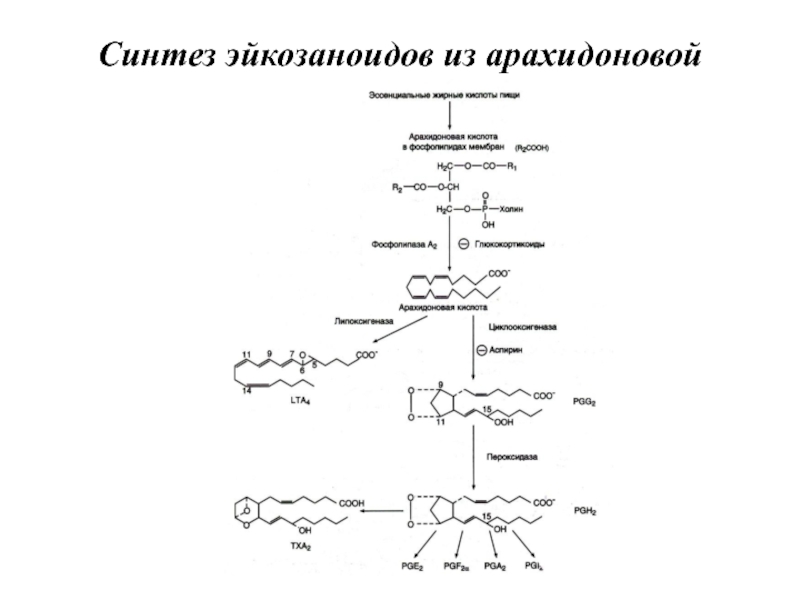
- 102. Синтез эйкозаноидов из арахидоновой кислоты
- 103. Характеристика биологического действия основных типов эйкозаноидов
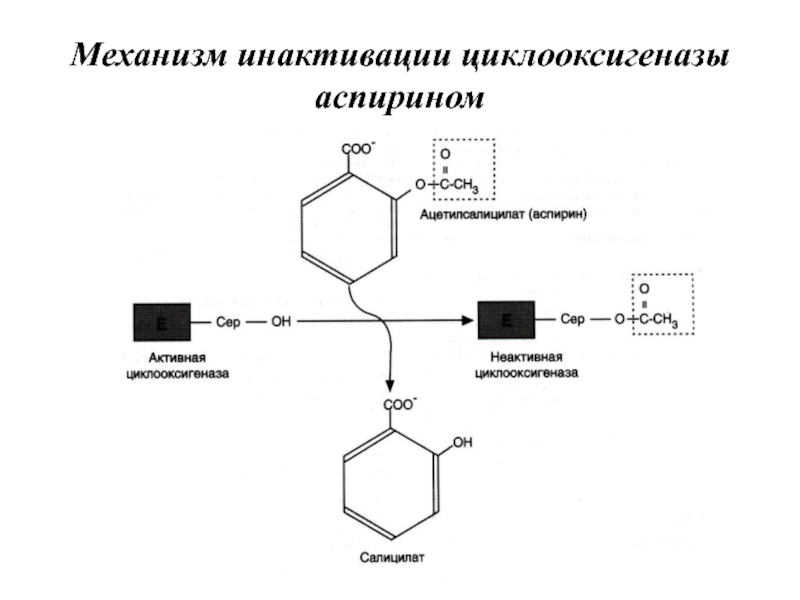
- 104. Механизм инактивации циклооксигеназы аспирином
Слайд 2План лекции
1. Определение гормонов
2. Принципы регуляции метаболизма и функций
3. Классификация гормонов
4.
Механизмы действия гормонов
5. Рецепторы гормонов
6. Гормоны гипоталамуса
7. Гормоны гипофиза
8. Гормоны щитовидной железы
9. Гормоны поджелудочной железы
10. Половые гормоны.
5. Рецепторы гормонов
6. Гормоны гипоталамуса
7. Гормоны гипофиза
8. Гормоны щитовидной железы
9. Гормоны поджелудочной железы
10. Половые гормоны.
Слайд 3Основные системы регуляции метаболизма и межклеточной коммуникации
Для нормального функционирования многоклеточного организма
необходима взаимосвязь между отдельными клетками, тканями и органами. Эту взаимосвязь осуществляют 4 основные системы регуляции.
• Центральная и периферическая нервные системы через нервные импульсы и нейромедиаторы;
• Эндокринная система через эндокринные железы и гормоны, которые секретируются в кровь и влияют на метаболизм различных клеток-мишеней;
• Паракринная и аутокринная системы посредством различных соединений, которые секретируются в межклеточное пространство и взаимодействуют с рецепторами либо близлежащих клеток, либо той же клетки (простагландины, гормоны ЖКТ, гистамин и др.);
• Иммунная система через специфические белки (цитокины, антитела).
• Центральная и периферическая нервные системы через нервные импульсы и нейромедиаторы;
• Эндокринная система через эндокринные железы и гормоны, которые секретируются в кровь и влияют на метаболизм различных клеток-мишеней;
• Паракринная и аутокринная системы посредством различных соединений, которые секретируются в межклеточное пространство и взаимодействуют с рецепторами либо близлежащих клеток, либо той же клетки (простагландины, гормоны ЖКТ, гистамин и др.);
• Иммунная система через специфические белки (цитокины, антитела).
Слайд 5Иерархия регуляторных систем
Системы регуляции обмена веществ и функций организма образуют 3
иерархических уровня.
Первый уровень — ЦНС. Нервные клетки получают сигналы, поступающие из внешней и внутренней среды, преобразуют их в форму нервного импульса и передают через синапсы, используя химические сигналы — медиаторы. Медиаторы вызывают изменения метаболизма в эффекторных клетках.
Второй уровень — эндокринная система. Включает гипоталамус, гипофиз, периферические эндокринные железы (а также отдельные клетки), синтезирующие гормоны и высвобождающие их в кровь при действии соответствующего стимула.
Третий уровень — внутриклеточный. Его составляют изменения метаболизма в пределах клетки или отдельного метаболического пути, происходящие в результате:
-изменения активности ферментов путём активации или ингибирования;
-изменения количества ферментов по механизму индукции или репрессии синтеза белков или изменения скорости их разрушения;
-изменения скорости транспорта веществ через мембраны клеток.
Первый уровень — ЦНС. Нервные клетки получают сигналы, поступающие из внешней и внутренней среды, преобразуют их в форму нервного импульса и передают через синапсы, используя химические сигналы — медиаторы. Медиаторы вызывают изменения метаболизма в эффекторных клетках.
Второй уровень — эндокринная система. Включает гипоталамус, гипофиз, периферические эндокринные железы (а также отдельные клетки), синтезирующие гормоны и высвобождающие их в кровь при действии соответствующего стимула.
Третий уровень — внутриклеточный. Его составляют изменения метаболизма в пределах клетки или отдельного метаболического пути, происходящие в результате:
-изменения активности ферментов путём активации или ингибирования;
-изменения количества ферментов по механизму индукции или репрессии синтеза белков или изменения скорости их разрушения;
-изменения скорости транспорта веществ через мембраны клеток.
Слайд 7Поддержание уровня гормонов в организме обеспечивает механизм отрицательной обратной связи. Изменение
концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов, действуя либо на эндокринные железы, либо на гипоталамус. Синтез и секреция тропных гормонов подавляется гормонами эндокринных периферических желёз. Такие петли обратной связи действуют в системах регуляции гормонов надпочечников, щитовидной железы, половых желёз.
Слайд 8Гормоны – органические вещества дистанционного действия, вырабатываемые в эндокринных железах и
осуществляющие совместно с нервной и иммунной системами интеграцию обмена веществ и физиологических функций в организме.
Основные общие биологические признаки:
1. Дистанционность действия
2. Строгая специфичность
3.Высокая биологическая активность
Основные общие биологические признаки:
1. Дистанционность действия
2. Строгая специфичность
3.Высокая биологическая активность
Слайд 9Химическая природа гормонов:
А) Белки и полипептиды
Б) Производные отдельных аминокислот
В) Стероиды
Слайд 12Пути воздействия гормонов на обмен веществ:
1. Изменяют интенсивность метаболизма
2. Активирует (ингибируют)
ферменты
3. Ускоряют (замедляют) синтез и разрушение макромолекул
4. Изменяют проницаемость мембран
5. Изменяют интенсивность деления клеток
6. Изменяют скорость синтеза гормонов других желез
Типы действия гормонов:
1. Мембранный (локальный)
2. Мембранно – внутриклеточный
3. Цитозольный (прямой)
3. Ускоряют (замедляют) синтез и разрушение макромолекул
4. Изменяют проницаемость мембран
5. Изменяют интенсивность деления клеток
6. Изменяют скорость синтеза гормонов других желез
Типы действия гормонов:
1. Мембранный (локальный)
2. Мембранно – внутриклеточный
3. Цитозольный (прямой)
Слайд 14Рецепторы гормонов
Начальный этап в действии гормона на клетку-мишень - взаимодействие гормона
с рецептором клетки. Концентрация гормонов во внеклеточной жидкости очень низка и обычно колеблется в пределах 10-6 – 10-11ммоль/л. Клетки-мишени отличают соответствующий гормон от множества других молекул и гормонов благодаря наличию на клетке-мишени соответствующего рецептора со специфическим центром связывания с гормоном
Слайд 19Рецепторы пептидных гормонов и адреналина располагаются на поверхности клеточной мембраны. Рецепторы
стероидных и тиреоидных гормонов находятся внутри клетки. Причём внутриклеточные рецепторы для одних гормонов, например глюкокортикоидов, локализованы в цитозоле, для других, таких как андрогены, эстрогены, тиреоидные гормоны, расположены в ядре клетки.
Рецепторы по своей химической природе являются белками и, как правило, состоят из нескольких доменов.
Рецепторы по своей химической природе являются белками и, как правило, состоят из нескольких доменов.
Слайд 20В структуре мембранных рецепторов можно выделить 3 функционально разных участка. Первый
домен (домен узнавания) расположен в N-концевой части полипептидной цепи на внешней стороне клеточной мембраны; он содержит гликозилированные участки и обеспечивает узнавание и связывание гормона. Второй домен — трансмембранный. У рецепторов одного типа, сопряжённых с G-белками, он состоит из 7 плотно упакованных α-спиральных полипептидных последовательностей. У рецепторов другого типа трансмембранный домен включает только одну α-спирализованную полипептидную цепь (например, обе β-субъединицы гетеротетрамерного рецептора инсулина (α2β2). Третий (цитоплазматический) домен создаёт химический сигнал в клетке, который сопрягает узнавание и связывание гормона с определённым внутриклеточным ответом.
Слайд 21Рецепторы стероидных и тиреоидных гормонов содержат 3 функциональные области. На С-концевом
участке полипептидной цепи рецептора находится домен узнавания и связывания гормона. Центральная часть рецептора включает домен связывания ДНК. На N-концевом участке полипептидной цепи располагается домен, называемый вариабельной областью рецептора, отвечающий за связывание с другими белками, вместе с которыми участвует в регуляции транскрипции.
Слайд 22Связывание гормона (первичного посредника) с рецептором приводит к изменению конформации рецептора.
Это изменение улавливается другими макромолекулами, т.е. связывание гормона с рецептором приводит к сопряжению одних молекул с другими (трансдукция сигнала). Таким образом, генерируется сигнал, который регулирует клеточный ответ путём изменения активности или количества ферментов и других белков. В зависимости от способа передачи гормонального сигнала в клетках меняется скорость реакций метаболизма:
• в результате изменения активности ферментов;
• в результате изменения количества ферментов.
• в результате изменения активности ферментов;
• в результате изменения количества ферментов.
Слайд 23В регуляции межклеточных взаимодействий участвуют также низкомолекулярные белковые соединения — цитокины.
Влияние цитокинов на различные функции клеток обусловлено их взаимодействием с мембранными рецепторами. Через образование внутриклеточных посредников сигналы передаются в ядро, где происходят активация определённых генов и индукция синтеза белков. Все цитокины объединяются следующими общими свойствами:
• синтезируются в процессе иммунного ответа организма, служат медиаторами иммунной и воспалительной реакций и обладают в основном аутокринной, в некоторых случаях паракринной и эндокринной активностью;
• действуют как факторы роста и факторы дифферинцировки клеток (при этом вызывают преимущественно медленные клеточные реакции, требующие синтеза новых белков);
• обладают плейотропной (полифункциональной) активностью.
• синтезируются в процессе иммунного ответа организма, служат медиаторами иммунной и воспалительной реакций и обладают в основном аутокринной, в некоторых случаях паракринной и эндокринной активностью;
• действуют как факторы роста и факторы дифферинцировки клеток (при этом вызывают преимущественно медленные клеточные реакции, требующие синтеза новых белков);
• обладают плейотропной (полифункциональной) активностью.
Слайд 27Тиреолиберин — трипептид, состоящий из пироглутаминовой кислоты, гистидина и пролинамида.
Синтез тиреолиберина
происходит в различных участках гипоталамуса, но в большей степени в паравентрикулярном ядре, а также в других областях ЦНС, где он выполняет функцию нейромедиатора, повышающего двигательную активность и АД.
Слайд 28Кортиколиберин — полипептид, содержащий 41 аминокислотный остаток. Как и другие пептидные
гормоны, Кортиколиберин синтезируется в виде прогормона. Т1/2 кортиколиберина в плазме крови составляет 60 мин. Основное количество кортиколиберина образуется в гипоталамусе, однако он обнаруживается и в других отделах ЦНС, где выполняет роль медиатора, участвуя в ответной реакции на различные стрессовые ситуации.
Слайд 29Гонадолиберин - декапептид. Предшественник гонадолиберина человека состоит из 92 аминокислотных остатков
и имеет молекулярную массу около 10 кД. Гонадолиберин стимулирует синтез и секрецию 2 гормонов гипофиза — ЛГ и ФСГ. Помимо гипоталамуса, нейроны, содержащие Гонадолиберин, находятся и в других областях ЦНС, контролирующих эмоциональное и половое поведение.
Слайд 30Соматолиберин — полипептид, состоящий из 44 аминокислотных остатков. В передней доле
гипофиза Соматолиберин стимулирует синтез и секрецию соматотропина. Трансдукция сигнала сопровождается повышением концентрации как цАМФ, так и ионов кальция. Т1/2 соматолиберина в крови составляет около 7 мин. Соматолиберин применяют в клинической практике для диагностики нарушений функции гипофиза.
Слайд 31Соматостатин первично был выделен из гипоталамуса, но впоследствии оказалось, что он
синтезируется во многих клетках, расположенных вне гипоталамуса: в желудке, кишечнике, поджелудочной железе, в области периферических нервных окончаний, в плаценте, надпочечниках и в сетчатке глаза. Соматостатин выполняет функции гормона и медиатора, вызывая торможение секреторных процессов, снижение активности гладкой мускулатуры и нейронов. Соматостатин состоит из 14 аминокислотных остатков и имеет циклическую структуру, образованную дисульфидной связью между двумя остатками цистеина.
Слайд 34Гормон роста синтезируется в соматотрофных клетках, наиболее многочисленных в передней доле
гипофиза. Содержание гормона роста составляет 5—16 мг в 1 г ткани железы, в то время как количество других гормонов гипофиза исчисляется в мкг/г. Т1/2 гормона в плазме крови составляет около 50 мин.
Гормон роста у всех видов млекопитающих представляет собой одноцепочечный пептид с молекулярной массой 22 кД, состоящий из 191 аминокислотного остатка и имеющий 2 внутримолекулярные дисульфидные связи.
Гормон роста образуется из прогормона с молекулярной массой 28 кД, не обладающего гормональной активностью. Уровень гормона роста в плазме крови не превышает 3 нг/мл. Секреция гормона роста носит пульсирующий характер с интервалами в 20—30 мин. Один из самых больших пиков отмечается вскоре после засыпания.
Гормон роста у всех видов млекопитающих представляет собой одноцепочечный пептид с молекулярной массой 22 кД, состоящий из 191 аминокислотного остатка и имеющий 2 внутримолекулярные дисульфидные связи.
Гормон роста образуется из прогормона с молекулярной массой 28 кД, не обладающего гормональной активностью. Уровень гормона роста в плазме крови не превышает 3 нг/мл. Секреция гормона роста носит пульсирующий характер с интервалами в 20—30 мин. Один из самых больших пиков отмечается вскоре после засыпания.
Слайд 45Гипофизарный нанизм, или карликовость (от греч. nemos — карлик). Причина нарушения
роста и физического развития — дефицит гормона роста. Большинство форм гипофизарного нанизма развивается вследствие мутаций гена гормона роста. У большинства больных гипофизарным нанизмом нарушение роста сочетается с другими эндокринными нарушениями. В некоторых случаях гипосекреция гормона роста может быть результатом аутоиммунного повреждения соматотрофных клеток гипофиза, черепно-мозговой травмы или радиации.
Нанизм Ларона возникает вследствие дефекта рецепторов гормона роста гепатоцитов и снижения синтеза ИФР-1 и ИФР-2. Концентрация СТГ в крови при этом повышена.
Карликовость африканских пигмеев — результат нарушения пострецепторной передачи гормонального сигнала СТГ. При этой форме карликовости концентрация гормона роста в плазме нормальная, а концентрация ИФР-1 значительно снижена.
Нанизм Ларона возникает вследствие дефекта рецепторов гормона роста гепатоцитов и снижения синтеза ИФР-1 и ИФР-2. Концентрация СТГ в крови при этом повышена.
Карликовость африканских пигмеев — результат нарушения пострецепторной передачи гормонального сигнала СТГ. При этой форме карликовости концентрация гормона роста в плазме нормальная, а концентрация ИФР-1 значительно снижена.
Слайд 46Группа гормонов, образующихся из проопиомеланокортина
Проопиомеланокортин (ПОМК) с молекулярной массой 28,5 кД
синтезируется в передней и промежуточной долях гипофиза и в некоторых других тканях (кишечнике, плаценте). Полипептидная цепь ПОМК состоит из 265 аминокислотных остатков.
После отщепления сигнального пептида происходит частичный протеолиз оставшейся полипептидной цепи с образованием АКТГ и α-липотропина (β-ЛП). В разных клетках в результате избирательного протеолиза образуется разный набор пептидов: α- и β-меланоцитстимулирующих гормонов (α- и β-МСГ) и эндорфинов. β-МСГ и кортикотропиноподобный гормон промежуточной доли у человека практически не образуются, так как у взрослых людей промежуточная доля не развита. В гипофизе человека найдены β-липотропин, γ-липотропин и β-эндорфин. Функции всех продуктов разрушения ПОМК недостаточно изучены.
После отщепления сигнального пептида происходит частичный протеолиз оставшейся полипептидной цепи с образованием АКТГ и α-липотропина (β-ЛП). В разных клетках в результате избирательного протеолиза образуется разный набор пептидов: α- и β-меланоцитстимулирующих гормонов (α- и β-МСГ) и эндорфинов. β-МСГ и кортикотропиноподобный гормон промежуточной доли у человека практически не образуются, так как у взрослых людей промежуточная доля не развита. В гипофизе человека найдены β-липотропин, γ-липотропин и β-эндорфин. Функции всех продуктов разрушения ПОМК недостаточно изучены.
Слайд 47Териотропный гормон (ТТГ)
Гликопротеин, содержащий две полипептидных цепи:
α – полипептид – 96
А.К. β – полипептид – 112 А.К
Обладают видовой специфичностью.
Орган-мишень – щитовидная железа.
Стимулирует рост и развитие эпителия щитовидной
железы.
Обладают видовой специфичностью.
Орган-мишень – щитовидная железа.
Стимулирует рост и развитие эпителия щитовидной
железы.
Слайд 48Лактотропный гормон
(пролактин, ЛТГ)
М ≈ 24 – 25 тыс.
Орган-мишень – молочная
железа
Действие – активирует ферменты, участвующие в биосинтезе составных частей молока.
Действие – активирует ферменты, участвующие в биосинтезе составных частей молока.
Слайд 51Окситоцин – нанопептид
Действие:
а) сокращение гладкой мускулатуры матки (роды, инвалюция матки)
б)
сокращение миоэпителия молочной железы (ускорение молокоотдачи)
Слайд 52Вазопресин-нанопептид
Действует на рецепторы кровеносных сосудов, повышает давление, обеспечивает обратное всасывание Н2О,
поддерживает водно-солевой обмен. М.М. - 1056
Слайд 53Меланостимулирующий гормон
(средняя доля)
Полипептид - 13-18 аминокислот ускоряет образование меланоцитов и
синтез в них пигментов.
Тирозин Меланин
Тирозин Меланин
Слайд 56Йодтиронины синтезируются в составе белка тиреоглобулина (Тг) в фолликулах, которые представляют
собой морфологическую и функциональную единицу щитовидной железы.
Тиреоглобулин — гликопротеин с молекулярной массой 660 кД, содержащий 115 остатков тирозина. 8—10% массы тиреоглобулина представлено углеводами. Содержание йодида в организме составляет 0,2—1%.
Тиреоглобулин синтезируется на рибосомах шероховатого ЭР в виде претиреоглобулина, затем переносится в цистерны ЭР, где происходит формирование вторичной и третичной структуры, включая процессы гликозилирования. Из цистерн ЭР Тиреоглобулин поступает в аппарат Гольджи, включается в состав секреторных гранул и секретируется во внеклеточный коллоид, где происходит йодирование остатков тирозина и образование йодтиронинов.
Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов.
Тиреоглобулин — гликопротеин с молекулярной массой 660 кД, содержащий 115 остатков тирозина. 8—10% массы тиреоглобулина представлено углеводами. Содержание йодида в организме составляет 0,2—1%.
Тиреоглобулин синтезируется на рибосомах шероховатого ЭР в виде претиреоглобулина, затем переносится в цистерны ЭР, где происходит формирование вторичной и третичной структуры, включая процессы гликозилирования. Из цистерн ЭР Тиреоглобулин поступает в аппарат Гольджи, включается в состав секреторных гранул и секретируется во внеклеточный коллоид, где происходит йодирование остатков тирозина и образование йодтиронинов.
Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов.
Слайд 62Инсулин. Строение, синтез и секреция
Инсулин — полипептид, состоящий из двух полипептидных
цепей. Цепь А содержит 21 аминокислотный остаток, цепь В — 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками. Инсулин может существовать в нескольких формах: мономера, димера и гексамера. Гексамерная структура инсулина стабилизируется ионами цинка, который связывается остатками Гис в положении 10 В-цепи всех 6 субъединиц
Слайд 66Глюкагон — одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона
происходит в α-клетках островков Лангерханса, в нейроэндокринных клетках кишечника и в некоторых отделах ЦНС. Неактивный предшественник проглюкагон в результате частичного протеолиза превращается в несколько пептидов. В клетках поджелудочной железы главный пептид — глюкагон; в клетках кишечника образуются глюкагоноподобные пептиды (от англ. GLP — glucagon like peptide): GLP-1, GLP-2, глицентин и другие.
Слайд 67Сахарный диабет — заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина.
Согласно
данным Всемирной организации здравоохранения, сахарный диабет классифицируют с учётом различия генетических факторов и клинического течения на две основные формы: диабет I типа — инсулинзависимый (ИЗСД), и диабет II типа — инсулиннезависимый (ИНСД).
Слайд 68Инсулинзависимый сахарный диабет — заболевание, вызываемое разрушением β-клєток островков Лангерханса поджелудочной
железы.
Деструкция β-клеток — результат аутоиммунных реакций. В аутоиммунной реакции принимают участие лимфоциты и макрофаги (моноциты). Эти клетки продуцируют цитокины, которые либо непосредственно повреждают β-клетки, либо опосредуют клеточные реакции против β-клеток.
Деструкция β-клеток — результат аутоиммунных реакций. В аутоиммунной реакции принимают участие лимфоциты и макрофаги (моноциты). Эти клетки продуцируют цитокины, которые либо непосредственно повреждают β-клетки, либо опосредуют клеточные реакции против β-клеток.
Слайд 69Инсулинзависимый сахарный диабет — общее название нескольких заболеваний, развивающихся в результате
относительного дефицита инсулина, возникающего вследствие нарушения секреции инсулина, нарушения превращения проинсулина в инсулин, повышения скорости катаболизма инсулина, а также повреждения механизмов передачи инсулинового сигнала в клетки-мишени (например, дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала и др.). ИНСД поражает людей, как правило, старше 40 лет.
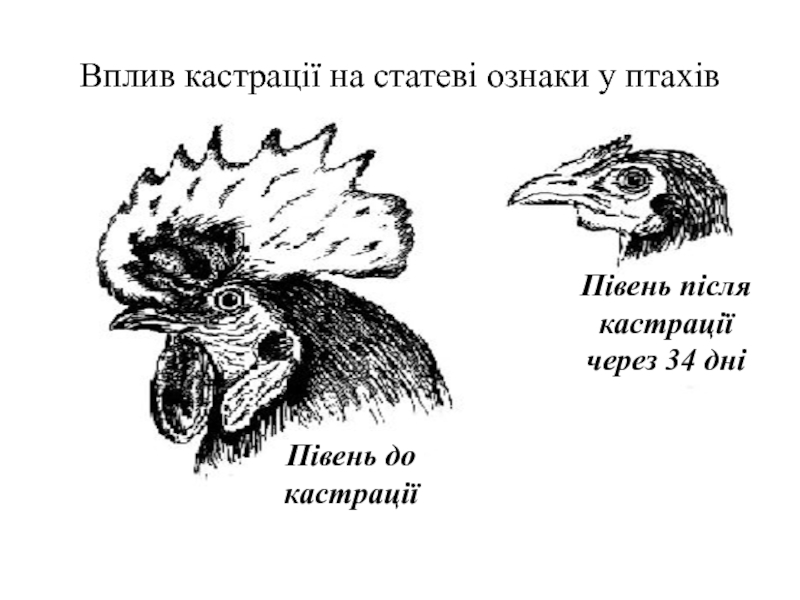
Слайд 72Півень після
кастрації
через 34 дні
Вплив кастрації на статеві ознаки у птахів
Півень
до
кастрації
кастрації
Слайд 77Альдостерон — наиболее активный минералокортикостероид, синтезирующийся в коре надпочечников из холестерола.
Синтез
и секреция альдостерона клетками клубочковой зоны непосредственно стимулируются низкой концентрацией Na+ и высокой концентрацией К+ в плазме крови. На секрецию альдостерона влияют также простагландины, AKTT. Однако наиболее важное влияние на секрецию альдостерона оказывает ренинангиотензиновая система.
Альдостерон не имеет специфических транспортных белков, но за счёт слабых взаимодействий может образовывать комплексы с альбумином. Гормон очень быстро захватывается печенью, где превращается в тетрагидроальдостерон-3-глюкуронид и экскретируется с мочой.
Альдостерон не имеет специфических транспортных белков, но за счёт слабых взаимодействий может образовывать комплексы с альбумином. Гормон очень быстро захватывается печенью, где превращается в тетрагидроальдостерон-3-глюкуронид и экскретируется с мочой.
Слайд 80В коре надпочечников синтезируется более 40 различных стероидов, различающихся по структуре
и биологической активности. Биологически активные кортикостероиды объединяют в 3 основные класса в зависимости от их преобладающего действия.
Глюкокортикоиды, С21 -стероиды, играют важную роль в адаптации к стрессу. Они оказывают разнообразные эффекты, но наиболее важный — стимуляция глюконеогенеза. Основной глюкокортикоид человека — кортизол.
Минералокортикоиды, С21-стероиды, необходимы для поддержания уровня Na+ и К+. Самый активный гормон этого класса — альдостерон.
Андрогены — С19-стероиды. В коре надпочечников образуются предшественники андрогенов, из которых наиболее активный — дегидроэпиандростерон (ДЭА) и слабый — андростендион. Самый мощный андроген надпочечников тестостерон синтезируется в надпочечниках в небольшом количестве. Эти стероиды превращаются в более активные андрогены вне надпочечников.
Глюкокортикоиды, С21 -стероиды, играют важную роль в адаптации к стрессу. Они оказывают разнообразные эффекты, но наиболее важный — стимуляция глюконеогенеза. Основной глюкокортикоид человека — кортизол.
Минералокортикоиды, С21-стероиды, необходимы для поддержания уровня Na+ и К+. Самый активный гормон этого класса — альдостерон.
Андрогены — С19-стероиды. В коре надпочечников образуются предшественники андрогенов, из которых наиболее активный — дегидроэпиандростерон (ДЭА) и слабый — андростендион. Самый мощный андроген надпочечников тестостерон синтезируется в надпочечниках в небольшом количестве. Эти стероиды превращаются в более активные андрогены вне надпочечников.
Слайд 82Предсердный натрийуретический фактор (ПНФ)
Это пептид, содержащий 28 аминокислот с единственным дисульфидным
мостиком. ПНФ синтезируется, главным образом, в кардиомиоцитах предсердий, и хранится в виде препрогормона, состоящего из 126 аминокислотных остатков.
Основным фактором, регулирующим секрецию предсердного натрийуретического фактора, является увеличение АД. Другие стимулы секреции — увеличение осмолярности плазмы, повышение частоты сердцебиений, повышенный уровень катехоламинов и глюкокортикои-дов в крови.
Основные клетки-мишени ПНФ — почки, периферические артерии.
Основным фактором, регулирующим секрецию предсердного натрийуретического фактора, является увеличение АД. Другие стимулы секреции — увеличение осмолярности плазмы, повышение частоты сердцебиений, повышенный уровень катехоламинов и глюкокортикои-дов в крови.
Основные клетки-мишени ПНФ — почки, периферические артерии.
Слайд 87Все циклины делят на 2 подсемейства: G1-циклины (D, Е) и митотические
циклины (А и В). Любой из циклинов представлен группой полиморфных белков, например циклин D представлен формами Dl, D2, D3. У каждого типа циклинов есть гомологичный участок из 100 аминокислотных остатков — «циклиновый бокс», отвечающий за связывание с циклинза-висимой киназой (от англ. CDK — cyclindependent kinases). В клетках эукариотов существует примерно восемь различных CDK (CDK1-8), активирующихся различными циклинами.
Циклинзависимые киназы, связывая циклин, переходят в активную форму и могут фосфорилировать специфические белки, например факторы транскрипции, белки-ингибиторы факторов транскрипции, которые регулируют синтез ферментов, обеспечивающих репликацию. Синтез каждого циклина начинается при подготовке к соответствующей фазе клеточного цикла, его концентрация в клетке повышается, а после окончания фазы резко падает до нуля. Завершившие свою работу комплексы циклинов и CDK связываются специфическими белками, ингибирующими их активность, и затем подвергаются разрушению.
Циклинзависимые киназы, связывая циклин, переходят в активную форму и могут фосфорилировать специфические белки, например факторы транскрипции, белки-ингибиторы факторов транскрипции, которые регулируют синтез ферментов, обеспечивающих репликацию. Синтез каждого циклина начинается при подготовке к соответствующей фазе клеточного цикла, его концентрация в клетке повышается, а после окончания фазы резко падает до нуля. Завершившие свою работу комплексы циклинов и CDK связываются специфическими белками, ингибирующими их активность, и затем подвергаются разрушению.
Слайд 88Эйкозаноиды
Эйкозаноиды — биологически активные вещества, синтезируемые большинством клеток из полиеновых жирных
кислот, содержащих 20 углеродных атомов (слово «эйкоза» по гречески означает 20).
Эйкозаноиды, включающие в себя простагландины, тромбоксаны, лейкотриены и ряд других веществ, — высокоактивные регуляторы клеточных функций. Они имеют очень короткий Т1/2, поэтому оказывают эффекты как «гормоны местного действия», влияя на метаболизм продуцирующей их клетки по аутокринному механизму, и на окружающие клетки — по паракринному механизму.
Эйкозаноиды, включающие в себя простагландины, тромбоксаны, лейкотриены и ряд других веществ, — высокоактивные регуляторы клеточных функций. Они имеют очень короткий Т1/2, поэтому оказывают эффекты как «гормоны местного действия», влияя на метаболизм продуцирующей их клетки по аутокринному механизму, и на окружающие клетки — по паракринному механизму.
Слайд 89Эйкозаноиды участвуют во многих процессах: регулируют тонус ГМК и вследствие этого
влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. Разные типы эйкозаноидов участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции. Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний, например бронхиальной астме и аллергическим реакциям.
Слайд 90Субстраты для синтеза эйкозаноидов
Главный субстрат для синтеза эйкозаноидов у человека
— арахидоновая кислота (20:4,ω-6), так как её содержание в организме человека значительно больше остальных полиеновых кислот-предшественников эйкозаноидов.
В меньшем количестве для синтеза эйкозаноидов используются эйкозапентаеновая (20:5, ω-3) и эйкозатриеновая (20:3, ω-6) жирные кислоты.
Полиеновые кислоты с 20 атомами углерода поступают в организм человека с пищей или образуются из незаменимых (эссенциальных) жирных кислот с 18 атомами углерода, также поступающими с пищей.
В меньшем количестве для синтеза эйкозаноидов используются эйкозапентаеновая (20:5, ω-3) и эйкозатриеновая (20:3, ω-6) жирные кислоты.
Полиеновые кислоты с 20 атомами углерода поступают в организм человека с пищей или образуются из незаменимых (эссенциальных) жирных кислот с 18 атомами углерода, также поступающими с пищей.
Слайд 91Простагландины обозначают символами, например PG А, где PG обозначает слово «простагландин»,
а буква А обозначает заместитель в пятичленном кольце в молекуле эйкозаноида.
Каждая из указанных групп простагландинов состоит из 3 типов молекул, отличающихся по числу двойных связей в боковых цепях. Число двойных связей обозначают нижним цифровым индексом, например, PG Е2.
Каждая из указанных групп простагландинов состоит из 3 типов молекул, отличающихся по числу двойных связей в боковых цепях. Число двойных связей обозначают нижним цифровым индексом, например, PG Е2.
Слайд 92Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда
и происходит их название, и стимулируют их агрегацию при образовании тромба.
Тромбоксаны имеют шестичленное кольцо, включающее атом кислорода. Так же, как и другие эйкозаноиды, тромбоксаны могут содержать различное число двойных связей в боковых цепях, образуя ТХ А2 или ТХ А3, отличающиеся по активности. ТХ В2 — продукт катаболизма ТХ А2 и активностью не обладает.
Тромбоксаны имеют шестичленное кольцо, включающее атом кислорода. Так же, как и другие эйкозаноиды, тромбоксаны могут содержать различное число двойных связей в боковых цепях, образуя ТХ А2 или ТХ А3, отличающиеся по активности. ТХ В2 — продукт катаболизма ТХ А2 и активностью не обладает.
Слайд 93Лейкотриены также образуются из эйкозаноевых кислот, однако в их структуре отсутствуют
циклы, как у простагландинов, и они имеют 3 сопряжённые двойные связи, хотя общее число двойных связей в молекуле больше. Лейкотриены С4, D4 и Е4 имеют заместители в виде трипептида глутатиона, дипептида глицил-цистеина или цистеина, соответственно.
Слайд 94Эйкозаноиды - гормоны местного действия по ряду признаков:
образуются в различных тканях
и органах, а не только в эндокринных железах;
• действуют по аутокринному или паракринному механизмам;
• концентрация эйкозаноидов в крови меньше, чем необходимо, чтобы вызвать ответ в клетках-мишенях.
Только при некоторых патологических состояниях эйкозаноиды могут оказывать системное действие, если их концентрация в крови увеличивается до количеств, когда они могут оказать действие на ГМК всего органа, например кишечника, лёгких, кровеносных сосудов.
• действуют по аутокринному или паракринному механизмам;
• концентрация эйкозаноидов в крови меньше, чем необходимо, чтобы вызвать ответ в клетках-мишенях.
Только при некоторых патологических состояниях эйкозаноиды могут оказывать системное действие, если их концентрация в крови увеличивается до количеств, когда они могут оказать действие на ГМК всего органа, например кишечника, лёгких, кровеносных сосудов.
Слайд 95Эйкозаноиды действуют на клетки через специальные рецепторы. Некоторые рецепторы эйкозаноидов связаны
с аденилатциклазной системой и протеинкиназой А — это рецепторы PGE, PG D, PC I. PG F2α, ТХ А2, эндоперекиси (ГПЭТЕ) и лейкотриены действуют через механизмы, увеличивающие уровень кальция в цитозоле клеток-мишеней. Во многих клетках эйкозаноиды влияют на степень активации аденилатциклазной системы в ответ на действие других факторов, например гормонов. В этих случаях эйкозаноиды влияют на конформацию G-белков в плазматической мембране клеток. Если эйкозаноид связывается со стимулирующими Gs-белками, то эффект основного стимулирующего агента увеличивается; если с Сі-ингибирующими — эффект снижается. Эйкозаноиды действуют на клетки почти всех тканей организма. Избыточная продукция эйкозаноидов наблюдается при многих заболеваниях.
Слайд 96Роль эйкозаноидов в развитии воспаления
Воспаление — реакция организма на повреждение или
инфекцию, направленная на уничтожение инфекционного агента и восстановление повреждённых тканей. Продукция медиаторов воспаления — эйкозаноидов, гистамина, кининов (пептидных гормонов местного действия) — активируется каскадами реакций, запускающимися при внедрении инфекционных агентов или повреждении тканей.
Слайд 97Многие эйкозаноиды выполняют функцию медиаторов воспаления и действуют на всех этапах
воспаления. В результате увеличивается проницаемость капилляров, транссудат и лейкоциты проходят через сосудистую стенку. Лейкотриен В4 и липоксин А4 являются мощными факторами хемотаксиса; взаимодействуя с рецепторами, стимулируют движение лейкоцитов в область воспаления и секрецию ими лизосомальных ферментов и фагоцитоз чужеродных частиц.
Слайд 98Аспирин — препарат, подавляющий основные признаки воспаления. Механизм противовоспалительного действия аспирина
стал понятен, когда обнаружили, что он ингибирует циклооксигеназу. Следовательно, он уменьшает синтез медиаторов воспаления и, таким образом, уменьшает воспалительную реакцию. Циклооксигеназа необратимо ингибируется путём ацетилирования серина в положении 530 в активном центре. Однако эффект действия аспирина не очень продолжителен, так как экспрессия гена этого фермента не нарушается и продуцируются новые молекулы фермента. Другие нестероидные противовоспалительные препараты (например, ибупрофен и ацетаминофен) действуют по конкурентному механизму, связываясь в активном центре фермента, и также снижают синтез простагландинов.