- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия биогенных элементов. Лекция 14 презентация
Содержание
- 1. Химия биогенных элементов. Лекция 14
- 2. План 14.1 Основы биогеохимии 14.2 Химия s-элементов 14.3 Химия d-элементов 14.4 Химия p-элементов
- 3. 14.1 Биогеохимия – это наука, изучающая распределение химических элементов и их миграцию в биосфере.
- 4. Основным вопросом биогеохимии является вопрос о взаимосвязи живого и неживого вещества.
- 5. Становление биогеохимии как науки произошло в 30-е
- 6. В.И. ВЕРНАДСКИЙ (1863-1945) Академик Вернадский– основоположник
- 7. Биосфера – это единственная область Земли, занятая
- 8. Анализируя содержание элементов в земной коре
- 9. Однако по количественному составу объекты живой и неживой природы существенно отличаются друг от друга.
- 10. 98 % земной коры составляют 8 химических
- 11. В живом организме преобладают 6 элементов: С,
- 12. В земной коре преобладают металлы,
- 13. Из основных элементов биомассы только кислород и кальций широко представлены в земной коре.
- 14. Такие элементы как кремний, алюминий и железо,
- 15. Согласно теории
- 16. Например: С – макро-элемент, т.к. образуемые им
- 17. БИОГЕННЫМИ называются химические элементы в той или
- 18. К важнейшим биогенным элементам относятся: 6 неметаллов-органогенов:
- 19. По содержанию в биомассе химические элементы делятся
- 20. МИКРОЭЛЕМЕНТЫ (10‾5-10‾3 %):
- 21. Установлена взаимосвязь между содержанием элемента в организме и его положением в ПС.
- 22. В подгруппах сверху вниз происходит увеличение токсичности
- 24. На токсичность химического элемента влияет степень его
- 25. Так, ионы хрома Сr3+ являются малотоксичными, а
- 26. А.П. Виноградов сформулировал понятие о БИОГЕОХИ-МИЧЕСКОЙ ПРОВИНЦИИ. 1895-1975
- 27. Это часть биосферы, характеризующаяся экстремальными геохимическими условиями
- 28. Например, Белорусское Полесье характеризуется крайне низким содержанием
- 29. Спектр йоддефицитных заболеваний весьма широк. Дефицит тиреоидных
- 30. Биогеохимия явилась фундаментом для современной экологической химии,
- 31. К важнейшим токсикантам относятся: 1) СО2 – энергетика, промышленность, отопление
- 32. Избыток CO2 в атмосфере создает парни-ковый эффект
- 33. 2) СО – металлургия, транспорт, переработка нефти;
- 34. 3) SO2 – энергетика, химическая промышленность, переработка нефти; является причиной появления кислотных дождей.
- 35. 4) NO и NO2 – двигатели внутреннего
- 36. 5) Hg – производство лаков и красок, обогащение руд, целлюлозно-бумажная промышлен-ность
- 37. 6) Pb – химическая и горнодобыва-ющая промышлен-ность, двигатели внутреннего сгорания
- 38. 7) фосфаты химические моющие средства, удобрения
- 39. 8) нефть – нефтеперерабатывающая промышленность, транспортировка нефти
- 40. 9) пестициды – сельское хозяйство, хлорирование воды
- 41. 14.2 Исходя из современной квантово-механической интерпретации периодической
- 42. Она основана на характере заполнения орбиталей электронами.
- 43. К s-блоку относятся химические элементы с электронной
- 44. Различают s1-элементы (щелочные металлы и водород )
- 45. Элементы s-блока – это металлы (исключение составляют
- 46. Их высокая металличность обусловлена большими атомными радиусами
- 47. В подгруппах s-элементов сверху вниз металличность атомов
- 48. В своих соединениях s-металлы проявляют степени окисления
- 49. Оксиды и гидроксиды s-металлов имеют основной характер,
- 50. Исключением являются BeO и Be(OH)2, обладающие амфотерными
- 51. Гидриды s-металлов – твердые солеподобные вещества ионного
- 52. Особое положение среди s-элементов занимает водород. Согласно
- 53. К важнейшим биогенным элементам s-блока, кроме H,
- 54. К высокотоксичным элементам относится барий. Например, высшей
- 56. 14.3 Элементами d-блока (или переходными элементами) называются
- 57. Исключение составляют Ag, Cu, Au, Cr,
- 58. Появление электронного проскока объясняется повышенной стабильностью d-подуровня:
- 59. Элементы d-блока расположены в побочных подгруппах
- 60. Особенностью d-элементов является отсутствие монотонности в изменении
- 61. Причиной этого явления является эффект
- 62. Сильнее всего эффект d-сжатия проявляется у d1,
- 63. R,нм Порядковый номер элемента Зависимость атомных радиусов
- 64. Наличие эффекта d - сжатия является причиной
- 65. Элементы триад имеют сходные физико-химические и биологические свойства из-за близкого значения атомных радиусов.
- 66. Триада железа
- 67. К важнейшим соединениям d-элементов относятся: оксиды основные
- 68. Гидроксиды Основания Амфотерные основания Кислоты Fe(OH)2 Zn(OH)2, Fe(OH)3 Cr(OH)3 H2FeO4
- 69. Гидриды Большинство d- элементов образуют гидриды переменного
- 70. Для большинства d-элементов характерно многообразие степеней окисления атомов в соединениях.
- 71. Степени окисления d-элементов
- 72. С ростом степени окисления: а) увеличивается кислотность
- 73. d-Элементы являются лучшими комплексообразователя-ми, так как для
- 74. Самыми сильными комплексообразовате-лями являются элементы триад. Это обусловлено эффектом d– cжатия.
- 75. В биосистемах d-элементы присутствуют только в форме комплексных соединений с биолигандами.
- 76. К биогенным элементам d-блока относятся Fe, Co,
- 77. 14.4 К p-блоку относятся элементы с общей формулой ns2npx, где x = 1-6
- 78. Они расположены в III A – VIII
- 79. Диагональ B – At делит p-элементы на металлы (под диагональю) и неметаллы (над диагональю)
- 80. В подгруппах сверху вниз металлические свойства p-элементов усиливаются, а неметаллические ослабевают.
- 81. Об этом свидетельствует уменьшение энергии ионизации, сродства к электрону и электроотрицательнос-ти.
- 82. В периодах слева направо усиливают-ся неметаллические свойства и ослабевают металлические.
- 83. Наиболее активными неметаллами являются галогены и халькогены.
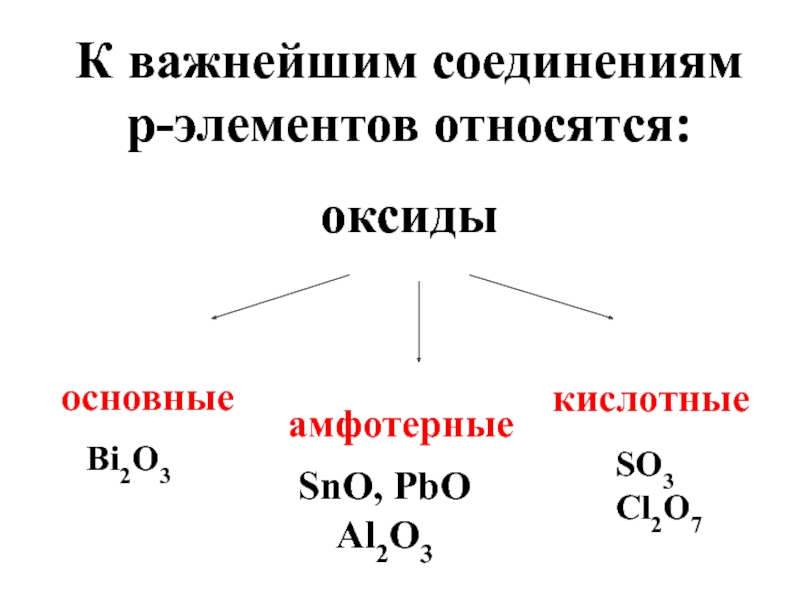
- 84. К важнейшим соединениям p-элементов относятся: оксиды основные кислотные амфотерные Bi2O3 SnO, PbO Al2O3 SO3 Cl2O7
- 85. Кроме того, неметаллы p-блока образуют несолеобразующие оксиды,
- 86. Гидроксиды Основания Амфотерные основания Кислоты Bi(OH)3 Al(OH)3 Pb(OH)2 Sn(OH)2 H2SO4 HNO3
- 87. C увеличением металличности атомов усиливается основность оксидов
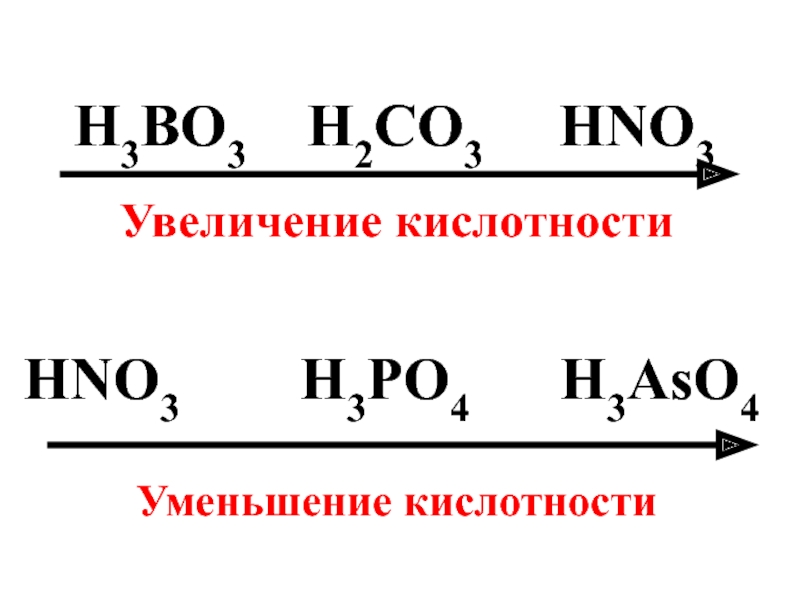
- 88. H3BO3 H2CO3 HNO3 Увеличение
- 89. Подобно d-элементам, p-элементы характеризуются многообразием степеней окисления атомов в их соединениях.
- 90. С увеличением степени окисления атомов возрастает кислотность
- 91. Гидриды p-металлов (AlH3)x, SnH2 – это твердые кристаллические вещества, разлагаемые водой и кислотами.
- 92. Водородные соединения p-неметаллов – газы, растворяющиеся в
- 93. Кроме того, элементы IV A- группы углерод
- 94. В подгруппах сила бескислородных кислот уменьшается с
- 95. Важнейшими биогенными элементами p-блока являются неметаллы-органогены С,
- 96. Благодарим за внимание!!!
Слайд 2План
14.1 Основы биогеохимии
14.2 Химия s-элементов
14.3 Химия d-элементов
14.4 Химия p-элементов
Слайд 314.1 Биогеохимия – это наука, изучающая распределение химических элементов и их
Слайд 5Становление биогеохимии как науки произошло в 30-е годы XX века.
Слайд 6В.И. ВЕРНАДСКИЙ
(1863-1945)
Академик Вернадский– основоположник современных наук о Земле - геохимии,
Слайд 7Биосфера – это единственная область Земли, занятая жизнью. Все живые существа
Слайд 8
Анализируя содержание элементов в земной коре и в живых организмах, Вернадский
Слайд 9Однако по количественному составу объекты живой и неживой природы существенно отличаются
Слайд 11В живом организме преобладают 6 элементов: С, H, О, N, P,
Слайд 14Такие элементы как кремний, алюминий и железо, находящиеся в земной коре
Слайд 15Согласно теории
Слайд 16Например: С – макро-элемент, т.к. образуемые им оксиды СО и СО2
Si – микроэлемент, т.к. SiO2 – нерастворимое в воде твердое вещество.
Слайд 17БИОГЕННЫМИ называются химические элементы в той или иной форме входящие в
Слайд 18К важнейшим биогенным элементам относятся:
6 неметаллов-органогенов: C, O, H, N, P,
10 биометаллов (металлов жизни): Na, K, Mg, Ca (s-элементы) и Fe, Co, Cu, Zn, Mn, Mo (d-элементы).
Слайд 19По содержанию в биомассе химические элементы делятся на:
МАКРОЭЛЕМЕНТЫ (более 10‾2 %):
Слайд 20МИКРОЭЛЕМЕНТЫ (10‾5-10‾3 %): биометаллы, относящиеся к d-блоку,
УЛЬТРАМИКРОЭЛЕМЕНТЫ (менее 10‾5 %): Hg, Au и др.
Слайд 22В подгруппах сверху вниз происходит увеличение токсичности химических элементов и их
Слайд 24На токсичность химического элемента влияет степень его окисления в соединении. Чем
Слайд 25Так, ионы хрома Сr3+ являются малотоксичными, а анионы СrO42- и Cr2O72-,
Слайд 27Это часть биосферы, характеризующаяся экстремальными геохимическими условиями и определенными постоянными реакциями
Слайд 28Например, Белорусское Полесье характеризуется крайне низким содержанием йода, что приводит к
Слайд 29Спектр йоддефицитных заболеваний весьма широк. Дефицит тиреоидных гормонов у плода приводит
Слайд 30Биогеохимия явилась фундаментом для современной экологической химии, изучающей вопросы, связанные с
Слайд 332) СО – металлургия, транспорт, переработка нефти;
СО образует комплекс с
Слайд 343) SO2 – энергетика, химическая промышленность, переработка нефти; является причиной появления
Слайд 354) NO и NO2 – двигатели внутреннего сгорания, реактивные двигатели,
домны,
Слайд 409) пестициды – сельское хозяйство, хлорирование воды (диоксины);
10) радиация – производство
Слайд 4114.2 Исходя из современной квантово-механической интерпретации периодической системы, классификация химических элементов
Слайд 42Она основана на характере заполнения орбиталей электронами. В соответствии с этим
Слайд 44Различают s1-элементы (щелочные металлы и водород ) и s2-элементы (Be, Mg,
Слайд 45Элементы s-блока – это металлы (исключение составляют H и He). Самыми
Слайд 46Их высокая металличность обусловлена большими атомными радиусами и лишь одним валентным
s2-Элементы уступают им по металличности, так как имеют меньшие радиусы и большее число валентных электронов.
Слайд 47В подгруппах s-элементов сверху вниз металличность атомов усиливается, что обусловлено увеличением
Слайд 48В своих соединениях s-металлы проявляют степени окисления +1 (щелочные) и +2
оксиды Me2O и MeO,
гидроксиды MeOH и Me(OH)2,
гидриды MeH и MeH2
соли
Слайд 49Оксиды и гидроксиды s-металлов имеют основной характер, усиливающий с ростом металличности
NaOH Mg(OH)2
Уменьшение основности
LiOH, NaOH, KOH, CsOH, FrOH
Увеличение основности
Слайд 50Исключением являются BeO и Be(OH)2, обладающие амфотерными свойствами:
2 H+ + BeO22-
Ka = 10-30
Kb = 10-18
Амфотерность – это кислотно-основная двойственность.
Слайд 51Гидриды s-металлов – твердые солеподобные вещества ионного типа, легко разлагающиеся водой
MgH2 + 2 H2O → Mg(OH)2 + 2 H2
MgH2 + 2 HCl → MgCl2 + 2 H2
Слайд 52Особое положение среди s-элементов занимает водород. Согласно современным представлениям, водород с
Слайд 53К важнейшим биогенным элементам s-блока, кроме H, относятся Na, K, Ca
Слайд 54К высокотоксичным элементам относится барий. Например, высшей летальной дозой BaCl2 является
Слайд 5614.3 Элементами d-блока (или переходными элементами) называются элементы, атомы которых имеют
Слайд 57Исключение составляют
Ag, Cu, Au, Cr, Pt, Nb, Ru, Rh и
Слайд 58Появление электронного проскока объясняется повышенной стабильностью d-подуровня:
а) полностью заполненного электронами (d10),
б)
Слайд 59
Элементы d-блока расположены в побочных подгруппах I Б –VIII Б; они
Слайд 60Особенностью d-элементов является отсутствие монотонности в изменении их свойств как в
Слайд 61Причиной этого явления является эффект
Слайд 62Сильнее всего эффект d-сжатия проявляется у d1, d2 и d3 –элементов,
Слайд 63R,нм
Порядковый номер элемента
Зависимость атомных радиусов d-элементов от их порядкового номера в
d6
d7
d8
d10
d1
Слайд 64Наличие эффекта d - сжатия является причиной появления триад d-элементов ,
Триада железа : Fe, Co, Ni.
Триады платиновых металлов:
Ru, Rh, Pd, Os, Ir, Pt.
Слайд 65Элементы триад имеют сходные физико-химические и биологические свойства из-за близкого значения
Слайд 67К важнейшим соединениям d-элементов относятся:
оксиды
основные
кислотные
амфотерные
FeO
MnO
ZnO, Fe2O3
Cr2O3
FeO3
Mn2O7
Слайд 69Гидриды
Большинство d- элементов образуют гидриды переменного состава
Слайд 70Для большинства d-элементов характерно многообразие степеней окисления атомов в
Слайд 72С ростом степени окисления:
а) увеличивается кислотность оксидов и гидроксидов,
б) возрастают окислительные
Слайд 73d-Элементы являются лучшими комплексообразователя-ми, так как для них характерны маленькие ионные
Слайд 74Самыми сильными комплексообразовате-лями являются элементы триад. Это обусловлено эффектом d– cжатия.
Слайд 76К биогенным элементам d-блока относятся Fe, Co, Mo, Cu, Zn, Mn.
активируют ферменты,
входят в состав гормонов и витаминов,
участвуют в процессах кроветворения и тканевого дыхания
Слайд 78Они расположены в III A – VIII A группах.
Халькогены (VI
Галогены (VII A группа),
Инертные газы (VIII A группа),
Элементы подгрупп бора, углерода и азота.
Слайд 80В подгруппах сверху вниз металлические свойства p-элементов усиливаются, а неметаллические ослабевают.
Слайд 81Об этом свидетельствует уменьшение энергии ионизации, сродства к электрону и
Слайд 84К важнейшим соединениям p-элементов относятся:
оксиды
основные
кислотные
амфотерные
Bi2O3
SnO, PbO
Al2O3
SO3
Cl2O7
Слайд 85Кроме того, неметаллы p-блока образуют несолеобразующие оксиды, имеющие высокую физиологическую активность
Слайд 87C увеличением металличности атомов усиливается основность оксидов и гидроксидов, а с
Слайд 89Подобно d-элементам, p-элементы характеризуются многообразием степеней окисления атомов в их соединениях.
Слайд 90С увеличением степени окисления атомов возрастает кислотность оксидов и гидроксидов элементов
HClO HClO2 HClO3 HClO4
Увеличение кислотности
Слайд 91Гидриды p-металлов (AlH3)x, SnH2 – это твердые кристаллические вещества, разлагаемые водой
Слайд 92Водородные соединения p-неметаллов – газы, растворяющиеся в воде с образованием:
a)бескислородных
б) оснований (NH3, PH3, AsH3),
Слайд 93Кроме того, элементы IV A- группы углерод и кремний образуют водородные
Слайд 94В подгруппах сила бескислородных кислот уменьшается с ростом активности соответствующих неметаллов:
HF
HCl
HBr
HI
H2S
H2Se
H2Te
Уменьшение кислотности
Уменьшение кислотности