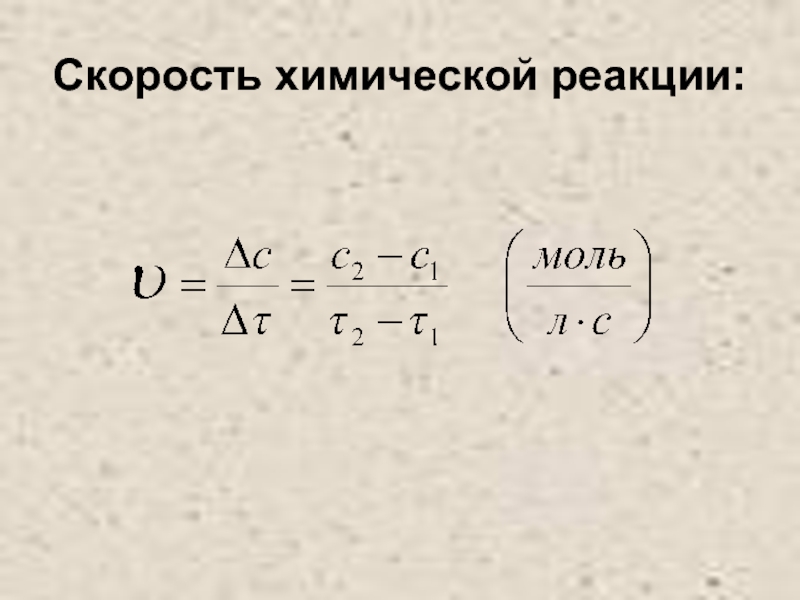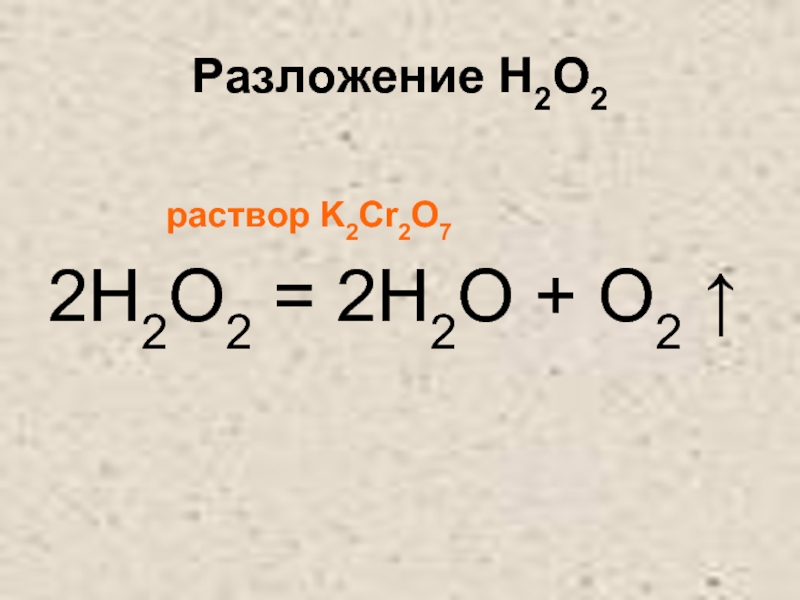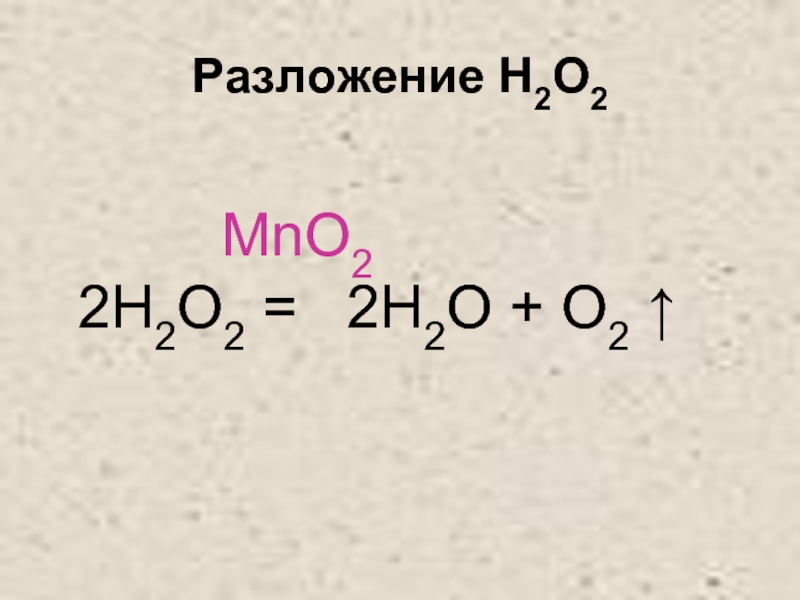- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок-исследованиеТема: Скорость химических реакций презентация
Содержание
- 1. Урок-исследованиеТема: Скорость химических реакций
- 2. Цель урока: Выяснить, что такое скорость химической
- 3. Скорость химической реакции:
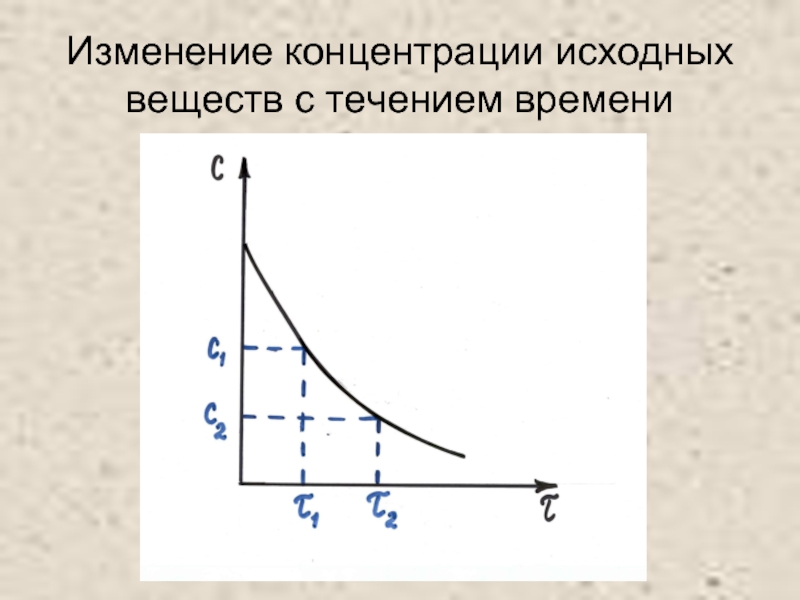
- 4. Изменение концентрации исходных веществ с течением времени
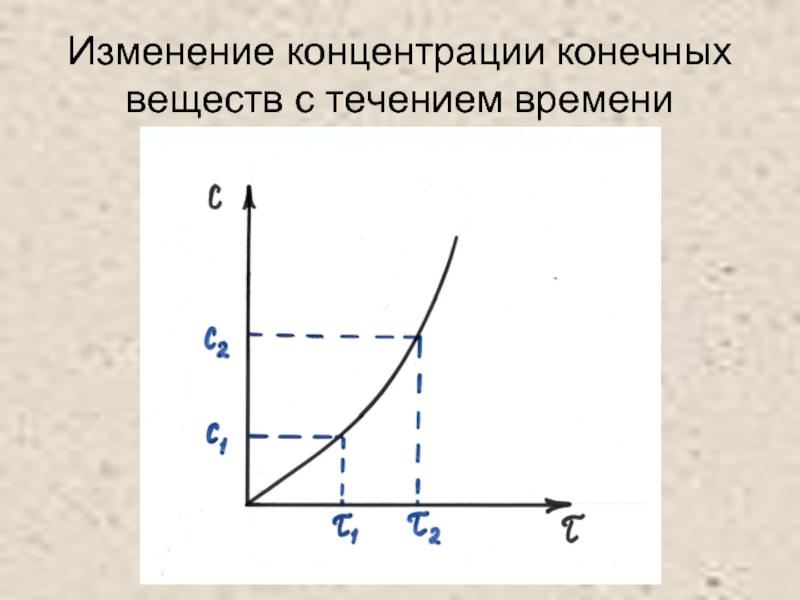
- 5. Изменение концентрации конечных веществ с течением времени
- 6. Скорость химической реакции в гомогенной системе:
- 7. Скорость химической реакции в гетерогенной системе:
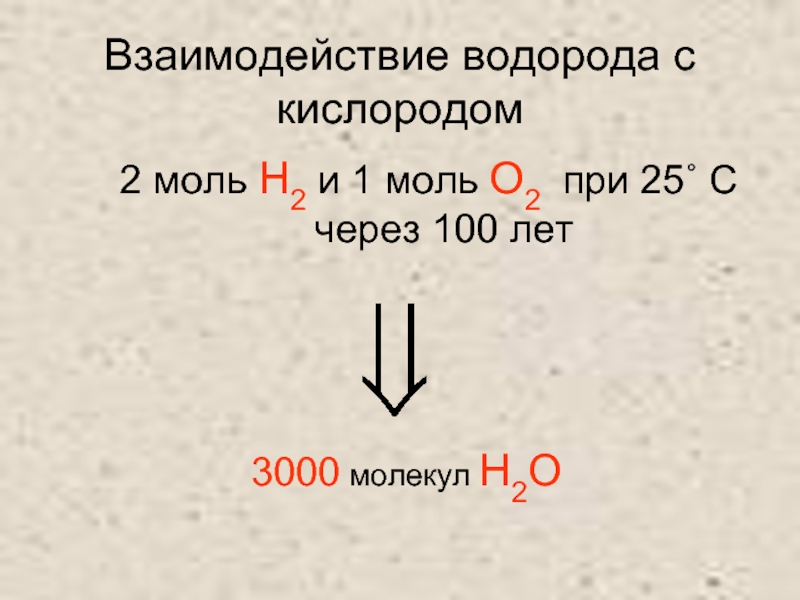
- 8. Взаимодействие водорода с кислородом 2 моль H2
- 9. Влияние на скорость реакции различных факторов
- 10. 1) Природа реагирующих веществ Zn
- 11. 2) Концентрация реагирующих веществ Zn +
- 12. Закон «действующих масс»: Скорость химической реакции прямо
- 13. Взаимодействие водорода с азотом
- 14. Горение угля
- 15. 3) Величина поверхности соприкосновения реагирующих
- 16. 4) Температура Правило Вант-Гоффа:
- 17. Правило Вант-Гоффа: Где - температурный коэффициент
- 18. Задача: Во сколько раз увеличится скорость реакции?
- 19. Энергия активации
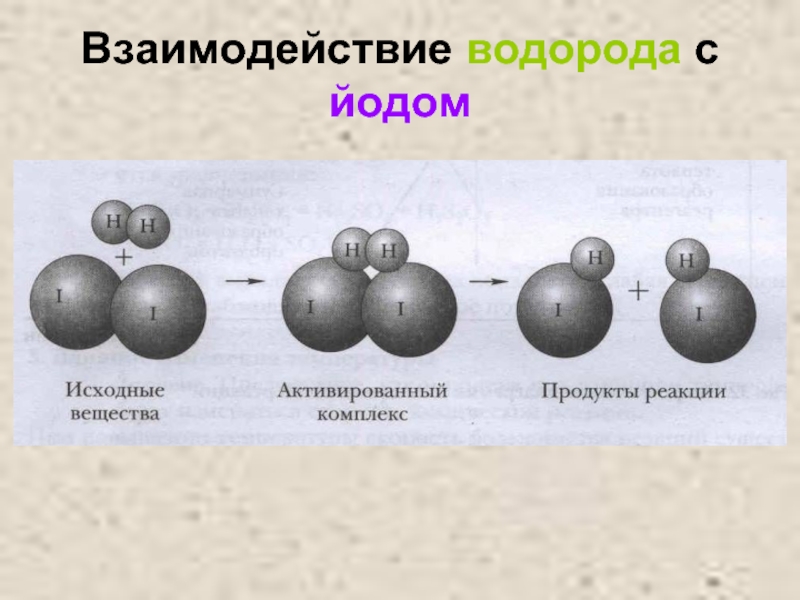
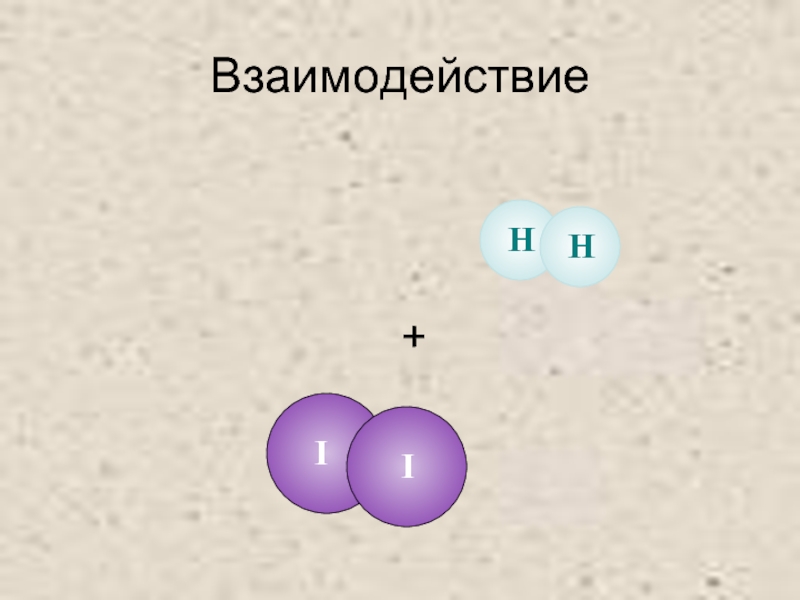
- 20. Взаимодействие водорода с йодом
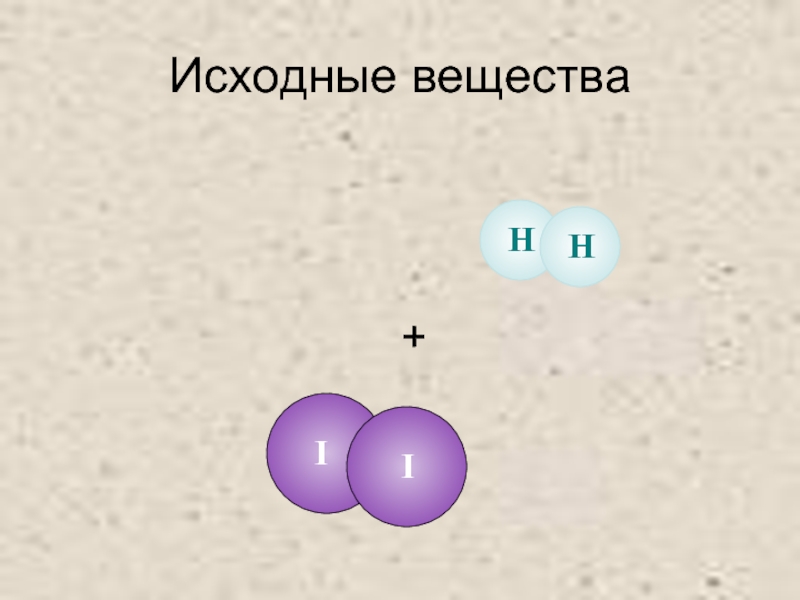
- 21. Исходные вещества +
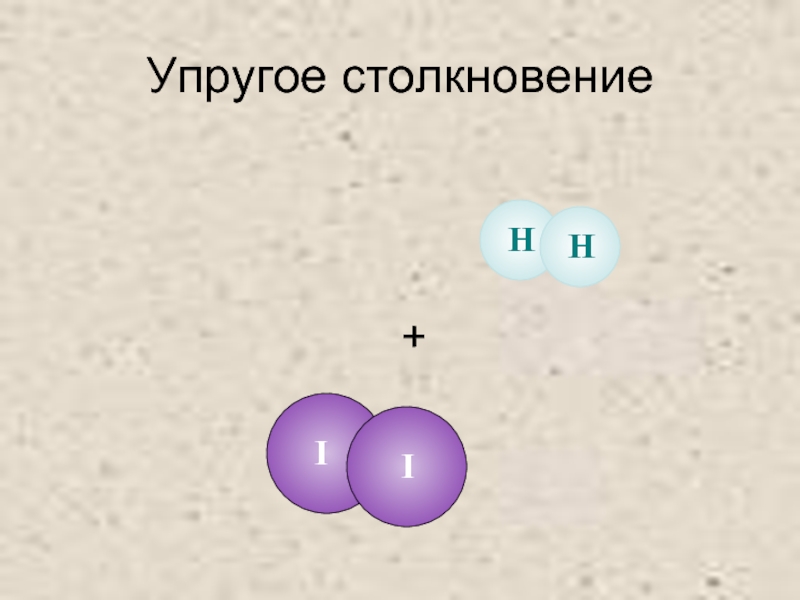
- 22. Упругое столкновение +
- 23. Взаимодействие +
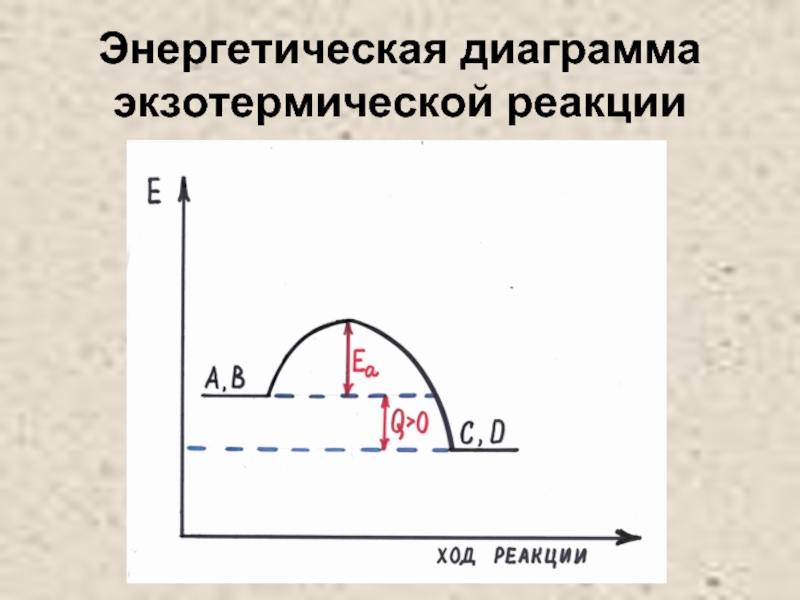
- 24. Энергетическая диаграмма экзотермической реакции
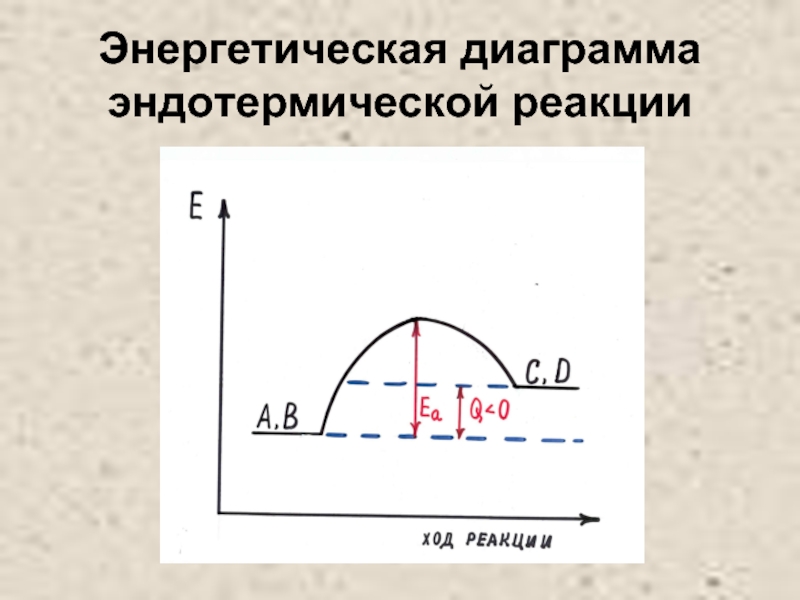
- 25. Энергетическая диаграмма эндотермической реакции
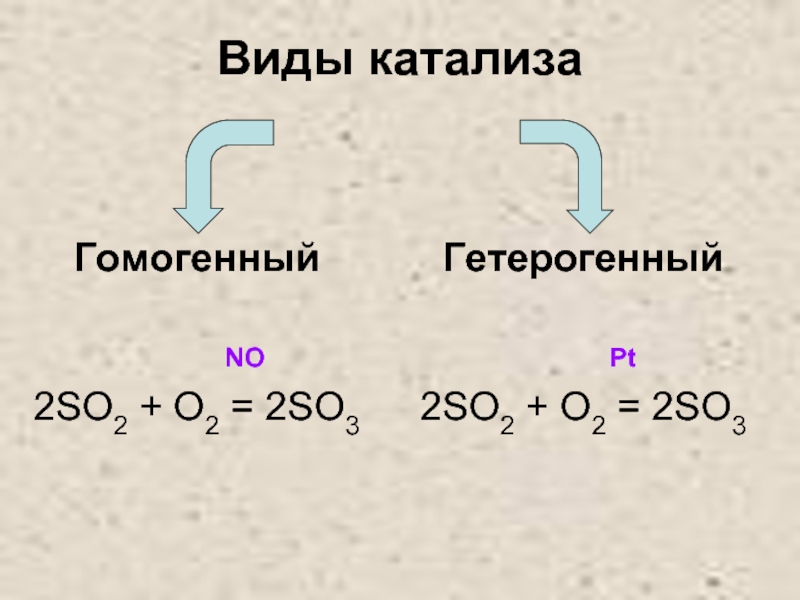
- 26. Виды катализа Гомогенный
- 27. Механизм действия катализаторов Для гомогенного катализа:
- 28. Окисление SO2 в SO3
- 29. Разложение H2O2
- 30. Разложение H2O2
Слайд 1Урок-исследование
Тема: Скорость химических реакций
Учитель химии МОУ «Лицей №4» Ширяева Татьяна Анатольевна
Слайд 2Цель урока:
Выяснить, что такое скорость химической реакции.
Выяснить, какие факторы и как
влияют на скорость химической реакции.
Слайд 8Взаимодействие водорода с кислородом
2 моль H2 и 1 моль О2 при
25˚ С
через 100 лет
3000 молекул H2О
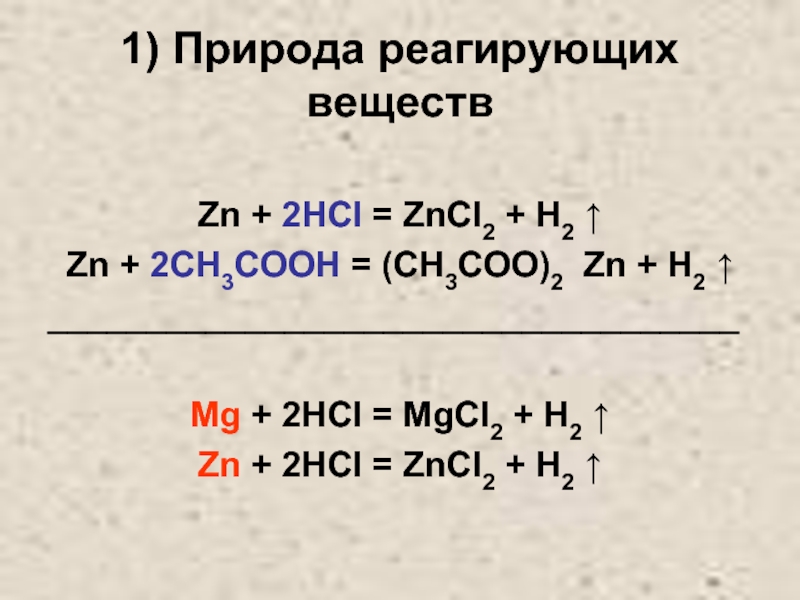
Слайд 101) Природа реагирующих веществ
Zn + 2HCl = ZnCl2 + H2
↑
Zn + 2CH3COOH = (CH3COO)2 Zn + H2 ↑
___________________________________
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Zn + 2CH3COOH = (CH3COO)2 Zn + H2 ↑
___________________________________
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Слайд 112) Концентрация реагирующих веществ
Zn + 2HCl = ZnCl2 + H2 ↑
а)
раствор HCl
б) концентрированная HCl
б) концентрированная HCl
Слайд 12Закон «действующих масс»:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Слайд 15
3) Величина поверхности соприкосновения реагирующих веществ
CaCO3 + 2HCl = CaCl2 +
H2O + CO2 ↑
а) кусочек CaCO3
б) измельченный CaCO3
а) кусочек CaCO3
б) измельченный CaCO3
Слайд 164) Температура
Правило Вант-Гоффа:
При повышении температуры на каждые 100 C
скорость большинства реакций увеличивается в 2-4 раза.
Слайд 27Механизм действия катализаторов
Для гомогенного катализа:
K
A + B = AB
A + K = [AK]
[AK] + B = AB + K
A + B = AB
A + K = [AK]
[AK] + B = AB + K