- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТЕРМОДИНАМИКА презентация
Содержание
- 1. ТЕРМОДИНАМИКА
- 2. Внутренняя энергия
- 3. Термодинамика – раздел физики, изучающий возможности использования
- 4. Число степеней свободы – число возможных независимых
- 5. Внутренняя энергия данной массы идеального газа зависит
- 6. Внутренняя энергия Теплообмен – процесс передачи энергии
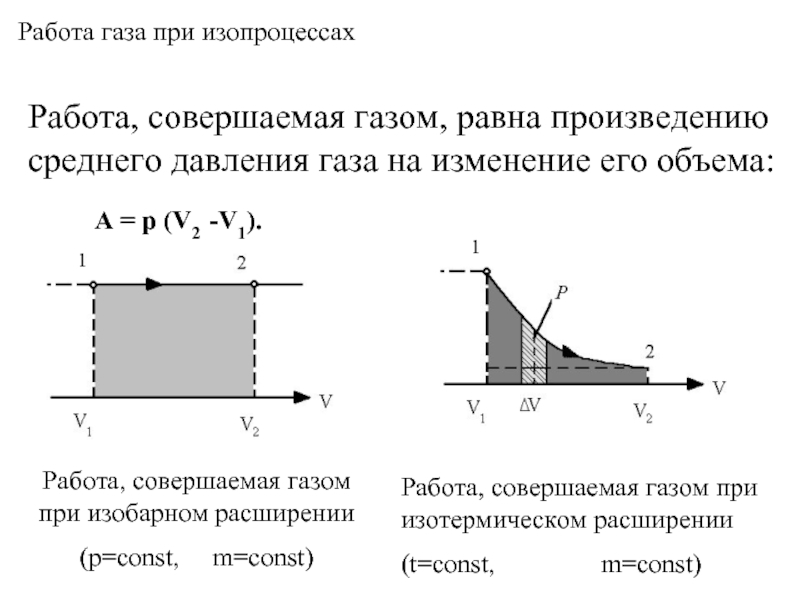
- 7. Работа газа при изопроцессах
- 8. Работа, совершаемая газом, равна произведению среднего давления
- 9. Работа газа при изопроцесах При расширении (ΔV>0)
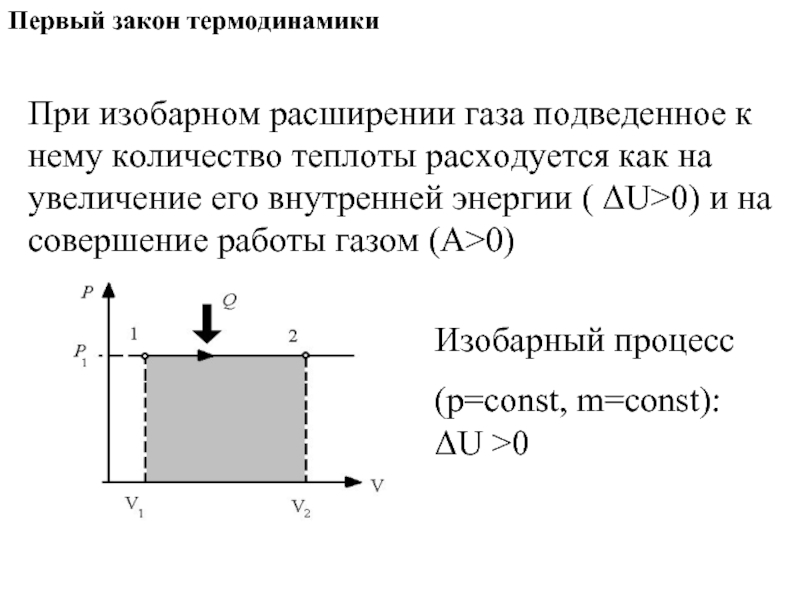
- 10. Первый закон термодинамики
- 11. Изменение внутренней энергии системы при переходе из
- 12. Первый закон термодинамики Изменение внутренней энергии газа
- 13. Первый закон термодинамики При изобарном расширении газа
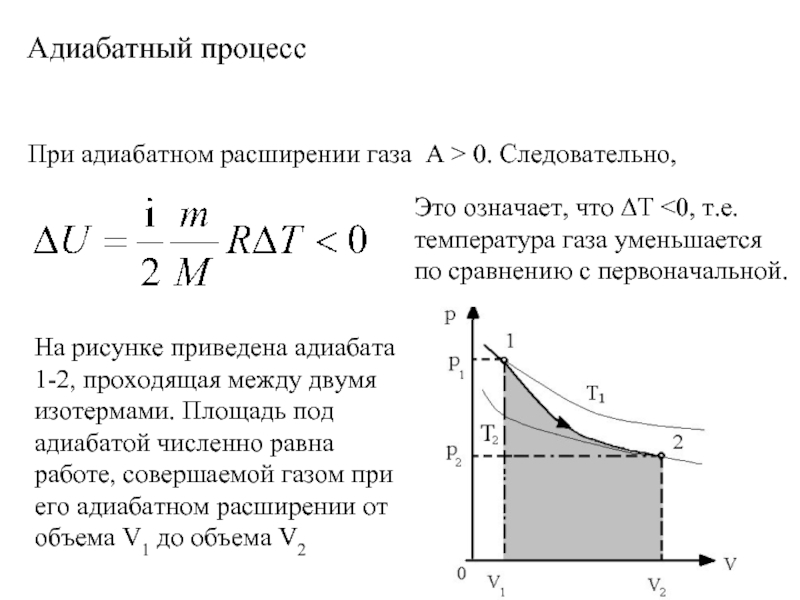
- 14. Адиабатный процесс
- 15. Теплоизолированная система – система, не обменивающаяся энергией
- 16. Адиабатный процесс При адиабатном расширении газа А > 0. Следовательно, Это означает, что ΔТ
- 17. Адиабатный процесс При сжатии поршнем воздуха, находящегося
- 18. Тепловые двигатели
- 19. Тепловой двигатель – устройство, преобразующее внутреннюю энергию
- 20. Второй закон термодинамики
- 21. Второй закон термодинамики Обратимый процесс – процесс,
- 22. Второй закон термодинамики Второй закон термодинамики В
- 23. Второй закон термодинамики Взаимная диффузия водорода и
Слайд 3Термодинамика – раздел физики, изучающий возможности использования внутренней энергии тел для
Внутренняя энергия
Средняя кинетическая энергия одного атома
Одной из основных величин, используемых в термодинамике, является внутренняя энергия тела.
Внутренняя энергия тела – сумма кинетической энергии хаотического теплового движения частиц (атомов или молекул) тела и потенциальной энергии их взаимодействия.
Слайд 4Число степеней свободы – число возможных независимых направлений движения молекулы.
Внутренняя энергия
Внутренняя
Слайд 5Внутренняя энергия данной массы идеального газа зависит лишь от одного макроскопического
Формулы для внутренней энергии идеального газа можно обобщить:
Внутренняя энергия
где i – число степеней свободы молекул газа.
Слайд 6Внутренняя энергия
Теплообмен – процесс передачи энергии от одного тела к другому
Количество теплоты, получаемое телом, - энергия, передаваемая телу извне в результате теплообмена.
Слайд 8Работа, совершаемая газом, равна произведению среднего давления газа на изменение его
Работа газа при изопроцессах
A = p (V2 -V1).
Работа, совершаемая газом при изобарном расширении
(p=const, m=const)
Работа, совершаемая газом при изотермическом расширении
(t=const, m=const)
Слайд 9Работа газа при изопроцесах
При расширении (ΔV>0) газ совершает положительную работу, отдавая
При сжатии (ΔV>0) работа, совершаемая газом, отрицательна. Внутренняя энергия газа при сжатии увеличивается
Слайд 11Изменение внутренней энергии системы при переходе из одного состояния в другое
Первый закон термодинамики
Δ U = Q + Aвн
Количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
Q = ΔU + A
Слайд 12Первый закон термодинамики
Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими
Q = Δ U
При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
Q = A
Слайд 13Первый закон термодинамики
При изобарном расширении газа подведенное к нему количество теплоты
Изобарный процесс
(p=const, m=const): ΔU >0
Слайд 15Теплоизолированная система – система, не обменивающаяся энергией с окружающими телами (Q=0).
Адиабатный
Адиабатный процесс – термодинамический процесс в изолированной системе.
Первый закон термодинамики для адиабатного процесса имеет вид:
или
Δ U+А=0
А= - Δ U
Слайд 16Адиабатный процесс
При адиабатном расширении газа А > 0. Следовательно,
Это означает, что
На рисунке приведена адиабата 1-2, проходящая между двумя изотермами. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатном расширении от объема V1 до объема V2
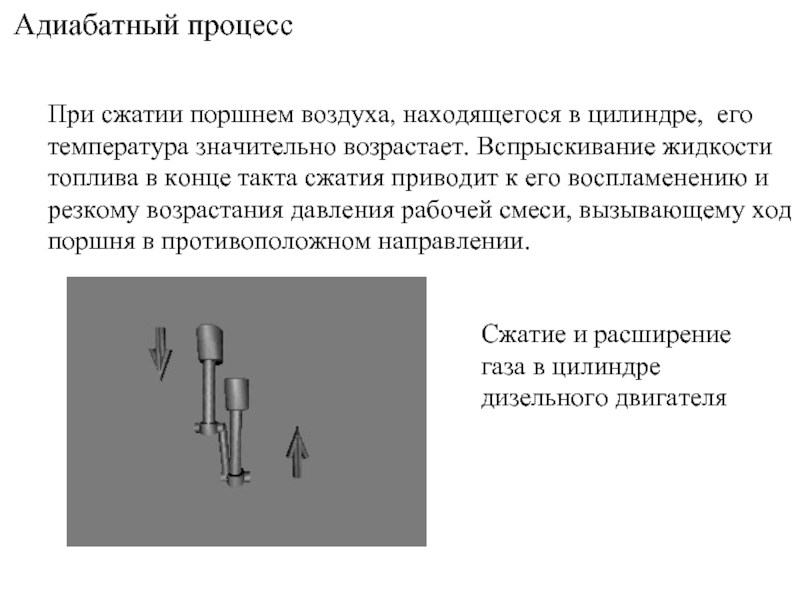
Слайд 17Адиабатный процесс
При сжатии поршнем воздуха, находящегося в цилиндре, его температура значительно
Сжатие и расширение газа в цилиндре дизельного двигателя
Слайд 19Тепловой двигатель – устройство, преобразующее внутреннюю энергию топлива в механическую энергию.
Тепловой
Коэффициент полезного действия теплового двигателя (КПД) – отношение работы, совершаемой двигателем за цикл, к количеству теплоты, полученному от нагревателя:
Слайд 21Второй закон термодинамики
Обратимый процесс – процесс, который может происходить как в
Необратимый процесс – процесс, обратный которому самопроизвольно не происходит.
Слайд 22Второй закон термодинамики
Второй закон термодинамики
В циклически действующем тепловом двигателе невозможно преобразовать
Диффузия – физическое явление, при котором происходит самопроизвольное взаимное проникновение частиц одного вещества в другое при их контакте.
Замкнутая система многих частиц самопроизвольно переходит из более упорядоченного состояния в менее упорядоченное.
Слайд 23Второй закон термодинамики
Взаимная диффузия водорода и кислорода, находящихся до открытия перегородки
При диффузии газы смешиваются, равномерно распределяясь по объему сосуда