- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атома презентация
Содержание
- 1. Строение атома
- 2. Ученые древности о строении вещества Древнегреческий ученый
- 3. Факты, указывающие на сложность строения атома.
- 4. Модели строения атома Учеными было
- 5. Опыт Резерфорда Английский физик Резерфорд впервые поставил
- 6. Опыт Резерфорда Но когда на пути α-частиц
- 7. Причины рассеивания α-частиц Электрон, входящий в состав
- 8. Механизм рассеивания. α-частица имеет положительный заряд, поэтому
- 9. Вывод из опыта Резерфорда. Учитывая то, что
- 10. Строение атома Из опыта Резерфорда следует, что
Слайд 2Ученые древности о строении вещества
Древнегреческий ученый Демокрит 2500 лет назад считал,
что любое вещество состоит из мельчайших частиц, которые впоследствии были названы «атомами», что в переводе на русский язык означает «неделимый»
Долгое время считалось, что атом является неделимой частицей.
Долгое время считалось, что атом является неделимой частицей.
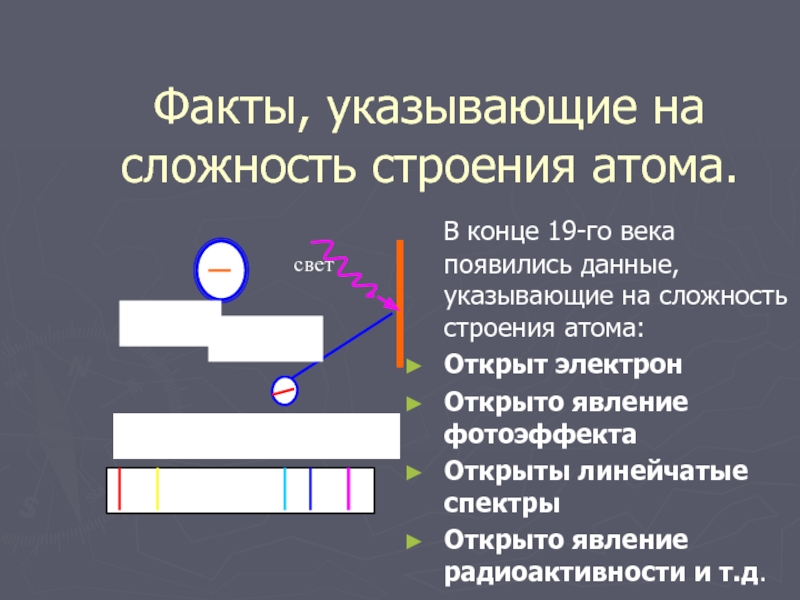
Слайд 3Факты, указывающие на сложность строения атома.
В конце 19-го века
появились данные, указывающие на сложность строения атома:
Открыт электрон
Открыто явление фотоэффекта
Открыты линейчатые спектры
Открыто явление радиоактивности и т.д.
Открыт электрон
Открыто явление фотоэффекта
Открыты линейчатые спектры
Открыто явление радиоактивности и т.д.
Слайд 4Модели строения атома
Учеными было предложено множество моделей строения атома.
английский ученый Томсон полагал, что атом представляет собой некую положительно заряженную материю, в которую как «изюм» в булочках вкраплены электроны, имеющие отрицательный заряд. Все модели были умозрительными и не являлись результатом проведения эксперимента.
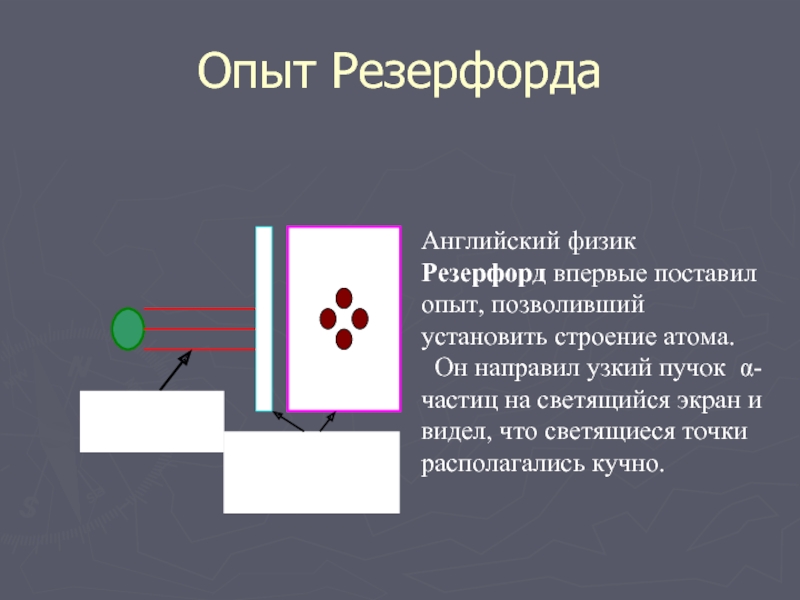
Слайд 5Опыт Резерфорда
Английский физик Резерфорд впервые поставил опыт, позволивший установить строение атома.
Он направил узкий пучок α-частиц на светящийся экран и видел, что светящиеся точки располагались кучно.
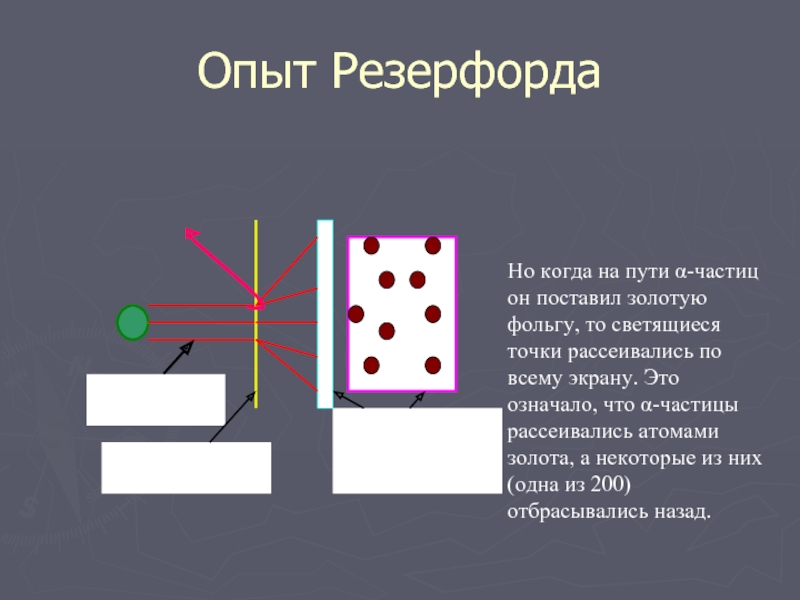
Слайд 6Опыт Резерфорда
Но когда на пути α-частиц он поставил золотую фольгу, то
светящиеся точки рассеивались по всему экрану. Это означало, что α-частицы рассеивались атомами золота, а некоторые из них (одна из 200) отбрасывались назад.
Слайд 7Причины рассеивания α-частиц
Электрон, входящий в состав атома нет мог рассеивать α-частиц
так как масса α-частицы примерно в 8000 раз больше массы электрона. Значит α-частицы рассеивались положительным зарядом атома в котором сосредоточена вся масса.
Слайд 8Механизм рассеивания.
α-частица имеет положительный заряд, поэтому отталкивается от положительного заряда, расположенного
где-то внутри атома. При этом чем ближе будет проходить траектория α-частицы к положительному заряду атома – тем больше сила действующая на нее, тем сильнее изменится ее траектория.
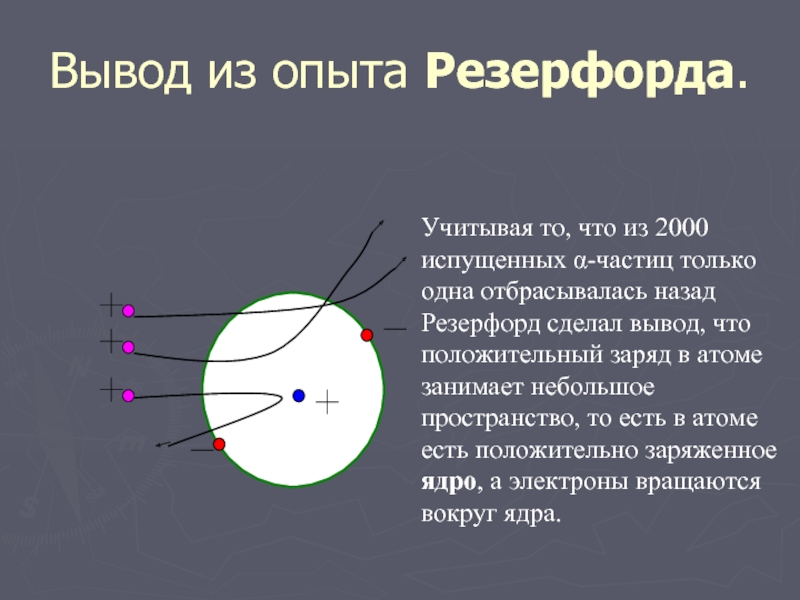
Слайд 9Вывод из опыта Резерфорда.
Учитывая то, что из 2000 испущенных α-частиц только
одна отбрасывалась назад Резерфорд сделал вывод, что положительный заряд в атоме занимает небольшое пространство, то есть в атоме есть положительно заряженное ядро, а электроны вращаются вокруг ядра.
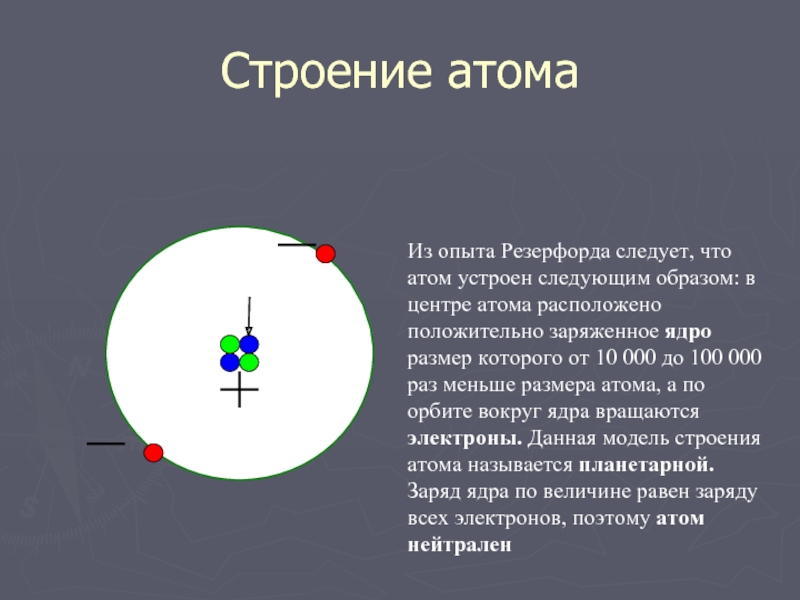
Слайд 10Строение атома
Из опыта Резерфорда следует, что атом устроен следующим образом: в
центре атома расположено положительно заряженное ядро размер которого от 10 000 до 100 000 раз меньше размера атома, а по орбите вокруг ядра вращаются электроны. Данная модель строения атома называется планетарной. Заряд ядра по величине равен заряду всех электронов, поэтому атом нейтрален