- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Современное состояние фармаконадзора в Российской Федерации презентация
Содержание
- 1. Современное состояние фармаконадзора в Российской Федерации
- 2. Современные лекарства подобны атомной энергии -
- 3. В 1994 г. в США серьезные
- 4. В США смертность и серьёзные повреждения в
- 5. Ежегодно в Великобритании регистрируют около 2000 больных
- 6. ФАРМАКОНАДЗОР - это наука и деятельность, направленная
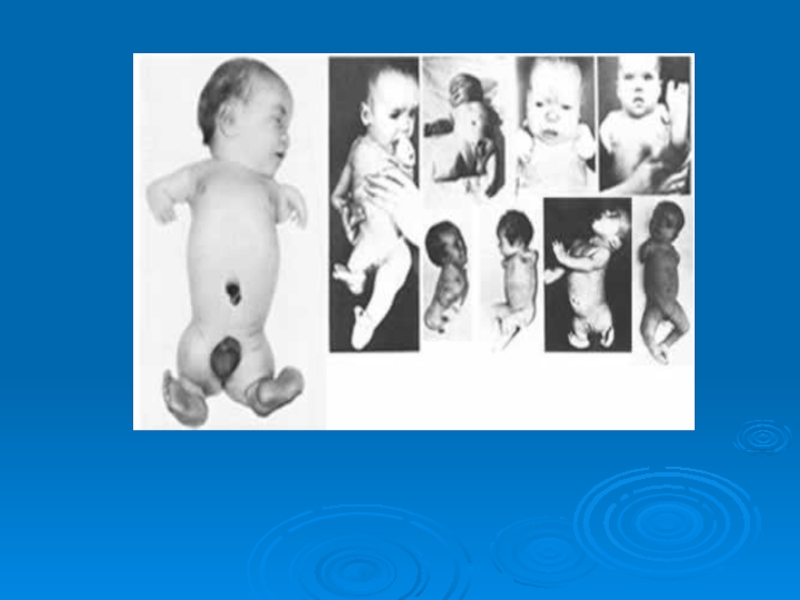
- 7. Новорожденные с фокомелией What prompted their start?
- 8. Birth of modern pharmacovigilance Thalidomide – Phocomelia 1961
- 9. 1962год Ассамблея ВОЗ – Резолюция о безопасности лекарств
- 10. Основные задачи сотрудничающего Центра ВОЗ по мониторингу
- 11. Национальные Центры 52 стран мира являются членами Международной программы ВОЗ по мониторингу лекарств.
- 12. В банке данных Центра Всемирной Организации Здравоохранения
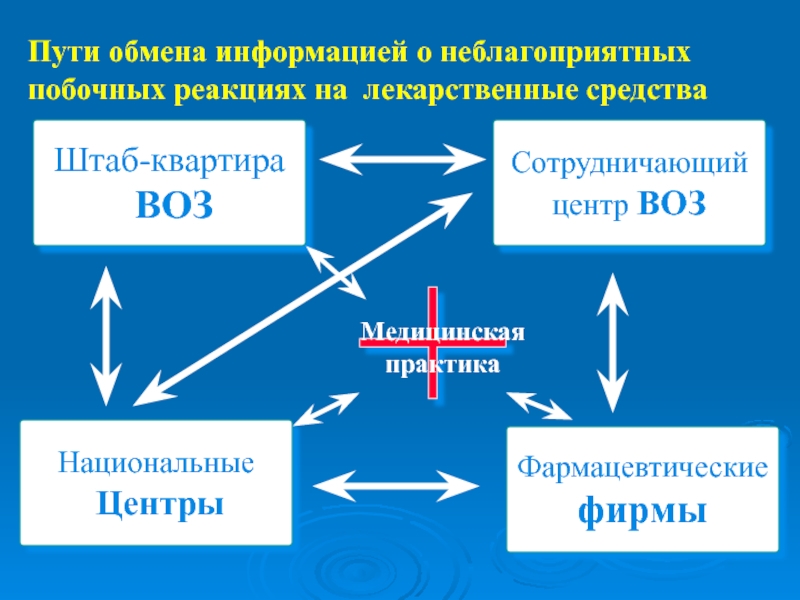
- 13. Пути обмена информацией о неблагоприятных побочных реакциях на лекарственные средства
- 14. Становление системы фармаконадзора в СССР и
- 15. Становление системы фармаконадзора в СССР и России
- 16. ГОСУДАРСТВЕННОЕ РЕГУЛИРОВАНИЕ В Российской Федерации государственную функцию
- 17. ГОСУДАРСТВЕННОЕ РЕГУЛИРОВАНИЕ 26 октября 2007 г. Росздравнадзор
- 18. 29 января 2008 года Росздравнадзор направил письма
- 19. Список регионов РФ, где созданы Региональные центры
- 20. Список регионов, где создаются центры мониторинга
- 21. Для эффективного функционирования системы сбора и анализа
- 22. Федеральный закон «О лекарственных средствах» Статья
- 23. «Золотой стандарт» системы спонтанных сообщений 250 –300
- 24. Согласно «Золотому стандарту» фармаконадзора, в Российской
- 25. Деятельность ФЦМБЛС Росздравнадзора Осуществляется практическая и научно-методическая
- 26. За период с января по декабрь
- 27. Информация ФЦ МБЛС 34 860 сообщений о НПР,
- 28. Информация ФЦМБЛС Проанализировано 18 сообщений о неблагоприятном
- 29. Информация ФЦ МБЛС Проведён анализ
- 30. Федеральная служба по надзору в сфере
- 32. Федеральная служба по надзору в сфере
- 34. Письмо Росздравнадзора от 02.12.2008 Руководителям медицинских учреждений
- 35. Писльмо Росздравнадзора от 02.12.2008 В случае невозможности
- 37. Письмо Росздравнадзора от 26.11.2008 Компаниям производителям
- 38. Проблемы предоставления информации о НПР
- 39. Практическая деятельность ФЦМБЛС в рамках фармаконадзора Ведение
- 40. Информационная и образовательная работа ФЦ МБЛС
- 41. Информационная и консультативная работа ФЦМБЛС Постоянно проводится
- 42. Примеры представления в Росздравнадзор информации о серьезных НПР
- 43. Уважаемые коллеги! В ФЦМБ ЛС
- 44. Уважаемые коллеги! Посылаем Вам сообщение о НПР
- 45. Уважаемые коллеги! В I квартале
- 47. ПЕРВОСТЕПЕННЫЕ ЗАДАЧИ НА БЛИЖАЙШЕЕ БУДУЩЕЕ
- 48. Срочно необходимо: Повышение ответственности производителей (особенно отечественных)
- 49. Безопасность больных – это вопрос не только
- 50. Осложнения лекарственной терапии можно уменьшить!! Вы
- 51. Мы только в начале пути Новые возможности Новые перспективы Мы открыты для сотрудничества
- 52. Федеральный центр мониторинга безопасности лекарственных средств Официальный
- 53. Безопасность больных – это не только важная
- 54. ВАРИАНТЫ ФАЛЬСИФИКАЦИИ ЛЕКАРСТВ препарат не содержит
Слайд 1Современное состояние фармаконадзора в Российской Федерации
В.К. Лепахин
Федеральный Центр мониторинга безопасности
Слайд 2Современные лекарства подобны атомной энергии - они могут принести как огромную
Сэр Деррик Данлоп
Первый председатель Комитета
по безопасности лекарств Великобритании
Слайд 3 В 1994 г. в США серьезные побочные эффекты имели место
у
Из них в 106 000 случаях -
летальный исход.
Pomeranz et al, JAMA, 1998,
279, 15: 1200 -1217
статистика
Слайд 4В США смертность и серьёзные повреждения в результате применения лекарственных средств
4 825 смертельных случаев
21000 тяжёлых осложнений
Это на 38% больше, чем за 1 квартал в прошлом году.
статистика
Слайд 5 Ежегодно в Великобритании
регистрируют около 2000 больных
с кровотечениями из ЖКТ
и
200
(на 11 млн. назначений)
в результате применения НПВС
Somerville K. et all Lancet 1996, 1, 462
статистика
Слайд 6ФАРМАКОНАДЗОР
- это наука и деятельность, направленная на выявление, оценку, понимание и
В настоящее время фармаконадзор включает в себя также мониторинг безопасности лекарственного растительного сырья, биологически активных добавок и вакцин.
Определение ВОЗ
Слайд 10Основные задачи сотрудничающего Центра ВОЗ по мониторингу лекарств
сбор, анализ, систематизация сообщений
формирование международной базы данных о НПР;
распространение информации;
научно-исследовательская работа (разработка методов и стандартов для оценки риска и пользы и др.)
международная гармонизация.
Слайд 11Национальные Центры 52 стран мира являются членами Международной программы ВОЗ по
Слайд 12 В банке данных Центра Всемирной Организации Здравоохранения —
более 4 млн
Ежегодно поступает около 200.000 собщений о НПРЛ
Слайд 14
Становление системы фармаконадзора в СССР и России
1969 год – организован Отдел
1973 год – создан Всесоюзный организационно-методический центр по изучению побочных действий лекарств Минздрава СССР
Слайд 15Становление системы фармаконадзора в СССР и России
14 апреля 1997 года –
Октябрь 1997 год – организовано более 20 региональных центров контроля безопасности лекарств
2 декабря 1997 года – Россия принята в качестве полноправного члена в Программу ВОЗ по международному мониторингу лекарств
Слайд 16ГОСУДАРСТВЕННОЕ РЕГУЛИРОВАНИЕ
В Российской Федерации государственную функцию по организации проведения экспертизы качества,
Федеральная служба по надзору в сфере здравоохранения и социального развития (Росздравнадзор)
Слайд 17ГОСУДАРСТВЕННОЕ РЕГУЛИРОВАНИЕ
26 октября 2007 г. Росздравнадзор создал Федеральный Центр мониторинга безопасности
Федеральному Центру делегированы полномочия по проведению мониторинга безопасности препаратов и экспертной оценки фактов и обстоятельств, угрожающих жизни и здоровью людей.
Слайд 1829 января 2008 года Росздравнадзор направил письма руководителям здравоохранения всех субъектов
Организовать в субъектах РФ региональные центры мониторинга безопасности лекарств, определив ответственные учреждения и\или подразделения по проблемам изучения НПР на ЛС
Привлечь к организации работы по выявлению и регистрации НПР главных специалистов, центры и кафедры клинической фармакологии ВУЗов, а также клинических фармакологов ЛПУ
Обеспечить контроль за своевременным представлением информации о НПР в региональные и федеральный центры мониторинга безопасности ЛС
Слайд 19Список регионов РФ, где созданы Региональные центры мониторинга безопасности лекарственных средств
Архангельская
Астраханская область
Карачаево-Черкесская Республика
Краснодарский край
Курганская область
Нижегородская область
Омская область
Оренбургская область
Пермская область
Приморский край
Республика Башкортостан
Республика Бурятия
Республика Коми
Республика Саха (Якутия)
Республика Хакасия
Рязанская область
Самарская область
Санкт-Петербург
Саратовская область
Ставропольский край
Удмуртская Республика
Ульяновская область
Челябинская область
Читинская область
Чувашская Республика
Слайд 20
Список регионов, где создаются центры мониторинга безопасности лекарственных средств
Амурская область
Владимирская область
Волгоградская
Воронежская область
Еврейская автономная область
Ивановская область
Иркутская область
Калининградская область
Кемеровская область
Кировская область
Костромская область
Липецкая область
Новгородская область
Орловская область
Пензенская область
Псковская область
Республика Дагестан
Республика Карелия
Республика Северная Осетия –Алания
Республика Татарстан
Республика Тыва
Тюменская область
Хабаровский край
Ханты-Мансийский автономный округ – Югра
Слайд 21Для эффективного функционирования системы сбора и анализа информации о НПР необходимы:
правовая
нормативные документы
контроль за выполнением требований нормативных документов
мотивация работников практического здравоохранения
обучение субъектов обращения лекарственных средств
кадровое, материальное и финансовое обеспечение работы Федерального и региональных центров МБЛ
Слайд 22Федеральный закон
«О лекарственных средствах»
Статья 41. Обязанность субъектов обращения лекарственных средств
п.1. Декларирует обязанность сообщать о побочных действиях, которые не соответствуют сведениям, содержащимся в инструкции
п.2. Предусматривает дисциплинарную, административную или уголовную ответственность за несообщение или сокрытие сведений, предусмотренных п. 1.
Слайд 23«Золотой стандарт» системы спонтанных сообщений
250 –300 сообщений/ 1 млн. жителей
не менее
Слайд 24Согласно «Золотому стандарту» фармаконадзора,
в Российской Федерации, с населением 142 млн.
Россия − должно поступать
40-60 тысяч сообщений
должно поступать
40-60 тысяч сообщений
о НПР в год
В 2007 году поступило
192 сообщения о НПР
В 2008 году поступило
1040 сообщений о НПР
Слайд 25Деятельность ФЦМБЛС Росздравнадзора
Осуществляется практическая и научно-методическая работа с целью совершенствования выявления,
Слайд 26
За период с января по декабрь 2008 г
ФЦ МБЛС получено:
Более 50 000 сообщений о НПР, из которых
1040 зарегистрированы на территории РФ.
709 поступило из РЦ и непосредственно от российских специалистов.
331 от зарубежных производителей ЛС.
В 38 случаях выявлена неэффективность препаратов.
Слайд 27Информация ФЦ МБЛС
34 860 сообщений о НПР, зарегистрированных на территории зарубежных стран,
Всего получено 617 сообщений о НПР, приведших к летальному исходу.
Слайд 28Информация ФЦМБЛС
Проанализировано 18 сообщений о неблагоприятном влиянии препаратов на исходы беременности.
В 7 из них сообщалось о тератогенных эффектах пароксетина (3 случая), ламотриджина, варфарина и такролимуса.
Слайд 29Информация ФЦ МБЛС
Проведён анализ
316 Периодических отчетов
полученных от зарубежных
производителей ЛС, и подготовлена
соответствующая информация для
Росздравнадзора и региональных центров.
Слайд 30Федеральная служба по надзору
в сфере здравоохранения и социального развития
Одобрено
Учёным советом
Научного
Медицинского применения
19 июня 2008 года
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО СОЗДАНИЮ И РАБОТЕ РЕГИОНАЛЬНЫХ ЦЕНТРОВ МОНИТОРИНГА БЕЗОПАСНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Москва 2008
Слайд 32Федеральная служба по надзору
в сфере здравоохранения и социального развития
Одобрено
Учёным советом
Научного
Медицинского применения
19 июня 2008 года
УТВЕРЖДАЮ
Руководитель Федеральной службы по
Надзору в сфере здравоохранения и социального развития
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО ОПРЕДЕЛЕНИЮ СТЕПЕНИ ДОСТОВЕРНОСТИ
ПРИЧИННО-СЛЕДСТВЕННОЙ СВЯЗИ
«НЕБЛАГОПРИЯТНАЯ ПОБОЧНАЯ
РЕАКЦИЯ−ЛЕКАРСТВО»
(классификация и методы)
Москва 2008
Слайд 34Письмо Росздравнадзора от 02.12.2008
Руководителям медицинских учреждений организовать представление в Росздравнадзор информации
назначить ответственных лиц за осуществление мониторинга безопасности лекарственных средств в медицинских учреждениях,
- Обеспечить возможность регистрации НПР (заполнение электронной формы карты-извещения) на сайте
www.roszdravnadzor.ru в разделе «Фармаконадзор».
Для получения персонифицированного доступа (логина и пароля) медицинским учреждениям необходимо направить запрос в Росздравнадзор по электронной почте
pharm@roszdravnadzor.ru
Слайд 35Писльмо Росздравнадзора от 02.12.2008
В случае невозможности использования сети Internet Росздравнадзор предлагает
- ввести учётную форму «Извещение о неблагоприятной реакции на лекарственное српедство» в каждую историю болезни и в каждую амбулаторную карту, которая должна быть заполнена независимо от наличия или отсутствия НПР.
при развитии серьёзных НПР, а также неожиданных реакций, не отражённых в инструкции по применению ЛС, направлять информацию в Региональный центр мониторинга безопасности лекарств, а при отсутствии в регионе такого центра – в территориальное управление Росздравнадзора;
- возложить на ответственных лиц контроль за своевременным информированием обо всех случаях развития НПР или неэффективности лекарственных средств.
Слайд 37 Письмо Росздравнадзора от 26.11.2008
Компаниям производителям или держателям регистрационных удостоверений предлагается организовать
назначить уполномоченного по фармаконадзору,
Обеспечить заполнение электронной карты-извещения о НПР на сайте www/roszdravnadzor.ru
в разделе «Фармаконадзор».
Для получения персонифицированного доступа (логина и пароля)
Фармацевтическим компаниям необходимо направить запрос в Росздравнадзор и представить информацию согласно приложению
Слайд 38Проблемы предоставления информации о НПР
Экспресс-сообщения
низкий уровень активности российских
низкое качество присылаемых сообщений
информацию предоставляют только некоторые крупные зарубежные компании
отечественные производители ЛС полностью игнорируют работу по фармаконадзору
Периодические отчеты о безопасности ЛС
предоставляют только крупные западные фирмы
Слайд 39Практическая деятельность ФЦМБЛС в рамках фармаконадзора
Ведение базы данных по сообщениям о
Анализ и систематизация полученных сообщений
Представление информации о НПР региональным центрам и медицинским работникам
Представление Росздравнадзору данных о НПР на ЛС, зарегистрированные в РФ
Подготовка предложений по принятию соответствующих административных мер по предупреждению лекарственных осложнений.
Слайд 40Информационная и образовательная работа ФЦ МБЛС
Подготовлены 2 номера журнала «Безопасность лекарств
Информация о фармаконадзоре представлена на конференциях во Владивостоке, в Москве, Красноярске, Новосибирске, Рязани, Саратове, Санкт-Петербурге
Слайд 41Информационная и консультативная работа ФЦМБЛС
Постоянно проводится
консультативная работа по
вопросам безопасности лекарств с
Слайд 43
Уважаемые коллеги!
В ФЦМБ ЛС в марте 2008 г. из Омского регионального
В связи с этим просим Вас сообщать о всех побочных эффектах гепаринов с указанием производителя препарата и, по возможности, серии.
Заранее благодарны.
С уважением,
ФЦ МБЛС
Слайд 44Уважаемые коллеги!
Посылаем Вам сообщение о НПР на р-р глюкозы пр-ва ОАО
Просим Вас проявлять особую бдительность к НПР на препараты российского производства и сообщать обо всех НПР на эти препараты.
Ваши сообщения - единственный источник информации о профиле и частоте НПР на отечественные препараты в медицинской практике, так как мы не получаем никакой информации по безопасности от российских производителей.
С уважением,
руководитель ФЦ МБЛС
член-корр. РАМН, профессор В.К. Лепахин
Слайд 45
Уважаемые коллеги!
В I квартале 2008 г. в Федеральный центр мониторинга безопасности
Если Ваши врачи наблюдали случаи неэффективности противосудорожных средств, особенно при переключении с одного препарата на другой, содержащий то же действующее вещество, убедительная просьба сообщать о них в ФЦ МБЛС.
С уважением,
ФЦ МБЛС
Слайд 47ПЕРВОСТЕПЕННЫЕ ЗАДАЧИ НА БЛИЖАЙШЕЕ БУДУЩЕЕ Утверждение карты- извещения о НПР в
Слайд 48Срочно необходимо:
Повышение ответственности производителей (особенно отечественных) за мониторинг безопасности лекарственных средств;
активизация
Слайд 49Безопасность больных – это вопрос не только денег и технологий
Ни деньги,
Центральное значение имеют политическая воля руководства (административная и финансовая поддержка системы фармаконадзора) и профессиональная и гражданская ответственность работников здравоохранения.
Слайд 50Осложнения лекарственной терапии можно уменьшить!!
Вы можете облегчить страдания и спасти жизнь
Слайд 52Федеральный центр мониторинга безопасности лекарственных средств
Официальный адрес (для корреспонденции): Москва, 127051,
Фактический адрес: Москва, 123182, ул. Щукинская, д.6.
Телефон: 8 (495) 234-61-04 * 3086, * 3093,*3091
Факс: 8 (499) 190-34-61
Сайт в интернете: www.regmed.ru (раздел «Фармаконадзор»)
Адрес электронной почты для сообщений о НПР: adr@regmed.ru
Слайд 53Безопасность больных – это не только важная медицинская, социальная и экономическая
Слайд 54ВАРИАНТЫ
ФАЛЬСИФИКАЦИИ ЛЕКАРСТВ
препарат не содержит действующего вещества, указанного на этикетке;
препарат содержит
препарат содержит действующее вещество, которое не указано на этикетке;
препарат содержит действующее вещество в указанных количествах, фальсификация касается производителя лекарств.