- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Понятие о строении атома. Срстав атомных ядер. презентация
Содержание
- 1. Понятие о строении атома. Срстав атомных ядер.
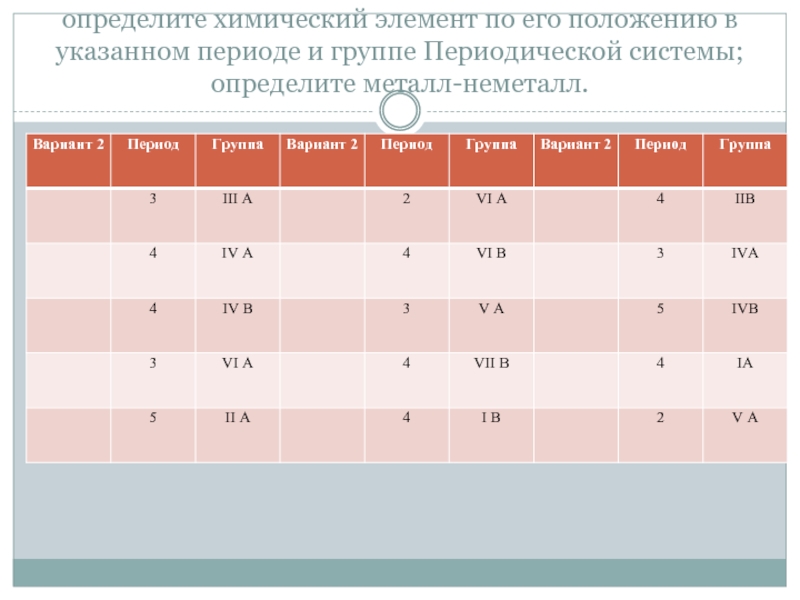
- 2. определите химический элемент по его положению в
- 3. Решите задачи:
- 4. Представление об атоме Атом-мельчайшая частица химического вещества
- 5. Научные открытия Ирландский физик Стони в1891 году
- 6. Антуан Анри Беккерель открыл явление радиоактивности
- 7. Джозеф Джон Томсон
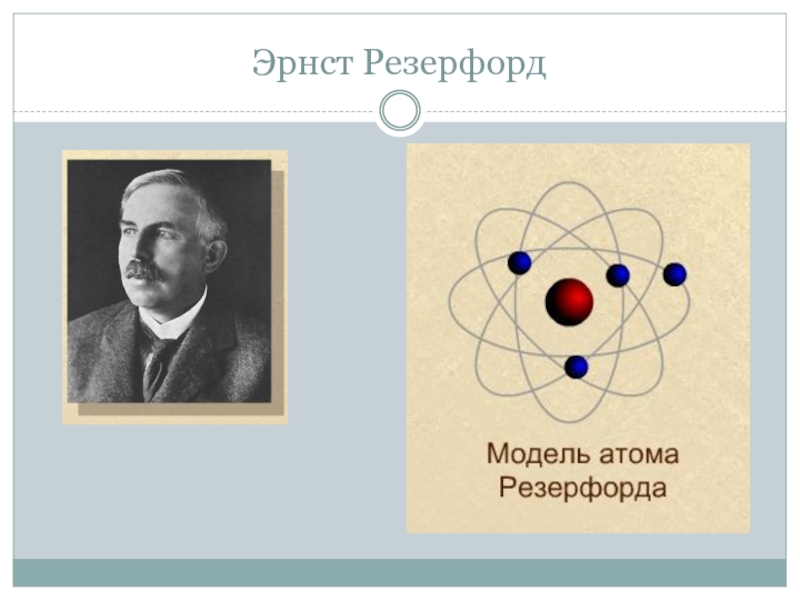
- 8. Эрнст Резерфорд
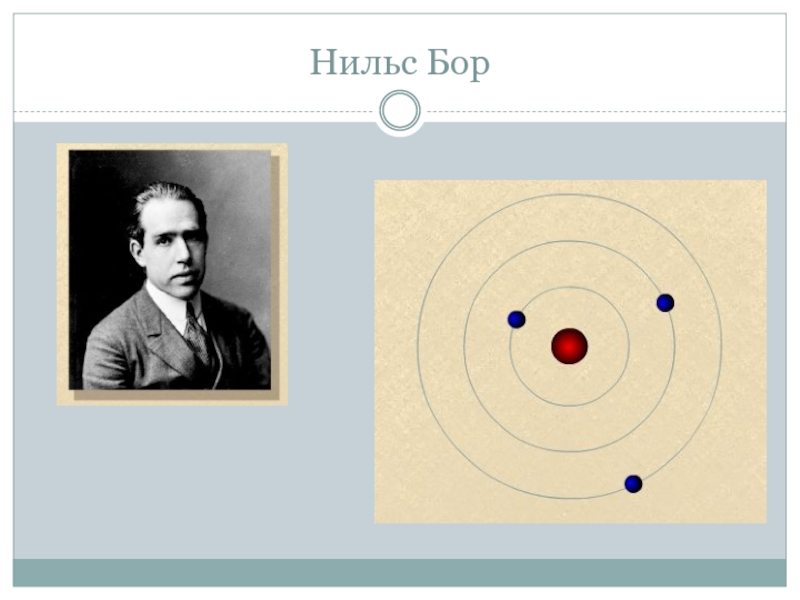
- 9. Нильс Бор
- 10. Планетарная модель строения атома В Солнечной
- 11. Каковы размеры ядра? Если представить себе атомное
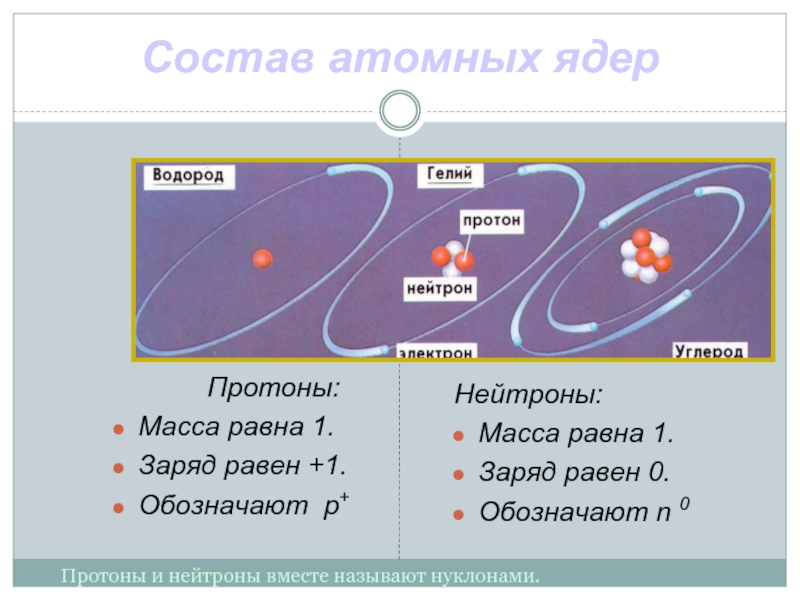
- 12. Состав атомных ядер Протоны: Масса равна 1.
- 13. Понятие об электроне Электроны вращаются вокруг
- 14. Строение атома и Периодическая система Число протонов
- 15. Изотопы Количество протонов и электронов в атоме
Слайд 2определите химический элемент по его положению в указанном периоде и группе
Периодической системы; определите металл-неметалл.
Слайд 4Представление об атоме
Атом-мельчайшая частица химического вещества .
Размеры атомов ничтожно малы: капля
воды состоит примерно из 6х1021 атомов.
Понятие «атом» возникло в античном мире для обозначения частиц вещества и в переводе с греческого означает «неделимый».Но это не так.
Понятие «атом» возникло в античном мире для обозначения частиц вещества и в переводе с греческого означает «неделимый».Но это не так.
Слайд 5Научные открытия
Ирландский физик Стони в1891 году открыл, что электричество переносится мельчайшими
частицами – электронами.
Джозеф Томсон и Жан Перрен доказали,что электроны несут отрицательный заряд.
Физик Анри Беккерель открыл явление радиоактивности.
Эрнест Резерфорд 1910 году доказал, что вся масса атома сосредоточена в ядре и предложил планетарную модель атома.
Джозеф Томсон и Жан Перрен доказали,что электроны несут отрицательный заряд.
Физик Анри Беккерель открыл явление радиоактивности.
Эрнест Резерфорд 1910 году доказал, что вся масса атома сосредоточена в ядре и предложил планетарную модель атома.
Слайд 10Планетарная модель строения атома
В Солнечной системе планеты обращаются вокруг Солнца.
В атоме
электроны обращаются вокруг ядра,которое заряжено положительно и притягивает отрицательно заряженные электроны.
Слайд 11Каковы размеры ядра?
Если представить себе атомное ядро в виде вишни, то
орбиты вращающихся вокруг него электронов в этом масштабе будут сравнимы с размером футбольного стадиона.
Слайд 12Состав атомных ядер
Протоны:
Масса равна 1.
Заряд равен +1.
Обозначают p+
Нейтроны:
Масса равна 1.
Заряд равен
0.
Обозначают n 0
Обозначают n 0
Протоны и нейтроны вместе называют нуклонами.
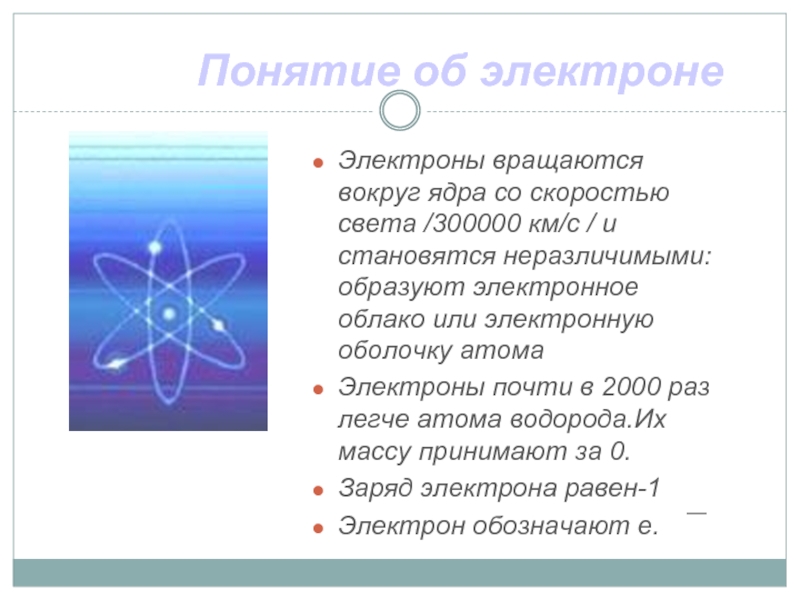
Слайд 13Понятие об электроне
Электроны вращаются вокруг ядра со скоростью света /300000 км/с
/ и становятся неразличимыми: образуют электронное облако или электронную оболочку атома
Электроны почти в 2000 раз легче атома водорода.Их массу принимают за 0.
Заряд электрона равен-1
Электрон обозначают е.
Электроны почти в 2000 раз легче атома водорода.Их массу принимают за 0.
Заряд электрона равен-1
Электрон обозначают е.
Слайд 14Строение атома и Периодическая система
Число протонов в атоме равно порядковому номеру
элемента.
Число электронов в атоме равно числу протонов и порядковому номеру элемента.
Сумма числа протонов и нейтронов в атоме называется массовым числом:
А=Z+N где
Z-число протонов
N-число нейтронов
Например, 16О: Z=8; А=16; N=A-Z=8
Число электронов в атоме равно числу протонов и порядковому номеру элемента.
Сумма числа протонов и нейтронов в атоме называется массовым числом:
А=Z+N где
Z-число протонов
N-число нейтронов
Например, 16О: Z=8; А=16; N=A-Z=8
Слайд 15Изотопы
Количество протонов и электронов в атоме одного элемента постоянно.
Количество нейтронов в
атомах одного элемента может быть разным.
Разновидности атомов одного элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами. Например, изотопы кислорода 16О,17О,18О.
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Разновидности атомов одного элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами. Например, изотопы кислорода 16О,17О,18О.
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.