- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Некоторые физико-химические величины, используемые при решении задач по химии презентация
Содержание
- 1. Некоторые физико-химические величины, используемые при решении задач по химии
- 2. Количество вещества – такое количество вещества, которое
- 3. Молярная масса – масса одного моля вещества
- 4. Молярный объем – объем одного моля вещества.
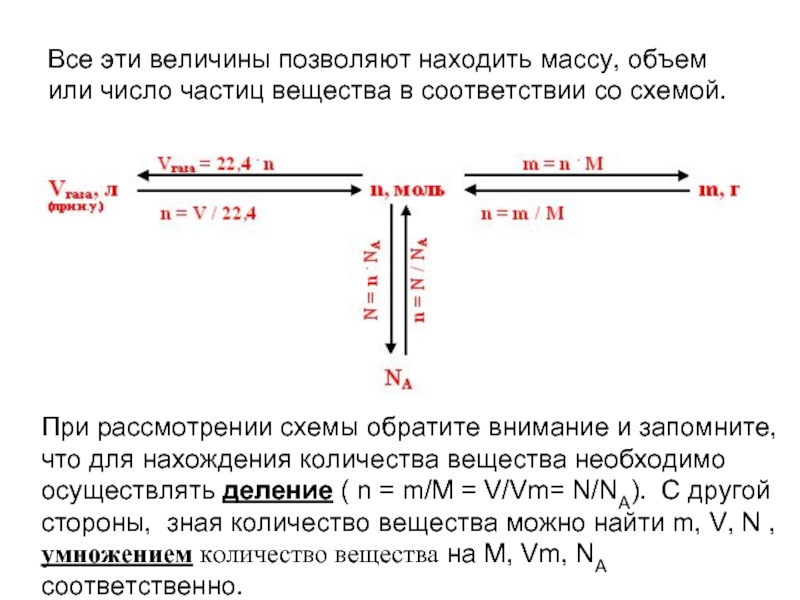
- 5. Все эти величины позволяют находить массу, объем
- 6. Следующая величина, которая заслуживает внимания это массовая
- 7. Кроме того для смесей газов или растворов
- 8. Плотность. Плотность любого вещества рассчитывается по
- 9. Кроме того, для газов вводиться понятие относительной
- 10. Плотность газов в задачах по органической химии
- 11. Одно из очень важных следствий закона Авогадро
- 12. Ну и последнее про что хотелось бы
- 13. Конец
Слайд 2Количество вещества – такое количество вещества, которое содержит 6 . 1023
Слайд 3Молярная масса – масса одного моля вещества (обозначают М, рассчитывается в
Слайд 4Молярный объем – объем одного моля вещества. Обозначают Vm .
Слайд 5Все эти величины позволяют находить массу, объем или число частиц вещества
При рассмотрении схемы обратите внимание и запомните, что для нахождения количества вещества необходимо осуществлять деление ( n = m/M = V/Vm= N/NA). С другой стороны, зная количество вещества можно найти m, V, N , умножением количество вещества на M, Vm, NA соответственно.
Слайд 6Следующая величина, которая заслуживает внимания это массовая доля. Массовая доля. Обозначается w.
Слайд 7Кроме того для смесей газов или растворов часто используется понятие молярная
Молярная концентрация : с (в-ва) = n(в-ва) / Vсистемы
в моль/л
Слайд 8Плотность. Плотность любого вещества рассчитывается по формуле ρ = m/V, измеряется обычно
Слайд 9Кроме того, для газов вводиться понятие относительной плотности ( D), которая
Относительная плотность :
Dн2 (х) = М(х) / М (Н2) ; Dвозд.(х) = М(х) / 29
Слайд 10Плотность газов в задачах по органической химии часто используется для нахождения
Слайд 11Одно из очень важных следствий закона Авогадро заключается в том, что: объемы
4л х л
2NH3 + 3O2 = N2 + 6 H2O 4/2 = x/3, х = 6 л
2 об. 3 об.
Слайд 12Ну и последнее про что хотелось бы сказать – это выход
Выход продукта реакции:
η (по массе) = mпрактич. / mтеоретич. (. 100%)
ϕ ( по объему) = V практич. / V теоретич. (. 100%)