- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
КОРРОЗИЯ МЕТАЛЛОВ презентация
Содержание
- 1. КОРРОЗИЯ МЕТАЛЛОВ
- 2. ПЛАН УРОКА Понятие коррозии Значение коррозии Виды
- 3. ЭТАПЫ УРОКА
- 4. ИСТОРИЧЕСКИЙ ЭТАП
- 6. ЭТАПЫ УРОКА информационный исторический экспериментальный практический
- 7. ИНФОРМАЦИОННЫЙ ЭТАП КОРРОЗИЯ – самопроизвольное разрушение металлов
- 8. ЗНАЧЕНИЕ КОРРОЗИИ Вызывает серьезные экологические последствия: утечка
- 9. ФАКТОРЫ, ВЫЗЫВАЮЩИЕ КОРРОЗИЮ Кислород и влага
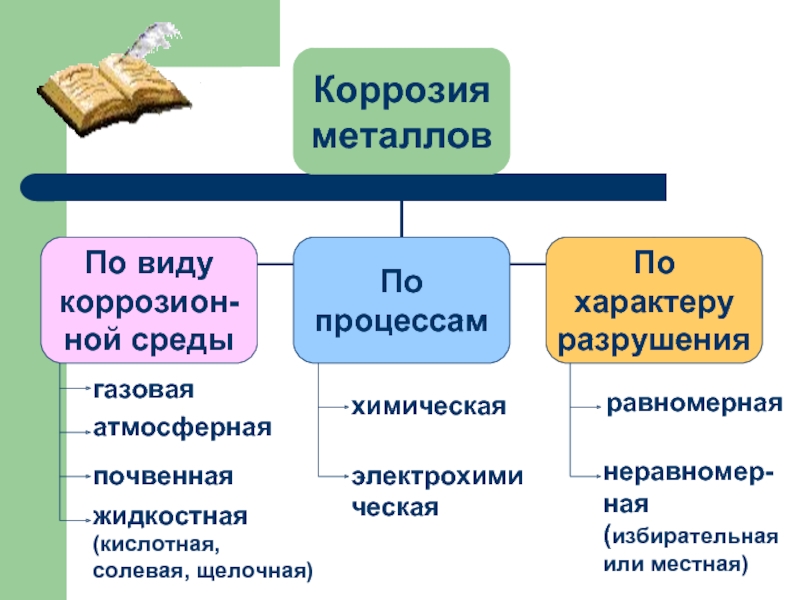
- 10. газовая атмосферная почвенная жидкостная (кислотная,
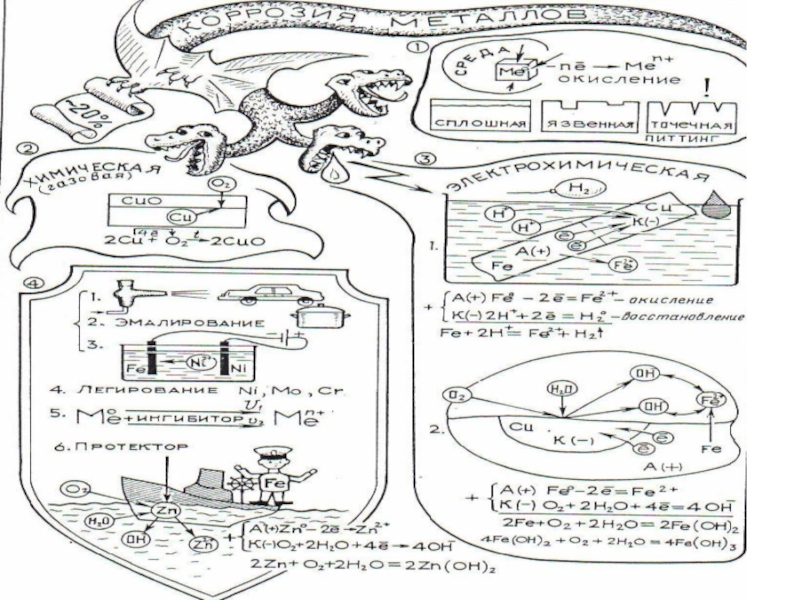
- 11. ВИДЫ КОРРОЗИИ ХИМИЧЕСКАЯ – это разрушение металлов
- 12. ХИМИЧЕСКАЯ КОРРОЗИЯ
- 13. ВИДЫ КОРРОЗИИ ЭЛЕКТРОХИМИЧЕСКАЯ – это разрушение металлов,
- 14. УСЛОВИЯ, СПОСОБСТВУЮЩИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ Положение металла
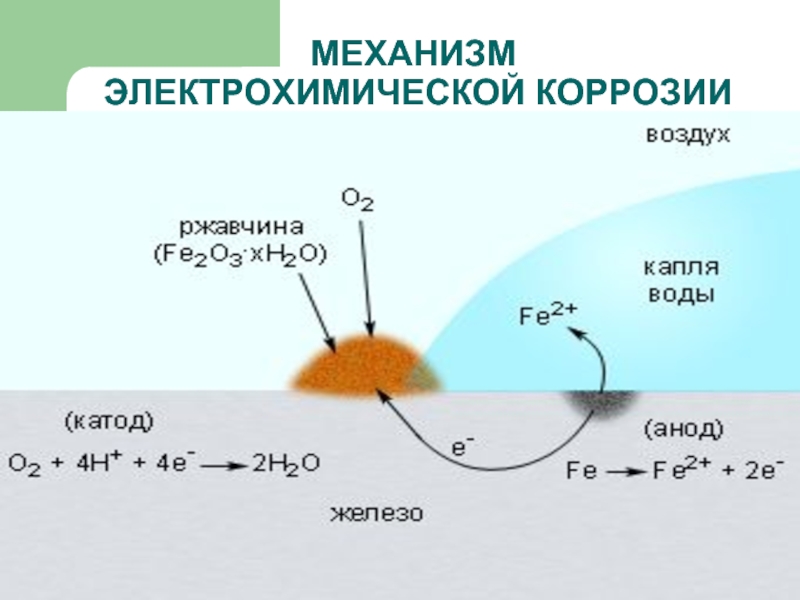
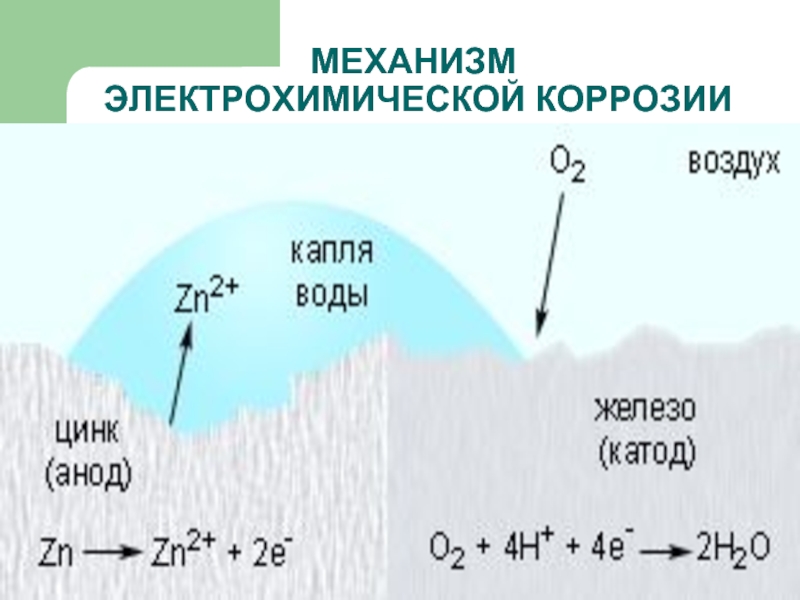
- 15. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
- 16. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
- 17. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
- 18. СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ Нанесение защитных покрытий
- 19. ЭТАПЫ УРОКА информационный исторический экспериментальный практический
- 20. ЭТАПЫ УРОКА информационный исторический экспериментальный практический
Слайд 2ПЛАН УРОКА
Понятие коррозии
Значение коррозии
Виды коррозии
Условия, способствующие коррозии
Химизм процесса коррозии
Способы защиты от
коррозии
Слайд 7ИНФОРМАЦИОННЫЙ ЭТАП
КОРРОЗИЯ – самопроизвольное разрушение металлов и сплавов в результате химического
или электрохимического взаимодействия их с окружающей средой.
Это окислительно-восстановительная реакция, при которой атомы металла превращаются в ионы. Чем активнее металл, тем он больше подвержен коррозии.
В роли окислителя выступают атмосферный кислород и катионы водорода.
Это окислительно-восстановительная реакция, при которой атомы металла превращаются в ионы. Чем активнее металл, тем он больше подвержен коррозии.
В роли окислителя выступают атмосферный кислород и катионы водорода.
Слайд 8ЗНАЧЕНИЕ КОРРОЗИИ
Вызывает серьезные экологические последствия: утечка нефти, газа, других химических продуктов.
Недопустима
во многих отраслях промышленности: авиационной, химического, нефтяного и атомного машиностроения.
Отрицательно влияет на жизнь и здоровье людей.
Отрицательно влияет на жизнь и здоровье людей.
Слайд 9ФАКТОРЫ,
ВЫЗЫВАЮЩИЕ КОРРОЗИЮ
Кислород и влага атмосферы
Углекислый и сернистый газы, содержащиеся в
атмосфере
Морская вода
Грунтовые воды
Морская вода
Грунтовые воды
Слайд 10газовая
атмосферная
почвенная
жидкостная (кислотная, солевая, щелочная)
химическая
электрохимическая
равномерная
неравномер- ная (избирательная или местная)
Слайд 11ВИДЫ КОРРОЗИИ
ХИМИЧЕСКАЯ – это разрушение металлов и сплавов в результате их
химического взаимодействия с веществами окружающей среды.
Защитная оксидная пленка на поверхности алюминия
Рыхлая пленка на поверхности железа, приводящая к разрушению металла
Защитная оксидная пленка на поверхности алюминия
Рыхлая пленка на поверхности железа, приводящая к разрушению металла
Слайд 13ВИДЫ КОРРОЗИИ
ЭЛЕКТРОХИМИЧЕСКАЯ – это разрушение металлов, которое сопровождается возникновением электрического тока
в воде или среде другого электролита.
Химические процессы – это окисление корродируемого металла, отдача электронов.
Электрические процессы – перенос электронов с одного участка изделия к другому.
Химические процессы – это окисление корродируемого металла, отдача электронов.
Электрические процессы – перенос электронов с одного участка изделия к другому.
Слайд 14УСЛОВИЯ,
СПОСОБСТВУЮЩИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Положение металла в ряду активности металлов: чем они
дальше расположены друг от друга, тем быстрее происходит коррозия.
Чистота металла: примеси ускоряют коррозию.
Неровности поверхности металла, трещины.
Грунтовые воды, морская вода, среда электролита.
Повышение температуры.
Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Чистота металла: примеси ускоряют коррозию.
Неровности поверхности металла, трещины.
Грунтовые воды, морская вода, среда электролита.
Повышение температуры.
Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Слайд 18СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ
Нанесение защитных покрытий (лаки, краски,
эмали);
Покрытие другим металлом (позолота, серебрение, хромирование, цинкование);
Создание и использование антикоррозионных сплавов
Введение в среду ингибиторов, снижающих агрессивность среды;
Протекторная защита
Покрытие другим металлом (позолота, серебрение, хромирование, цинкование);
Создание и использование антикоррозионных сплавов
Введение в среду ингибиторов, снижающих агрессивность среды;
Протекторная защита