- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Компьютерная эволюционная биология презентация
Содержание
- 1. Компьютерная эволюционная биология
- 2. Понятие координированных замен аминокислотных остатков Исследование наборов
- 3. Обзор подходов к анализу координированных замен Под
- 4. Экспериментальные свидетельства кооперативного эффекта замен остатков Тот
- 5. В работе [Vemet et al., 1992] проанализированы
- 6. Малкольм и сотрудники рассматривали лизоцимы двух видов
- 7. Выявление и анализ координированных замен в последовательностях
- 8. Основные методы анализа координированных замен можно условно
- 9. Проблема учета эволюционной зависимости последовательностей. При оценке
- 10. Использование информационных мер для оценки парной зависимости
- 11. В работе [Clarke, 1995] анализировались последовательности ДНК
- 12. Метод оценки парных корреляций с использованием информационного
- 13. Этот информационный подход получил дальнейшее развитие в
- 14. В целом результаты, полученные О.Б. Птициным и
- 15. АНАЛИЗ РЕЖИМА АДАПТИВНОЙ ЭВОЛЮЦИИ В БЕЛКАХ ВИРУСА
- 16. Сравнительный анализ, в частности, позволил выявить шесть
- 17. Материалы и методы. Последовательности ВГС. Последовательности
- 18. Выявление адаптивного режима эволюции. Мы использовали критерий
- 19. Оценка статистической зависимости между режимом эволюции ко
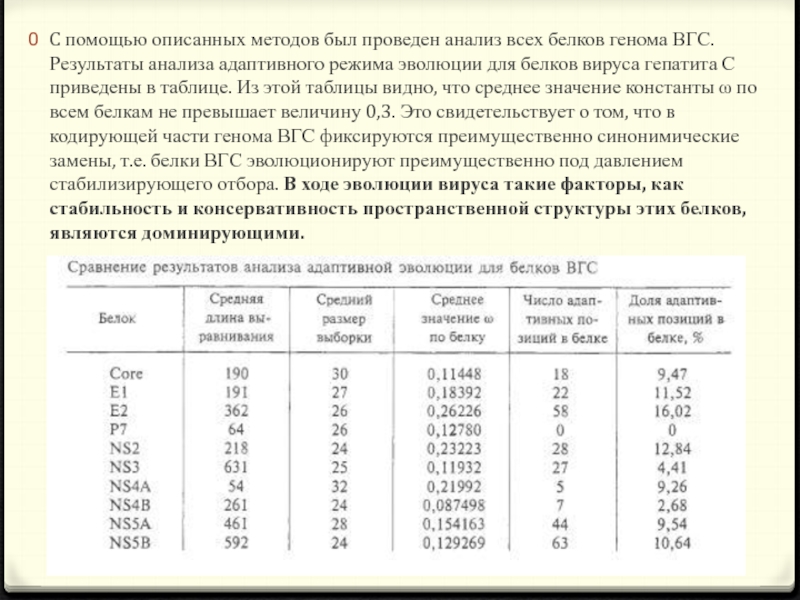
- 20. C помощью описанных методов был проведен анализ
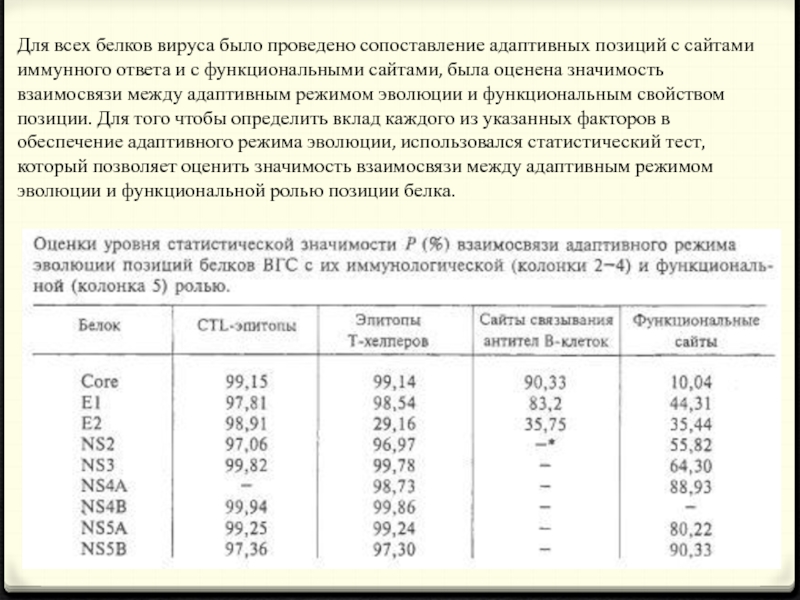
- 21. Для всех белков вируса было проведено сопоставление
- 22. Из таблицы видно, что большинство белков ВГС
- 23. Белок NS4A имеет достаточно высокое среднее значение
Слайд 1Компьютерная эволюционная биология
Координированные замены аминокислотных остатков в белках
Выполнила:
Студентка факультета Агрономии и
Слайд 2Понятие координированных замен аминокислотных остатков
Исследование наборов гомологичных последовательностей изофункциональных белков является
Согласно существующим представлениям, возможны три механизма консервативности таких характеристик. Первый механизм обусловлен инвариантностью функционально важных позиций белка. Это означает, что любые мутации в них приводят к нарушению функции белка. Второй механизм обусловлен консервативными заменами аминокислот в позициях белка. Эти замены происходят таким образом, что физико-химические свойства остатка существенно не меняются. Согласно третьему механизму, дополнительный вклад в консервативность могут вносить координированные замены аминокислотных остатков. Это замены в парах или группах позиций белка, которые фиксируются зависимым образом. В последнее время методы выявления и анализа подобных замен интенсивно развиваются. Информация, полученная в ходе анализа парных координированных замен, позволяет получать важные данные о структуре и функции белка, предсказывать взаимные контакты остатков и улучшать распознавание типов укладки полипептидных цепей.
Слайд 3Обзор подходов к анализу координированных замен
Под координированными заменами аминокислот понимаются за
О заменах остатков, компенсаторных по отношению
к их суммарному объему, говорят,
если повреждающий эффект от замены остатка
в одной позиции белка может быть скомпенсирован
заменой в другой позиции последовательности,
так что общий эффект двух замен оказывается
нейтральным. Примером замен, компенсаторных
по отношению к суммарному заряду, могут служить замены
остатков, формирующие солевой мостик.
Слайд 4Экспериментальные свидетельства кооперативного эффекта замен остатков
Тот факт, что стабильность или активность
Слайд 5В работе [Vemet et al., 1992] проанализированы замены аминокислотных остатков в
Слайд 6Малкольм и сотрудники рассматривали лизоцимы двух видов птиц отряда Курообразных (Galliformes).
Мэтью и Фершт анализировали термостабильность тетрамерной формы р53 человека и его мутантных производных. Проводились замены остатков, как единичные, так и множественные, в позициях гидрофобного ядра, которые в белках млекопитающих являются консервативными (позиции 330, 332, 340, 341, 344 и 348).
Слайд 7Выявление и анализ координированных замен в последовательностях гомологичных белков.
Задача выявления
рассматривается набор гомологичных аминокислотных последовательностей изофункционального белкового семейства;
предполагается, что все анализируемые белки имеют сходную пространственную структуру;
по набору последовательностей требуется выявить позиции белка, замены в которых происходят зависимым образом (координированно);
на основании информации о зависимых заменах аминокислот не обходимо выявить особенности пространственной структуры и функции анализируемых белков.
Оценка степени зависимости позиций в белке включает несколько подзадач:
выбор меры зависимости аминокислотных замен, оценка значимости выявленных корреляций;
учет эволюционной зависимости анализируемых последовательностей при оценке значимости выявленных корреляций;
учет дальних корреляций, обусловленных опосредованными взаимодействиями аминокислотных остатков в белке;
выбор критерия правильности предсказания координированных замен и интерпретация полученных результатов;
выявление групп позиций, замены в которых происходят координированным образом;
анализ взаимосвязи между зависимыми заменами остатков и их функциональной роли в белках.
Слайд 8Основные методы анализа координированных замен можно условно разделить на две группы.
Слайд 9Проблема учета эволюционной зависимости последовательностей.
При оценке зависимости аминокислотных замен в парах
Слайд 10Использование информационных мер для оценки парной зависимости аминокислотных замен.
При оценке
где Раi , аj - вероятность (наблюдаемая частота) появления пары аминокислот типа аi, аj в позициях i, j; Раi - вероятность (наблюдаемая частота) появления остатка типа аi, в позиции i.
Эта мера имеет смысл «взвешенной информации». Вес вклада в величину С для пары аi, аj равен частоте ее встречаемости. Преимущество описанной выше меры обосновывается эмпирическими наблюдениями. Автор указывает, что взвешивание приводит к выявлению большего числа пар позиций, зависимость аминокислотных замен в которых находит приемлемое структурное или функциональное обоснование. Статистическая значимость величины С определялась в этой работе с помощью перестановочного теста.
Слайд 11В работе [Clarke, 1995] анализировались последовательности ДНК связывающего домена класса «гомеодомен».
Слайд 12Метод оценки парных корреляций с использованием информационного подхода был предложен в
Величины энтропии для i-й позиции Н(i) и для пары позиций Н(i, j) выражаются следующим образом:
Здесь P (Si) — частота встречаемости аминокислоты типа Si в позиции P(Sj,Sj) — частоты встречаемости пары аминокислот Si и s'j в позициях i и j, соответственно. Значимость обнаруженной статистической зависимости оценивалась на основе перестановочного теста.
Слайд 13Этот информационный подход получил дальнейшее развитие в работах Гиро и соавторов,
Для оценки значимости полученных зависимостей в работе [Lapedes et al., 1997] предложен подход, использующий численное моделирование для оценки «корректного» порога для величины взаимной парной информации. Проводилась симуляция эволюции белкового семейства согласно модели независимых замен в позициях белка и эволюционному дереву анализируемых последовательностей. По распределению величин парной информации оценивалось ее критическое значение, такое, что вероятность наблюдать его для независимых позиций белка будет достаточно низкой. Полученное критическое значение использовалось далее для оценки значимости выявленных зависимостей при анализе реальных данных.
Слайд 14В целом результаты, полученные О.Б. Птициным и М.В. Волькенштейном, Герштейном и
Таким образом, при проведении анализа координированных замен необходимо использовать меры зависимости замен, которые по возможности наиболее адекватно отражают взаимодействия аминокислотных остатков. Вместе с тем, требуется учитывать как филогенетические особенности анализируемой выборки, так и опосредованные взаимодействия в белках. Важными моментами такого анализа являются оценка вклада координированных замен в постоянство интегральных физико-химических характеристик белка, а также сопоставление данных, полученных в ходе корреляционного анализа, с данными о структурно-функциональной организации и эволюции исследуемых белков.
Слайд 15АНАЛИЗ РЕЖИМА АДАПТИВНОЙ ЭВОЛЮЦИИ В БЕЛКАХ ВИРУСА ГЕПАТИТА С
Вирус гепатита
Функциональное изучение белков ВГС затруднено, так как существуют значительные сложности с культивированием вируса in vitro, а также почти невозможно моделировать заболевание на лабораторных животных, поскольку единственным модельным объектом в природе является шимпанзе. Между тем, персистируя в ходе хронической инфекции в организме человека дли тельное время, а также отличаясь большой скоростью размножения и высокой мутабильностью своего РНК-генома, популяция вируса обладает возможностью, эволюционируя, уходить от иммунного ответа хозяина. Другим потенциальным источником изменчивости может служить обмен генетическим материалом с другими популяциями ВГС. Возможность подобного обмена между отдаленными популяциями облегчается высокой подвижностью такого хозяина, как человек. Повышение изменчивости ВГС чрезвычайно затрудняет борьбу с ним. Поэтому важную роль в изучении ВГС и закономерностей его эволюции играют современные теоретические методы анализа его геномных последовательностей. Одним из таких подходов является сравнительный и эволюционный анализ последовательностей геномов ВГС.
Слайд 16Сравнительный анализ, в частности, позволил выявить шесть основных групп генотипов, обозначаемых
Информация о позициях белков, подверженных движущему отбору, может быть важной как для функционального анализа белков ВГС, так и для оценки перспектив борьбы с ним (поиск мишеней для фармакологических препаратов, антигенных детерминант для вакцинации и т.д.). Настоящая работа посвящена исследованию адаптивного режима эволюции белков вируса гепатита С человека, выявлению на основе этих данных особенностей их структурно-функциональной организации, характера их взаимодействия с клетками иммунной системы, а также возможностей для их коэволюции в системе «человек- вирус».
Слайд 17Материалы и методы.
Последовательности ВГС.
Последовательности для анализа были взяты из базы
Слайд 18Выявление адаптивного режима эволюции.
Мы использовали критерий отношения скоростей синонимических и несинонимических
Слайд 19Оценка статистической зависимости между режимом эволюции ко дона и его функциональной
Для оценки статистической зависимости между адаптивным режимом эволюции кодонов и функцией со ответствующих аминокислотных остатков был проведен перестановочный тест. В ходе этого теста каждому кодону сопоставлялось два при знака. Первый признак S отражал характер замен (адаптивный/нейтральный). Если в какой-либо из исследованных нами моделей величина параметра ω превышала 1 с вероятностью более 0,9, то для такого кодона признак режима эволюции принимал значение 1 (адаптивный), в противном случае признак принимал значение 0 (нейтральный). Второй признак F отражал функциональную нагрузку кодона. Если аминокислотный остаток принадлежал функциональному сайту, то для такого ко дона его значение было равно 1, в противном случае - 0.
Слайд 20C помощью описанных методов был проведен анализ всех белков генома ВГС.
Слайд 21Для всех белков вируса было проведено сопоставление адаптивных позиций с сайтами
Слайд 22Из таблицы видно, что большинство белков ВГС содержит позиции, подверженные адаптивной
Слайд 23Белок NS4A имеет достаточно высокое среднее значение ω по белку. Из-за
Таким образом, результаты анализа кодирующих районов генома ВГС позволили выявить адаптивную эволюцию для ряда позиций белков.




![В работе [Vemet et al., 1992] проанализированы замены аминокислотных остатков в зоне контакта двух субъединиц](/img/tmb/5/415262/444f52875573f0b77551845e12603c34-800x.jpg)





![В работе [Clarke, 1995] анализировались последовательности ДНК связывающего домена класса «гомеодомен». Для учета эволюционной зависимости](/img/tmb/5/415262/a9b58a9b6818a6ea9f08dce6361111ca-800x.jpg)