- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая технология презентация
Содержание
- 1. Химическая технология
- 2. Химическая технология – наука о наиболее выгодных
- 3. Принципы химической технологии: 1) экологичность безотходность
- 4. Производство чугуна Производство стали Производство серной кислоты Производство аммиака Производство азотной кислоты Производство метанола
- 5. Производство чугуна
- 6. Сырье: Железная руда Кокс, воздух, обогащенный кислородом, флюсы (известняк, доломит) Кокс Железная руда Известняк
- 7. Основной процесс: Кокс сгорает, про
- 8. Побочные процессы: Одновременно восстанавливаются оксиды
- 9. Доменная печь. В верхнюю часть – колошник
- 10. Доменная печь
- 11. Производство стали
- 12. Сырье: Чугун, металлолом, оксиды железа; воздух, обогащенный
- 13. Вспомогательные процессы: Для удаления образующегося оксида
- 14. А – загрузка
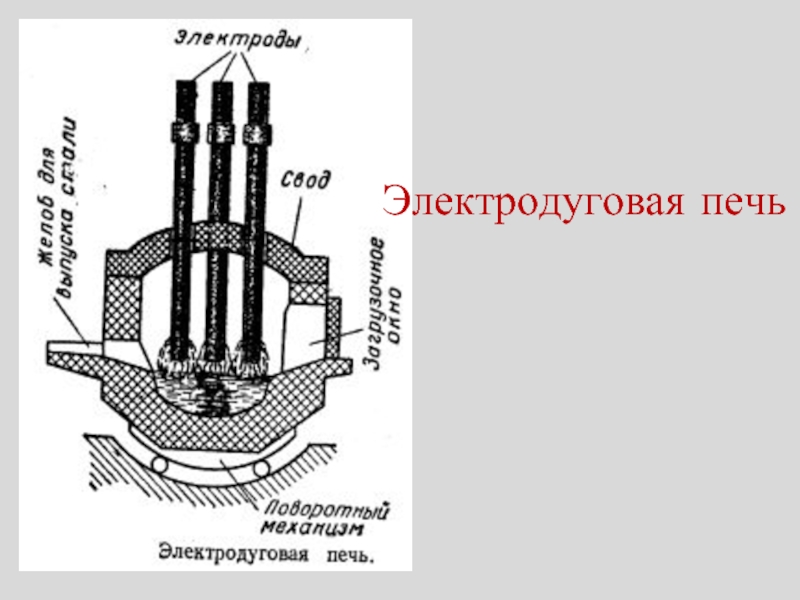
- 15. Электродуговая печь
- 16. Мартеновская печь Примеси окисляют, пропуская предварительно нагретый
- 17. Производство серной кислоты H2SO4 Контактный способ
- 18. Всего - 60 млн. тонн
- 19. Сырье: Пирит (серный колчедан) FeS2 Самородная сера
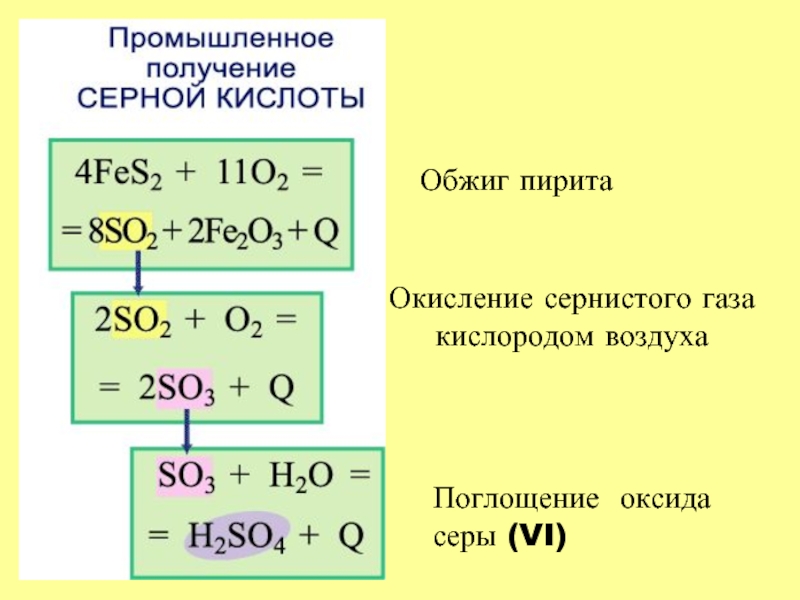
- 20. Обжиг пирита Окисление сернистого газа кислородом воздуха Поглощение оксида серы (VI)
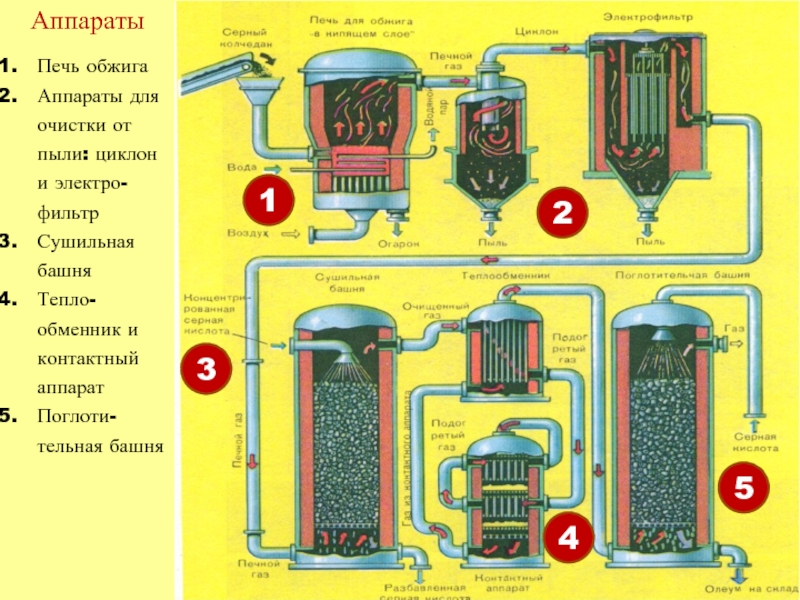
- 21. Аппараты 3 2 1 4 5 Печь
- 22. Печь обжига Подача воздуха снизу «кипящий слой»
- 23. Аппараты для очистки от пыли Циклон –
- 24. вернуться Сушильная башня Поглощение паров воды осуществляется
- 25. вернуться контактный аппарат Воздух, SO2
- 26. вернуться Поглотительная башня SO3
- 27. Синтез аммиака NH3
- 28. Сырье: азотоводородная смесь Вспомогательный материал: катализатор (пористое железо)
- 29. Газы реагируют при 450-500˚С в присутствии катализатора
- 30. Направление движения азотоводородной смеси в колонне синтеза
- 31. Производство азотной кислоты HNO3
- 32. Сырье: аммиак, воздух Вспомогательные материалы: катализаторы (платинородиевые
- 33. Воздушноаммиачная смесь поступает в контактный аппарат, где
- 34. Производство метанола СH3OН
- 35. Сырье: синтез газ – смесь СО +
Слайд 2Химическая технология – наука о наиболее выгодных приемах переработки химического сырья.
Проблемы,
сырье
процесс
энергетика
аппаратура
материалы аппаратов
управление процессом
охрана труда
экология
экономика
развитие высоких технологий.
Слайд 3Принципы химической технологии:
1) экологичность
безотходность
охрана труда
охрана окружающей среды
2) экономичность
использование теплоты химической реакции
увеличение скорости ( «кипящий слой», катализатор, измельчение сырья, перемешивание)
полное использование сырья (циркуляционный процесс).
Слайд 4Производство чугуна
Производство стали
Производство серной кислоты
Производство аммиака
Производство азотной кислоты
Производство метанола
Слайд 6Сырье:
Железная руда
Кокс, воздух, обогащенный кислородом, флюсы (известняк, доломит)
Кокс
Железная руда
Известняк
Слайд 7Основной процесс:
Кокс сгорает, про этом выделяется теплота, необходимая для реакции
С + О2 = СО2 + 394 кДж
Оксид углерода (IV) восстанавливается коксом:
СО2 + С = 2 СО – 174 кДж
Оксид железа в руде восстанавливается оксидом углерода (II):
Fe2O3 + 3 CO = 2 Fe + 3 CO2 + 30 кДж
Слайд 8Побочные процессы:
Одновременно восстанавливаются оксиды других элементов, содержащихся в руде:
MnO2 +
SiO2 + 2 CO = Si + 2 CO2
P2O5 + 5 CO = 2 P + 5 CO2
Известняк разлагается:
CaCO3 = CaO + CO2
Тугоплавкая примесь SiO2 в руде удаляется оксидом кальция:
CaO + SiO2 = CaSiO3
Слайд 9Доменная печь.
В верхнюю часть – колошник – подается шихта. В нижнюю
Слайд 12Сырье:
Чугун, металлолом, оксиды железа;
воздух, обогащенный кислородом, раскислители (ферромарганец),
добавки.
Основной процесс:
Элементы, содержащиеся
2 С + О2 = 2 СО 4 P + 5 O2 = 2 P2O5
Si + O2 = SiO2 S + O2 = SO2
2 Mn + O2 = 2 MnO 2 Fe + O2 = 2 FeO
Образовавшийся оксид железа (II) также принимает участие в окислении:
C + FeO = Fe + CO Mn + FeO = Fe + MnO
Si + 2 FeO = 2 Fe + SiO2 2 P + 5 FeO = 5 Fe + P2O5
Тугоплавкие примеси образуют шлак:
СаО + SiO2 = CaSiO3 3 CaO + P2O5 = Ca3(PO4)2
Слайд 13Вспомогательные процессы:
Для удаления образующегося оксида железа (II) добавляют ферромарганец (раскислитель):
Mn +
Оксил марганца (II) переходит в шлак:
MnO + SiO2 = MnSiO3
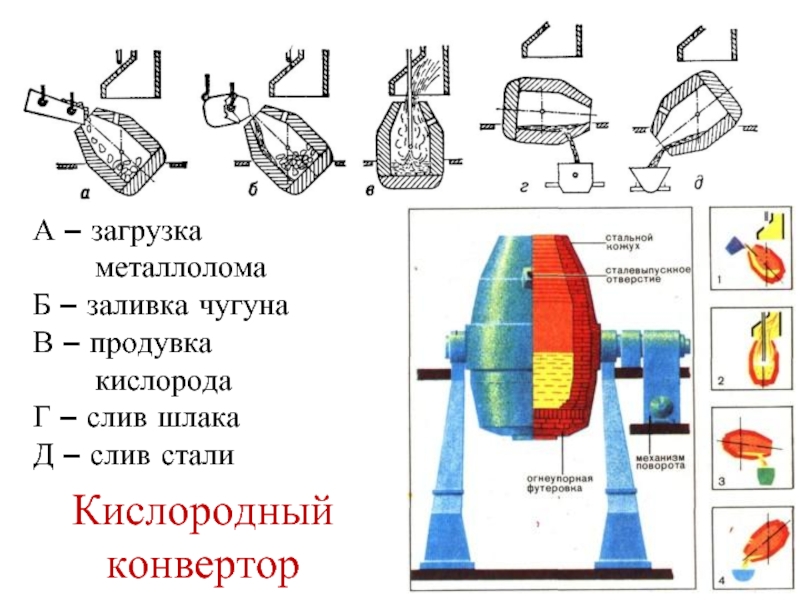
Слайд 14А – загрузка
металлолома
Б – заливка чугуна
В
кислорода
Г – слив шлака
Д – слив стали
Кислородный конвертор
Слайд 16Мартеновская печь
Примеси окисляют, пропуская предварительно нагретый в регенераторах воздух над расплавленным
Производство периодическое.
Слайд 19Сырье:
Пирит (серный колчедан) FeS2
Самородная сера
воздух
Пирит крупнокристаллический
Пирит мелкокристаллический
Самородная сера
Вспомогательный материал: катализатор (оксид
Слайд 21Аппараты
3
2
1
4
5
Печь обжига
Аппараты для очистки от пыли: циклон и электро-фильтр
Сушильная башня
Тепло-обменник и
Поглоти-тельная башня
Слайд 22Печь обжига
Подача воздуха снизу
«кипящий слой»
4 FeS2 + 11 O2 = 2
Непрерывно поступает измельченный колчедан.
Оптимальная температура 400-450˚С. При большей температуре руда спекается, при меньшей – замедляется скорость реакции. Утилизация теплоты. Использование отходов.
Печной газ
вернуться
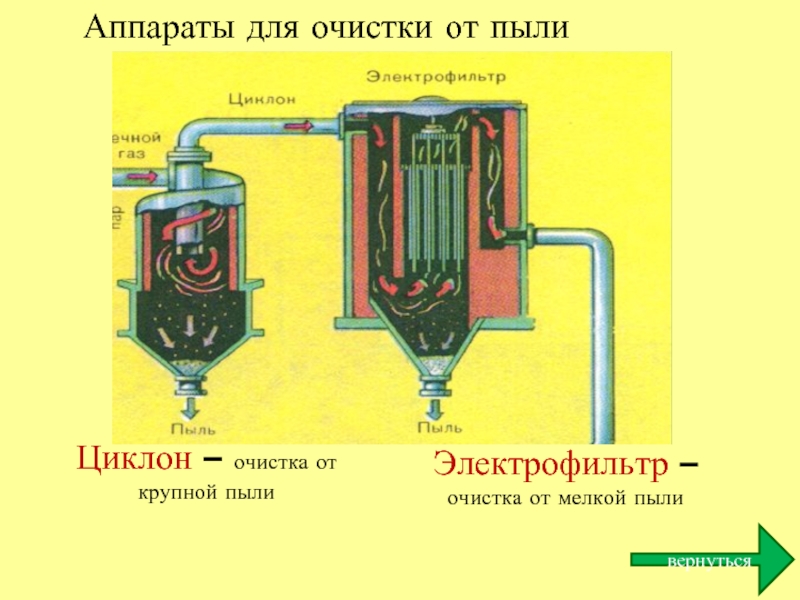
Слайд 23Аппараты для очистки от пыли
Циклон – очистка от крупной пыли
Электрофильтр –
вернуться
Слайд 24вернуться
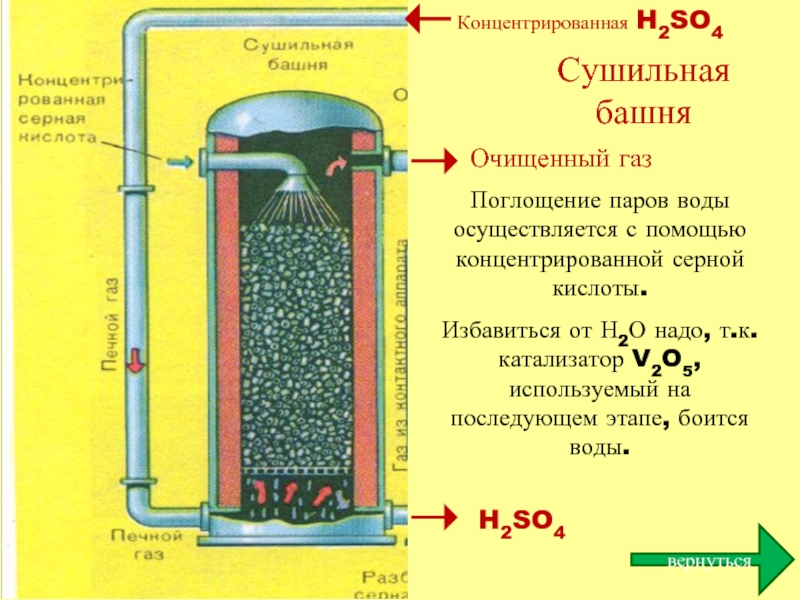
Сушильная башня
Поглощение паров воды осуществляется с помощью концентрированной серной кислоты.
Избавиться от
Очищенный газ
H2SO4
Концентрированная H2SO4
Слайд 25вернуться
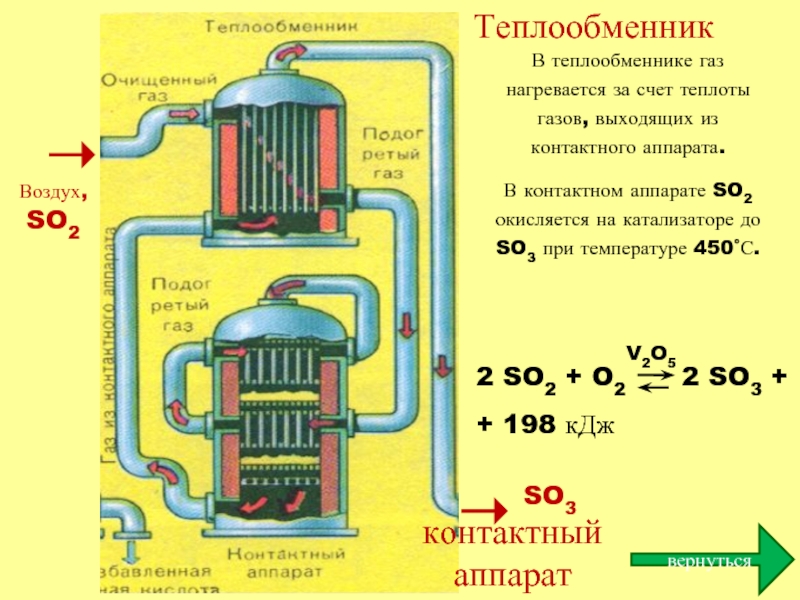
контактный аппарат
Воздух, SO2
Теплообменник
SO3
В теплообменнике газ нагревается за счет теплоты газов, выходящих
В контактном аппарате SO2 окисляется на катализаторе до SO3 при температуре 450˚С.
Слайд 26вернуться
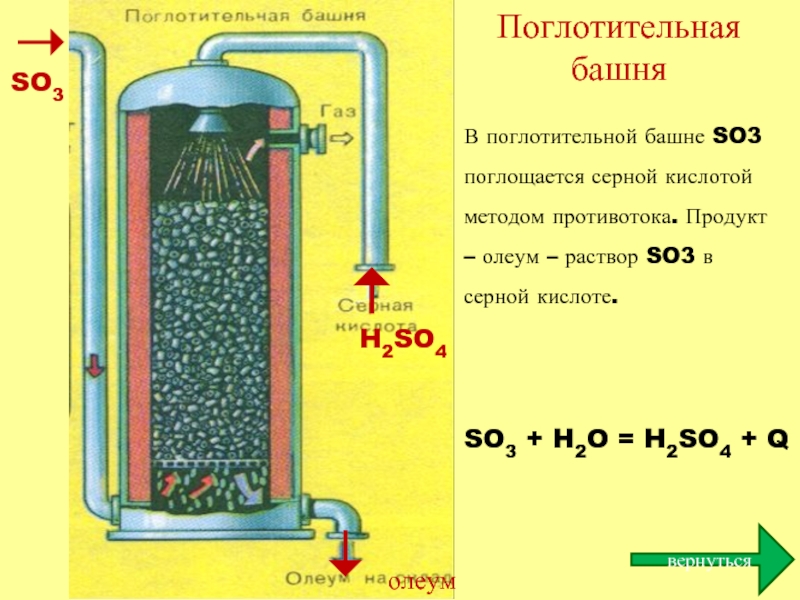
Поглотительная башня
SO3
H2SO4
олеум
В поглотительной башне SO3 поглощается серной кислотой методом противотока. Продукт
SO3 + H2O = H2SO4 + Q
Слайд 29Газы реагируют при 450-500˚С в присутствии катализатора под давлением 15▪106 Па
Слайд 30Направление движения азотоводородной смеси в колонне синтеза выбирают так, чтобы максимально
возвращая непрореагировавшую смесь в колонну синтеза. Процесс непрерывный,
циркуляционный.
Слайд 32Сырье: аммиак, воздух
Вспомогательные материалы: катализаторы (платинородиевые сетки), вода,
концентрированная серная кислота.
Основной
Аммиак окисляется при 800˚С в присутствии катализатора:
4 NH3 + 5 O2 = 4 NO + 6 H2O + Q
Дальнейшие процессы происходят при обычной температуре:
2 NO + O2 = 2 NO2 +Q
4 NO2 + 2 H2O + O2 = 4 HNO3 + Q
Слайд 33Воздушноаммиачная смесь поступает в контактный аппарат, где происходит окисление аммиака. Температура
Технологический процесс
Слайд 35Сырье: синтез газ – смесь СО + 2 Н2
Вспомогательные материалы: катализаторы
Производства метанола и аммиака объединяют из-за сходства технологических процессов.
При прохождении газовой смеси через слой катализатора образуется 10-15 % метанола, который конденсируют, а непрореагировавшую смесь смешивают с новой порцией сырья и отправляют в колонну синтеза.