- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 1 Лекарственные средства из группы производных бензолсульфокислот Доц. Яворская Л.П. презентация
Содержание
- 1. Лекция 1 Лекарственные средства из группы производных бензолсульфокислот Доц. Яворская Л.П.
- 2. План 1. Лекарственные средства из группы хлорпроизводных
- 3. Сульфатная кислота – H2SO4
- 4. Введение сульфогруппы –SO3H
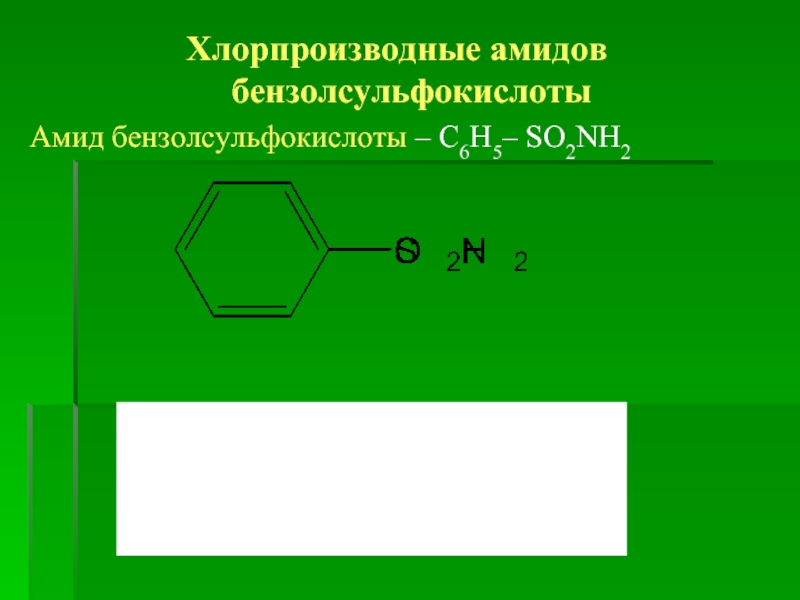
- 5. Хлорпроизводные амидов бензолсульфокислоты Амид бензолсульфокислоты – С6Н5– SO2NH2
- 6. Хлорпроизводные амидов бензолсульфокислоты имеют общую формулу где
- 7. Известны различные хлорамины. 1. Хлорамин Б и
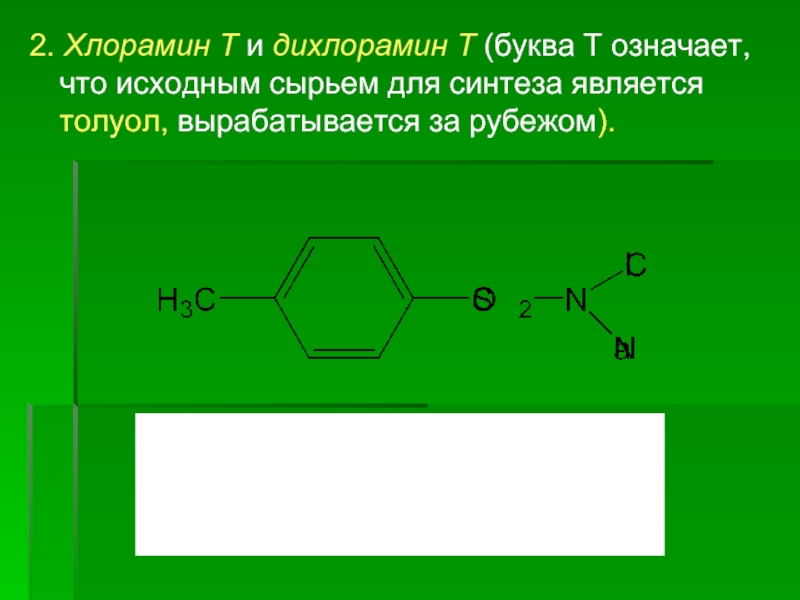
- 8. 2. Хлорамин Т и дихлорамин Т (буква
- 9. Дихлорамины имеют большее содержание активного хлора.
- 10. Аналогичное действие имеют
- 11. Хлорамин
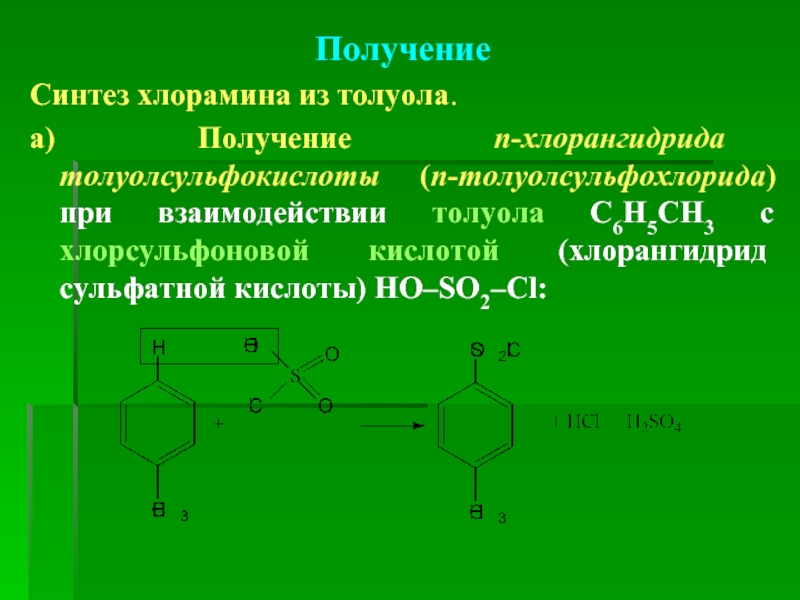
- 12. Получение Синтез хлорамина из толуола. а)
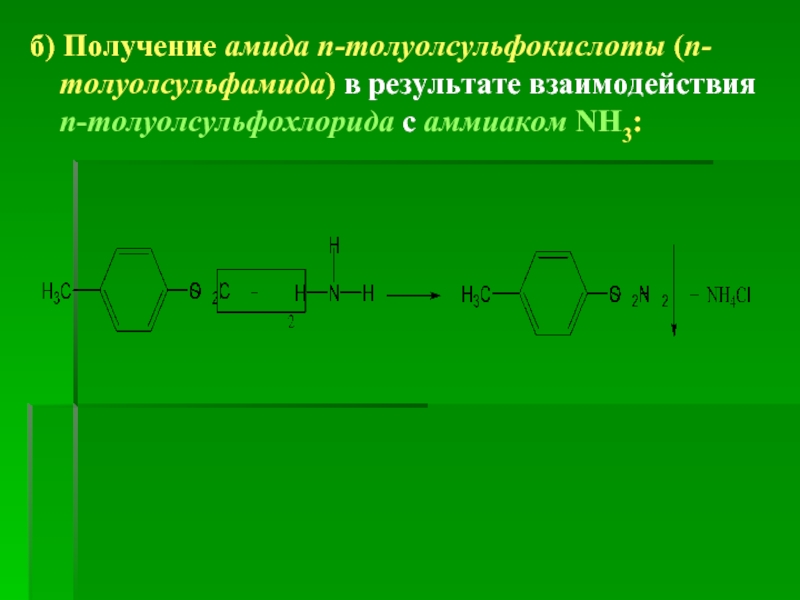
- 13. б) Получение амида п-толуолсульфокислоты (п-толуолсульфамида) в результате взаимодействия п-толуолсульфохлорида с аммиаком NH3:
- 14. Осадок толуолсульфамида отфильтровывают и промывают водой от
- 15. В реакционной
- 16. Свойства Описание. ГФУ.
- 17. На воздухе хлорамин разлагается под действием
- 18. Идентификация А. Гидролиз препарата и действие водного
- 19. С. Прокаливание препарата в тигле и выявление
- 20. Нефармакопейная реакция 1. ГФ ІХ. Реакция с
- 21. Испытания на чистоту 1. Прозрачность раствора.
- 22. Количественное определение Йодометрия, титрованне по заместителю
- 23. Хранение В воздухонепроницаемом контейнере,
- 24. Пантоцид Pantocidum Не менее 50 % активного
- 25. Получение Синтез пантоцида из толуола. Схема синтеза
- 26. б) Получение амида толуолсульфокислоты в результате
- 27. г) Пропускание газа хлора Cl2 сквозь щелочной
- 28. Свойства Описание. Белый
- 29. Идентификация Гидролиз препарата и действие водного раствора
- 30. 2. Реакция с раствором КІ в присутствии
- 31. Йодометрия, титрованне по заместителю 4HOCl
- 32. Хранение В плотно укопоренном контейнере, предохраняющем
- 33. Для обеззараживания воды применяют по 1 таблетке
- 34. Лекарственные средства – производные алкилуреидов бензолсульфокислот Бензолсульфокислота – С6Н5–SO2OH
- 35. Мочевина (карбамид) – амид карбонатной кислоты Н2СО3
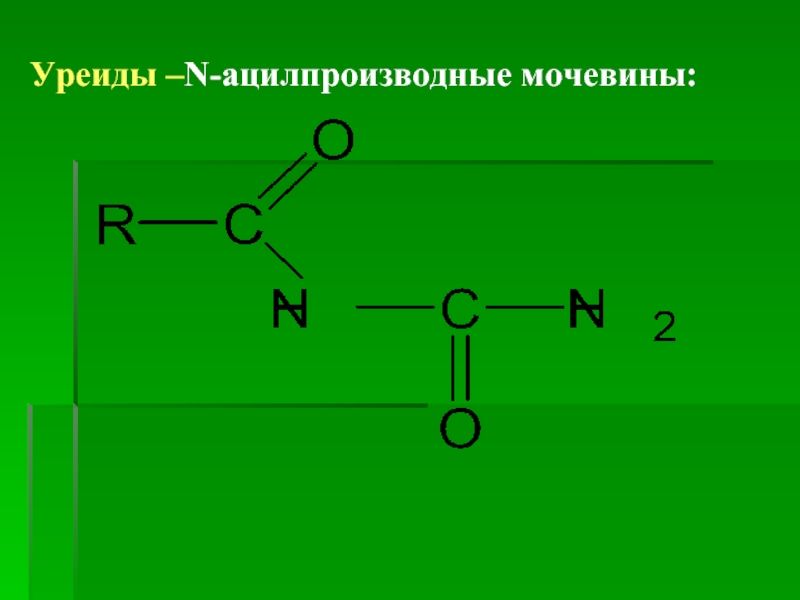
- 36. Уреиды –N-ацилпроизводные мочевины:
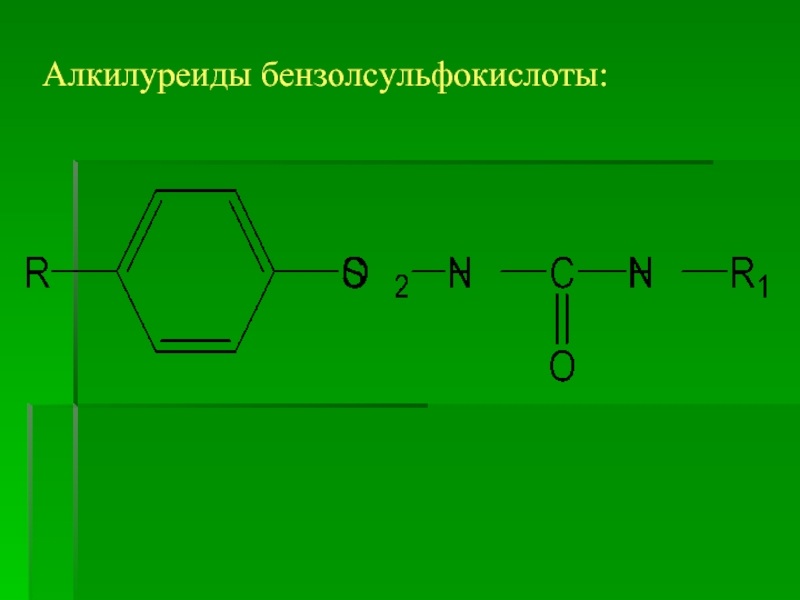
- 37. Алкилуреиды бензолсульфокислоты:
- 38. Алкилуреиды бензолсульфокислоты понижают
- 39. Хлорпропамид Chlorpropamidum Chlorpropamide Химическое название: N-(п-хлорбензолсульфонил)-N’-пропилмочевина.
- 40. Получение Синтез хлорпропамида из хлорбензола. а)
- 41. б) Получение амида п-хлорбензолсульфокислоты (п-хлорбензолсульфамида) в результате взаимодействия п-хлорбензолсульфохлорида с аммиаком NH3:
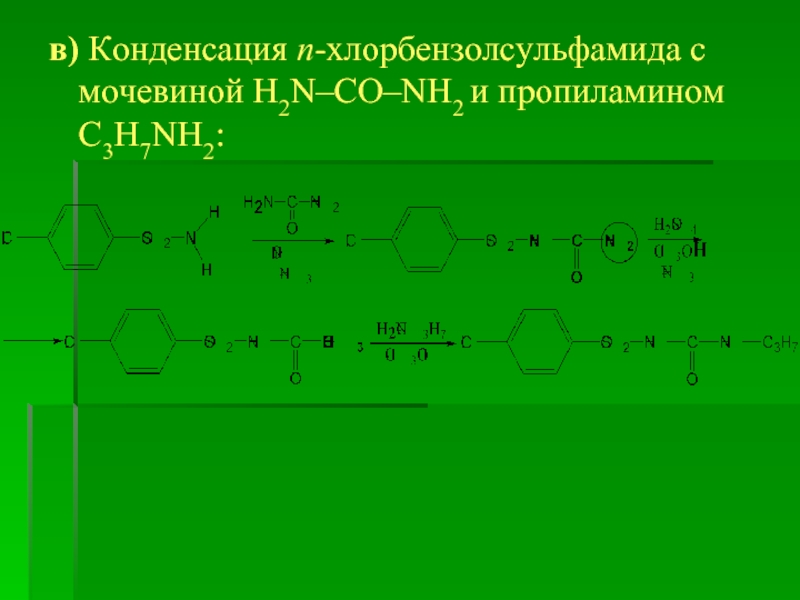
- 42. в) Конденсация п-хлорбензолсульфамида с мочевиной H2N–CO–NH2 и пропиламином С3Н7NH2:
- 43. 2. Синтез хлорпропамида из хлорбензола с использованием
- 44. б) Конденсация п-хлорбензолсульфамида с фосгеном Cl–CO–Cl
- 45. в) Конденсация с пропиламином С3Н7NH2:
- 46. Свойства Описание. Белый кристаллический
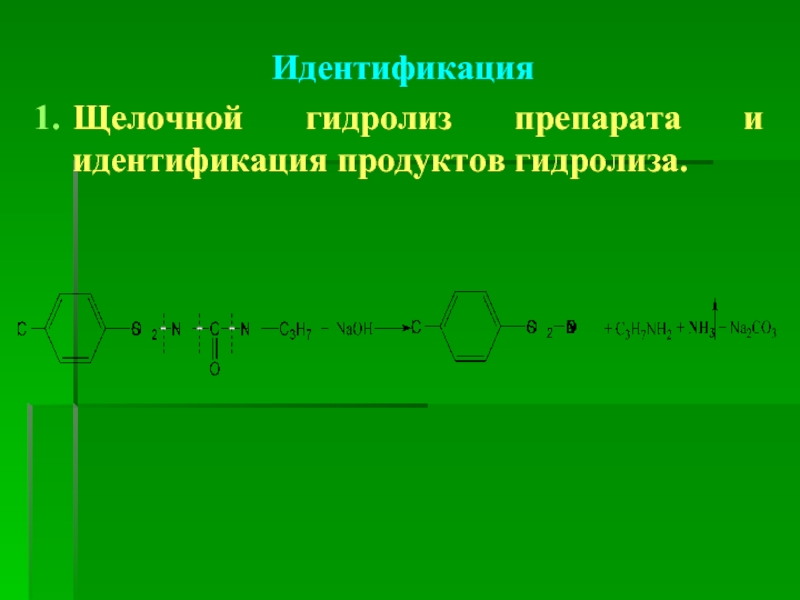
- 47. Идентификация Щелочной гидролиз препарата и идентификация продуктов гидролиза.
- 48. 2. Кислотный гидролиз препарата и идентификация продуктов гидролиза.
- 49. 3. Минерализация препарата и выявление Сульфура и
- 50. 4. УФ-спектроскопия. Определение удельного показателя поглощения растворов
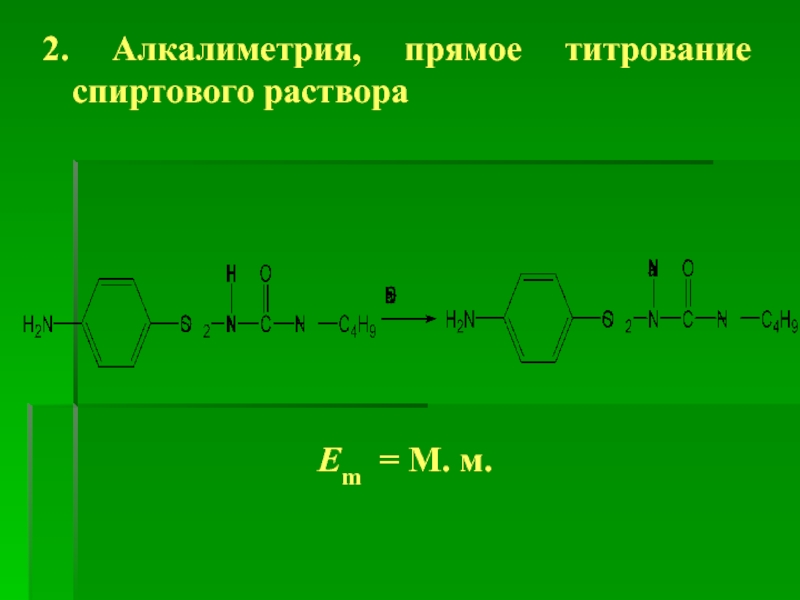
- 51. Количественное определение Алкалиметрия, прямое титрование спиртового раствора Em = М. м.
- 52. 2. Гравиметрия. Хранение. Список сильнодействующих веществ. В
- 53. По химическому строению и фармакологическому действию хлорпропамид
- 54. При нормализации уровня сахара в крови дозу
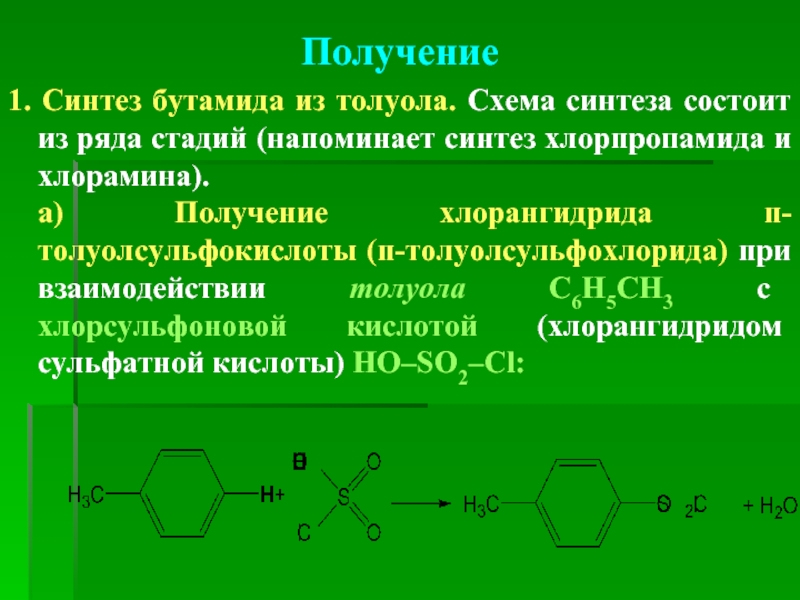
- 56. Получение 1. Синтез бутамида из толуола. Схема
- 57. б) Получение амида п-толуолсульфокислоты (п-толуолсульфамида) в результате взаимодействия п-толуолсульфохлорида с аммиаком NH3:
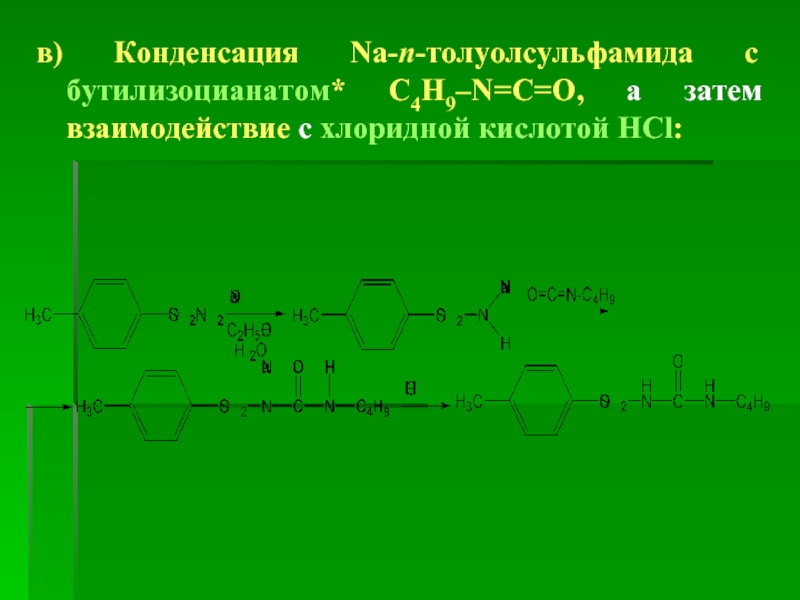
- 58. в) Конденсация Na-п-толуолсульфамида с бутилизоцианатом* С4H9–N=C=O, а затем взаимодействие с хлоридной кислотой HCl:
- 59. Свойства Описание. Белый кристаллический порошок без
- 60. Идентификация 1. Щелочной гидролиз препарата и идентификация продуктов гидролиза
- 61. 2. Кислотный гидролиз препарата и идентификация продуктов гидролиза
- 62. 3. Минерализация препарата и выявление Сульфура. SO42–
- 63. 4. Сульфатная зола и тяжелые металлы. Сульфатная
- 64. Количественное определение ГФ Х. Алкалиметрия, прямое титрование
- 65. Хранение. Список сильнодействующих веществ. В плотно укопоренном
- 66. Назначают в начале лечения по 2 г
- 67. Противопоказания: заболевания печени и почек, лейкопения, острые
- 68. Букарбан
- 69. Химическое название: N-(п-аминобензолсульфонил)-N’-бутилмочевина или N-(4-аминобензолсульфонил)-N’-н-бутилкарбамид. Букарбан
- 70. Получение 1. Синтез букарбана из ацетанилида.
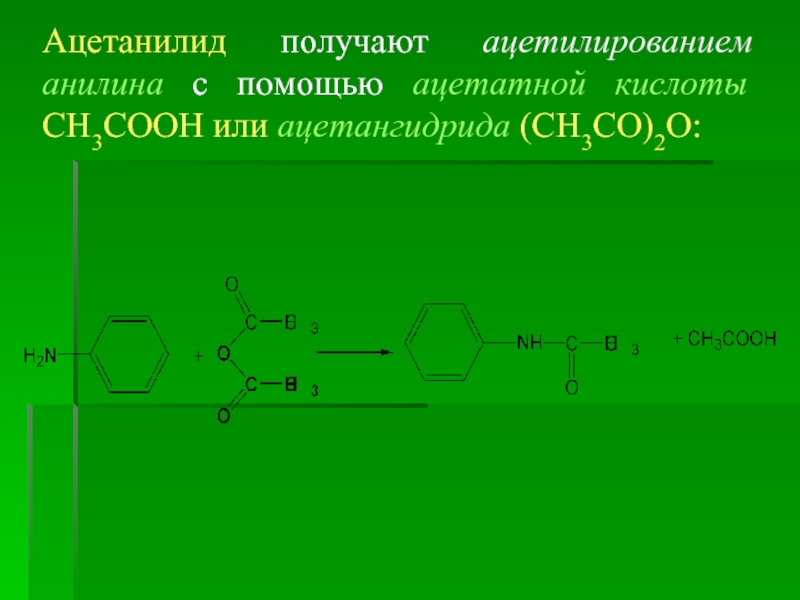
- 71. Ацетанилид получают ацетилированием анилина с помощью ацетатной кислоты СН3СООН или ацетангидрида (СН3СО)2О:
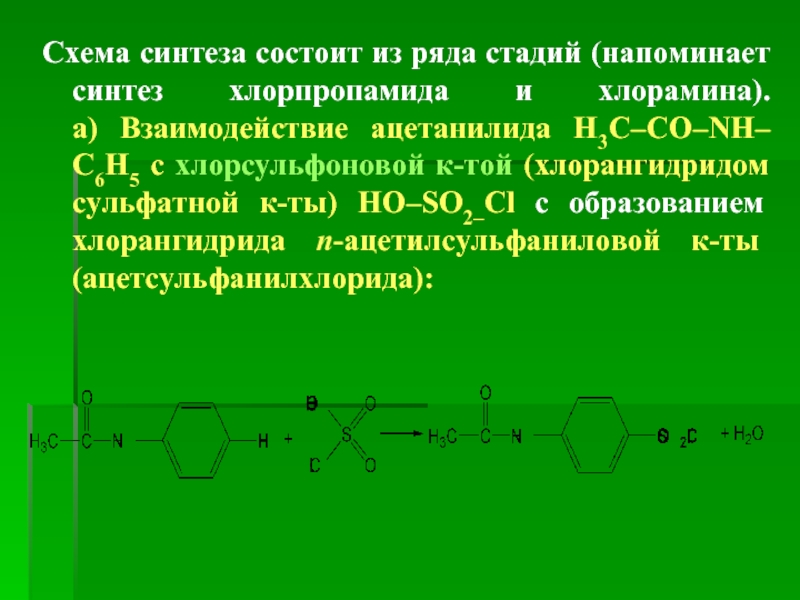
- 72. Схема синтеза состоит из ряда стадий (напоминает
- 73. б) Конденсация п-aцетсульфанилхлорида с калий цианатом K–O–C≡N (изомерен с изоцианатом K–N=C=O) с образованием п-ацетаминобензолсульфонилизоцианата:
- 74. в) Реакция с н-бутиламином С4H9NН2 c последующим гидролизом ацетилбукарбана с образованием букарбана:
- 75. Свойства Описание. Белый кристаллический порошок. Температура
- 76. Идентификация Реакция на первичную ароматическую аминогруппу (ГФУ)
- 77. 2. Щелочной гидролиз препарата и идентификация продуктов
- 78. 4. Минерализация препарата и выявление Сульфура. SO42– + Ba2+ → BaSO4 5. ИК-спектроскопия.
- 79. Количественное определение Нитритометрия, прямое титрование
- 80. 2. Алкалиметрия, прямое титрование спиртового раствора Em = М. м.
- 81. Хранение. Список сильнодействующих веществ. В плотно укопоренном
- 82. Кроме того, он
- 83. Глибенкламид
- 84. Свойства Описание. Кристаллический порошок белого или
- 85. Е. Флуоресценция раствора субстанции в сульфатной кислоте.
- 86. 3. Общие примеси тяжелых металлов – в
- 87. Количественное определение Алкалиметрия, прямое титрование спиртового раствора Еm = М. м.
- 88. Хранение. В плотно укупорен. контейнере, в
Слайд 2План
1. Лекарственные средства из группы хлорпроизводных амидов бензолсульфокислоты – хлорамины, пантоцид.
2.
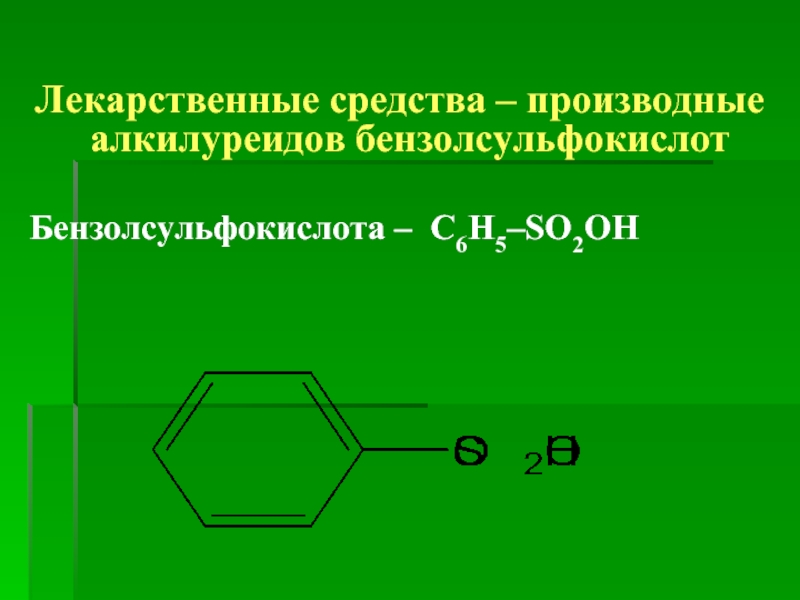
Слайд 3Сульфатная кислота – H2SO4 HO–SO2–OH
Бензолсульфокислота (бензенсульфатная к-та, сульфобензойная к-та) – продукт замещения одной группы –ОН в молекуле сульфатной к-ты на бензеновое ядро –С6Н5:
С6Н5–SO2–OH С6Н5–SO3H Графическая формула:
Слайд 4 Введение сульфогруппы –SO3H в ароматическое ядро придает
Бензолсульфокислота образует ряд производных, среди которых имеются важные лекарственные средства – производные амидов (хлорамин, пантоцид) и алкилуреидов (хлорпропамид, бутамид, букарбан, глибенкламид).
Слайд 6Хлорпроизводные амидов бензолсульфокислоты имеют общую формулу
где R – H, COOH
Замена одного або двух атомов Гидрогена в бензолсульфамидной группе на Хлор приводит к образованию нестойких соединений – хлораминов, которые легко разлагаются с выделением „активного хлора”, который проявляет окислительные свойства. Поэтому хлорамины имеют вираженные антисептические и дезинфицирующие свойства.
Слайд 7Известны различные хлорамины.
1. Хлорамин Б и дихлорамин Б (буква Б означает,
Слайд 82. Хлорамин Т и дихлорамин Т (буква Т означает, что исходным
Слайд 9Дихлорамины имеют большее содержание активного хлора.
Сущность
HClO → HCl + O 2HClO → 2HCl + O2
или выделения ”активного хлора” Cl2:
2HOCl → Cl2 + Н2O2 → Cl2 + Н2O + О
или
4HOCl → 2Cl2 + 2Н2O + О2
Слайд 10 Аналогичное действие имеют гипохлориты, например, натрия гипохлорит
NaClO + НОН ⇔ NaОН + НСlO
Но преимущество хлораминов перед гипохлоритами состоит в том, что они не образуют щелочи NaОН, которая разъедает поверхность раны.
Слайд 11Хлорамин
Сhloraminum
Химическое название: натрия N-хлор-4-метилбензол-сульфонимида тригидрат, N-хлорбензолсульфамид-натрия тригидрат.
Слайд 12Получение
Синтез хлорамина из толуола.
а) Получение п-хлорангидрида толуолсульфокислоты (п-толуолсульфохлорида) при взаимодействии
Слайд 13б) Получение амида п-толуолсульфокислоты (п-толуолсульфамида) в результате взаимодействия п-толуолсульфохлорида с аммиаком
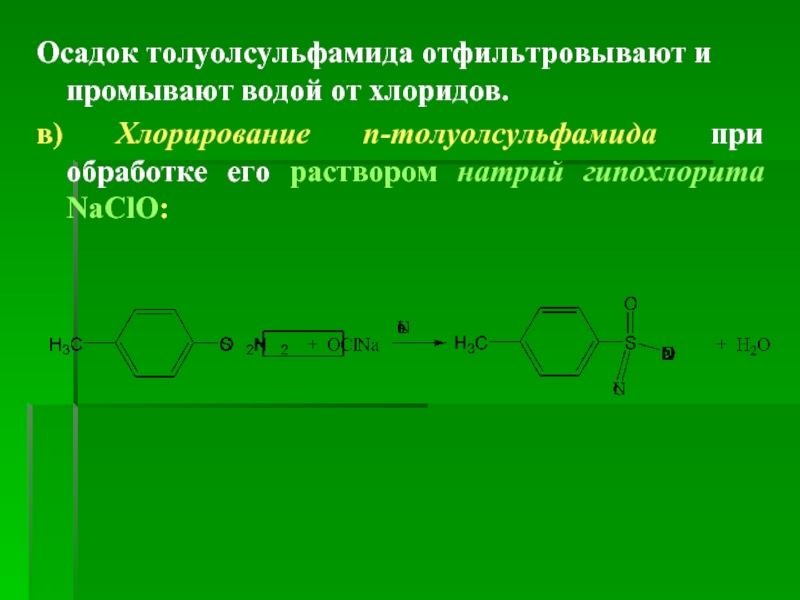
Слайд 14Осадок толуолсульфамида отфильтровывают и промывают водой от хлоридов.
в) Хлорирование п-толуолсульфамида при
Слайд 15 В реакционной смеси не должно быть
Чтобы не допустить этой реакции, в третьей стадии синтеза к реакционной смеси прибавляют концентрированный раствор натрий хлорида NaCl.
Слайд 16Свойства
Описание. ГФУ. Кристаллический порошок белого або белого
Растворимость. Легко растворим в воде Р, растворим в 96 % спирте Р, практически нерастворим в эфире Р.
Содержит 25–29 % активного хлора* (* активный хлор – это хлор Cl2, который способен вытеснять из калий йодида KI свободный йод I2).
Слайд 17 На воздухе хлорамин разлагается под действием углекислого газа СО2 и слышен
При быстром нагревании хлорамин разлагается со взрывом и вспышкой.
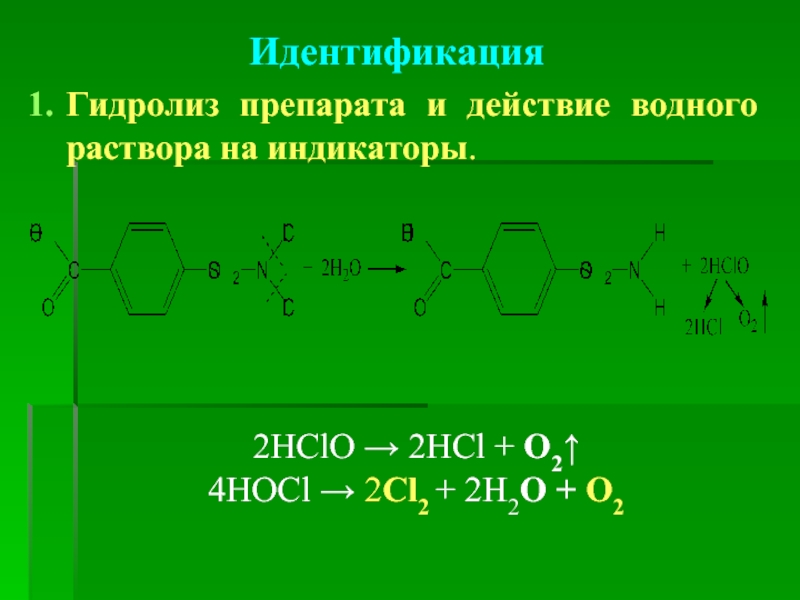
Слайд 18Идентификация
А. Гидролиз препарата и действие водного раствора на индикаторы.
H3C–С6Н4–SO–NСl–ONa +
NaClO + НОН ⇔ NaОН + НСlO
2HClO → 2HCl + O2↑
4HOCl → 2Cl2 + 2Н2O + О2
В. Прокаливание препарата в тигле и выявление в фильтрате хлорид-ионов.
Cl– + Ag+ → AgCl↓
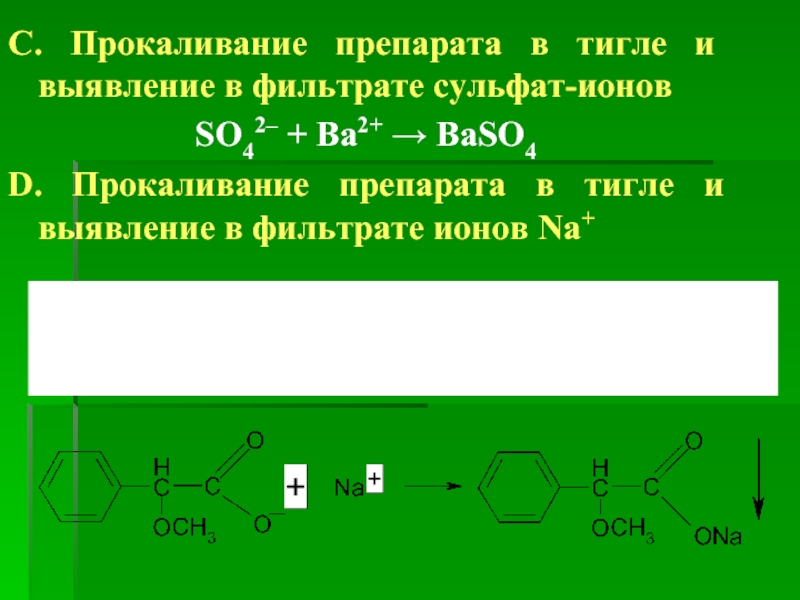
Слайд 19С. Прокаливание препарата в тигле и выявление в фильтрате сульфат-ионов
SO42–
D. Прокаливание препарата в тигле и выявление в фильтрате ионов Na+
Слайд 20Нефармакопейная реакция
1. ГФ ІХ. Реакция с раствором KI в присутствии хлороформа
Слайд 21Испытания на чистоту
1. Прозрачность раствора.
2. Цветность раствора.
3. рН
4. Ортопроизводные.
5. Остаток, нерастворимый в этаноле.
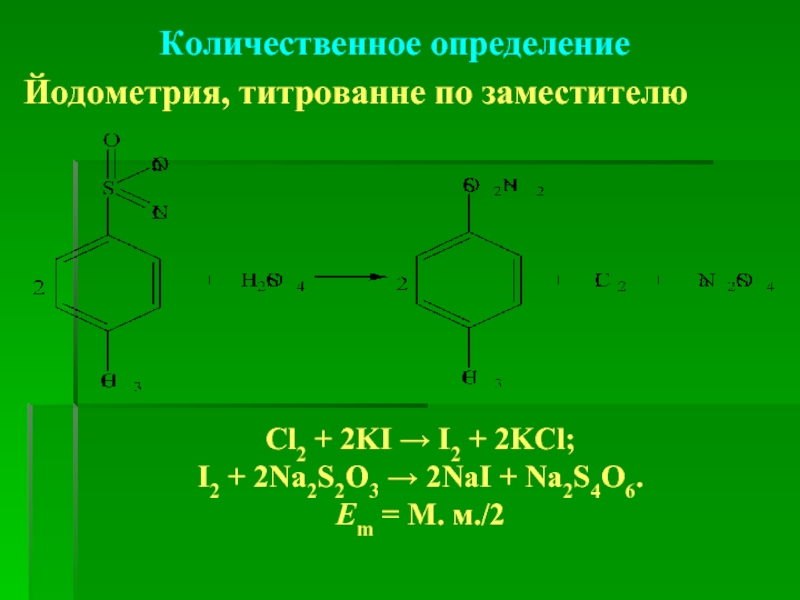
Слайд 22Количественное определение
Йодометрия, титрованне по заместителю
Cl2 + 2KI → I2 + 2KCl;
I2
Еm = М. м./2
Слайд 23Хранение
В воздухонепроницаемом контейнере, у захищ. от света, сухом
Применение. Наружное антисептическое и дезодорирующее средство.
Применяют для лечения инфицированных ран (1,5–2 % р-ры – промывание ран, смачивание тампонов и салфеток), дезинфекции рук (0,25–0,5 % р-р), обработки неметал. инструментария, обеззараживания предметов ухода за больными (1–3 % р-р), при туберкулезной инфекции (5 % р-р).
Для дезинфекции иногда используют “активированные” растворы хлорамина: добавление NH3, (NH4)2SO4 или NH4Cl усиливает бактерицидные свойства растворов.
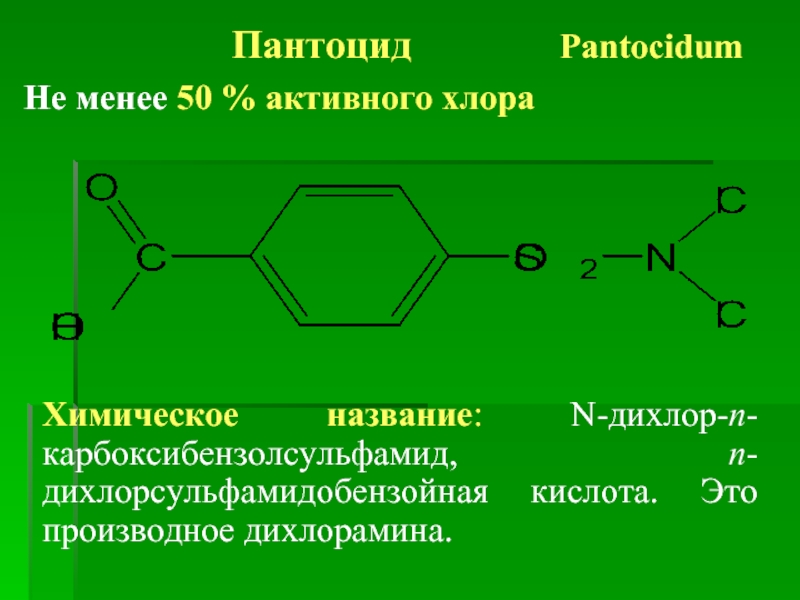
Слайд 24 Пантоцид Pantocidum
Не менее 50 % активного хлора
Химическое название: N-дихлор-п-карбоксибензолсульфамид, п-дихлорсульфамидобензойная кислота.
Слайд 25Получение
Синтез пантоцида из толуола. Схема синтеза состоит из ряда стадий (напоминает
Слайд 26
б) Получение амида толуолсульфокислоты в результате взаимодействия п-толуолсульфохлорида с аммиаком NH3:
Осадок толуолсульфамида отфильтровывают и промывают водой от хлоридов.
в) Окисление толуолсульфамида при обработке его хромовой смесью (р-р K2Cr2O7 и конц. H2SO4) до п-сульфамидобензойной кислоты:
Слайд 27г) Пропускание газа хлора Cl2 сквозь щелочной раствор п-сульфамидобензойной к-ты до
г) Пропускание газа хлора Cl2 сквозь щелочной раствор п-сульфамидобензойной к-ты до полного осаждения пантоцида:
Слайд 28Свойства
Описание. Белый порошок со слабым запахом хлора.
Натриевая соль пантоцида легко растворима в воде. Поэтому таблетки пантоцида всегда содержат 50 % безводного натрия карбоната.
Слайд 29Идентификация
Гидролиз препарата и действие водного раствора на индикаторы.
2HClO → 2HCl
4HOCl → 2Cl2 + 2Н2O + О2
Слайд 302. Реакция с раствором КІ в присутствии хлороформа (идентификация хлора –
Испытания на чистоту
Количественное определение
Cl2 + 2KI → I2 + 2KCl
Слайд 31Йодометрия, титрованне по заместителю
4HOCl → 2Cl2 + 2Н2O + О2
Cl2
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Em = М. м. Cl2/2 = А. м. Cl
Слайд 32
Хранение
В плотно укопоренном контейнере, предохраняющем от действия света, в сухом и
Применение. Активное антисептическое средство.
Применяют главным образом для обеззараживания воды (поэтому слышен слабый запах хлора), используя таблетки, содержащие пантоцид 0,0082 г, безводный Na2CO3 0,0036 г и NaCl 0,1082 г. Одна таблетка содержит 3 мг активного хлора.
Слайд 33Для обеззараживания воды применяют по 1 таблетке пантоцида на 0,5–0,75 л
Используют пантоцид также для дезинфекции рук (1–1,5 % р-ы), спринцеваний и обработки ран (0,1–0,5 % р-ры).
Слайд 34
Лекарственные средства – производные алкилуреидов бензолсульфокислот
Бензолсульфокислота – С6Н5–SO2OH
Слайд 38 Алкилуреиды бензолсульфокислоты понижают уровень сахара в крови
Слайд 39 Хлорпропамид
Chlorpropamidum
Chlorpropamide
Химическое название: N-(п-хлорбензолсульфонил)-N’-пропилмочевина.
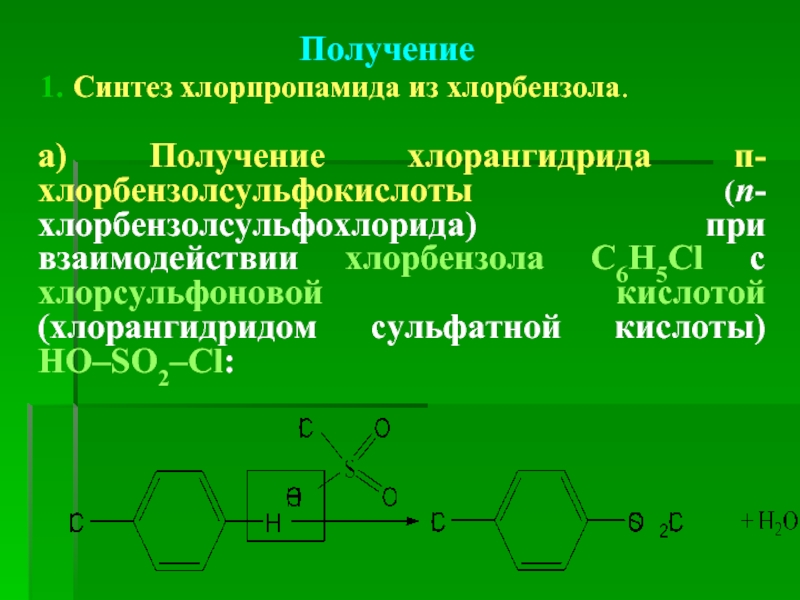
Слайд 40Получение
Синтез хлорпропамида из хлорбензола.
а) Получение хлорангидрида п-хлорбензолсульфокислоты (п-хлорбензолсульфохлорида) при взаимодействии хлорбензола
Слайд 41
б) Получение амида п-хлорбензолсульфокислоты (п-хлорбензолсульфамида) в результате взаимодействия п-хлорбензолсульфохлорида с аммиаком
Слайд 432. Синтез хлорпропамида из хлорбензола с использованием фосгена.
Синтез состоит из
а) см. метод 1 – получают п-хлорбензолсульфамид:
Слайд 46Свойства
Описание. Белый кристаллический порошок без запаха и вкуса.
Растворимость. Практически нерастворим в воде, растворим в спирте, ацетоне, бензоле и хлороформе, мало растворим в эфире, растворим в растворах едких щелочей*.
*Наличие сульфамидной группы –SO2–NH– обуславливает кислую реакцию спиртовых растворов, а также растворимость таких препаратов в воде.
Слайд 493. Минерализация препарата и выявление Сульфура и Хлора.
а) Выявление в фильтрате
SO42– + Ba2+ → BaSO4
б) Выявление в фильтрате хлорид-ионов
Cl– + Ag+ → AgCl↓
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2]Cl + 2HNO3 → AgCl↓ + 2NH4NO3
Слайд 504. УФ-спектроскопия. Определение удельного показателя поглощения растворов хлорпропамида в этаноле или
Испытания на чистоту
1. Общие примеси хлоридов – в пределах эталонов.
2. Сульфаты (недопустимая примесь). 0,3 г препарата взбалтывают с 30 мл воды и фильтруют. Фильтрат не должен давать реакции на сульфаты.
3. Потеря массы при высушивании. Не должна превышать 0,5 %.
4. Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 г препарата не должна превышать 0,1 % и должна выдерживать испытания на тяжелые металлы.
Слайд 522. Гравиметрия.
Хранение. Список сильнодействующих веществ. В плотно укопоренном контейнере, в сухом,
В. р. д. внутрь 0,3 г. В. с. д. внутрь 1,0 г.
Применение. Гипогликемическое (сахаропонижающее, антидиабетическое) средство.
Действие производных сульфонилмочевины связано со стимуляцией ими β-клеток поджелудочной железы, сопровождающейся мобилизацией и усилением выброса эндогенного инсулина, а также увеличением количества инсулинчувствительных рецепторов на клетках-мишенях. Одной из важных особенностей этих препаратов является их эффективность при пероральном применении. Эти препараты обычно назначают больным при легких формах сахарного диабета в возрасте старше 35 лет.
Слайд 53По химическому строению и фармакологическому действию хлорпропамид близок к бутамиду, однако
Назначают внутрь утром перед едой (или во время завтрака), начиная с 0,5 г препарата 1 раз в день. В случае плохой переносимости препарат назначают непосредственно после еды. Некоторым больным рекомендуют в вечерние часы еще принимать другие препараты этой группы (сульфонилмочевины). Хлорпропамид в вечернее время принимать не рекомендуется.
Слайд 54При нормализации уровня сахара в крови дозу препарата уменьшают до 0,125
При замене инсулина хлорпропамидом ориентировочная доза 0,25 г хлорпропамида вместо 20 ЕД инсулина.
Противопоказания: нарушение функции печени и почек, а также лицам пожилого возраста. Не рекомендуется принимать препарат при инсулинозависимом диабете (диабете І типа).
Форма выпуска: таблетки по 0,1 г и 0,25 г.
Слайд 55
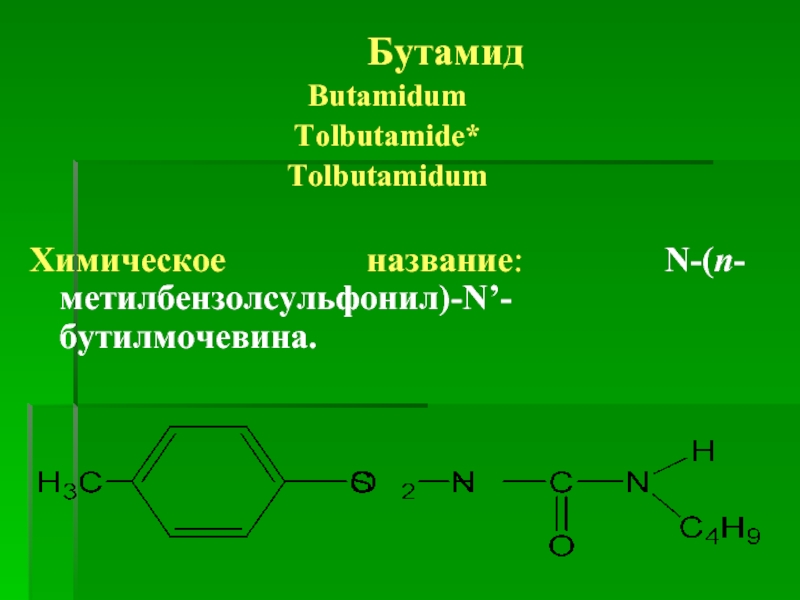
Butamidum
Tolbutamide*
Tolbutamidum
Химическое название: N-(п-метилбензолсульфонил)-N’-бутилмочевина.
Слайд 56Получение
1. Синтез бутамида из толуола. Схема синтеза состоит из ряда стадий
Слайд 57б) Получение амида п-толуолсульфокислоты (п-толуолсульфамида) в результате взаимодействия п-толуолсульфохлорида с аммиаком
Слайд 58в) Конденсация Na-п-толуолсульфамида с бутилизоцианатом* С4H9–N=C=O, а затем взаимодействие с хлоридной
Слайд 59Свойства
Описание. Белый кристаллический порошок без запаха или с очень слабым
Растворимость. Практически нерастворим в воде, растворим в 95 % спирте, легко растворим в ацетоне и хлороформе, мало растворим в эфире.
Слайд 623. Минерализация препарата и выявление Сульфура.
SO42– + Ba2+ → BaSO4
4. УФ-спектроскопия.
Испытания на чистоту
1. Общие примеси хлоридов – в пределах эталонов.
2. Сульфаты (недопустимая примесь). 0,3 г препарата взбалтывают в течение 2 минут с 30 мл воды и фильтруют. Фильтрат не должен давать реакции на сульфаты.
3. Потеря массы при высушивании. Около 0,5 г препарата (точная навеска) сушат при 100–105 °С до постоянной массы. Потеря в массе не должна превышать 0,5 %.
Слайд 634. Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 г
Слайд 64Количественное определение
ГФ Х. Алкалиметрия, прямое титрование спиртового раствора
Em = М.
2. Гравиметрия.
Слайд 65Хранение. Список сильнодействующих веществ. В плотно укопоренном контейнере, в сухом месте.
В.
В. с. д. внутрь 4,0 г.
Применение. Гипогликемическое (антидиабетическое) средство.
Бутамид – один из основных представителей пероральных гипогликемизирующих производных сульфонилмочевины. Понижение уровня сахара наиболее выражено в первые 5–6 часов после прийома препарата и продолжается до 12 часов (после однократного применения).
Слайд 66Назначают в начале лечения по 2 г в сутки: 1 г
Если больной принимал инсулин (не менее 40 ЕД в сутки), то бутамид назначают в дозе 1 г 2 раза в сутки, а инсулин уменьшают наполовину. Если инсулина больному требуется менее 10 ЕД в сутки, то применяя бутамид, инсулин можно отменить.
Лечение больных бутамидом производят под тщательным наблюдением врача (определенная диета, систематический анализ крови на содержание сахара, общий анализ крови).
Слайд 67Противопоказания: заболевания печени и почек, лейкопения, острые инфекционные болезни, при беременности
Форма выпуска: таблетки по 0,25 г и 0,5 г.
Слайд 69Химическое название: N-(п-аминобензолсульфонил)-N’-бутилмочевина или N-(4-аминобензолсульфонил)-N’-н-бутилкарбамид.
Букарбан по химическому строению отличается от
Слайд 71
Ацетанилид получают ацетилированием анилина с помощью ацетатной кислоты СН3СООН или ацетангидрида
Слайд 72Схема синтеза состоит из ряда стадий (напоминает синтез хлорпропамида и хлорамина). а)
Слайд 73б) Конденсация п-aцетсульфанилхлорида с калий цианатом K–O–C≡N (изомерен с изоцианатом K–N=C=O)
Слайд 74в) Реакция с н-бутиламином С4H9NН2 c последующим гидролизом ацетилбукарбана с образованием
Слайд 75Свойства
Описание. Белый кристаллический порошок. Температура плавления 140–143 °С.
Растворимость. Нерастворим в
Слайд 76Идентификация
Реакция на первичную ароматическую аминогруппу (ГФУ) (получение азокрасителя с помощью реакции
Слайд 772. Щелочной гидролиз препарата и идентификация продуктов гидролиза
3. Кислотный гидролиз
Слайд 79Количественное определение
Нитритометрия, прямое титрование
5NaNO2 +2KIО3 + 2HCl → I2 + 5NaNO3
Еm = М. м.
Слайд 81Хранение. Список сильнодействующих веществ. В плотно укопоренном контейнере, в сухом месте.
Применение.
В связи с наличием в молекуле аминогруппы –NH2 при бензеновом цикле, что характерно для сульфаниламидных препаратов антибактериального действия, этот препарат может вызывать изменения микрофлоры кишечника и желудочно-кишечные нарушения.
Слайд 82 Кроме того, он чаще вызывает кожно-аллергические явления
Применяют орально по 0,5–3 г в день. Показания и дозы такие же, как для бутамида. Возможна комбинация с инсулином.
Лечение больных букарбаном производят под тщательным наблюдением врача (систематический анализ суточной мочи и крови на содержание глюкозы, общий анализ крови не реже 1 раз в 2 недели).
Противопоказания такие же, как для бутамида.
Форма выпуска: таблетки по 0,5 г в упаковке по 50 шт.
Слайд 83 Глибенкламид ГФУ, дополн.
Glibenclamidum
Maninil*
Глюкобене
Химическое название: 1-[[4-[2-[(5-хлор-2-метоксибензоил)амино]этил]фенил]сульфонил]-3-циклогексилкарбамид
Слайд 84Свойства
Описание. Кристаллический порошок белого или почти белого цвета.
Растворимость. ГФУ, дополн.
Идентификация
А. Определение температуры плавления.
В. УФ-спектроскопия.
С. ИК-спектроскопия.
D. Тонкослойная хроматография.
Слайд 85Е. Флуоресценция раствора субстанции в сульфатной кислоте.
Испытания на чистоту
1.
2. Сопутствующие примеси полупродукта синтеза определяют методом тонкослойной хроматографии.
Слайд 863. Общие примеси тяжелых металлов – в пределах эталона. Не более
4. Потеря массы при высушивании. Не должна превышать 1,0 %.
5. Сульфатная зола. Сульфатная зола из 1,0 г препарата не должна превышать 0,1 % и должна выдерживать испытания на тяжелые металлы.
Слайд 88
Хранение. В плотно укупорен. контейнере, в защищен. от света месте.
Применение. Гипогликемическое
Подобно другим антидиабетическим производным сульфонилмочевины, глибенкламид является стимулятором β-клеток поджелудочной железы. В отличие от других противодиабетических препаратов проявляет большую активность, быстрее всасывается, относительно хорошо переносится. Максимальная кон-ция в крови наступает через 1–2 часа, длительность действия 8–12 часов. Принимают внутрь после еды 1–2 раза в день, начиная с 0,0025 г.
Форма выпуска: таблетки по 0,005 г (5 мг) по 20 штук в упаковке.





























































![Глибенкламид ГФУ, дополн. 1GlibenclamidumManinil*ГлюкобенеХимическое название: 1-[[4-[2-[(5-хлор-2-метоксибензоил)амино]этил]фенил]сульфонил]-3-циклогексилкарбамид](/img/tmb/1/2293/bd19eab63f12789d122734b015327ebc-800x.jpg)










