- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Желтухи и гепатиты у детей презентация
Содержание
- 1. Желтухи и гепатиты у детей
- 2. Желтуха – визуальное проявление гипербилирубинемии
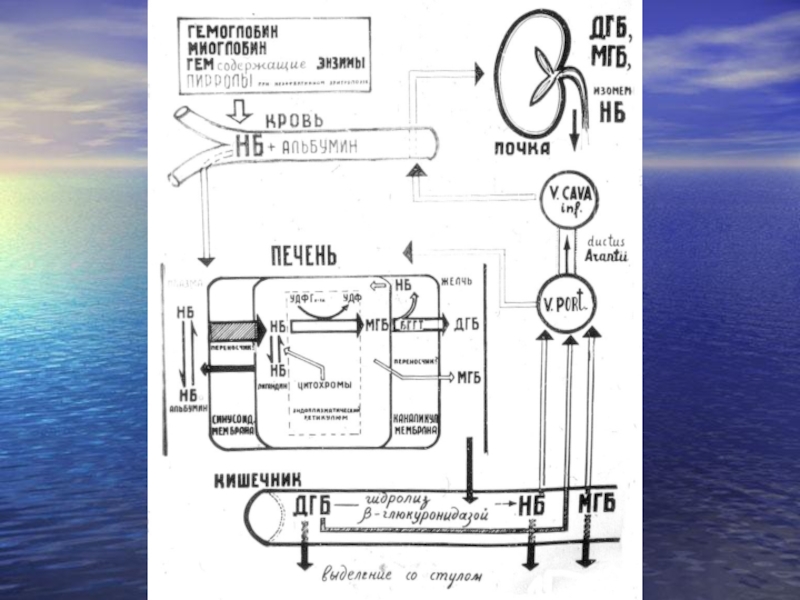
- 3. Образование билирубина (схема).
- 4. Частота желтух у новорождённых
- 5. Транзиторная (физиологическая) желтуха новорождённых Причиной повышения уровня
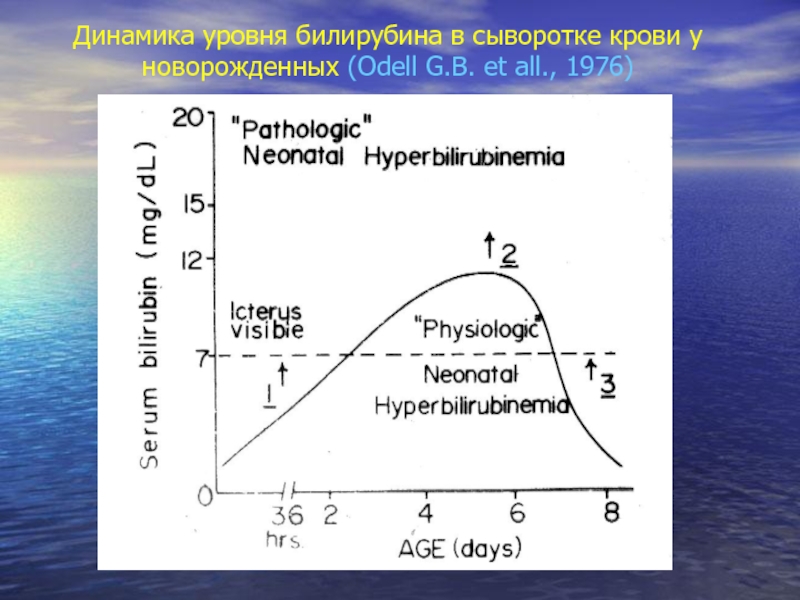
- 7. Динамика уровня билирубина в сыворотке крови у новорожденных (Odell G.B. et all., 1976)
- 8. Физиологическая целесообразность транзиторной гипербилирубинемии новорождённых
- 9. Важно помнить: физиологическая желтуха – диагноз
- 10. Патологические желтухи имеют одну или несколько
- 11. Желтухи новорожденных (патогенетическая классификация)
- 12. Желтухи новорожденных (патогенетическая классификация) (продолжение)
- 13. Желтухи новорожденных (патогенетическая классификация) (продолжение)
- 14. Желтухи новорожденных (патогенетическая классификация) (продолжение)
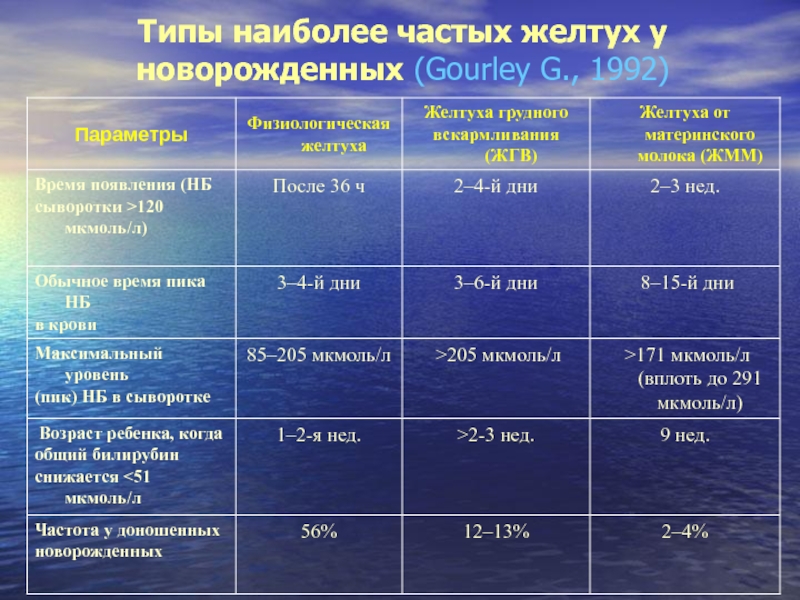
- 15. Типы наиболее частых желтух у новорожденных (Gourley G., 1992)
- 16. Гемолитическая болезнь новорожденных (ГБН)
- 17. Гемолитическая болезнь новорожденных Известно
- 18. Гемолитическая болезнь новорожденных Установлено,
- 19. Обозначение антигенов и соответствующих им антител системы резус
- 20. Гемолитическая болезнь новорожденных ГБН развивается
- 21. Гемолитическая болезнь новорожденных
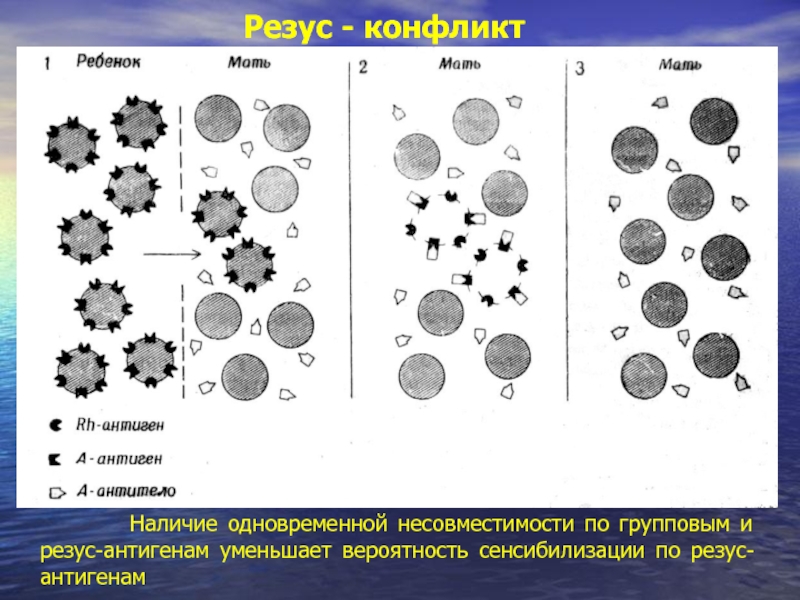
- 22. Во время первой беременности и после нее происходит сенсибилизация матери резус-антигенами ребенка Резус - конфликт
- 23. Резус - конфликт При последующей беременности резус-антитела проникают в кровоток ребенка и вызывают гемолиз
- 24. Резус - конфликт
- 25. Гемолитическая болезнь новорожденных
- 26. Гемолитическая болезнь новорожденных Естественные антитела
- 27. Тяжесть ГБН в зависимости от титра анти-D
- 28. Классификация ГБН вид конфликта (резус, АВ0, другие
- 29. Гипербилирубинемии новорождённых
- 30. Факторы риска билирубиновой энцефалопатии, реализации нейротоксичности НБ:
- 31. Гипербилирубинемии новорождённых
- 32. Гипербилирубинемии новорождённых 2) появление классических признаков ядерной
- 33. Гипербилирубинемии новорождённых 3) период ложного благополучия и
- 34. Гипербилирубинемии новорождённых 4) период формирования клинической картины
- 35. Гипербилирубинемии новорождённых Важно
- 36. План обследования при подозрении на ГБН:
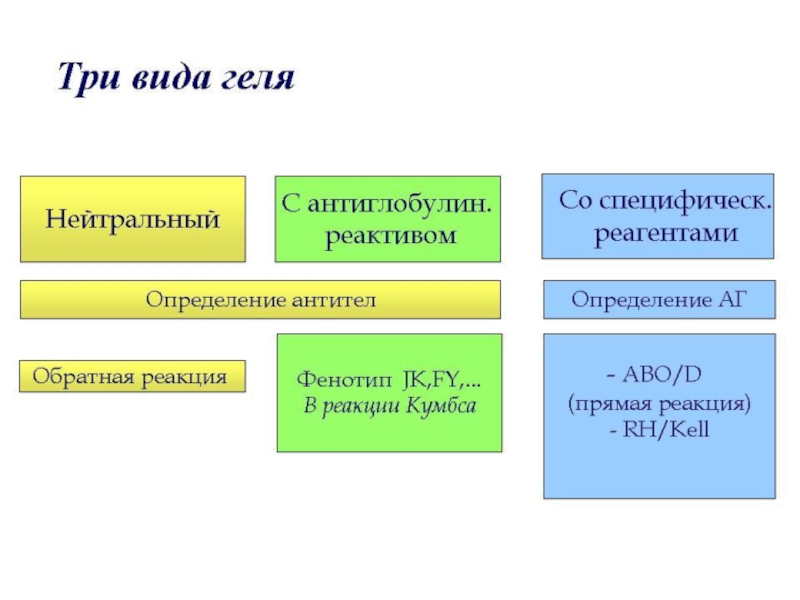
- 37. Преимущества гелиевых технологий (Т.А. Бушмарина, ГСКП, СПб, 2005)
- 40. Эффективные методы лечения гипербилирубинемий новорожденных с позиций
- 41. Лечение новорождённых с непрямой гипербилирубинемией
- 42. Эффективность фототерапии определяют четыре факта: Длина
- 43. Фототерапия Положительный эффект фототерапии заключается
- 44. Неонатальная гипербилирубинемия Фототерапия
- 45. Фототерапия Установлено, что чем больше
- 48. Фототерапия Длительность фототерапии определяется ее
- 49. Лечение новорождённых с непрямой гипербилирубинемией
- 50. Лечение новорождённых с непрямой гипербилирубинемией
- 51. Показания к фототерапии и заменному переливанию крови
- 52. Факторы риска поражения мозга при гипербилирубинемиях: масса
- 53. Показания для заменного переливания крови (ЗПК) у
- 54. Показания для заменного переливания крови (ЗПК) у
- 55. Катамнез детей с неонатальной гипербилирубинемией выше 25
- 56. Заменное переливание крови При
- 57. Заменное переливание крови
- 58. Синдром «сгущения желчи»
- 59. Болезнь Жильбера (GilbertA.N., 1858-1927, франц. терапевт) (БЖ
- 60. Синдром Криглера–Наджара. Обусловлен отсутствием глюкуронилтрансферазы в печени
- 61. Желтуха Люцея–Дрискола Желтуха Люцея–Дрискола– глубокий, но транзиторный,
- 62. Острые гепатиты у детей
- 63. Острые гепатиты в РФ (Г.Г. Онищенко, февраль
- 64. Гепатит А Заболеваемость занимает 3-е место после
- 65. Соотношение стертых (субклинических и безжелтушных) и манифестных форм гепатита А у детей и взрослых
- 66. Гепатит А у детей Вирус гепатита А
- 67. Гепатит А у детей Патогенез. В 1979
- 69. Гепатит А у детей
- 70. Гепатит А у детей Клиника. Желтушный период
- 71. Гепатит А у детей Клиника. Постжелтушный период
- 72. Гепатит А у детей
- 73. Гепатит А у детей Диагностика Выявление антигена
- 74. Гепатит А у детей Противоэпидемические мероприятия Изоляция
- 75. Гепатит А у детей Лечение Легкие формы
- 76. Гепатит А у детей Профилактика Вакцины
- 77. Гепатит В у детей Вирус гепатита В
- 78. Гепатит В у детей Заболеваемость детей ~
- 79. Гепатит В у детей Эпидемиология Путь заражения:
- 80. Гепатит В у детей Патогенез Внедрение
- 81. Гепатит В у детей
- 82. Гепатит В у детей Клиника (начальный
- 83. Гепатит В у детей Клиника (желтушный
- 84. Гепатит В у детей Клиника (течение по
- 85. Злокачественная форма гепатита В у детей
- 86. Злокачественная форма гепатита В у детей Варианты
- 87. Злокачественная форма гепатита В у детей Прекома
- 88. Перинатальный гепатит В у детей
- 89. Наблюдение за детьми от матерей носителей антител
- 90. Наблюдение за детьми от матерей носителей антител
- 91. Гепатит В у детей (лечение) Интерферон альфа
- 92. Профилактика гепатита В Введение вакцинации позволило
- 93. Профилактика гепатита В В 24 субъектах РФ
- 94. Гепатит D Вирус является дельта-
- 95. Гепатит С (HCV) Заболеваемость
- 96. Риск инфицирования при переливании компонентов крови в
- 97. «Особенности клинических проявлений и оптимизации терапии у
- 98. Гепатит С Инкубационный период – 28 –
- 99. Идиопатический неонатальный гепатит (ИНГ)
- 100. Идиопатический неонатальный гепатит (ИНГ)
- 101. Неонатальный гигантоклеточный гепатит
- 102. Г Герпетический гепатит
- 103. Цитомегаловирусный гепатит
- 104. Гепатит при врожденном сифилисе
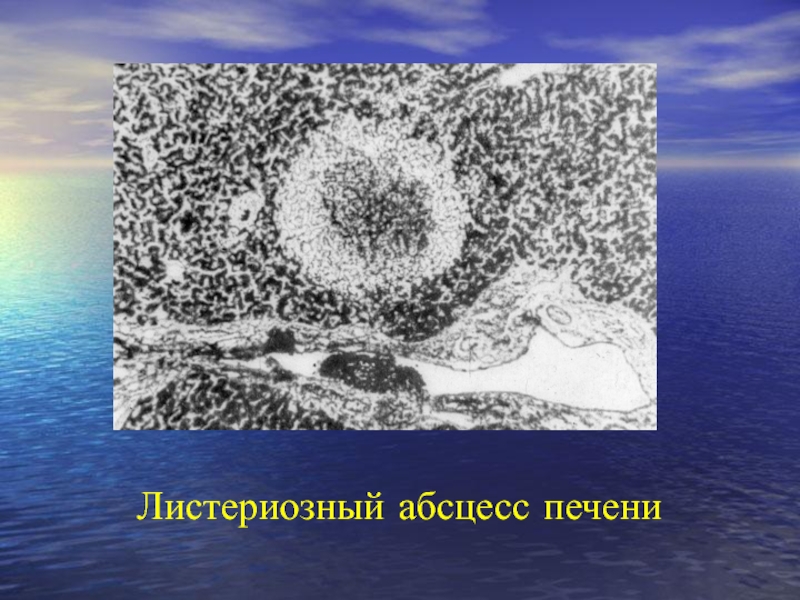
- 105. Листериозный абсцесс печени
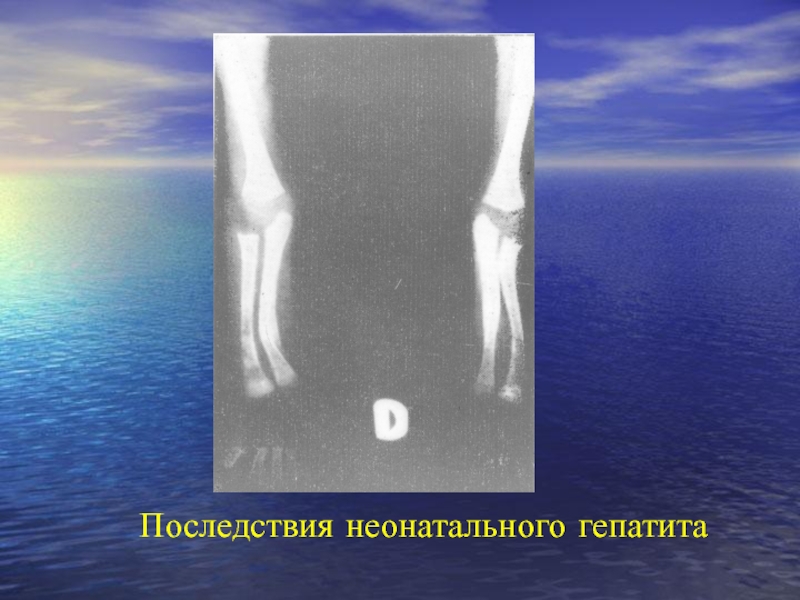
- 106. Последствия неонатального гепатита
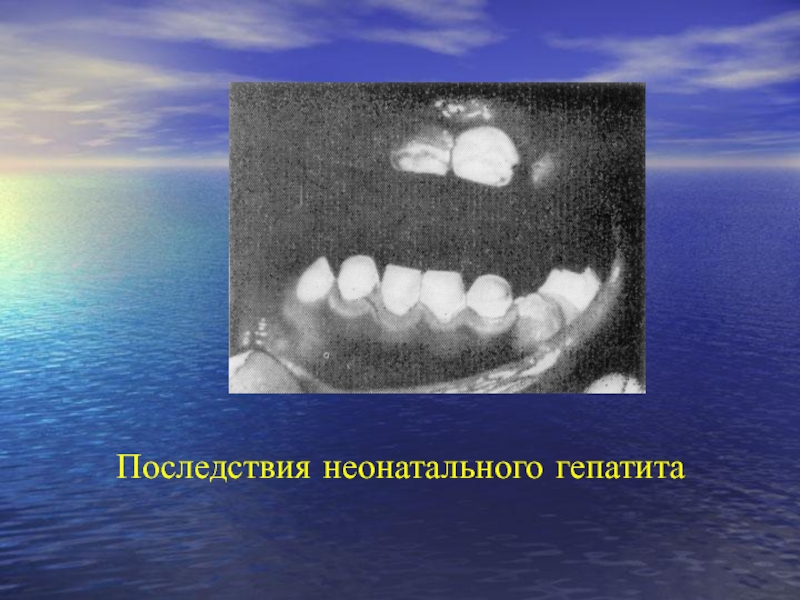
- 107. Последствия неонатального гепатита
- 108. Лечение при врожденном гепатите
- 109. Лечение при врожденном гепатите Глюкокортикоиды используют лишь
- 110. Лечение при врожденном гепатите Гепатотропные препараты (Эссенциале,
- 111. Интерферонотерапия. Используют отечественный препарат
- 112. Хронические заболевания печени Первичные заболевания печени Врожденные
- 113. Узловые звенья патогенеза ХГ (В.Ф. Учайкин
- 114. Хронический гепатит (ХГ)
- 115. Хронический гепатит (лечение) Показания для использования парентерального
- 116. Хронический гепатит (лечение) Стандартное лечение, рекомендуемое
- 117. Хронический гепатит (лечение) Почти у всех больных
- 118. Хронический гепатит (лечение) Комбинированная терапия показана при:
- 119. Хронический гепатит (лечение) Дозы: Ремантадин – 5,0
- 120. Аутоиммунный ХГ (ХАГ)
- 121. Галактоземия Галактоземия – наследственная аномалия обмена веществ
Слайд 1
Желтухи и гепатиты у детей
Шабалов Николай Павлович
Российская Военно-Медицинская Академия
Кафедра детских болезней
Слайд 2
Желтуха – визуальное проявление гипербилирубинемии
Билирубин – конечный продукт
У взрослых желтуха появляется при уровне билирубина более 25 мкмоль/л, у доношенных новорожденных – 85 мкмоль/л, а у недоношенных – 105 - 120 мкмоль/л.
Слайд 4Частота желтух у новорождённых
По данным исследования, проведенного
Пик уровня билирубина в сыворотке крови при физиологической желтухе приходится на 3–5-й дни жизни.
Слайд 5Транзиторная (физиологическая) желтуха новорождённых
Причиной повышения уровня билирубина (Б), которое развивается у
повышенное его образование (137–171 мкмоль/кг/сут., т.е. в 2–3 раза больше, чем у взрослых) из-за:
более короткой продолжительности жизни эритроцитов с фетальным гемоглобином (70–90 дней – у новорожденных и 100–120 дней – у взрослых),
высокого образования Б в катаболическую фазу обмена веществ из неэритроцитарных источников гема (миоглобин, цитохромы печени и др.),
выраженного неэффективного эритропоэза;
пониженная функциональная способность печени из-за:
временной недостаточности глюкуронил-трансферазной активности печени, экскретирующей материнские гормоны у ребенка,
сниженной способности гепатоцита к захвату и экскреции Б;
повышенное поступление НБ из кишечника из-за:
повышенной (по сравнению со взрослыми) энтеро-гепатогенной циркуляции билирубина (причем, часть билирубина из кишечника избегает ее за счет открытого Аранциева протока),
высокой активности β-глюкуронидазы кишечной стенки,
стерильности кишечника.
Слайд 8Физиологическая целесообразность транзиторной гипербилирубинемии новорождённых
Билирубин – антиоксидант и
Слайд 9Важно помнить:
физиологическая желтуха – диагноз исключения патологических желтух;
у детей
Визуальная оценка степени желтушности кожных покровов может привести к ошибке
(Американская академия педиатрии – ААП; Pediatrics 2004, 114:297-316).
Слайд 10Патологические желтухи
имеют одну или несколько характерных черт:
имеются при рождении или
сочетаются с признаками гемолиза (анемия, высокий ретикулоцитоз, в мазке крови – ядерные эритроидные формы, избыток сфероцитов – +++, ++++), бледностью, гепато-спленомегалией;
длятся более 1 нед. у доношенных и 2 нед. – у недоношенных детей;
протекают волнообразно;
темп прироста (нарастания) неконъюгированного билирубина (НБ, непрямой билирубин) составляет >3,4 мкмоль/л/ч (0,2 мг%/ч) или > 85 мкмоль/л/сут. (5 мг%/сут.);
уровень НБ в сыворотке пуповинной крови – >60 мкмоль/л (3,5 мг%) или 85 мкмоль/л (5 мг%) – в первые 12 ч жизни, 171 мкмоль/л (10 мг%) – на 2-е сутки жизни, максимальные величины НБ превышают 221 мкмоль/л (12,9 мг%);
уровень билирубиндиглюкуронида (БДГ, прямой билирубин) не должен превышать 20% от уровня общего Б, но при использовании Vitros ( в прошлом Ektachem) системы (Ortho-Clinical Diagnostics, Raritan,NJ) уровни БДГ более 1 мг% - аномальны (ААП, 2004). При определении по Иендрасеку БДГ выше 1,5 мг% - патология.
Американская академия педиатрии, - ААП (Pediatrics 2004; 114:297-316) не рекомендует подтверждать выявленный высокий уровень Б в капиллярной крови определением его в венозной;
Слайд 16Гемолитическая болезнь новорожденных (ГБН)
ГБН – заболевание, обусловленное
Слайд 17Гемолитическая болезнь новорожденных
Известно 14 основных эритроцитарных групповых систем,
ГБН обычно вызывает несовместимость плода и матери по резус или АВ0-антигенам (АВ > D > Kell>c > C >E >e).
Слайд 18Гемолитическая болезнь новорожденных
Установлено, что антигенная система резус состоит
Резус-положительные лица могут быть гомозиготы (DD) – 44% или гетерозиготы (Dd) – 56%, поэтому 25% детей от резус-отрицательных матерей и резус-положительных отцов будут резус-отрицательными.
Слайд 20Гемолитическая болезнь новорожденных
ГБН развивается в 1-3% случаев несовместимости плода
Несовместимость по АВ0-антигенам, приводящая к ГБН, обычно бывает при группе крови матери 0(I) и группе крови ребенка A (II). По данным американских акушеров, риск резус-аллоиммунизации составляет 16%, если мать и ребенок совместимы по АВ0-групповым антигенам, и 1,5% – если они по ним не совместимы. Если ГБН развивается при двойной несовместимости ребенка и матери, т.е. мать 0(I) Rh(0), а ребенок A(II) Rh(+) или B(III) Rh(+), то, как правило, она обусловлена А или В-антигенами.
Слайд 21Гемолитическая болезнь новорожденных
Эритроциты плода регулярно обнаруживают в
Проникшие в кровоток матери эритроциты плода (даже в количестве 0,1 мл), имеющие D-антиген, отсутствующий у матери, приводят во время первой беременности к синтезу вначале Rh-антител, относящихся к иммуноглобулинам класса М, которые через плаценту не проникают, а затем и антител класса IgG, которые уже могут проникать через плаценту.
Слайд 22Во время первой беременности и после нее происходит сенсибилизация матери резус-антигенами
Резус - конфликт
Слайд 23Резус - конфликт
При последующей беременности резус-антитела проникают в кровоток ребенка и
Слайд 24Резус - конфликт
Наличие одновременной несовместимости по
Слайд 25Гемолитическая болезнь новорожденных
Во время первой беременности
Именно поэтому введение экзогенных резус-антител (анти-D-иммуноглобулин) в течение 24–72 ч после родов или аборта (D-антигены появляются у эмбриона в начале второго месяца гестационного возраста) – эффективный метод и снижения резус-сенсибилизации, и частоты резус-ГБН. В странах, где такая профилактика проводится, частота резус-ГБН резко снизилась, например, в Великобритании – на 95%.
Слайд 26Гемолитическая болезнь новорожденных
Естественные антитела у женщин с группой крови
Слайд 27Тяжесть ГБН в зависимости от титра анти-D антител у матери
Титр анти-D
Менее или 1 : 64
1 : 128 – 1 : 256
1 : 256 и более
Форма ГБН
Легкая форма
Средней тяжести
Высокий риск тяжелой формы
Слайд 28Классификация ГБН
вид конфликта (резус, АВ0, другие антигенные системы);
клиническая форма (внутриутробная
степень тяжести при желтушной и анемической формах (легкая, средней тяжести и тяжелая);
осложнения (острая билирубиновая энцефалопатия, ядерная желтуха, другие неврологические расстройства; геморрагический или отечный синдром, поражения печени, сердца, почек, надпочечников, синдром «сгущения желчи», обменные нарушения – гипогликемия и др.);
сопутствующие заболевания и фоновые состояния (недоношенность, внутриутробные инфекции, асфиксия и др.).
Слайд 29Гипербилирубинемии новорождённых
Для неонатологов самым существенным
Мозг новорожденного более чувствителен к токсическому действию НБ (ядерная желтуха у взрослых развивается лишь при уровне НБ в крови 684–770 мкмоль/л) вследствие отсутствия в нем лигандина (специфический белок, связывающий в цитоплазме НБ) и очень низкой активности билирубин-оксигеназной системы, окисляющей НБ и делающей его нетоксичным, большого содержания ганглиозидов и сфингомиелина, к которым НБ имеет большое сродство, сниженной способности очищения цереброспинальной жидкости от билирубина, повышенной проницаемости капилляров и большего внеклеточного пространства в мозге.
Слайд 30Факторы риска билирубиновой энцефалопатии,
реализации нейротоксичности НБ:
повреждающие гематоэнцефалический барьер, повышающие его проницаемость:
повышающие чувствительность нейронов к токсическому действию НБ: недоношенность, тяжелая асфиксия (особенно осложненная выраженной гиперкапнией), гипотермия, голодание, тяжелые гипогликемия и анемия;
снижающие способность альбумина прочно связывать НБ: недоношенность, гипоальбуминемия, ацидоз, инфекции, гипоксия или конкурирующие с НБ за места для прочного связывания на альбумине - внутрисосудистый гемолиз, повышенный уровень в крови неэстерифицированных жирных кислот, некоторые лекарства (сульфаниламиды, алкоголь, фуросемид, дифенин, диазепам, индометацин и салицилаты, метициллин, оксациллин, цефалотин, цефоперазон).
Слайд 31Гипербилирубинемии новорождённых
Билирубиновая энцефалопатия (БЭ) клинически редко выявляется
1) доминирование признаков билирубиновой интоксикации – вялость, снижение мышечного тонуса и аппетита вплоть до отказа от пищи, «бедность» движений и эмоциональной окраски крика (монотонный, неэмоциональный крик), неполная выраженность рефлекса Моро (есть только первая его фаза), ротаторный нистагм, срыгивания, рвота, патологическое зевание, «блуждающий взгляд»;
Слайд 32Гипербилирубинемии новорождённых
2) появление классических признаков ядерной желтухи – спастичность, ригидность затылочных
Слайд 33Гипербилирубинемии новорождённых
3) период ложного благополучия и исчезновения спастичности (начиная с середины
Слайд 34Гипербилирубинемии новорождённых
4) период формирования клинической картины неврологических осложнений начинается в конце
Слайд 35Гипербилирубинемии новорождённых
Важно подчеркнуть, что, по мнению большинства
Слайд 36План обследования при подозрении на ГБН:
Определение группы крови и резус-принадлежности
Анализ периферической крови ребенка с оценкой мазка крови.
Анализ крови с подсчетом количества ретикулоцитов, а при возможности – определения уровня карбоксигемоглобина.
Динамическое определение концентрации билирубина в сыворотке крови ребенка.
Иммунологические исследования, включая прямую реакцию Кумбса (у детей от резус-отрицательных матерей желательно с пуповинной кровью).
При отягощенном по ГБН анамнезе и выявлении резус-антител в высоком или нарастающем титре у беременной определение в пуповинной крови уровня Б и постановка прямой пробы Кумбса являются обязательными.
Уровень альбуминов в сыворотке крови
Слайд 40Эффективные методы лечения гипербилирубинемий новорожденных с позиций доказательной медицины
Заменное переливание крови
Фототерапия
Вливание иммуноглобулинов внутривенно при гемолитической болезни новорожденных
Слайд 41Лечение новорождённых с непрямой гипербилирубинемией
Фототерапия в настоящее
С момента предложения фототерапии для терапии непрямых гипербилирубинемий у новорожденных в 1957 г. Р.Дж. Кремером (R.J.Cremer) и соавт. установлено, что это практически совершенно безопасный и эффективный метод лечения.
Слайд 42Эффективность фототерапии
определяют четыре факта:
Длина волны источника света. Наиболее эффективны специальные
Освещенность. Обычно источник света располагают на расстоянии 15–20 см над ребенком, и облучение должно быть не меньшим, чем 5–6 мкВт/см2/нм, но лучший эффект достигается при освещенности 10–11 мкВт/см2/нм.
Размер облучаемой поверхности. Чем обширнее поверхность облучения, тем эффективнее фототерапия. Поэтому ребенок должен быть полностью обнажен (прикрыты лишь глаза); повреждающего эффекта фототерапии на половые железы не установлено.
Постоянность или прерывистость. Считается, что фототерапия должна проводиться непрерывно, но перерыв примерно на 1 ч после 6–12 часовой экспозиции не снижает ее эффективности (Halamek L.P., Stevenson D.K., 2002). Короткие перерывы делают во время кормления и общения ребенка с семьей.
ААП (2004) рекомендует в любом отделении интенсивной терапии периодически проверять эффективность источника света.
Слайд 43Фототерапия
Положительный эффект фототерапии заключается в увеличении экскреции билирубина из
фотоокислением НБ с образованием биливердина, дипирролов или монопирролов, которые водорастворимы и выводятся из организма с мочой и калом;
конфигурационными изменениями молекулы НБ, 4Z, 15Zизомеров на 4Е, 15Е или 4Zизомеры НБ, опять таки водорастворимые;
структурными изменениями молекулы НБ с образованием люмибилирубина (фотобилирубин II, циклобилирубин, люмибилирубин), длительность полувыведения которого из крови – 2 ч, тогда как 4Z, 15ZНБ – 12–15 ч. Все упомянутые конфигурационные и структурные изомеры НБ обнаруживают в моче у детей, находящихся на фототерапии.
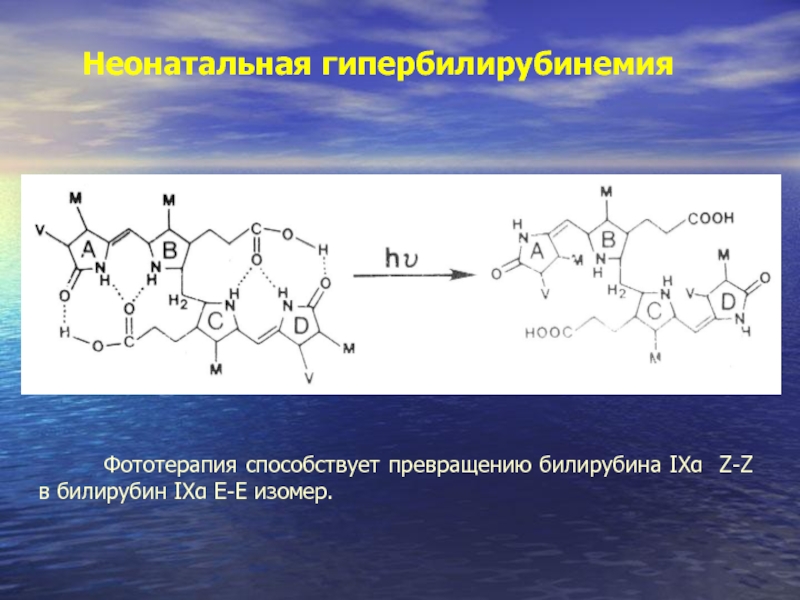
Слайд 44Неонатальная гипербилирубинемия
Фототерапия способствует превращению билирубина IXα Z-Z
Слайд 45Фототерапия
Установлено, что чем больше площадь и интенсивность излучения, тем
Слайд 48Фототерапия
Длительность фототерапии определяется ее эффективностью – темпами снижения уровня
Необходимость добавления к фототерапии инфузионной терапии в настоящее время оспаривается и её рекомендуют лишь детям с четкими признаками дегидратации.
Слайд 49Лечение новорождённых с непрямой гипербилирубинемией
Иммуноглобулины внутривенно. R.Goffstein, R.W.Cooke (2003),
Слайд 50Лечение новорождённых с непрямой гипербилирубинемией
Абсолютным показанием для обменного –
Появление признаков билирубиновой энцефалопатии 2 стадии – абсолютное показание к неотложному ЗПК на любые сутки жизни.
Слайд 51Показания к фототерапии и заменному переливанию крови у новорожденных детей 24-168
*Минимальные значения билирубина являются показанием к началу соответствующего лечения в случаях, когда на организм ребенка действуют патологические факторы, повышающие риск билирубиновой энцефалопатии
Слайд 52Факторы риска поражения мозга при гипербилирубинемиях:
масса тела менее 1500 г;
асфиксия
гипопротеинемия (общий белок сыворотки крови – менее 50 г/л);
гипогликемия (глюкоза крови – менее 2,6 ммоль/л);
анемия при рождении с содержанием гемоглобина менее 140 г/л;
появление желтухи в первые 5 ч жизни при резус-конфликте и в первые 12 ч жизни – при АВ0-конфликте;
инфекции.
Кроме того, при резус-конфликте:
совпадение групп крови матери и ребенка по системе АВ0;
гемотрансфузии в анамнезе у матери и ГБН – у предыдущих детей в семье;
осложненное течение беременности (инфекционные, соматические заболевания, длительный гестоз).
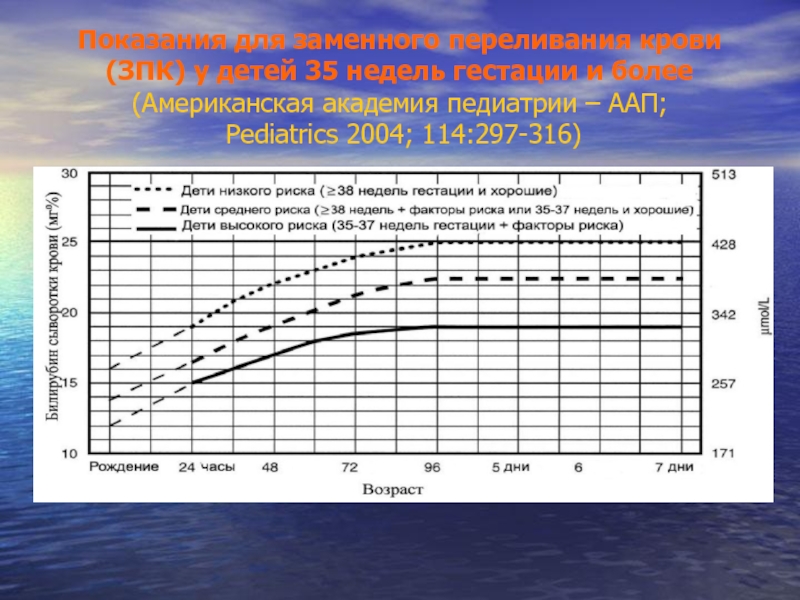
Слайд 53Показания для заменного переливания крови (ЗПК) у детей 35 недель гестации
Слайд 54Показания для заменного переливания крови (ЗПК) у детей 35 недель гестации
Пунктирная линия для детей первых 24 часов жизни указывает на неопределеннность вследствие широкого диапазона клинических обстоятельств и широкого диапазона ответа на фототерапию
- Немедленное ЗПК показано детям с признаками острой билирубиновой энцефалопатии (мышечная гипотония, гипертонус шейных мышц, опистотонус, лихорадка, высокочастотный крик) даже если уровень билирубина снижается
- Факторы риска - изоиммунная ГБН, Г-6-ФД - дефицит, выраженная летаргия, температурная нестабильность, сепсис, ацидоз
- Оценить соотношение уровня альбумина и билирубина
- Оценивать общий уровень билирубина, ибо прямой билирубин - не эквивалент конъюгированного билирубина
- У детей 35-37 недель гестации (средний риск) надо индивидуализировать уровень билирубина как показание для ЗПК
Слайд 55Катамнез детей с неонатальной гипербилирубинемией выше 25 мг% (428 мкмоль/л) (Thomas Newman
Прослежен катамнез у 140 доношенных новорожденных, имевших уровень билирубина более 25 мг% (428 мкмоль/л), из них 130 – с уровнем билирубина 428-511 мкмоль/л и 10 с уровнем билирубина более 513 мкмоль/л в возрасте 2-х лет 132 (94%) и 5 лет (59%) в сравнении с рандомизированной группой новорожденных (419), родившихся в те же годы (1995-1998). Длительность гипербилирубинемии более 428 мкмоль/л у 75% была менее 6 часов и более 340 мколь/л 24 часов у 50% . Всех детей лечели с помощью фототерапии (ЗПК у 5).
Случаев ядердной желтухи не было.
Достоверной разницы в обнаружении неврологических, поведенческих, сензорных отклонений между группами не замечено, но 9 детей в группе детей с гипербилирубинемиями имели более низкой коэффциент IQ сравнению с группой сравнения.
Согласно J.F. Watchko (2006, там же) из 116 детей с ядерной желтухой, зарегистрированных в США, у 90 (78%) - уровень билирубина был более 513 мкмоль/л, а у 59% - более 598 мкмоль/л. По приведенным им данным частота гипербилирубинемий более 428 мкмоль/л – 1:700, а более 513 мкмоль/л – 1:10 000.
Слайд 56Заменное переливание крови
При резус-конфликте для ЗПК используют кровь
При ГБН с конфликтом по редким факторам для ЗПК используют донорскую кровь, не имеющую «конфликтного» фактора.
Учитывая, что наиболее опасные осложнения ЗПК, связанные с инфекциями и иммуносупрессией, обусловлены в основном лейкоцитами (в частности, ВИЧ и герпетические вирусы тропны к лимфоцитам) в настоящее время для ЗПК используют при Rh-конфликте отмытые и свежезамороженные Rh-отрицательные эритроциты в свежезамороженной плазме (соотношение 2:1) одногруппые ребенку или при групповой несовместимости свежезамороженные О(I) группы эритроциты и плазму AB(IV) в том же соотношении.
Срок хранения свежезамороженных эритроцитов не более 72 часов
Слайд 57Заменное переливание крови
Упомянутый объем крови для ЗПК
Летальность при ЗПК колеблется в разных центрах от 0,1 до 0,5%.
Слайд 58Синдром «сгущения желчи»
Может осложнять течение любой желтухи
Слайд 59Болезнь Жильбера (GilbertA.N., 1858-1927, франц. терапевт) (БЖ - частота в популяции –
БЖ - наиболее распространенная из наследственных конъюгационных желтух форма и примерно половина больных имела выраженную желтуху в неонатальном периоде. Подъем НБ в сыворотке крови у таких больных не высокий; случаев ядерной желтухи не описано. Причина гипербилирубинемии - снижение проникновения НБ в гепатоцит (до 30% от нормального) и одновременное некоторое снижение активности глюкуронилтрансферазы печени, что и определяет положительный эффект терапии фенобарбиталом – интенсивность желтухи уменьшается или она исчезает. Болезнь определяет ген, расположенный на 2-й паре хромосом, состоящий из 5 экзонов, в первом из которых при БЖ появляется дополнительный динуклеотид (ТА – тимидин, аденин). Дефект наследуется по данным разных авторов по аутосомно-рецессивному или - аутосомно-доминатаному типу. Диагноз в периоде новорождённости может быть заподозрен лишь при анализе родословных и выявлению умеренной желтухи с НБ и отсутствием у ребенка увеличения печени, селезенки, признаков повышенного гемолиза. Прогноз благоприятный. Желтуха интермиттирует, усиливаясь при интеркуррентных заболеваниях или после голодания, назначения парацетамола. У старших детей и взрослых возможны провокационные пробы: увеличение уровня НБ в сыворотке крови после назначения парацетамола, никотиновой кислоты; снижение уровня НБ в сыворотке крови после назначения фенобарбитала.
Слайд 60Синдром Криглера–Наджара.
Обусловлен отсутствием глюкуронилтрансферазы в печени (I тип) или очень низкой
При синдроме Криглера–Наджара II типа неонатальная гипербилирубинемия не столь тяжелая, и НБ обычно не превышает 376 мкмоль/л. Развитие ядерной желтухи возможно лишь в неонатальном периоде. Дефект конъюгации билирубина обнаруживают обычно и у одного из родителей (уровень НБ – 34–68 мкмоль/л). В ответ на терапию фенобарбиталом гипербилирубинемия, желтуха уменьшаются (вплоть до исчезновения), но после отмены лечения могут рецидивировать.
При обоих вариантах желтухи Криглера–Наджара показано и назначение препаратов, уменьшающих гепато-энтерогенную циркуляцию билирубина (агар-агар, холестирамин, энтеросорбенты). Разрабатываются новые подходы к лечению желтухи Криглера–Наджара I типа – пересадка печени, а в эксперименте – пересадка дефектного гена.
Слайд 61Желтуха Люцея–Дрискола
Желтуха Люцея–Дрискола– глубокий, но транзиторный, неонатальный дефект активности глюкуронилтрансферазы; наследуется
Диагноз ставят на основании исключения других гипербилирубинемий, анализа семейного анамнеза.
Практически желтуха Люцея–Дрискола аналогична ЖГВ, правда с гораздо более высокими уровнями НБ, и при учете семейного анамнеза (родословной).
Слайд 62Острые гепатиты у детей
Ежегодно в конце прошлого века
Исторические аспекты:
Вспышки гепатитов описаны с XVII века
С.П. Боткин описал острый гепатит – гепатит А в настоящее время (по предложению А.А. Киселя в нашей стране долго называвшейся болезнью Боткина)
1912 г. – Cockanе доказал эпидемическую природу гепатита А
1964 г. – Blumberg выделил «австралийский» антиген сывороточного гепатита (гепатит В) – Нобелевская премия (1977)
1973 г. – Feinstone описал морфологию вируса гепатита А
1980 г. – Rizzetto выделил гепатит D
1983 г. – М.С. Балаян и соавт. описали и выдели гепатит Е (ранее гепатит ни А, ни В с энтеральным путем передачи)
1989 г. - Choo C выделил вирус гепатита С (ранее гепатит ни А ни В)
1996 г. – Linnen выделил гепатит G
1998 г. - Okamotо выделил вирус гепатита TTV
Слайд 63Острые гепатиты в РФ
(Г.Г. Онищенко, февраль 2007 г)
Заболеваемость гепатитами А и
Заболеваемость гепатитами В и С с парентеральным механизмом передачи в 2006 году по сравнению с 2005 годом снизилась на 18,3 и 8,6% соответственно
Слайд 64Гепатит А
Заболеваемость занимает 3-е место после ОРВИ и кишечных инфекций и
Зарегистрированная заболеваемость в середине 90-х годов составляла 235 на 100 000 населения (в 2000 году – 150), из них 60% -дети (Учайкин В.Ф.).
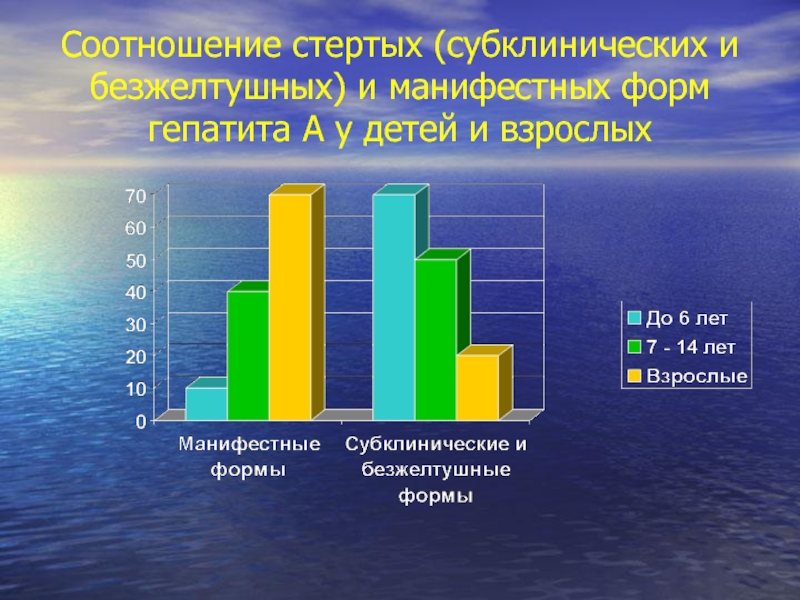
Субклинические и безжелтушные формы встречаются у 70-90% детей до 6 лет, больных гепатитом А, 50-60% детей 6-14 лет и 20-30% - взрослых, фульминантное течение - 0,01% (Учайкин В.Ф.).
В конце прошлого – начале нынешнего века заболеваемость гепатитом А, как у детей так и у взрослых, существенно снизилась из-за введения профилактической вакцинации.
Гепатит А – острая инфекция, имеющая циклическое течение, оканчивающаяся через 1,5-3 месяца выздоровлением, и хронический гепатит, вызванный вирусом гепатита А не описан.
Вполне возможно, что аномалии желчного пузыря, отмечающиеся примерно у 15-20% взрослых, вызваны перенесенным в детстве гепатитом А.
Слайд 65Соотношение стертых (субклинических и безжелтушных) и манифестных форм гепатита А у
Слайд 66Гепатит А у детей
Вирус гепатита А – антропогенный РНК (капсид состоит
Эпидемиология. Путь заражения фекально-оральный (пища, вода) и тесный контакт. Парентеральный с препаратами крови и трансплацентарный пути – чрезвычайно редки. Инкубационный период 15-45 дней (обычно около 30 дней). Вирус обнаруживают в крови и испражнениях с середины инкубационного периода, когда можно выявить и повышение активности в крови АЛТ, АСТ, Ф-1-ФА. Максимальное выделение вируса во второй половине инкубационного периода. В первые дни желтушного периода вирус в крови и испражнениях имеют 10-15% больных, а после 4-5 дня – лишь в единичных случаях.
Слайд 67Гепатит А у детей
Патогенез. В 1979 году было доказано, что в
Периоды болезни:
инкубационный,
начальный или продромальный (преджелтушный),
разгара или желтушный,
постжелтушный,
реконвалесценции.
Слайд 69Гепатит А у детей
Клиника.
Темная моча ~ 95%
Утомляемость пониженный аппетит ~ 95%
Тошнота ~ 95%; рвота ~ 75%
Слабость ~ 80%; сонливость ~ 60%
Лихорадка ~ 80% (обычно в течение 1-3 дней)
Головная боль ~ 70%; раздражительность ~ 60%
Неприятные ощущения в животе и болезненность края печени при пальпации– 70%
Побледнение кала ~ 60%; запор ~ 30%; зуд ~ 40%
Боли в мышцах ~ 60%; боли в суставах ~ 20%
Боль в горле, катаральные явления ~ 10-15%
Слайд 70Гепатит А у детей
Клиника. Желтушный период
Продолжительность ~ 2-2
Увеличение и болезненность края печени при пальпации
Обесцвеченный кал
Уменьшение признаков интоксикации
Увеличение селезенки ~ 15%
Интенсивность желтухи (В.Ф. Учайкин):
Легкая (билирубин до 85 мкмоль/л) – 72%
Средней тяжести (85-170 мкмоль/л) – 23%
Тяжелая (более 171 мкмоль/л) – 5%
Слайд 71Гепатит А у детей
Клиника. Постжелтушный период
Медленное уменьшение размеров печени и снижение
Период реконвалесценции
Постепенное исчезновение болезненности в правом подреберье и неприятных ощущений в животе.
Слайд 72Гепатит А у детей
Исходы гепатита А (В.Ф.
Выздоровление через 1 месяц ~ 50%
Выздоровление через 2 месяца ~ 67%
Выздоровление через 3 месяца ~ 76%
Выздоровление через 6 месяцев ~ 88,4%
Остаточный фиброз печение через год ~ 4,5%
Слайд 73Гепатит А у детей
Диагностика
Выявление антигена вируса в крови – с середины
Выявление специфических IgM антител - с середины инкубационного, продромальный и желтушный периоды, нарастания титра специфических IgG антител в постжелтушном периоде
Повышение в крови активности печеночных энзимов:
АЛТ, АСТ (АЛТ во много раз больше, чем АСТ)
Гепатоспецифических (фосфо-1-фруктоальдолаза, уроканиназа, гамма-глютамил-трансфераза и др.)
Выявление признаков нарушения белковосинтетической и других функций печени
Слайд 74Гепатит А у детей
Противоэпидемические мероприятия
Изоляция больного – не менее 30 дней
Карантин на контактных (дошкольники и школьники) – 35 дней с момента разобщения
Мероприятия в очаге: выделения засыпают сухой хлорной известью на 1 час, горшки замачивают в 3% растворе хлорной извести на 30 минут, игрушки и предметы ухода замачивают 1% раствором хлорной извести на 1 час, влажная уборка 1% раствором хлорамина, а белье, посуду, одежду обеззараживают 30-минутными кипячением.
Мероприятия с контактными: в США принято вводить контактным внутримышечно иммуноглобулин в дозе 0,02 мл/кг массы (Red book, 2003)
Слайд 75Гепатит А у детей
Лечение
Легкие формы гепатита А при наличии соответствующих условий
При выраженной интоксикации применяют энтеросорбенты (Энтеродез 0,3 г/кг/сутки в 2-3 приема в промежутке между приемами пищи; Энтеросгель и др.), при холестатическом компоненте – урсодезоксихолиевую кислоту в дозе 10-12 мг/кг/сутки, а при затяжном течении в комбинации с стимуляторами интерфероногенеза (Циклоферон, Амиксин).
Слайд 76Гепатит А у детей
Профилактика
Вакцины Havrix-1440 ( фирма Smith-Kline-Beecham), ГЕП-А (Россия)
Вакцинируют детей старше года и иммунитет сохраняется на 1 год, но после бустерного введения вакцины через 6-12 месяцев иммунитет сохраняется в течение 20 лет.
Слайд 77Гепатит В у детей
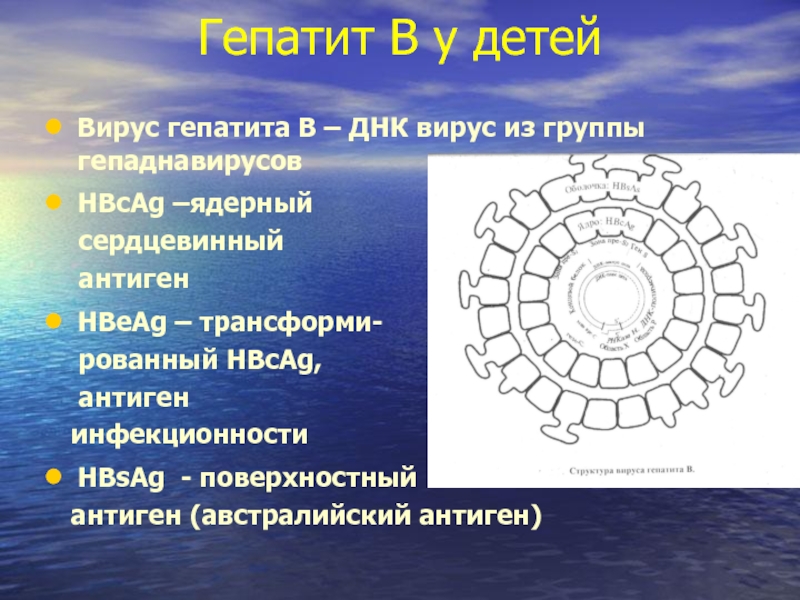
Вирус гепатита В – ДНК вирус из группы
HBcAg –ядерный
сердцевинный
антиген
HBeAg – трансформи-
рованный HBcAg,
антиген
инфекционности
HBsAg - поверхностный
антиген (австралийский антиген)
Слайд 78Гепатит В у детей
Заболеваемость детей ~ 9-10 на 100 000 в
В мире в настоящее время около 2 млрд. инфицированных вирусом гепатита В, а у 350 млн. Выявлена хроническая форма.
В России в 2002 г. было 7,4 миллионов больных гепатитом В или носителей HBsAg.
В Москве и Санкт-Петербурге носителей HBsAg
~ 4%, Западной Сибири – 10-15%.
Вирус гепатита В очень стоек: при комнатной температуре и в холодильнике сохраняется 6-12 месяцев, в 1-2% растворе хлорамина – 2 часа, 1,5% растворе формалина - 7 суток, кипячении – более 10 минут, автоклавировании при 120 С – более 5 минут.
Слайд 79Гепатит В у детей
Эпидемиология
Путь заражения:
Парентеральный – трансфузии крови и её препаратов,
Половой
Трансплацентарный или контактный при прохождении по инфицированным родовым путям
Путь заражения среди детей с гепатитом В, находившихся в конце 20-го века в клинике В.Ф. Учайкина: 29,8% - при переливании крови или плазмы, 45,25% - парентеральный, 25% - при бытовых контактах.
Слайд 80Гепатит В у детей
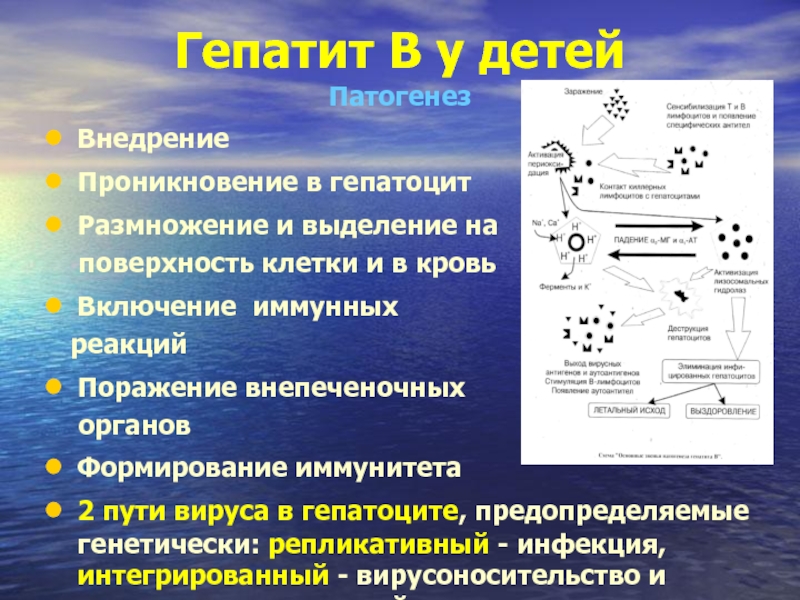
Патогенез
Внедрение
Проникновение в гепатоцит
Размножение и выделение на
Включение иммунных
реакций
Поражение внепеченочных
органов
Формирование иммунитета
2 пути вируса в гепатоците, предопределяемые генетически: репликативный - инфекция, интегрированный - вирусоносительство и иммунопатологический процесс
Слайд 81Гепатит В у детей
Клиника (периоды болезни)
Инкубационный период
Начальный период (преджелтушный) – от нескольких часов до 2 недель (по В.Ф. Учайкину – в среднем – 5 дней)
Желтушный ~ 3-5 недель (от7-10 дней – до 1,5-2 месяцев)
Реконвалесценции
Слайд 82Гепатит В у детей
Клиника (начальный период)
Типично постепенное
Слайд 83Гепатит В у детей
Клиника (желтушный период)
Характеризуется постепенным
Интоксикация характеризуется признаками ваготонии: брадикардией, снижением АКД, угнетением ЦНС.
У 7-8% детей отмечают симметричные пятнисто-папулезные высыпания на конечностях, ягодицах, туловище (синдром Джонатти-Крости), иногда – артралгии, геморрагии, гематурию, развитие гломерулонефрита (иммунокомплексные поражения).
Слайд 84Гепатит В у детей
Клиника (течение по В.Ф.Учайкину)
Острое течение – 90%
Хронический гепатит
Злокачественное (фульминатное) течение раньше - исключительно у детей первого года жизни (~ у 14%), а теперь и у подростков-наркоманов
Носительство HBsAg встречается у 90% детей при перинатальном инфицировании, у 30% - при инфицировании в раннем детстве, в 2-8% - при инфицировании школьников и взрослых. Риск перехода носительства HBsAg в хронический гепатит по данным разных авторов колеблется от 10 до 25%
Риск рака печени – среди хронических носителей HBsAg, полученного в раннем детстве – 25%
Слайд 85Злокачественная форма гепатита В у детей
Преджелтушный период - 3-5
При появлении желтухи – возбуждение, рвота с кровью, вздутие живота, тахикардия, геморрагический синдром, олигурия, уменьшение размеров печени (важный симптом злокачественного течения). Возможно развитие печеночных ком.
Слайд 86Злокачественная форма гепатита В у детей
Варианты печеночных ком:
Гипериммунная – развивается в
Распадная или эндогенная кома развивается к конце первой - начале второй недели болезни и определяется резко выраженной печеночной недостаточностью и некрозом гепатоцитов
Метаболическая, экзогенная кома – при активации хронического гепатита и дельта-инфекции
Слайд 87Злокачественная форма гепатита В у детей
Прекома – периоды возбуждения сменяются периодами
Кома I – стойкое отсутствие сознания и реакции на осмотр, суженные зрачки, но сохраненная на болевое раздражение, слабо реагирующие на свет, нарушения глотания, нарастание «печеночного запаха», геморрагического синдрома, олигурии, печень у края реберной дуги.
Кома II- возникает через 1-2 суток, характеризуется отсутствием реакции на болевые раздражения, расширенными зрачками, не реагирующими на свет, гипотонией, появлением периодического дыхания типа Куссмауля или Чейн-Стокса.
Слайд 88Перинатальный гепатит В у детей
При перенесении матерью
Первый триместр – 0–6%
Второй триместр – 6-25%
Третий триместр – 67%
Клинические проявления врожденного гепатита В обычно развиваются по окончанию периода новорождённости.
Слайд 89Наблюдение за детьми от матерей носителей антител к HBsAg
Слайд 90Наблюдение за детьми от матерей носителей антител к HBsAg
Слайд 91Гепатит В у детей (лечение)
Интерферон альфа 1млн ЕД 1-2 раза в
Отечественный интерферон Интераль 3 млн ЕД на кв. м з раза в неделю 6 месяцев
Применение парентеральных интерферонов в Англии разрешено с 2х лет (Sherlock Sh., Dooley J., 2002). В России разработан оригинальный препарат Виферон - рекомбинантный интерферон α2β в сочетании с витаминами Е и С, вводимый ректально. У детей первого года жизни, инфицированных от больных матерей, целесообразно использовать Виферон в свечах (суточная доза 3 млн. МЕ/м2, 2 раза в день, 3 раза в неделю). Показано, что эффективность и длительность лечения зависит от сроков его назначения. Чем раньше поставлен диагноз и начата терапия, тем больше эффект и короче срок лечения. При начале лечения в первые 2-4 месяца жизни эффективность терапии составляет 67-80%, что в два раза выше тех, кому препарат назначался после 7-го месяца жизни (Демиденко Т.П. и соавт., 2004).
Слайд 92Профилактика гепатита В
Введение вакцинации позволило в США снизить заболеваемость гепатитом В
Слайд 93Профилактика гепатита В
В 24 субъектах РФ получили 2 прививки против гепатита
Слайд 94Гепатит D
Вирус является дельта-
частицей
35-37 нм, содержащий РНК,
паразитирует на HBsAg
2 варианта течения:
коинфекция, суперинфекция
Частота при легком течении
гепатита В – 2,3%, средней
тяжести и тяжелом – 18%,
злокачественном – 54%
(В.Ф. Учайкин)
Клиника – острый гепатит
после инкубационного
периода – 2-3 недели
Слайд 95Гепатит С (HCV)
Заболеваемость детей в 2000 году 2,5
Распространенность носителей антител к HCV Москве и СПб – 0,5-3,5%, некоторых регионах 6-16%. В мире около 400 млн. носителей HCV.
Вирус – РНК-содержащий из группы флавивирусов, чувствительный к хлороформу и формалину, погибающий при кипячении через 2 минуты. В СПб у детей доминируют 3а и 1а вирусы (33 и 31%), в России у взрослых– 1b, чаще вызывающий более тяжелое течение и исход в цирроз.
Эпидемиология: путь передачи - парентеральный (препараты крови, инфицированные иглы и др.), вертикальный (трансплацентарный), вероятен и половой. Уже через год 50-80% наркоманов инфицированы HCV.
Слайд 96Риск инфицирования при переливании компонентов крови в России (В. Покровский, Е. Селиванов,
1 случай гепатита В на 5 000 трансфузий
1 случай гепатита С на 2 000 трансфузий
1 случай ВИЧ-инфицирования на 600 000
Ориентировочно ежегодно в России переливают 7 млн. доз компонентов крови, следовательно, число заболевших ежегодно составляет:
Гепатит В – 1400
Гепатит С – 3500
ВИЧ-инфекция – 12 человек
Суммарные затраты на лечение посттрансфузионных инфекций составляют 133,4 млн. $
Слайд 97«Особенности клинических проявлений и оптимизации терапии у больных с врожденными коагулопатиями,
Обследованы все 349 проживающих в Санкт-Петербурге больных с врожденными коагулопатиями, получивших трансфузионную терапию
HBsAg обнаружен у троих пациентов с гемофилией А (0,86%)
HCV-антитела выявлены у 211 пациентов (60,5%), но у 80,4% взрослых больных гемофилией (у 160 з 190) и 30 и 42% соответственно пациентов с болезнью Виллебранда.
Скрининг доноров на HBsAg начат в 1965 году, а на HCV-антитела в 1993 году
О. Гарезина обследовала также 54 родственника (матери, отцы, жены, дети, братья, сестры) инфицированных больных и обнаружила HBs-антитела 41,4% и HCV-антитела у 11%, хотя никому из них трансфузий не проводили. Вывод – заражение родственников произошло бытовым путём.
Слайд 98Гепатит С
Инкубационный период – 28 – 56 дней
Клиника – доминирует (у
Риск передачи HCV от матери к плоду – 5-7,5%
Слайд 99Идиопатический неонатальный гепатит
(ИНГ)
Частота ИНГ составляет, по данным
50 000–70 000 новорожденных. Семейный характер ИНГ встречается у 10–15% больных.
Клиническая картина. Обычно дети с ИНГ (без или с внутри или внепеченочными атрезиями и гипоплазиями желчных путей) рождаются без желтухи, она появляется между 2-й и 4-й неделями жизни. Пеленки после мочеиспускания темно-желтые. При типичном течении на 1–2-й неделе появляется обесцвеченный стул. Интенсивность желтухи и выраженность обесцвеченности стула могут колебаться день ото дня («флюктуирующая» желтуха); постепенно кожа приобретает серовато-зеленоватый оттенок, а стул – глинистый цвет.
Гипербилирубинемия носит обычно смешанный генез, т.е. в крови высоки уровни и билирубиндиглюкуронида, и НБ. Другими характерными признаками являются увеличение печени с плотным ее краем (при пальпации), увеличение живота (нередко с асцитом), нарушение общего состояния (плохой аппетит, срыгивания, нарушения сосания и глотания, низкая прибавка массы тела, мышечная гипотония, гипорефлексия, вздутие живота, вялость и др.), увеличение селезенки, нередко геморрагический синдром (следствие низкого синтеза печенью факторов свертывания крови, тромбоцитопении). У отдельных больных в клинической картине могут доминировать признаки холестаза, цитолиза гепатоцитов, печеночной недостаточности. Уровень α-фетопротеина (α-ФП) в крови больного зависит от тяжести поражения печени.
Слайд 100Идиопатический неонатальный гепатит
(ИНГ)
Слайд 108Лечение при врожденном гепатите
Специфической терапии при ИНГ и
Слайд 109Лечение при врожденном гепатите
Глюкокортикоиды используют лишь при гепатите с УЗИ признаками
Слайд 110Лечение при врожденном гепатите
Гепатотропные препараты (Эссенциале, Гептрал, Гепатофальк, Гепатек, Сирепар, Силибон
При холестатических гепатитах показано назначение препаратов урсодезоксихолиевой кислоты в дозе 10-12 мг/кг/сутки
Слайд 111Интерферонотерапия.
Используют отечественный препарат Виферон 1 (150 000 ЕД),
Слайд 112Хронические заболевания печени
Первичные заболевания печени
Врожденные
Наследственные пигментные гепатозы
Инфекционные (хронические гепатиты, циррозы, паразитозы)
Токсические
Синдром Рея
Опухоли печени
Вторичные (симптоматические) болезни печени
Портальная гипертензия
Наследственные обменные заболевания печени
Застойная печень при болезнях ССС
Имммунопатологические болезни печени
Поражения печени при болезнях системы крови
Слайд 113Узловые звенья патогенеза ХГ
(В.Ф. Учайкин и Б.А. Святский ,1998):
- инфекция
- длительная репликация вирусов на фоне повышенного специфического антителогенеза по отношению к вирусным антигенам (при сниженном синтезе интерферонов);
- генетически детерминированная слабость Т-клеточного иммунитета с дисбалансом иммунорегуляторных субпопуляций за счет более значительного снижения функции Т-супрессоров;
- дефицит макрофагальной активности;
- действие эффекторных клеток на мембраны гепатоцитов с экспрессированными вирусными антигенами,, а также печеночно-специфический липопротеин;
- активация в печени перекисного окисления липидов и лизосомальных протеиназ;
- включение печени в аутоиммунный процесс;
дополнительное значение могут иметь нарушения внутрипеченочной гемодинамики,, а также нарушение микроциркуляции, вследствие чего развивается состояние внутрипеченочной гипоксии
Слайд 114Хронический гепатит (ХГ)
ХГ – воспалительное заболевание печени,
Этиология. Вызывают вирусы гепатита В, С, В+D, аутоиммунный гепатит, токсический или лекарственно-индуцированный гепатит.
Классификация:
По этиологии
По активности (минимальная, умеренная, выраженная, неактивный)
По выраженности морфологических изменений (перипортальный фиброз, внутридольковая дегенерация, воспаление в перипортальных трактах)
По стадиям фиброза
По фазам развития вируса (репликации, интеграции)
Слайд 115Хронический гепатит (лечение)
Показания для использования парентерального α-интерферона, активирующего естественные киллеры (Реаферон,
∙ Острые гепатиты В и С
∙ Хронические гепатиты В и С
∙ Обнаружение РНК HCV в ПЦР
Противопоказания для использования α-интерферона:
∙ Абсолютные:
Психозы, эписиндромы в настоящее время или а анамнезе
Выраженные нейтро- и тромбоцитопении
Декомпенсированный цирроз печени
Возраст до 2-х лет
∙ Относительные:
Декомпенсированный сахарный диабет
Аутоиммунные заболевания
Слайд 116 Хронический гепатит (лечение)
Стандартное лечение, рекомендуемое Международным консенсусом гепатологов (Париж,1999): 3
Предикторы эффективности ИФН-терапии при ХГ
Не 1-ый генотип вируса
Сравнительно малая (до 3-х лет) длительность инфекции
Высокая активность аминотрансфераз (АлАТ) перед началом
терапии
Низкая вирусная нагрузка (число колоний РНК HCV в ПЦР
менее 2 млн)
Горизонтальный (в отличие от вертикального - от больной
матери к новорожденному) путь передачи
Отсутствие иммуносупрессии
Слайд 117Хронический гепатит (лечение)
Почти у всех больных после первых 3-5 инъекций ИНФ
Эффективность монотерапии препаратами ИНФ составляет: у детей с ХГ В - 40-60%, ХГ С 1b при генотипе HCV - 20-35%, 2а и 3а генотипе - 70-80%
Слайд 118Хронический гепатит (лечение)
Комбинированная терапия показана при:
∙ Предположении о низкой активности терапии
∙ Неэффективности ранее проводимой терапии ИНФ
∙ При отсутствии ответа на терапию ИНФ в течение 3-6 месяцев или развитии рецидива.
Варианты комбинированной терапии
∙ Препараты ИНФ + Ремантадин + препараты урсодеоксихолиевой кислоты (Урсофальк, Урсосан и др.)
∙ Препараты ИНФ + препараты рибавирина (Ребетол) + препараты урсодеоксихолиевой кислоты
∙ Препараты ИНФ + препараты ламивудина (Зеффрикс, Эпивир) + препараты урсодеоксихолиевой кислоты
Слайд 119Хронический гепатит (лечение)
Дозы:
Ремантадин – 5,0 мг/кг/сутки внутрь на два приема в
Ламивудин – 3-4 мг/кг/сутки внутрь на два приема в течение 3-6 месяцев
Рибавирин – 10,6 мг/кг/сутки на два приема внутрь утром и вечером в течение 3-6 месяцев
Урсодеоксихолиевая кислота – 10-15 мг/кг/сутки на 2-3 приема в течение 12 месяцев
Комбинированная терапия увеличивает эффективность лечения больных с ХГ по данным разных авторов до 85-95%.
Слайд 120Аутоиммунный ХГ (ХАГ)
ХАГ– прогрессирующее воспалительное заболевание печеночной
ХАГ протекает как активный хронический гепатит с выраженной гипергаммаглобулинемией, очень высоким уровнем IgG и какими либо внепеченочными иммунопатологическими (аутоиммунными) расстройствами: аутоиммунным тиреоидитом, неспецифическим язвенным колитом, , синовитами, диффузным токсическим зобом, артралгиями или артритами, легочными инфильтратами, эритемами, гемолитической анемией, тромбоцитопенической пурпурой, поражениями сердца и др.
Лечение сводится к назначению глюкокортикоидов и иммуносупрессоров.
Слайд 121Галактоземия
Галактоземия – наследственная аномалия обмена веществ Заболевание может быть связано с
Частота составляет около 1:40 000–50 000 новорожденных.
Патогенез. Накопление в крови галактозы или галактозо-1-фосфата определяет развитие гепатотоксичности, умственной отсталости и катаракты (накопление галактиола).
Клиника. Желтуха обычно появляется на 2–3-й день жизни, гипербилирубинемия непрямая; чуть позднее (на 5–6-й день жизни) выявляются гепатомегалия, рвота, большие потери массы тела, летаргия или приступы гипогликемий, судорог и изредка спленомегалия, диарея. В этот момент катаракта еще отсутствует, но в хрусталике можно видеть как бы «тучки», «капли воды». Очень часто у таких детей развивается сепсис, вызванный обычно кишечной палочкой. Этот вариант течения типичен для детей с нулевой активностью галактозо-1-фосфатуридилтрансферазы. При других вариантах, когда активность фермента определяется (до 10% от нормы) или при дефиците галактокиназы в периоде новорождённости дети могут выглядеть здоровыми, и лишь на первом году жизни развиваются катаракта, увеличение печени с постепенным развитием цирроза, но без умственной отсталости.
Диагноз ставят на основании обнаружения сахара в моче (галактозурия), аминоацидурии, повышения уровня в крови галактозо-1-фосфата или галактозы, резкого снижения в эритроцитах активности галактозо-1-фосфатуридилтрансферазы или галактокиназы. Лечение – кормление безмолочными смесями, т.е. не содержащими лактозу (дисахарид, состоящий из галактозы и глюкозы).
Вторичная профилактика С 2006 в России введен обязательный скриниг новорождённых на галактоземию.