УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
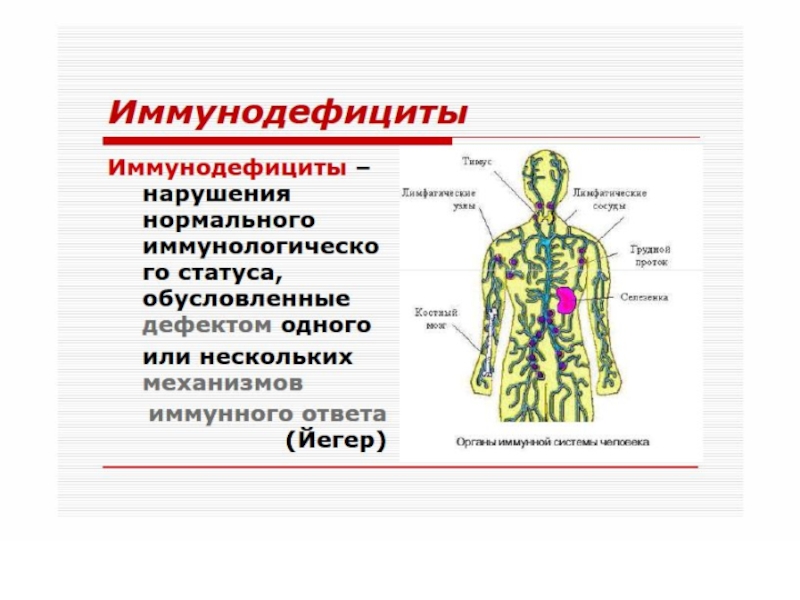
Иммунопатология. Иммунодефициты презентация
Содержание
- 1. Иммунопатология. Иммунодефициты
- 2. Организм человека имеет множество механизмов защиты от
- 3. НЕСПЕЦИФИЧЕСКАЯ ЗАЩИТА ОРГАНИЗМА Линии защиты. Сопротивляемость
- 4. СТРУКТУРА СИСТЕМЫ ИММУНОБИОЛОГИЧЕСКОГО НАДЗОРА (ИБН) ОРГАНИЗМА
- 5. Специфическая и неспецифическая иммунная защита Неспецифические факторы
- 6. И М М У Н И Т
- 8. ВОЗМОЖНЫЕ ЭФФЕКТЫ АНТИГЕНА В
- 9. Антитела - это иммуноглобулины, связывающиеся с поверхностными
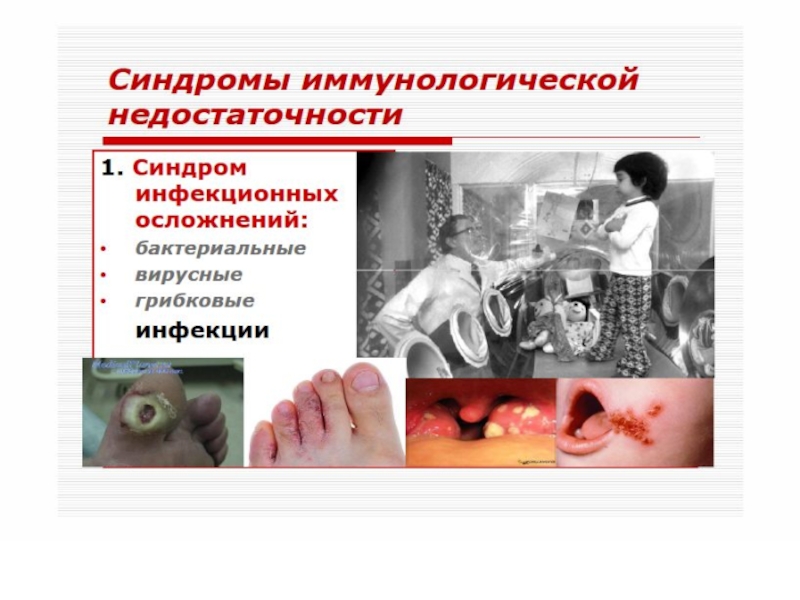
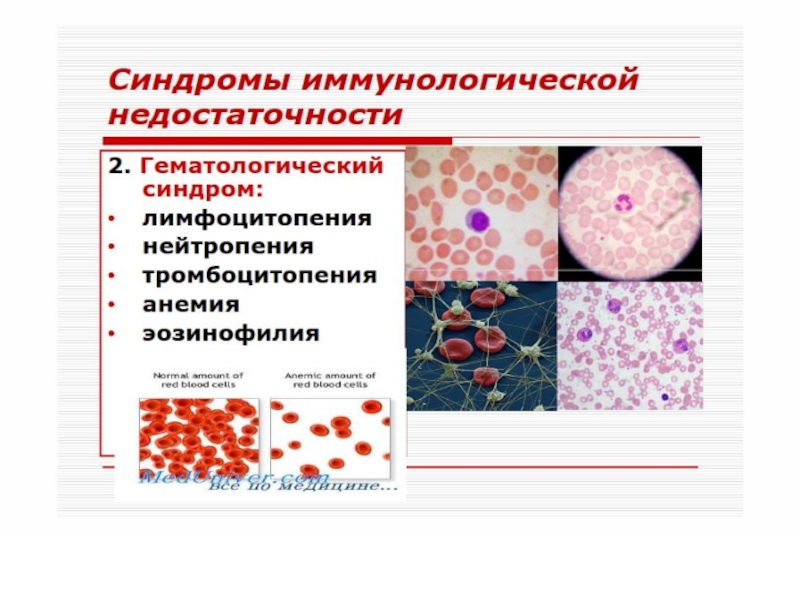
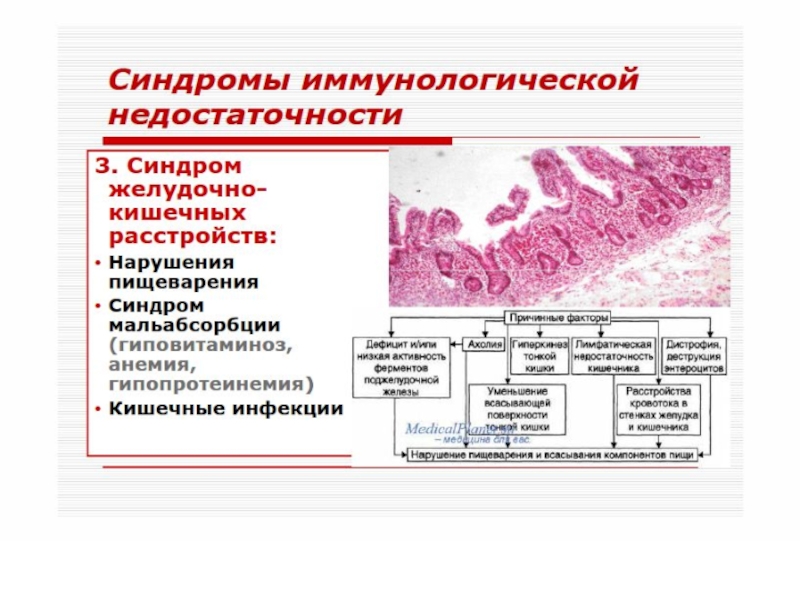
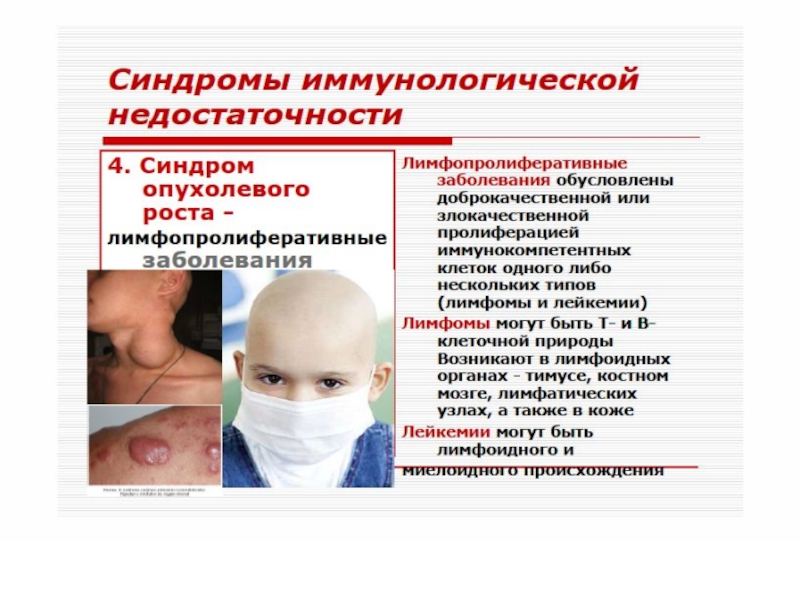
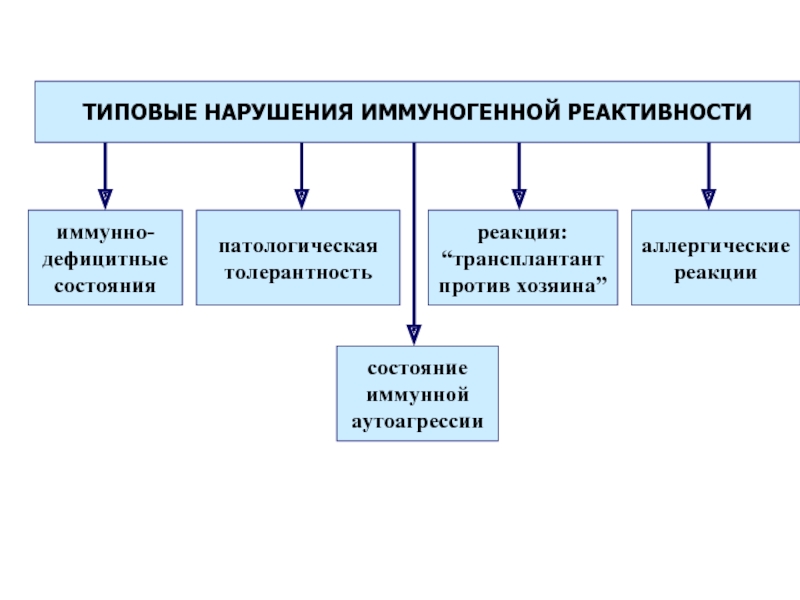
- 51. Различают первичные (наследственные) и вторичные
- 52. Согласно классификации, предложенной ВОЗ, в
- 53. Первичные иммунодефициты
- 55. Комбинированные иммунодефициты Наиболее
- 56. «Швейцарский тип» агаммаглобулинемии развивается по
- 57. Синдром Луи-Бар описан в 1941
- 58. Синдром Вискотта-Олдрича. Нарушение
- 59. Атаксия-телеангиэктазия. Комбинированный иммунодефицит: недоразвитие вилочковой
- 60. Клеточные иммунодефициты Синдром
- 61. ИД с преимущественным поражением Т-системы
- 62. Гуморальные иммунодефициты - характеризуются нормальным уровнем Вл,
- 63. Синдром Брутона.
- 64. Снижена резистентность организма к стафилококку,
- 65. Приобретенные (вторичные) иммунодефициты
- 66. К развитию клеточного вторичного ИДС
- 67. Физиологический иммунодефицит новорожденных.
- 68. Отмечается низкая фагоцитарная активность и
- 69. При старении снижается активность как
- 70. Синдром приобретенного
- 71. Первые случаи заболевания были зарегистрированы
- 72. Этиология. Возбудитель
- 73. Попав в организм, возбудитель СПИДа
- 74. Патогенез СПИДа.
- 77. Массовая гибель Т-хелперов происходит в
- 78. Существует несколько версий о механизмах
- 79. Считают, что встраивание ДНК вируса
- 80. Клиника (стадии болезни).
- 81. 2. Продромальный период. Характеризуется
- 82. При этом у больного развиваются
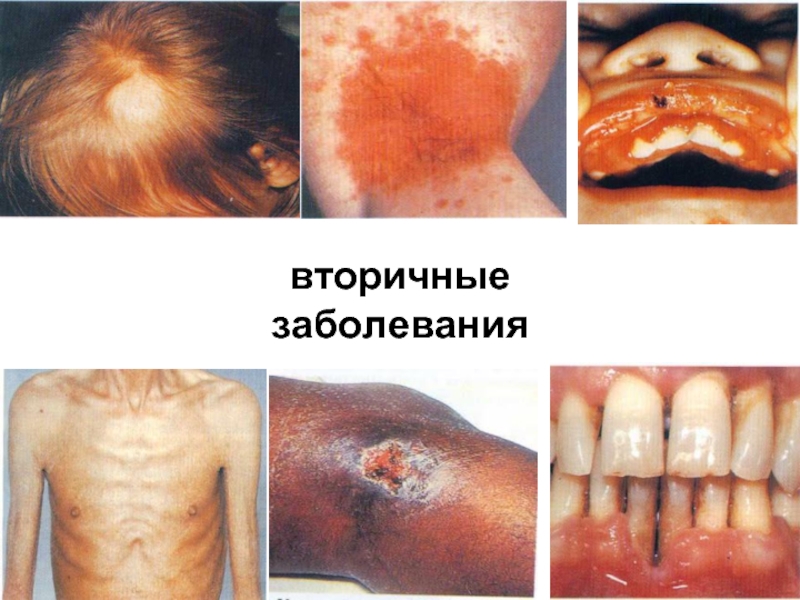
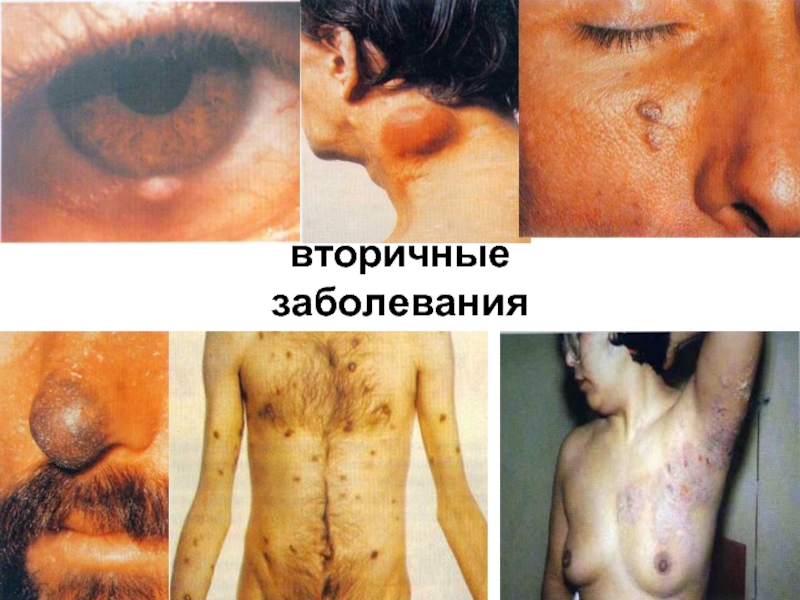
- 83. вторичные заболевания
- 84. вторичные заболевания
- 85. повторные и стойкие, часто генерализованные
- 86. Принципы лечения основаны на политерапии:
- 87. Патология неспецифических факторов защиты
- 88. Генетический дефект может затронуть любой
- 89. Приобретенная недостаточность комплемента отмечена при
- 90. Врожденный дефицит фактора С1 –
- 91. Дефицит С2 – снижение бактерицидности
- 92. Нарушаются процессы фагоцитоза и лизиса
- 93. Дефицит С5 фактора – нарушения
- 94. Дефицит С6 – заболевания суставов.
- 95. Патология пропердиновой системы. Пропердин –
- 96. Патология фагоцитоза. Фагоцитарная недостаточность
- 97. По механизму развития
- 98. Наследственные формы возникают в результате
- 99. В основе лежат наследственные или
- 100. Дисрегуляторная. Обычно это
- 101. Гормоны. Увеличение
- 102. Лейкокины, простагландины, кинины, пептиды.
- 103. БЛАГОДАРЮ ЗА ВНИМАНИЕ!!! Спасибо за внимание!
Слайд 1Иммунопатология
Лекция
Иммунопатология
Иммунодефициты
Кафедра патофизиологии
Уфа 2017
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ
Слайд 2Организм человека имеет множество механизмов защиты от различных вредных агентов: от
неживых веществ, таких, как токсины, химикалии или инородные частицы, и от живых организмов, в том числе (и в первую очередь) от возбудителей инфекционных болезней - вирусов, бактерий, грибов, простейших и гельминтов. Защиту осуществляют две системы:
неспецифическая (сопротивляемость организма) и
специфическая (иммунная система)
неспецифическая (сопротивляемость организма) и
специфическая (иммунная система)
Слайд 3НЕСПЕЦИФИЧЕСКАЯ ЗАЩИТА ОРГАНИЗМА
Линии защиты. Сопротивляемость организма складывается из двух линий защиты.
Поверхностные анатомические барьеры (эпителий кожи и слизистых оболочек), находящиеся на границе внутренней и внешней среды, - первая линия неспецифической защиты. Физико-химические и биологические свойства эпителия, а также выделяемые на поверхность эпителия секреторные вещества и клетки не позволяют патогенам попасть во внутреннюю среду организма.
Если же патоген преодолевает этот поверхностный барьер и оказывается во внутренней среде организма, его встречает комплекс клеточных и гуморальных неспецифических факторов. Это вторая линия неспецифической защиты, к которой относятся фагоцитирующие клетки, комплемент, интерфероны, кинины и некоторые другие вещества, а также естественные антитела (антигеннезависимые) и естественные киллеры. В совокупности обе линии защиты составляют врождённые, естественно присущие организму, т.е. конституциональные факторы.
Если же патоген преодолевает этот поверхностный барьер и оказывается во внутренней среде организма, его встречает комплекс клеточных и гуморальных неспецифических факторов. Это вторая линия неспецифической защиты, к которой относятся фагоцитирующие клетки, комплемент, интерфероны, кинины и некоторые другие вещества, а также естественные антитела (антигеннезависимые) и естественные киллеры. В совокупности обе линии защиты составляют врождённые, естественно присущие организму, т.е. конституциональные факторы.
Слайд 4
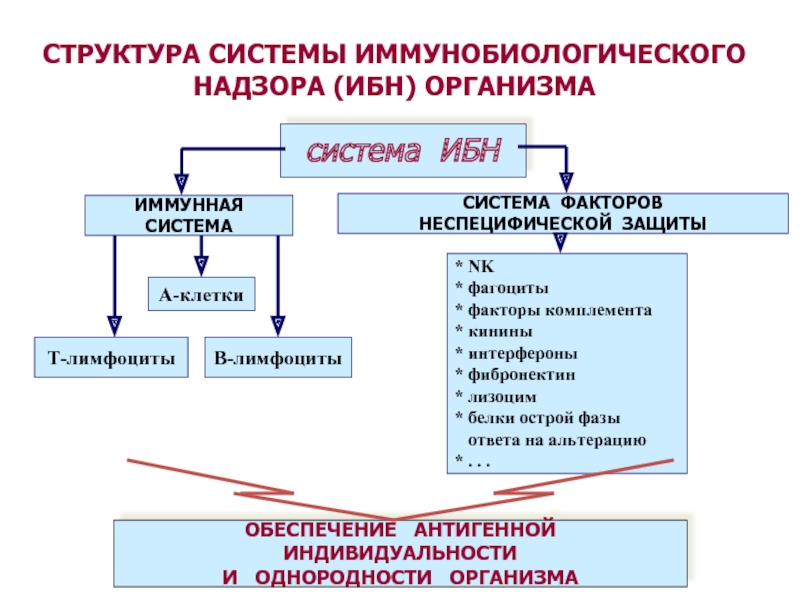
СТРУКТУРА СИСТЕМЫ ИММУНОБИОЛОГИЧЕСКОГО НАДЗОРА (ИБН) ОРГАНИЗМА
система ИБН
ОБЕСПЕЧЕНИЕ АНТИГЕННОЙ
ИНДИВИДУАЛЬНОСТИ
И ОДНОРОДНОСТИ ОРГАНИЗМА
И ОДНОРОДНОСТИ ОРГАНИЗМА
Слайд 5Специфическая и неспецифическая иммунная защита
Неспецифические факторы иммунитета, такие как фагоциты, естественные
киллерные клетки и комплемент (особые ферменты) могут бороться с инфекцией как самостоятельно, так и в кооперации со специфической защитой.
Под специфической защитой понимаются специализированные
лимфоциты, которые
могут бороться только
с одним антигеном.
Под специфической защитой понимаются специализированные
лимфоциты, которые
могут бороться только
с одним антигеном.
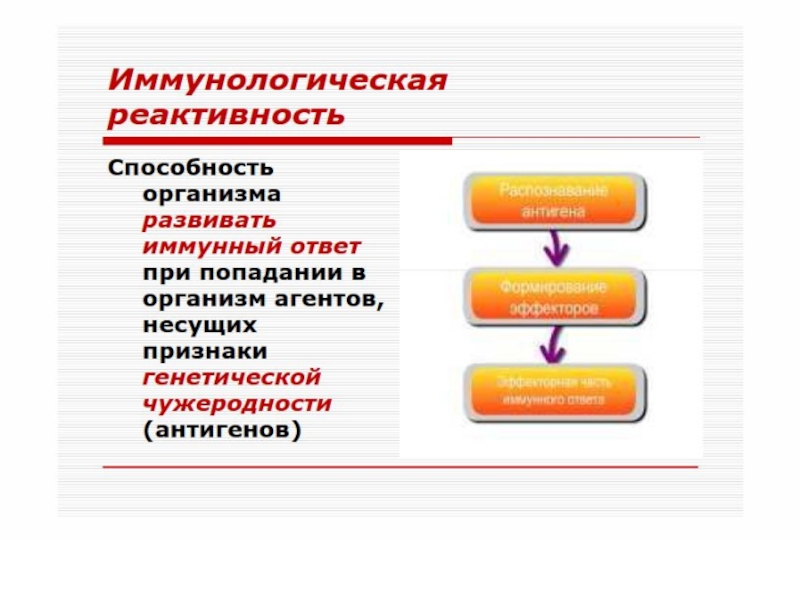
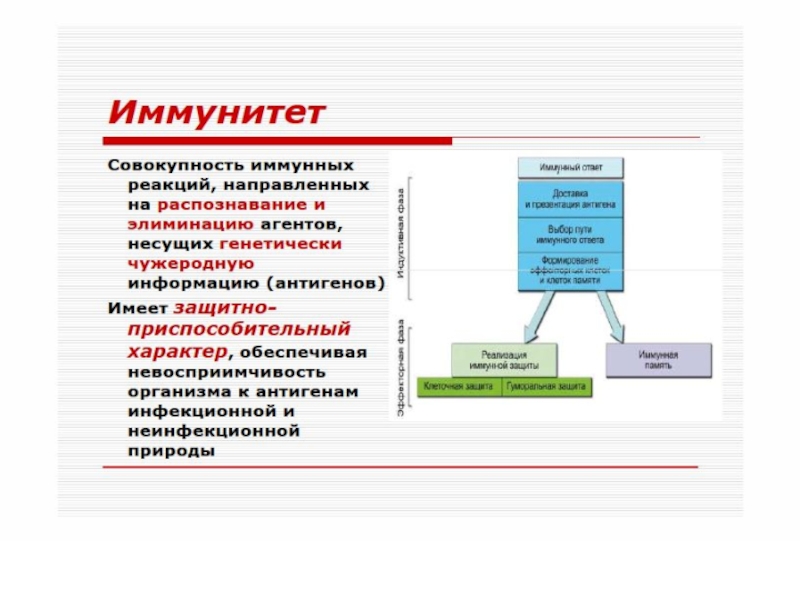
Слайд 6И М М У Н И Т Е Т
* Физиологическая форма
иммуногенной реактивности.
* Формируется в результате реализации наследуемой генетической программы и/или при контакте клеток иммунной системы с чужеродным ей антигеном.
* Обеспечивает постоянный и однородный антигенный состав организма.
* Реализуется путем обнаружения, как правило, деструкции, инактивации и элиминации чужеродного антигена.
* Характеризуется повышенной резистентностью организма к нему.
* Формируется в результате реализации наследуемой генетической программы и/или при контакте клеток иммунной системы с чужеродным ей антигеном.
* Обеспечивает постоянный и однородный антигенный состав организма.
* Реализуется путем обнаружения, как правило, деструкции, инактивации и элиминации чужеродного антигена.
* Характеризуется повышенной резистентностью организма к нему.
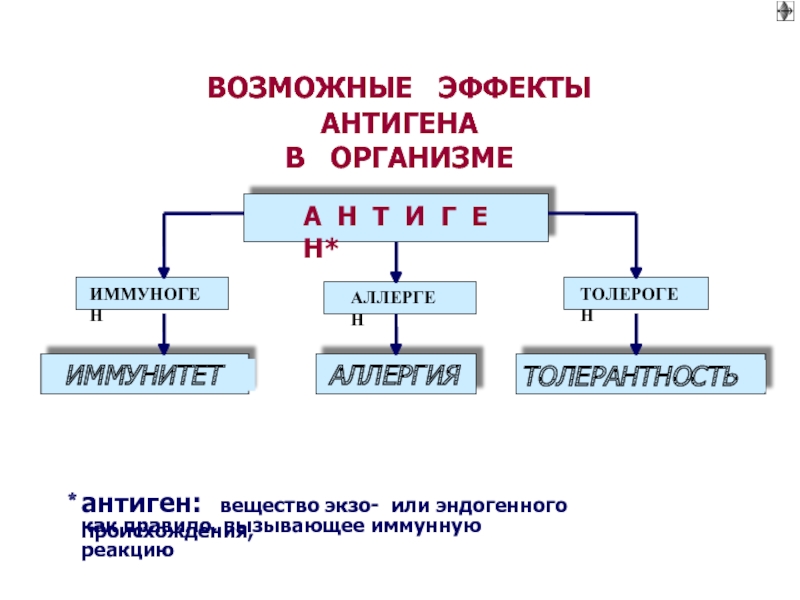
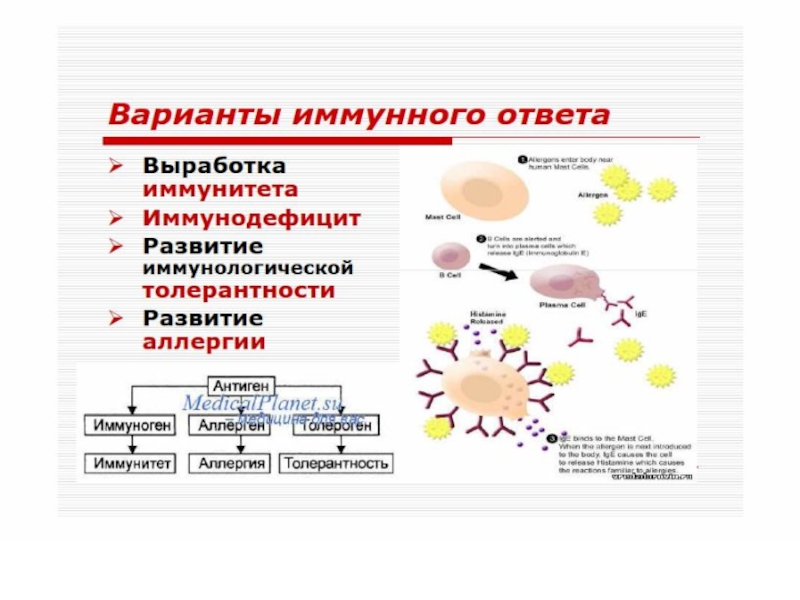
Слайд 8ВОЗМОЖНЫЕ ЭФФЕКТЫ АНТИГЕНА
В ОРГАНИЗМЕ
А Н Т И Г
Е Н*
ИММУНОГЕН
АЛЛЕРГЕН
ТОЛЕРОГЕН
ИММУНИТЕТ
АЛЛЕРГИЯ
ТОЛЕРАНТНОСТЬ
∗
антиген: вещество экзо- или эндогенного происхождения,
как правило, вызывающее иммунную реакцию
Слайд 9Антитела - это иммуноглобулины, связывающиеся с поверхностными антигенами микроорганизмов и с
продуктами их жизнедеятельности (например, с токсинами).
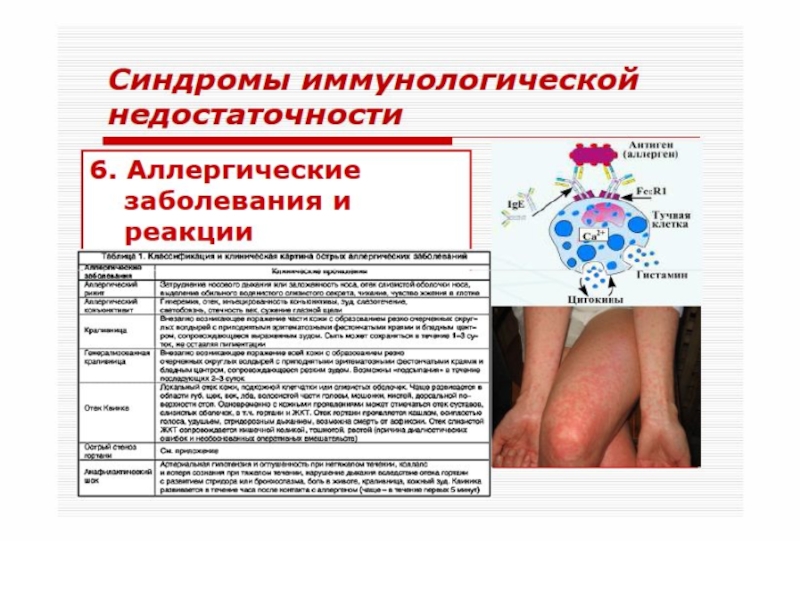
IgA - препятствует адгезии и проникновению микроорганизмов и токсинов в подслизистую и систему кровообращения. Связанные с IgA микробы и токсины удаляются за счет механического клиренса. IgA реакция на инфекцию не сопровождается болезнью.
IgG связываются с микробами и токсинами в глубине тканей или в циркуляторном русле. Они активируют систему комплемента и фагоциты (нейтрофилы), таким образом, уничтожая бактерии и токсины. IgG ответ сопровождается болезнью.
IgE связываются с базофилами и тучными клетками. При встрече с паразитом они вызывают выброс гистамина и других биологически активных веществ из этих клеток. Гистамин привлекает эозинофилы, которые оказывают повреждающее действие на паразитов. При нарушенном иммунном ответе, IgE может вырабатываться против непаразитарных антигенов, что приводит к аллергии.
IgA - препятствует адгезии и проникновению микроорганизмов и токсинов в подслизистую и систему кровообращения. Связанные с IgA микробы и токсины удаляются за счет механического клиренса. IgA реакция на инфекцию не сопровождается болезнью.
IgG связываются с микробами и токсинами в глубине тканей или в циркуляторном русле. Они активируют систему комплемента и фагоциты (нейтрофилы), таким образом, уничтожая бактерии и токсины. IgG ответ сопровождается болезнью.
IgE связываются с базофилами и тучными клетками. При встрече с паразитом они вызывают выброс гистамина и других биологически активных веществ из этих клеток. Гистамин привлекает эозинофилы, которые оказывают повреждающее действие на паразитов. При нарушенном иммунном ответе, IgE может вырабатываться против непаразитарных антигенов, что приводит к аллергии.
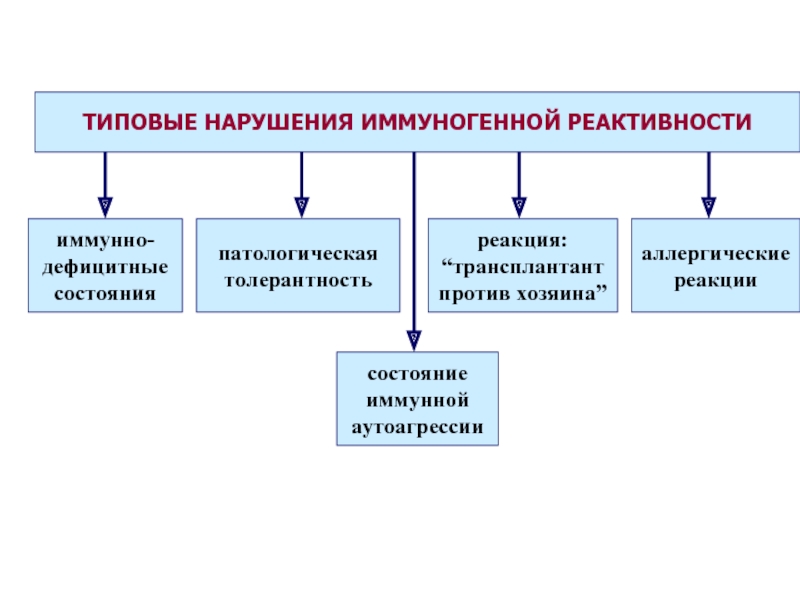
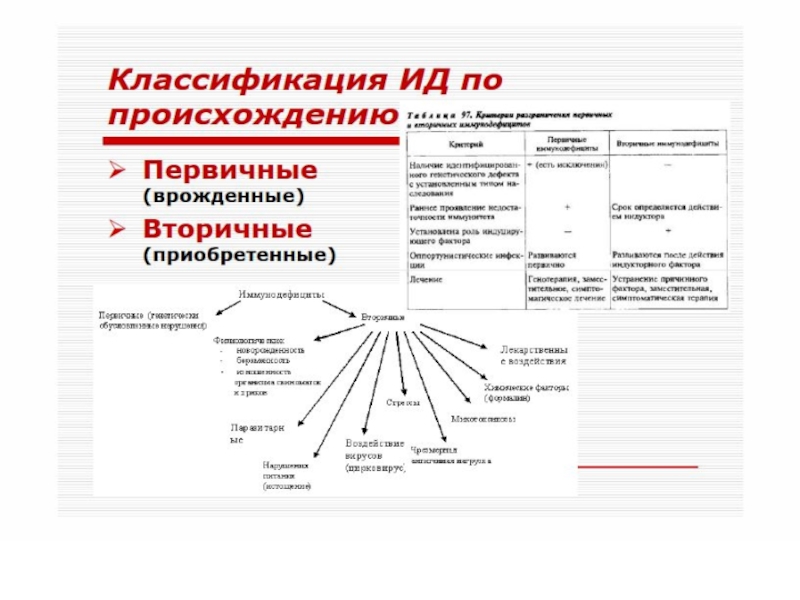
Слайд 51 Различают первичные (наследственные) и вторичные (приобретенные) иммунодефициты.
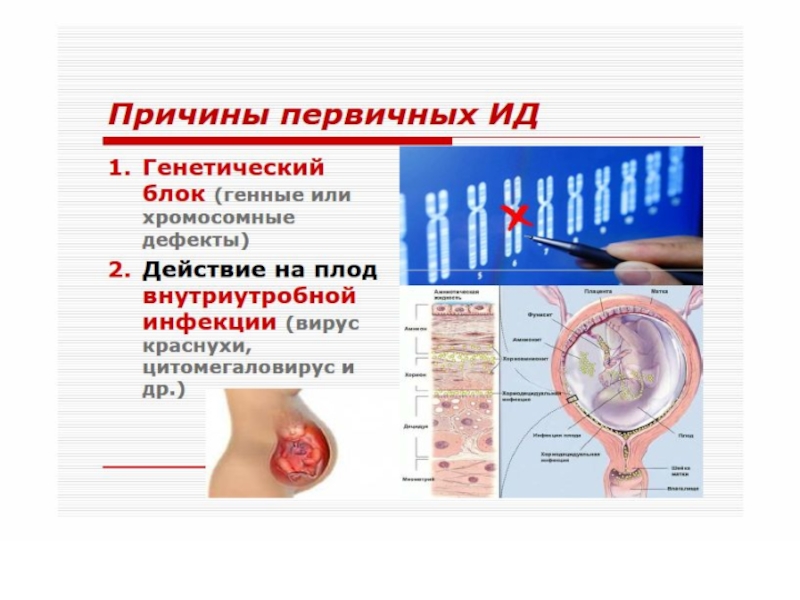
В основе патогенеза первичных лежит, как правило, генетически обусловленный блок развития или выпадение иммунных процессов вследствие дефекта ферментов или мембранных структур.
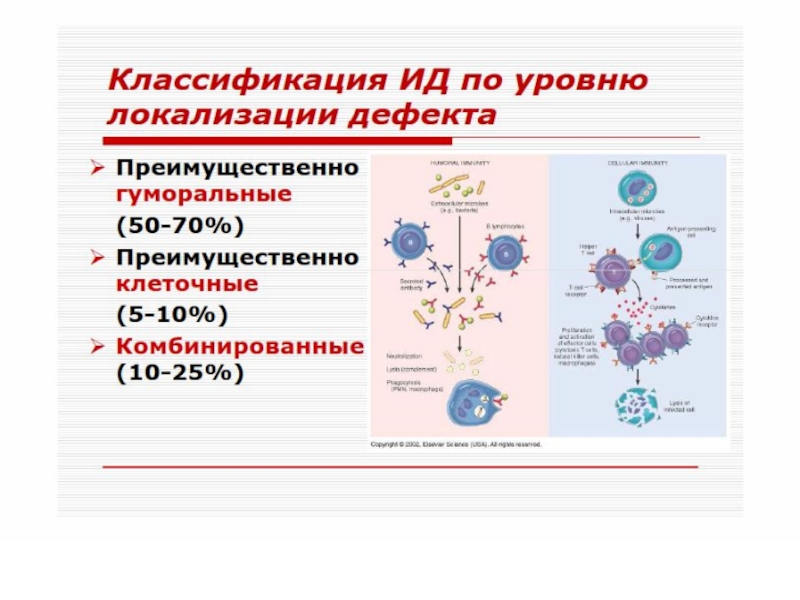
Слайд 52 Согласно классификации, предложенной ВОЗ, в зависимости от преобладающего типа
поражений звеньев иммунной системы, различают следующие:
1.комбинированные иммунодефициты с повреждением гуморального (В) и клеточного (Т) звеньев иммунной системы
2. с преимущественным повреждением клеточного (Т) звена иммунной системы
3. с преимущественным повреждением гуморального (В) звена иммунной системы
1.комбинированные иммунодефициты с повреждением гуморального (В) и клеточного (Т) звеньев иммунной системы
2. с преимущественным повреждением клеточного (Т) звена иммунной системы
3. с преимущественным повреждением гуморального (В) звена иммунной системы
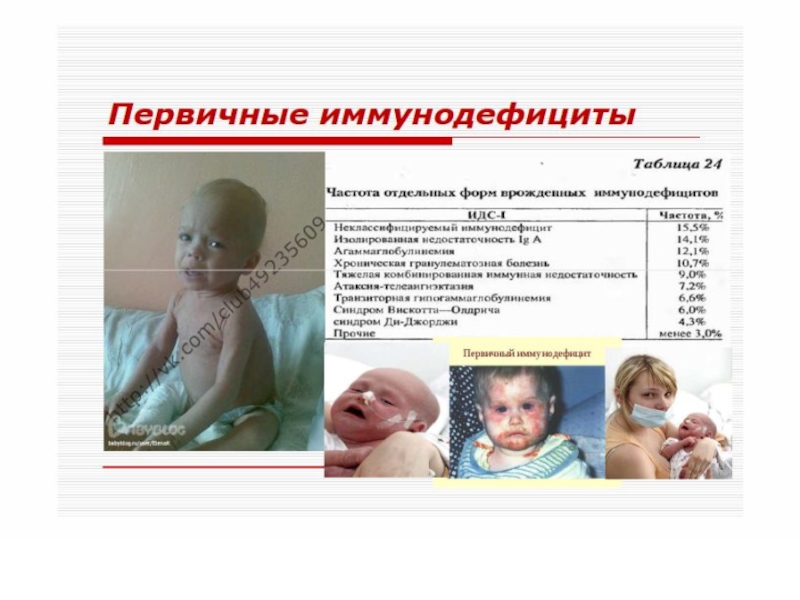
Слайд 53 Первичные иммунодефициты
Первичные иммунодефициты – очень
редкие состояния (1 на 1 млн. чел). Являются уделом детского возраста, так как большая часть больных не доживает до 20 лет, а при более легких формах дефекты со временем компенсируются.
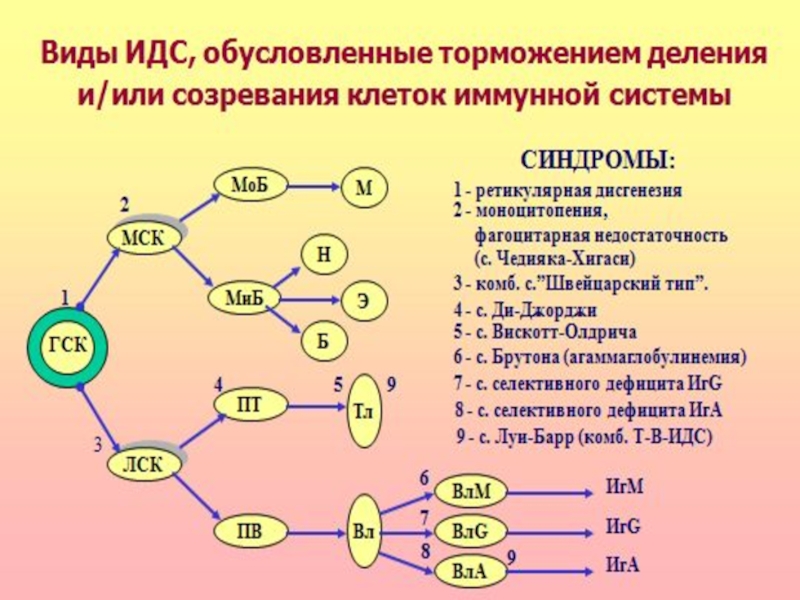
Слайд 55 Комбинированные иммунодефициты
Наиболее тяжелая разновидность ИДС – синдром
ретикулярной дисгенезии, связанный с нарушением дифференцировки и пролиферации гемопоэтической стволовой клетки. Характеризуется значительным уменьшением в костном мозге стволовых клеток и блоком созревания лимфоцитов и моноцитов всех субсистем. Пациенты погибают, как правило, вскоре после рождения от инфекций (часто от сепсиса) или злокачественных новообразований.
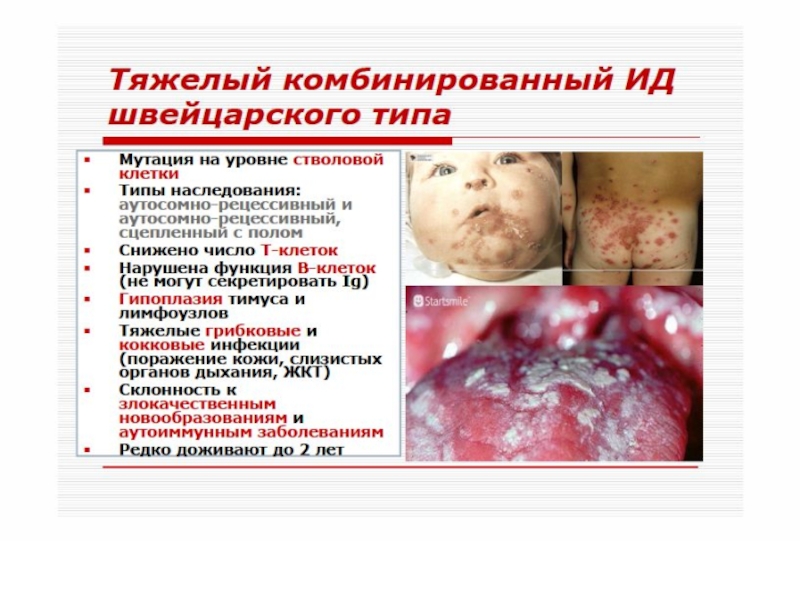
Слайд 56 «Швейцарский тип» агаммаглобулинемии развивается по аутосомно-рецессивному типу. Дефект развития
на уровне лимфоидной стволовой клетки – нарушение дифференцировки стволовых клеток, блок созревания Т- и В-лимфоцитов. Количество В-лимфоцитов может быть в пределах нормы, но они не способны синтезировать иммуноглобулины (гипогаммаглобулинемия). Больные погибают в течение первого года жизни от бактериальных, паразитарных, вирусных, грибковых инфекций.
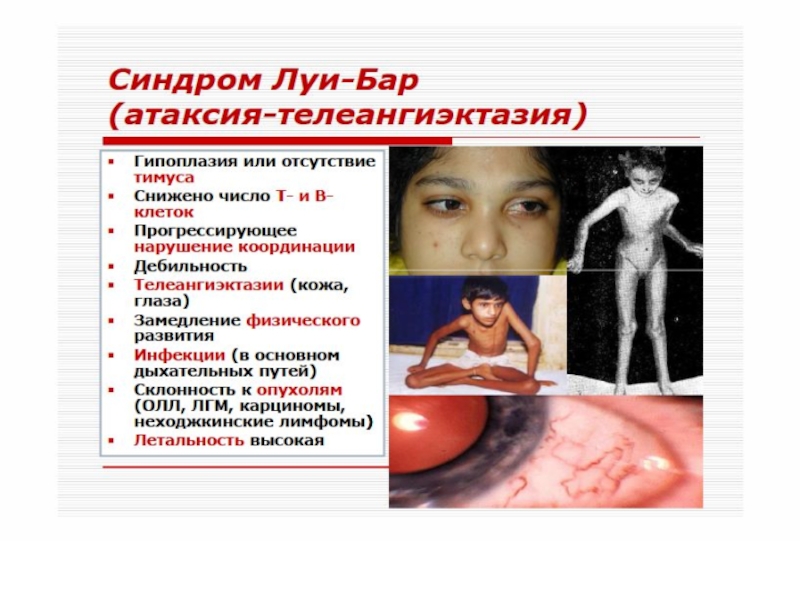
Слайд 57 Синдром Луи-Бар описан в 1941 году. Дефект созревания Т-
и В-лимфоцитов (особенно Т-хелперов), резкое снижение их содержания в крови и дефицит иммуноглобулинов классов А, Е, реже G. Пациенты погибают, от инфекций и опухолей.
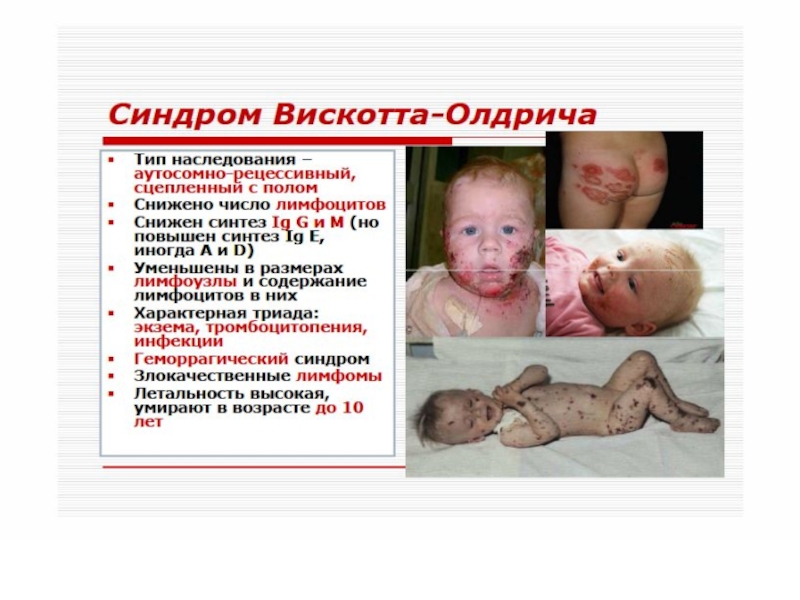
Слайд 58 Синдром Вискотта-Олдрича.
Нарушение структуры и физико-химических свойств мембран
Т-лимфоцитов. Дефицит Т-лимфоцитов сочетается с гипогаммаглобулинемией дисрегуляторного генеза, тромбоцитопенией с геморрагическим синдромом. Частые вирусные и бактериальные инфекции, аллергические реакции, экзема.
Слайд 59 Атаксия-телеангиэктазия. Комбинированный иммунодефицит: недоразвитие вилочковой железы, дефицит Т-клеток и
IgG2, IgG4, IgE, IgA. Неврологическая симптоматика, поражение сосудистой стенки, нарушение пигментации. Это обусловлено нарушением процессов репарации ДНК, дефектами клеточного цикла
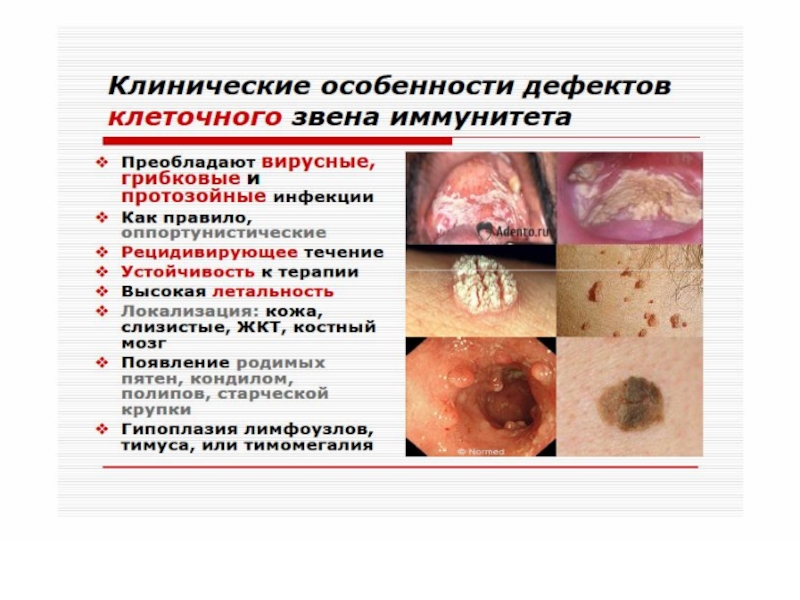
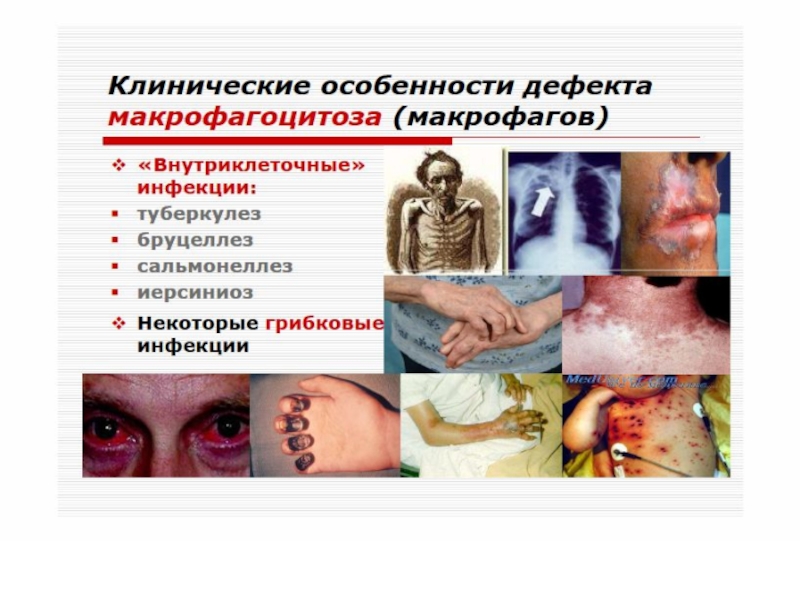
Слайд 60 Клеточные иммунодефициты
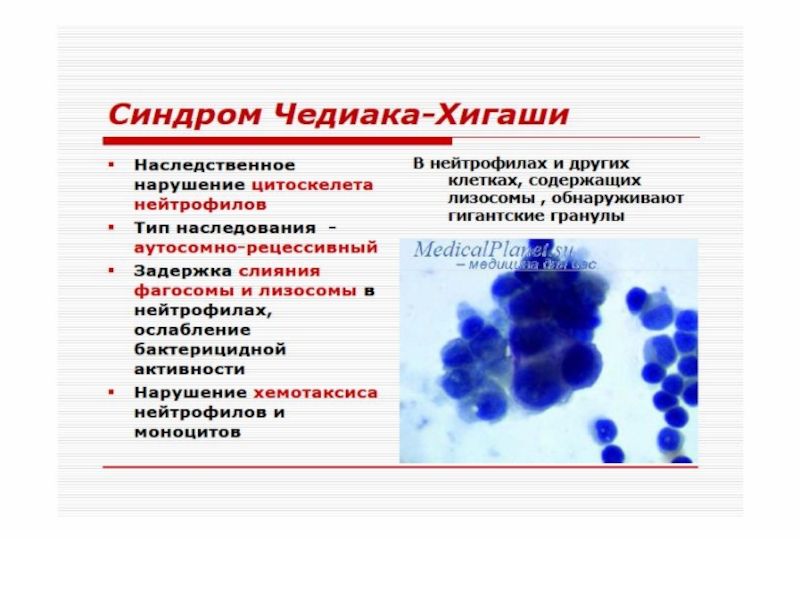
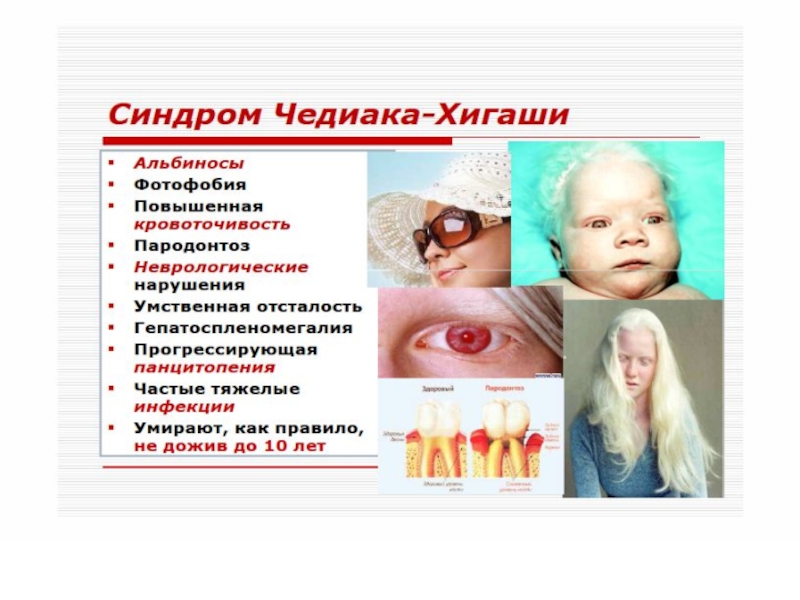
Синдром Чедиака-Хигаси обусловлен блокадой пролиферации миелостволовых
клеток, созревания миело- и монобластов. Сопровождается моноцитопенией, нейтропенией и фагоцитарной недостаточностью, что клинически проявляется частыми хроническими бактериальными инфекциями.
Нарушения в субсистеме А-клеток (моноциты, нейтрофилы, эозинофилы, базофилы, т.е. все клетки, способные к фагоцитозу) проявляются фагоцитарной недостаточностью
Нарушения в субсистеме А-клеток (моноциты, нейтрофилы, эозинофилы, базофилы, т.е. все клетки, способные к фагоцитозу) проявляются фагоцитарной недостаточностью
Слайд 61 ИД с преимущественным поражением Т-системы лимфоцитов. Проявляются развитием инфекций
с внутриклеточным паразитированием возбудителя (туберкулез, лепра, микозы, вирусные инфекции). Клиническим проявлением является
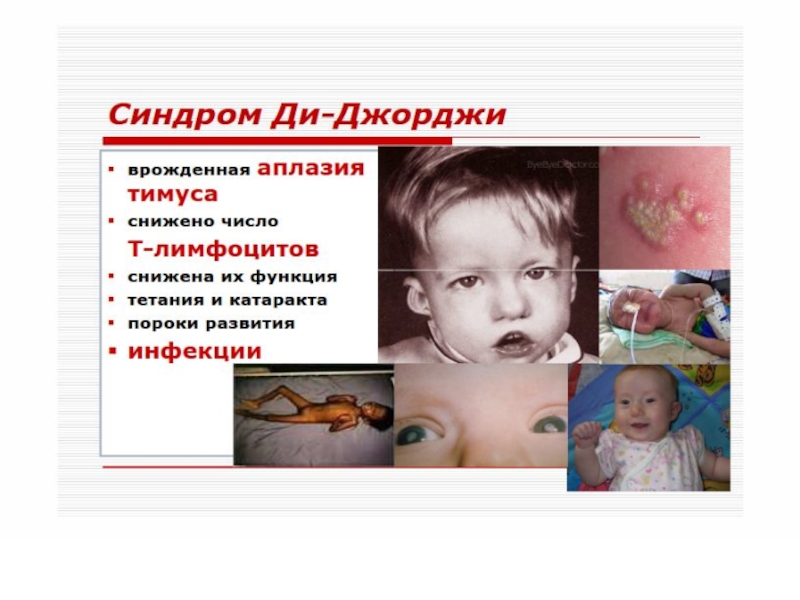
синдром Ди-Джорджи. В основе лежит гипо- или аплазия стромальных элементов вилочковой и паращитовидной желез. Значительный дефицит Т-лимфоцитов. Чаще болеют девочки. Заболевание характеризуется гипокальциемией, судорогами, рецидивирующими инфекциями дыхательных и мочевыводящих путей.
синдром Ди-Джорджи. В основе лежит гипо- или аплазия стромальных элементов вилочковой и паращитовидной желез. Значительный дефицит Т-лимфоцитов. Чаще болеют девочки. Заболевание характеризуется гипокальциемией, судорогами, рецидивирующими инфекциями дыхательных и мочевыводящих путей.
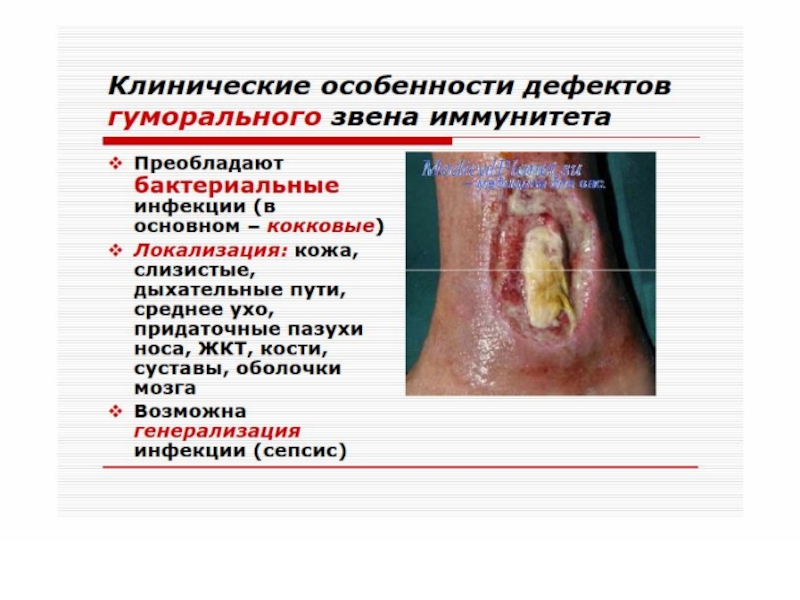
Слайд 62Гуморальные иммунодефициты
- характеризуются нормальным уровнем Вл, но пониженной их функциональной активностью.
Клеточный иммунитет сохранен. У больных отмечается частое развитие гнойных инфекций (стрептококовых, пневмококковых), аутоиммунных процессов, диареи
Слайд 63 Синдром Брутона. Описан в 1952 году.
Наследственный дефект дифференцировки В-лимфоцитов, сцепленный с Х-хромосомой сопровождающийся гипо- или агаммаглобулинемией. В основе патогенеза лежит мутация гена, контролирующего синтез фермента тирозинкиназы. Отсутствие этого фермента нарушает образование антигенраспознающих рецепторов Вл.
Слайд 64 Снижена резистентность организма к стафилококку, стрептококку, пневмококку, кишечной палочке,
сальмонеллам, протею, вирусным инфекциям, особенно к вирусу полиомиелита.
Селективные дефициты IgA, IgG – гипогаммаглобулинемии.
Частые рецидивирующие инфекции верхних дыхательных путей, желудочно-кишечного тракта, конъюнктивы.
Селективные дефициты IgA, IgG – гипогаммаглобулинемии.
Частые рецидивирующие инфекции верхних дыхательных путей, желудочно-кишечного тракта, конъюнктивы.
Слайд 65 Приобретенные (вторичные) иммунодефициты
Они развиваются под влиянием различных
повреждающих факторов физического, химического или биологического характера. К развитию гуморального вторичного ИДС часто приводят заболевания, сопровождающиеся потерей белков или нарушением их синтеза: ожоговая болезнь, хроническая почечная и печеночная недостаточность.
Слайд 66 К развитию клеточного вторичного ИДС приводят тяжелые вирусные инфекции,
т.к. вирусы часто имеют тропность к Т-лимфоцитам, грибковые заболевания.
Вторичные ИДС могут быть следствием действия повреждающих факторов (радиация, цитостатики, глюкокортикоиды, антибиотики и пр.).
В то же время, известны физиологические иммунодефициты, свойственные раннему постнатальному и старческому возрастам, связанные с беременностью.
Вторичные ИДС могут быть следствием действия повреждающих факторов (радиация, цитостатики, глюкокортикоиды, антибиотики и пр.).
В то же время, известны физиологические иммунодефициты, свойственные раннему постнатальному и старческому возрастам, связанные с беременностью.
Слайд 67Физиологический иммунодефицит новорожденных.
Он характеризуется неполноценностью клеточного и
гуморального звеньев ИО, а также факторов неспецифической резистентности. Большое количество лимфоцитов в периферической крови сочетается со снижением функциональной активности Т- и В-лимфоцитов. В основном образуются IgМ, а содержание IgG и IgА снижено и достигает уровня взрослых только к 11-14 летнему возрасту.
Слайд 68 Отмечается низкая фагоцитарная активность и опсонизирующая способность крови. Уровень
комплемента снижен и нормализуется к 3-6 месяцу жизни.
Иммунный статус беременных женщин отличается снижением числа и функций Т- и В-лимфоцитов, что, по-видимому, связано с увеличением содержания и активности Т-супрессоров. Это необходимо для подавления иммунного ответа на антигены плода.
Иммунный статус беременных женщин отличается снижением числа и функций Т- и В-лимфоцитов, что, по-видимому, связано с увеличением содержания и активности Т-супрессоров. Это необходимо для подавления иммунного ответа на антигены плода.
Слайд 69 При старении снижается активность как гуморального, так и клеточного
звеньев иммунитета. Снижаются уровни нормальных антител в крови и способность к их синтезу. Значительно уменьшается выработка антител IgG, IgА, а также активность неспецифических механизмов защиты. Угнетается синтез IgЕ, поэтому аллергические реакции протекают не так остро. С возрастом учащаются и становятся более активными аутоиммунные болезни
Слайд 70 Синдром приобретенного иммунодефицита
СПИД –
тяжелое, с летальным исходом заболевание вирусной этиологии, которое поражает иммунную систему организма человека, передается при половом контакте, через кровь, при повреждении кожи и слизистых и проявляется генерализованной лимфаденопатией, оппортунистическими инфекциями (протозойными, грибковыми, бактериальными, вирусными) и онкогенными поражениями.
Слайд 71 Первые случаи заболевания были зарегистрированы в 1981 г. в
США. Наиболее высокая инфицированность наблюдается в странах Центральной и Восточной Африки (от 4 до 12-20%). На втором месте по распространенности заболевания находятся страны американского континента.
Слайд 72 Этиология.
Возбудитель СПИДа (AIDS - Acquired Immune
Deficiency Syndrome) относится к ретровирусам подсемейства лентивирусов (ВИЧ - HIV от англ. Human immunodeficiency virus). ВИЧ способен к значительной антигенной изменчивости. Мутационная активность его в 5 раз выше, чем вируса гриппа. В организм вирус проникает с кровью и ее дериватами, с клетками при пересадке тканей, со спермой и слюной через поврежденную слизистую.
Слайд 73 Попав в организм, возбудитель СПИДа внедряется в клетки, богатые
рецепторами CD-4, к которым гликопротеиды вирусной оболочки имеют высокий аффинитет. Наиболее богаты этими рецепторами Т-хелперы, но вирус может проникать и в моноциты, клетки глии, нейроны.
Слайд 74 Патогенез СПИДа.
ВИЧ, инкорпорированный в геноме клеток
в форме ДНК провируса, способен стимулировать транскрипцию РНК вируса с помощью ДНК-зависимой РНК-синтетазы клетки. На основе этой РНК синтезируются белковые компоненты вируса, которые затем интегрируют с его нуклеиновой кислотой. После завершения сборки вирусные частицы отторгаются от клетки, попадают в жидкие среды организма и атакуют новые клетки, имеющие рецепторы CD-4, приводя к их гибели.
Слайд 77 Массовая гибель Т-хелперов происходит в связи с взаимодействием вирусного
белка на поверхности зараженной клетки с рецептором CD-4 на поверхности незараженных клеток. Одна зараженная клетка может присоединить к себе до 500 незараженных. Образуется гигантская нежизнеспособная структура.
Инфицированные клетки впоследствии лизируются.
Инфицированные клетки впоследствии лизируются.
Слайд 78 Существует несколько версий о механизмах лизиса клеток, пораженных ВИЧ:
1 - мембраны клеток разрушаются при отпочковывании вируса от клетки. Вероятность гибели клетки пропорциональна количеству рецепторов CD-4 на их поверхности, поэтому количество Тh значительно уменьшается.
2 - рассматривается возможность встраивания белков вирусной оболочки в клеточные мембраны и эти клетки распознаются ИКС как чужеродные и уничтожаются
2 - рассматривается возможность встраивания белков вирусной оболочки в клеточные мембраны и эти клетки распознаются ИКС как чужеродные и уничтожаются
Слайд 79 Считают, что встраивание ДНК вируса в геном Т-хелпера лишает
их способности к трансформации, созреванию и реагированию на стимулы, в том числе на ИЛ-2.
Это вызывает их инактивацию и лизис, особенно Т-хелперов. Именно поэтому развивается лимфопения. Кроме того, снижается количество и функциональная активность естественных NK. Указанные изменения создают предрасположенность больных к инфекциям, опухолям, а также к неспособности к развитию аллергических реакций клеточного типа.
Это вызывает их инактивацию и лизис, особенно Т-хелперов. Именно поэтому развивается лимфопения. Кроме того, снижается количество и функциональная активность естественных NK. Указанные изменения создают предрасположенность больных к инфекциям, опухолям, а также к неспособности к развитию аллергических реакций клеточного типа.
Слайд 80 Клиника (стадии болезни).
1. Инкубационный период длится
от 3-7 нед. до 3-5 лет и более, он более короток при гомосексуальном и парентеральном путях заражения и у детей, родившихся от больных матерей. После попадания в организм здорового человека вирус начинает интенсивно размножаться. Антитела к ВИЧ могут быть обнаружены уже через 4-8 нед. после заражения.
Слайд 81 2. Продромальный период. Характеризуется
-перемежающейся или непрерывной лихорадкой (38-40ºС)
неясной этиологии (проливные поты, снижение физической активности).
-- немотивированной потерей массы тела более 10%, непропорционально уровню питания и физической нагрузке
- перемежающейся или непрерывной диареей (не всегда)
-- немотивированной потерей массы тела более 10%, непропорционально уровню питания и физической нагрузке
- перемежающейся или непрерывной диареей (не всегда)
Слайд 82 При этом у больного развиваются персистирующая (постоянная) генерализованная лимфаденопатия
и умеренный иммунодефицит, который может сохраняться длительное время (до 10 лет и более) - так называемый период скрытого течения инфекции.
3. Стадия вторичных заболеваний характеризуется нарушениями иммунитета (лимфопения, резкое снижение Т-хелперов, подавление функции В-лимфоцитов). Организм поражается прогрессирующими оппортунистическими инфекциями:
3. Стадия вторичных заболеваний характеризуется нарушениями иммунитета (лимфопения, резкое снижение Т-хелперов, подавление функции В-лимфоцитов). Организм поражается прогрессирующими оппортунистическими инфекциями:
Слайд 85 повторные и стойкие, часто генерализованные грибковые, вирусные, бактериальные и
протозойные поражения кожи, слизистых и внутренних органов,
туберкулез легких и внелегочный, пневмоцистная пневмония, повторный или диссеминированный опоясывающий лишай, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии (наиболее близко стадия Зв соответствует стадии СПИДа по критериям ВОЗ).
4.Терминальная стадия –заканчивается летально.
туберкулез легких и внелегочный, пневмоцистная пневмония, повторный или диссеминированный опоясывающий лишай, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии (наиболее близко стадия Зв соответствует стадии СПИДа по критериям ВОЗ).
4.Терминальная стадия –заканчивается летально.
Слайд 86 Принципы лечения основаны на политерапии:
1.Средства, нейтрализующие вирус
СПИДа
2.Предотвращение проникновения вируса в клетки организма
3.Средства, ингибирующие ранние этапы интеграции ДНК-вируса в геном клетки-хозяина и др.
2.Предотвращение проникновения вируса в клетки организма
3.Средства, ингибирующие ранние этапы интеграции ДНК-вируса в геном клетки-хозяина и др.
Слайд 87 Патология неспецифических факторов защиты
Дефекты системы комплемента. Комплемент
– это система, состоящая из 9 белковых компонентов, являющихся, как правило, неактивными ферментами и регуляторными белками. Регуляторные белки контролируют процессы активации ферментов, не допуская неконтролируемой активации комплемента.
Слайд 88 Генетический дефект может затронуть любой из компонентов как классического,
так и альтернативного путей активации системы
Иммунологические реакции будут протекать с отклонениями от нормы, особенно воспалительные процессы, в которых система комплемента играет очень важную роль.
Иммунологические реакции будут протекать с отклонениями от нормы, особенно воспалительные процессы, в которых система комплемента играет очень важную роль.
Слайд 89 Приобретенная недостаточность комплемента отмечена при развитии у человека эндокардита,
сепсиса, малярии, некоторых вирусных инфекций. Все эти заболевания могут приводить к развитию гломерулонефрита, возможно, вследствие накопления неразрушенных в отсутствие комплемента комплексов АГ-АТ. Активность комплемента снижается также при СКВ, ревматоидном артрите и некоторых других заболеваниях.
Слайд 90 Врожденный дефицит фактора С1 – наиболее частая патология системы
комплемента, наследуется по аутосомному признаку. Невозможна активация комплемента по классическому пути, нарушается фагоцитоз и лизис микробов, наблюдаются повторные и тяжелые гнойные процессы. При врожденном дефиците ингибитора С1 (эстеразы) облегчается активация комплемента и развивается ангионевротический отек Квинке. Резистентность к инфекциям при дефиците ингибитора С1-эстеразы не изменена.
Слайд 91 Дефицит С2 – снижение бактерицидности сыворотки, предрасположенность к вирусным
инфекциям, диффузным заболеваниям соединительной ткани, гломерулонефриту и тромбоцитопении.
Компонент С3 является ключевым в формировании регуляторных и ферментных свойств комплемента, при его дефиците наблюдается высокая смертность. При дефиците ингибитора С3 постоянно активируется С3, снижается поэтому его содержание в крови.
Компонент С3 является ключевым в формировании регуляторных и ферментных свойств комплемента, при его дефиците наблюдается высокая смертность. При дефиците ингибитора С3 постоянно активируется С3, снижается поэтому его содержание в крови.
Слайд 92 Нарушаются процессы фагоцитоза и лизиса микробов, снижается сопротивляемость организма
к инфекциям – склонность к повторным микробно-воспалительным заболеваниям, лихорадка, кожные сыпи, артралгии.
При дефиците ингибитора С4 фактора симптомокомплекс, сходный с системной красной волчанкой.
При дефиците ингибитора С4 фактора симптомокомплекс, сходный с системной красной волчанкой.
Слайд 93 Дефицит С5 фактора – нарушения фагоцитоза и лизиса из-за
невозможности образования соответствующих компонентов комплемента. Тяжелые кишечные инфекции, вызванные грамотрицательной флорой, поражение кожи. При наследственной недостаточности С5 с раннего детства дерматиты и диарея, нарушение развития ребенка.
Слайд 94 Дефицит С6 – заболевания суставов. Дефицит ингибитора С6 –
эпизодические лихорадочные состояния, частые повторные инфекции
С7 – диффузные заболевания соединительной ткани: склеродермии, телеангиэктазии.
С8 – клинически может не проявляться.
С7 – диффузные заболевания соединительной ткани: склеродермии, телеангиэктазии.
С8 – клинически может не проявляться.
Слайд 95 Патология пропердиновой системы. Пропердин – белок крови, нормальное антитело,
появляющееся в ответ на иммунизацию веществами полисахаридной природы. Соединяясь с полисахаридами микробной клетки, активирует систему комплемента по альтернативному пути. Его защитное действие проявляется в бактерицидном, вируснейтрализующем эффекте. Снижение уровня пропердина в крови, а, следовательно, и его защитных свойств отмечается при тяжелых патологических процессах (шок, лейкозы, хронические инфекции).
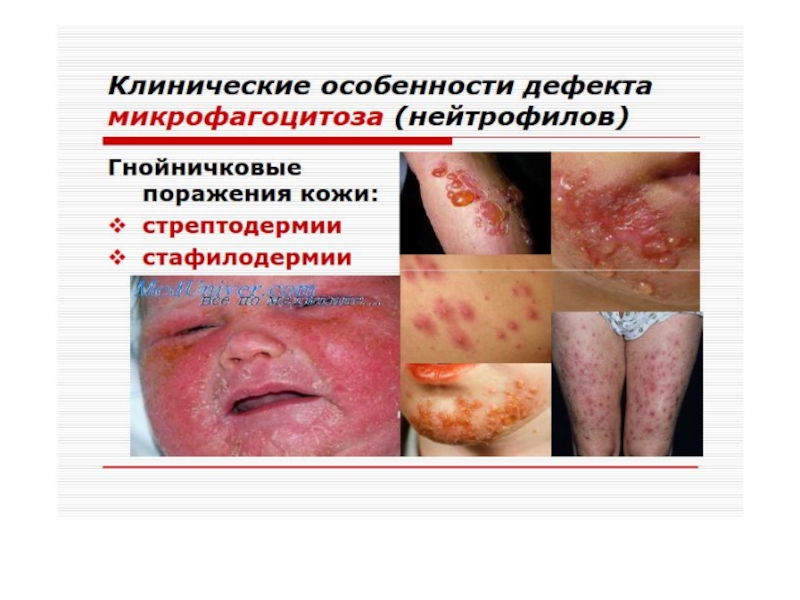
Слайд 96 Патология фагоцитоза.
Фагоцитарная недостаточность делится на следующие виды.
По происхождению
Первичная (наследственная) – большинство форм передается по аутосомно-рецессивному типу, реже сцеплено с полом (Х-хромосомой)
Вторичная (приобретенная) – как результат инфекционно-токсических заболеваний, нарушений функций печени и почек, системных болезней соединительной ткани, опухолевой трансформации мононуклеарных клеток при миелолейкозе.
Первичная (наследственная) – большинство форм передается по аутосомно-рецессивному типу, реже сцеплено с полом (Х-хромосомой)
Вторичная (приобретенная) – как результат инфекционно-токсических заболеваний, нарушений функций печени и почек, системных болезней соединительной ткани, опухолевой трансформации мононуклеарных клеток при миелолейкозе.
Слайд 97 По механизму развития
Лейкопеническая.
Приобретенные формы развиваются
при подавлении процессов пролиферации и созревания моноцитов, в частности при воздействии радиации, токсинов, цитостатиков. Например, действие гликолитического яда монойодацетата, микробных токсинов нарушает в лейкоцитах выработку АТФ, что приводит к незавершенному фагоцитозу.
Слайд 98 Наследственные формы возникают в результате наследственной блокады деления и
дифференцировки миелоидной стволовой клетки.
Дисфункциональная фагоцитарная недостаточность.
Характеризуется парциальными или комбинированными расстройствами различных этапов фагоцитоза и презентации антигена.
Дисфункциональная фагоцитарная недостаточность.
Характеризуется парциальными или комбинированными расстройствами различных этапов фагоцитоза и презентации антигена.
Слайд 99 В основе лежат наследственные или приобретенные дефекты структуры актина
фагоцитов, ферментопатии глюкозомонофосфатного шунта, гликолиза, гидролаз лизосом (чаще всего миелопероксидазы). Дисглобулинемии (чаще с избытком IgE или недостатком IgG), сочетающиеся с нарушением процесса опсонизации и адгезивных свойств фагоцитов. Недостаточность кислороднезависимых факторов лизиса объектов фагоцитоза (лизоцима, лактоферрина, катионных белков).
Слайд 100 Дисрегуляторная.
Обычно это приобретенная форма, развивается вследствие нарушения
регуляции различных этапов фагоцитоза биологически активными веществами.
Нейромедиаторы (катехоламины, ацетилхолин)
– избыток или недостаток понижают активность фагоцитоза.
Нейромедиаторы (катехоламины, ацетилхолин)
– избыток или недостаток понижают активность фагоцитоза.
Слайд 101 Гормоны.
Увеличение концентрации глюкокортикоидов сопровождается нарушением процессов
деления и созревания моноцитов, повышением жесткости их мембран и снижением в связи с этим их подвижности и адгезивных свойств.
Слайд 102 Лейкокины, простагландины, кинины, пептиды.
Значительное отклонение их концентрации
от нормального диапазона изменяют характер и интенсивность метаболизма фагоцитов, состояние их мембран, активность их ферментов, влияя на реализацию процессов фагоцитоза, делая их мало- или неэффективными.