- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Генотерапия. Принципы генной терапии презентация
Содержание
- 1. Генотерапия. Принципы генной терапии
- 2. Принципы генной терапии
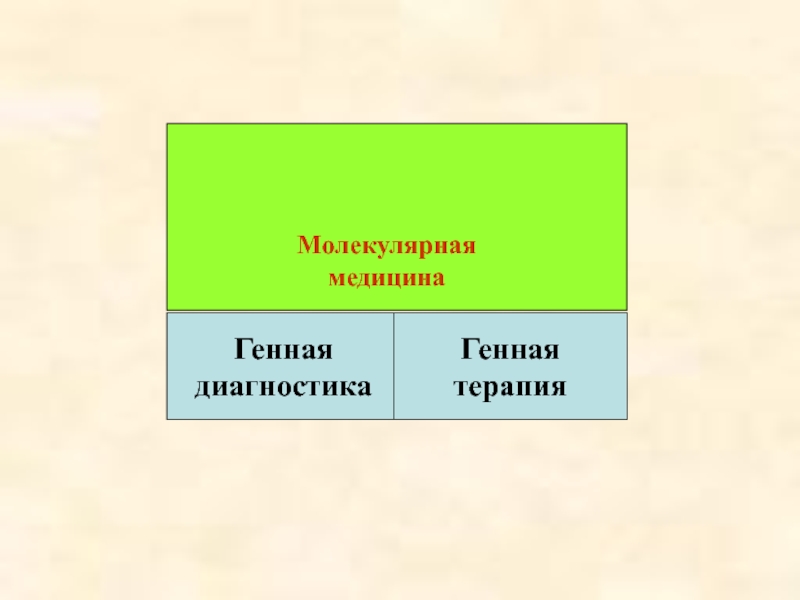
- 3. Молекулярная медицина Генная диагностика Генная терапия
- 4. Генная терапия -новая область современной биомедицины, основанная
- 5. 14 сентября 1990 г. -
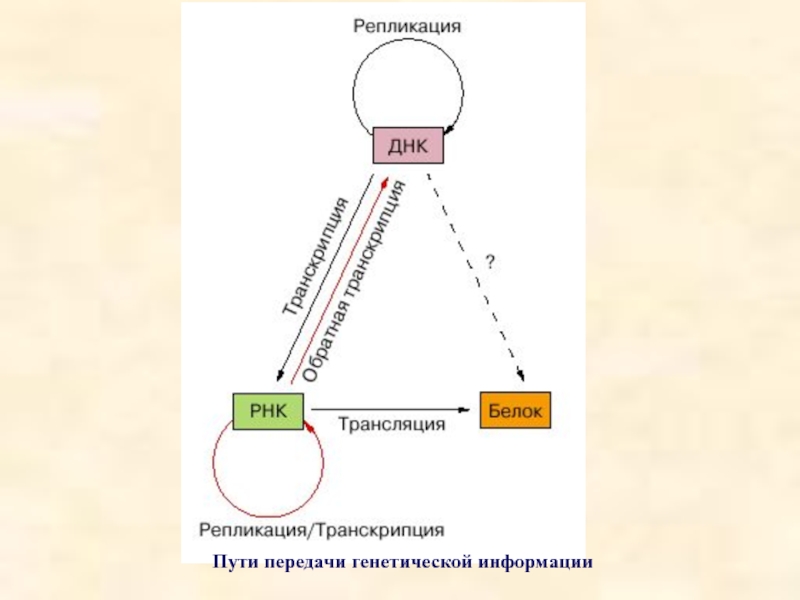
- 6. Пути передачи генетической информации
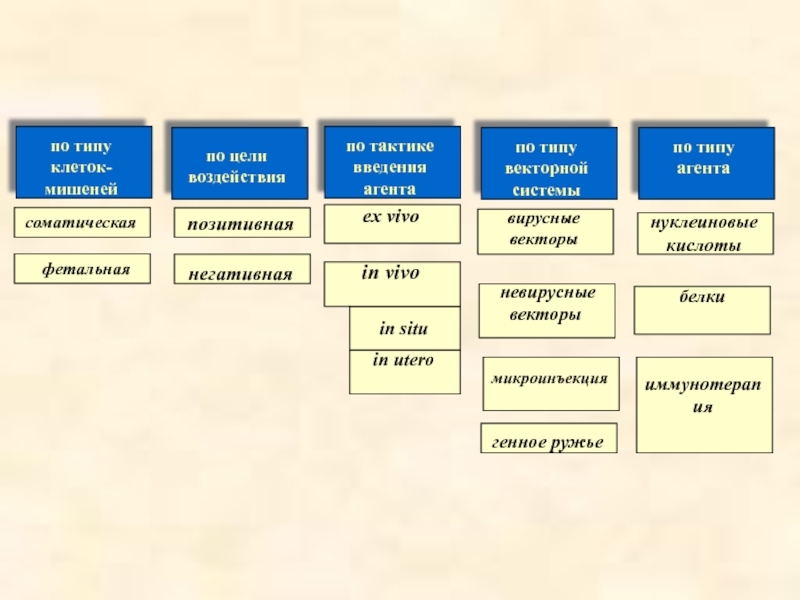
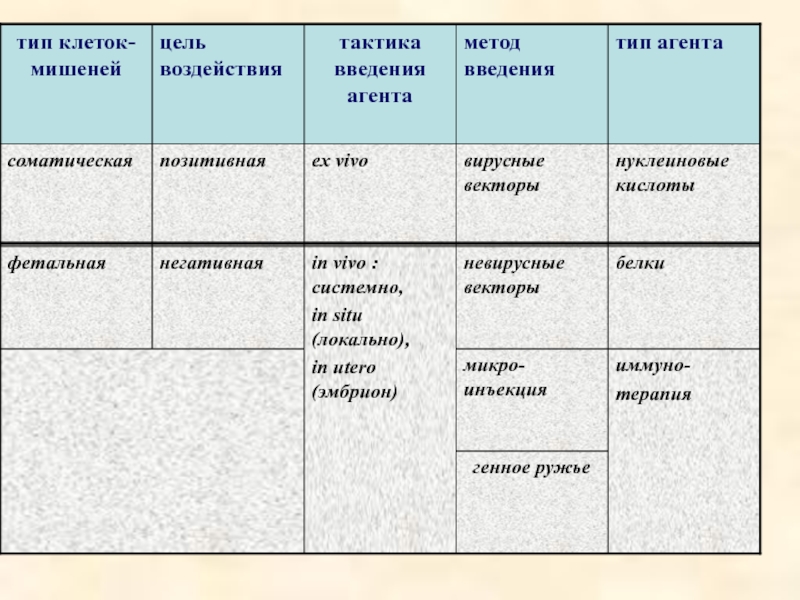
- 7. Классификация генной терапии
- 8. 1) по типу клеток-мишеней: соматическая
- 9. 4) по типу векторной системы: вирусные
- 10. белки
- 12. Смена парадигм генной терапии от
- 13. Генотерапевтические агенты
- 14. Нуклеиновые кислоты – генотерапевтические агенты Антисенс
- 15. Антисенс ДНК и РНК Преимущества: относительная
- 16. Рибозимы Преимущества: каталитические свойства (расщепление мишени)
- 17. Peptide – nucleic acids (PNA) Дуплексы DNA/PNA
- 18. РНК - ловушки Гиперэкспрессия коротких РНК (РНК
- 19. Белки – генотерапевтические агенты Трансдоминантные негативные белки Одноцепочечные антитела (intrabodies) Суицидные гены
- 20. Трансдоминантные негативные белки – мутантная версия
- 21. Одноцепочечные антитела Новый класс генотерапевтических агентов.
- 22. Суицидные гены Вместо ингибирования (или компенсации) функции
- 24. Bystander effect («эффект свидетеля» Распространение токсичных продуктов
- 25. Иммунотерапия ДНК – вакцины Антиген – специфичные Т лимфоциты
- 26. Плазмидный вектор для экспрессии HBs антигена Способы введения: Внутрикожно Подкожно Внутримышечно ? Внутривенно
- 27. Преимущества: дешевизна производства отсутствие иммуногенности
- 28. Знаем: что лечить Знаем: чем лечить Не знаем: КАК ЛЕЧИТЬ?
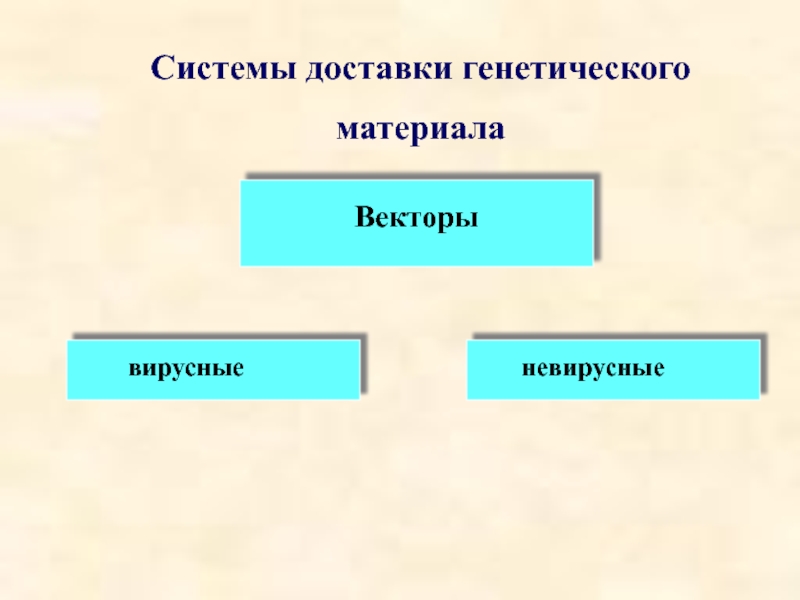
- 29. Системы доставки генетического материала Векторы вирусные невирусные
- 30. Вирусные векторы: ретровирусы аденовирусы
- 31. Аденовирусы Преимущества: способны инфицировать неделящиеся клетки
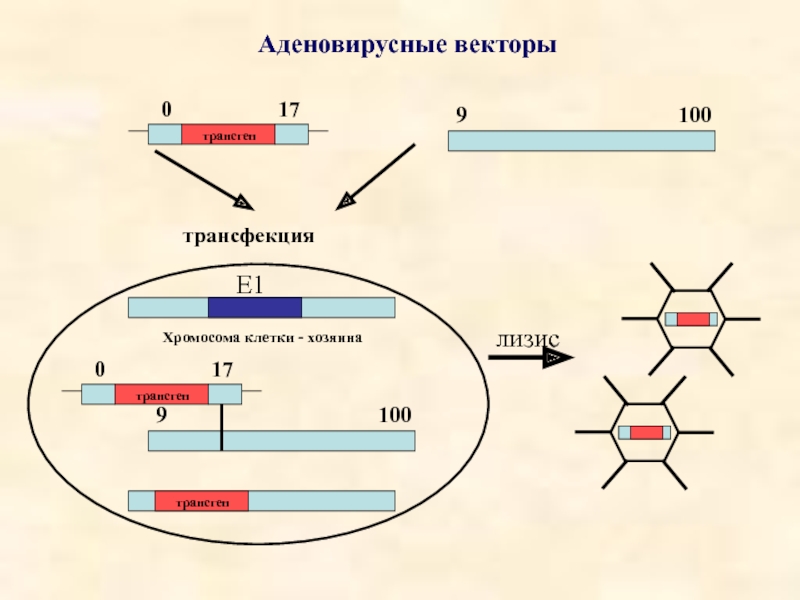
- 32. Аденовирусные векторы
- 33. Ретровирусы Преимущества: не иммуногенны постоянная
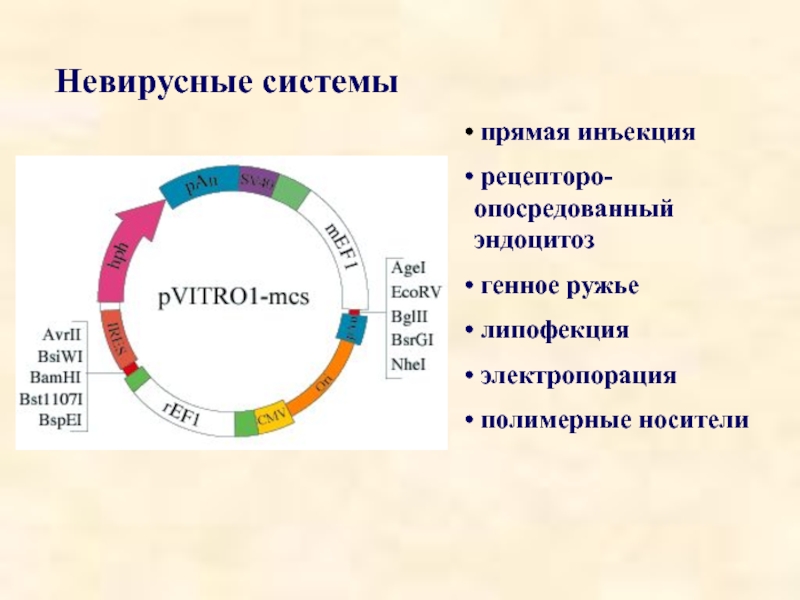
- 34. Невирусные системы прямая инъекция рецепторо-опосредованный
- 35. Плазмидные векторы - достоинства: отсутствие токсичности
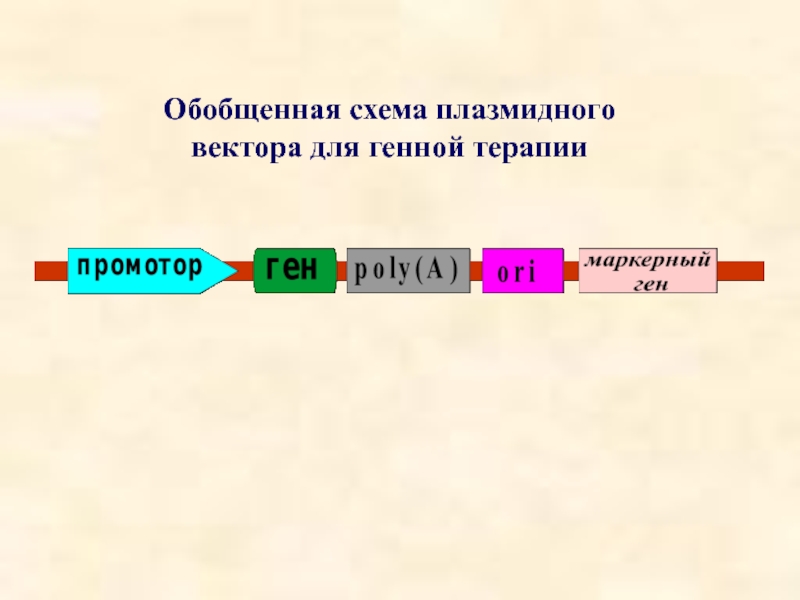
- 36. Обобщенная схема плазмидного вектора для генной терапии
- 37. Маркерные гены: SEAP (secreted alkaline phosphatase)
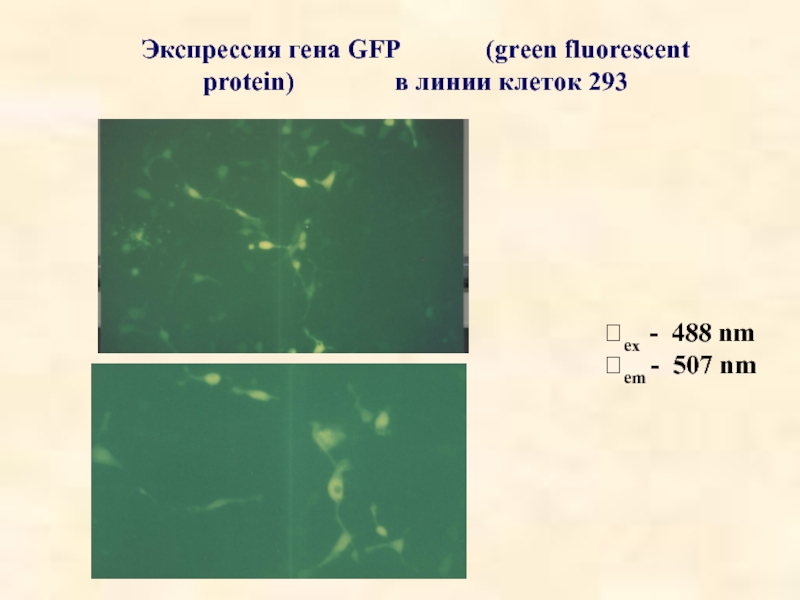
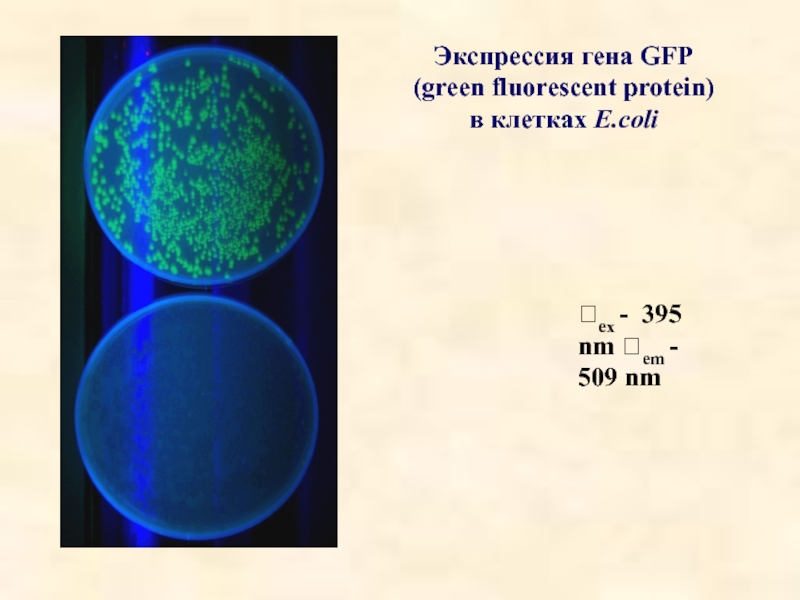
- 38. Экспрессия гена GFP
- 39. Экспрессия гена GFP
- 40. Физические методы доставки рекомбинантных плазмидных векторов:
- 42. Принцип действия “Effecten Transfection Reagent” (“QIAGEN”, Germany)
- 43. Смешанные системы доставки
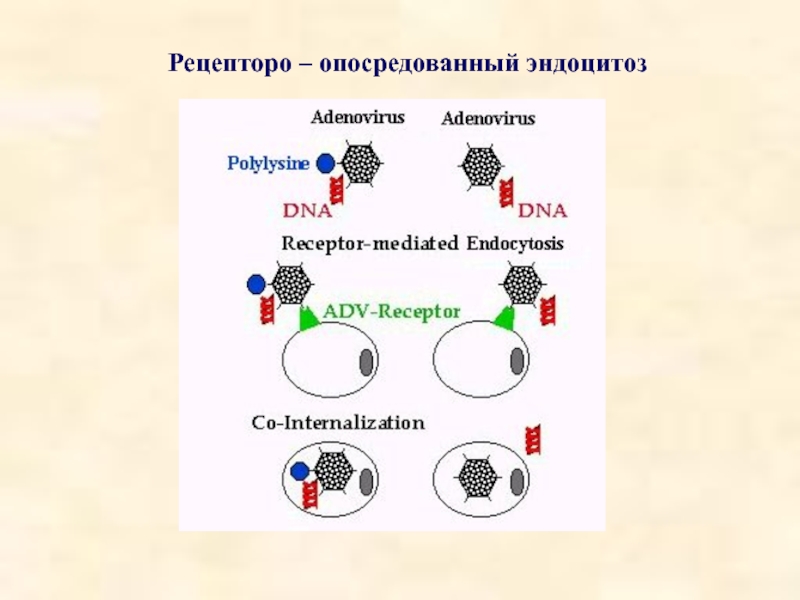
- 44. Рецепторо – опосредованный эндоцитоз
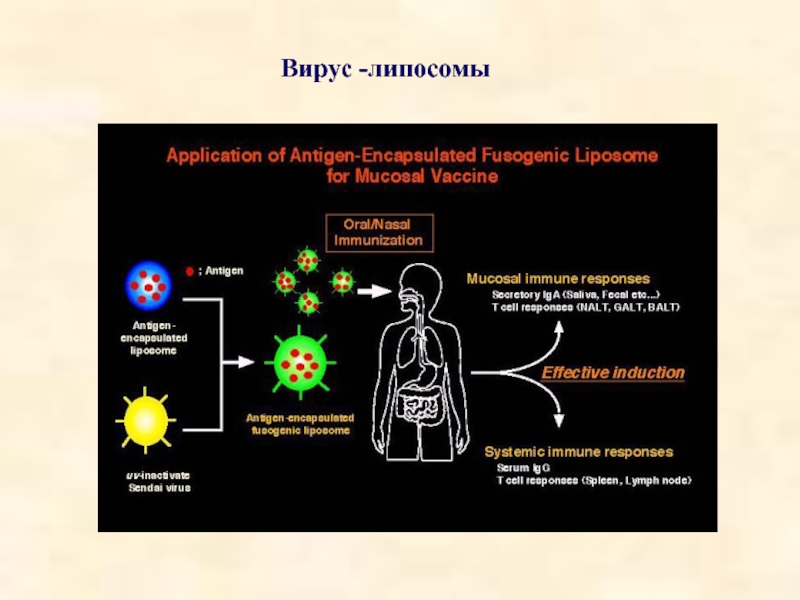
- 45. Вирус -липосомы
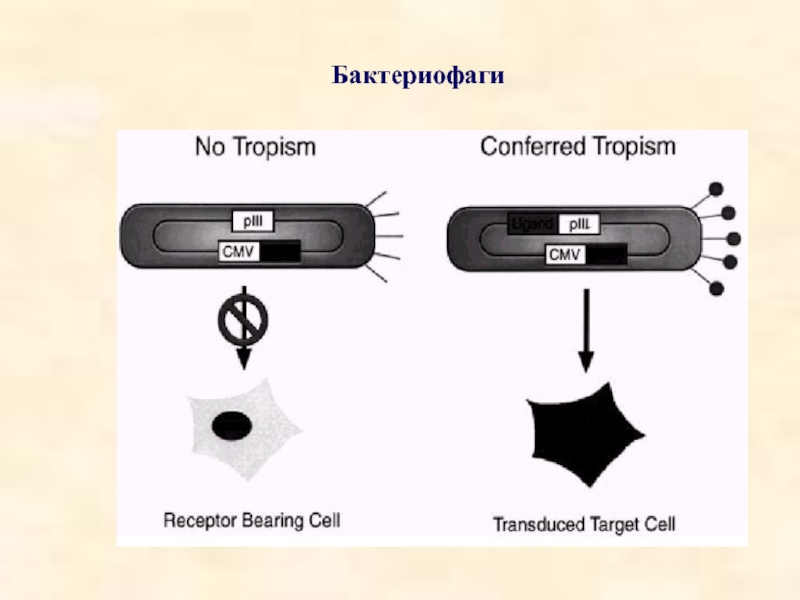
- 46. Бактериофаги
- 47. Генная терапия в медицине
- 48. Клинические испытания генотерапевтических препаратов. I
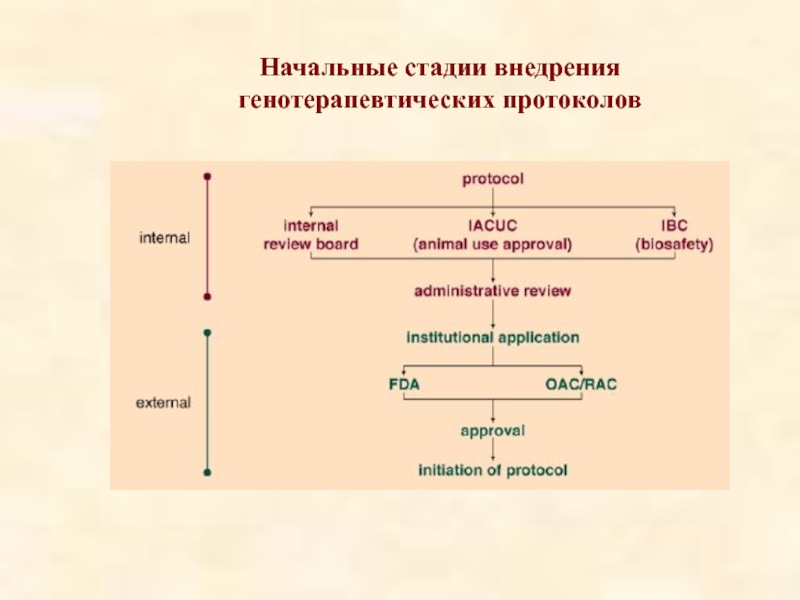
- 49. Начальные стадии внедрения генотерапевтических протоколов
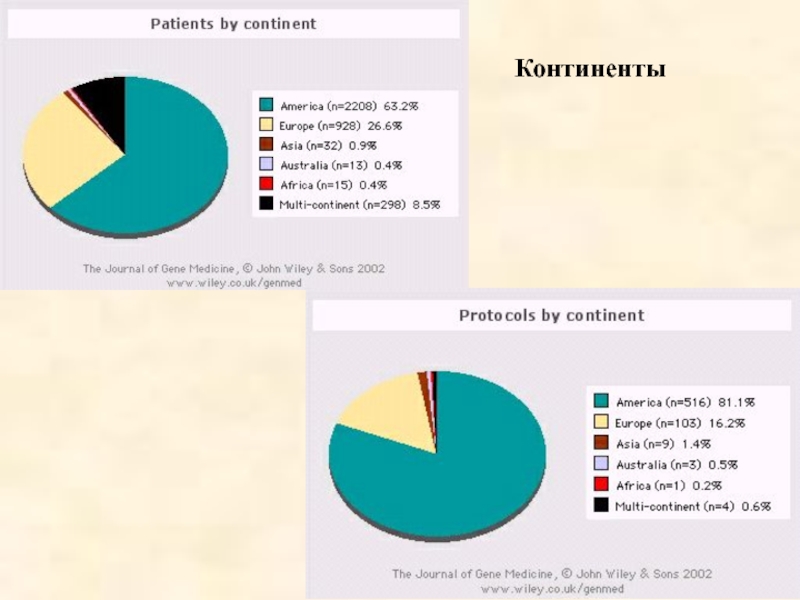
- 50. Зарегистрировано 636 клинических протоколов генной терапии
- 51. Из 636 генотерапевтических проектов: 420
- 52. Современное состояние генной терапии
- 53. Континенты
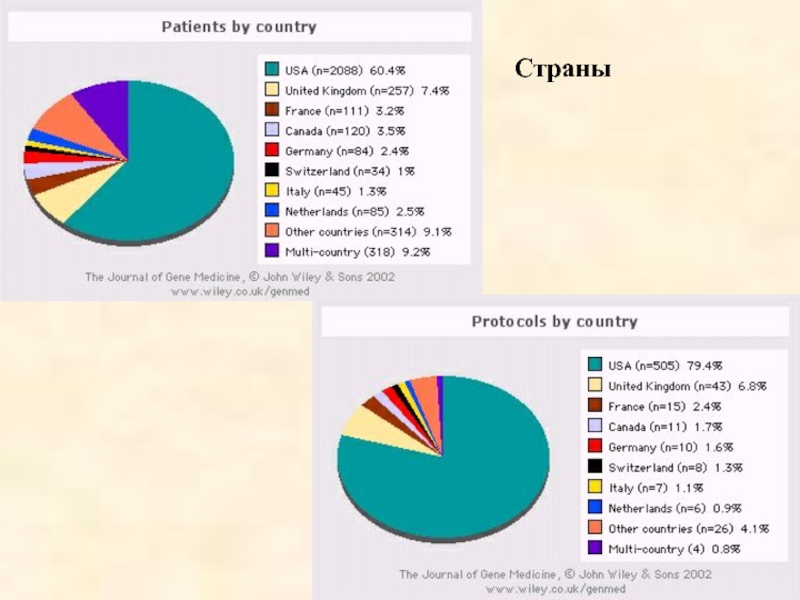
- 54. Страны
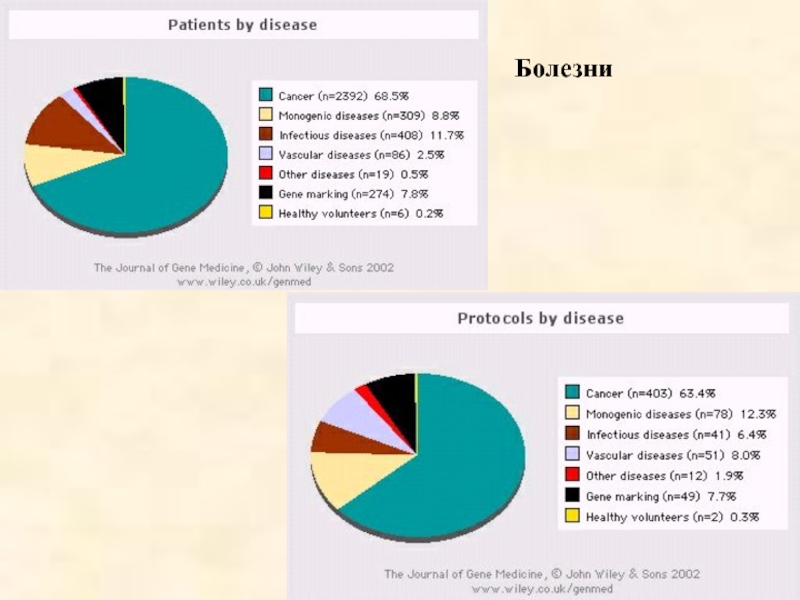
- 55. Болезни
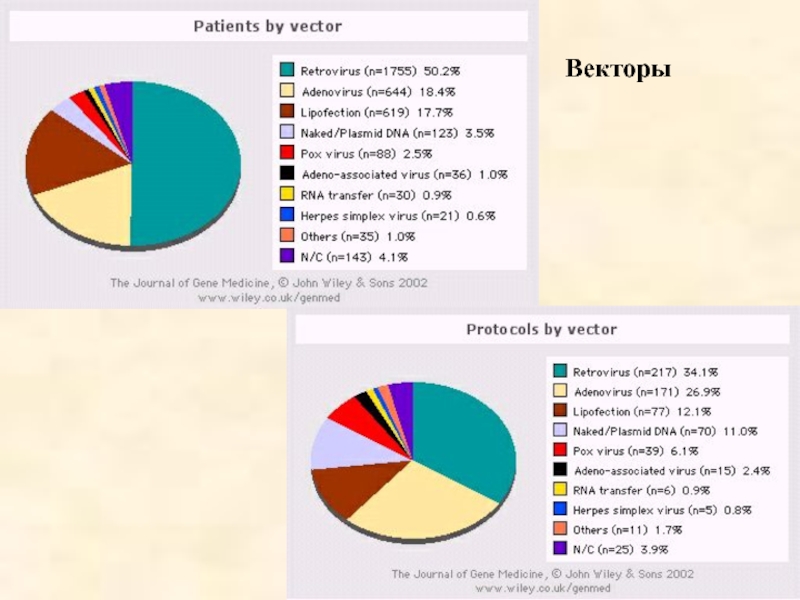
- 56. Векторы
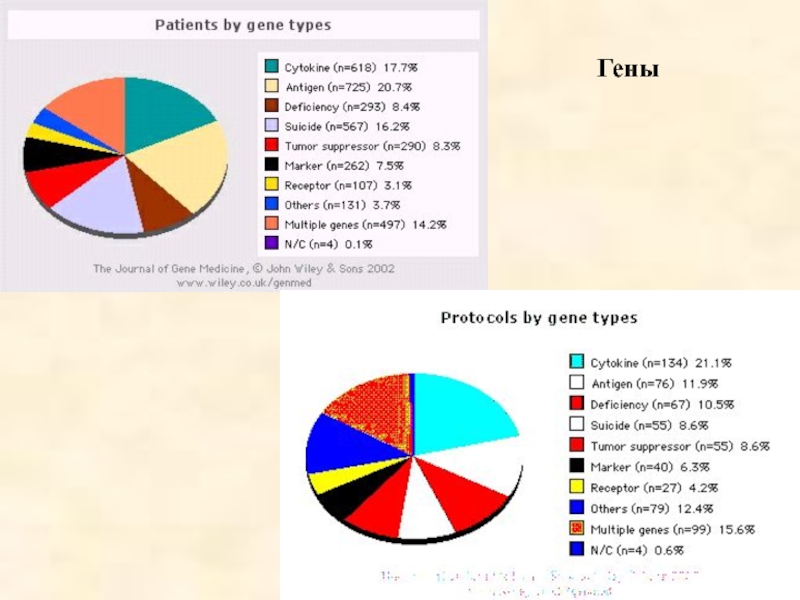
- 57. Гены
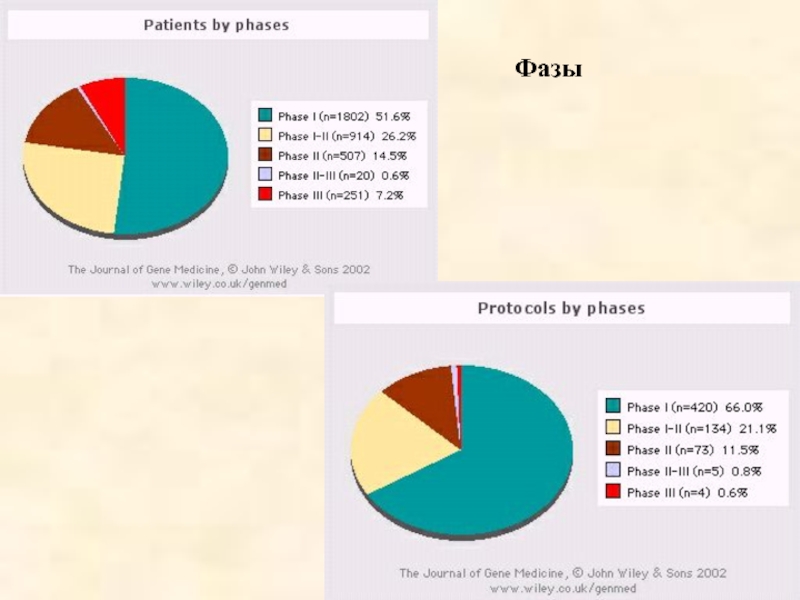
- 58. Фазы
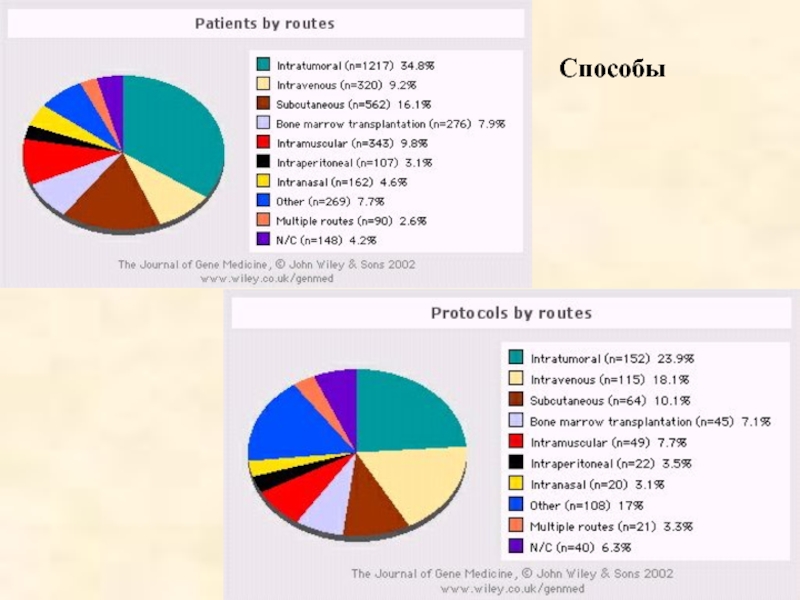
- 59. Способы
- 60. III фаза клинических испытаний Генная терапия глиобластомы
- 61. Реализуемые механизмы: прямой эффект фосфорилированного ганцикловира
- 62. Генная терапия остеосаркомы (ESCCHN) (2 протокола)
- 63. Генная терапия метастатической меланомы (иммунотерапия) Генотерапевтический агент
- 64. Первый трагический случай Смерть в
- 65. ПРИМЕРЫ: муковисцидоз (кистозный фиброз поджелудочной железы)
- 68. Основные подходы в генокоррекции онкологических заболеваний
- 71. Новые подходы к коррекции генных дефектов:
- 72. Выводы: Генная терапия пригодна для лечения широкого
- 73. вопросы Сможет ли генная терапия в будущем
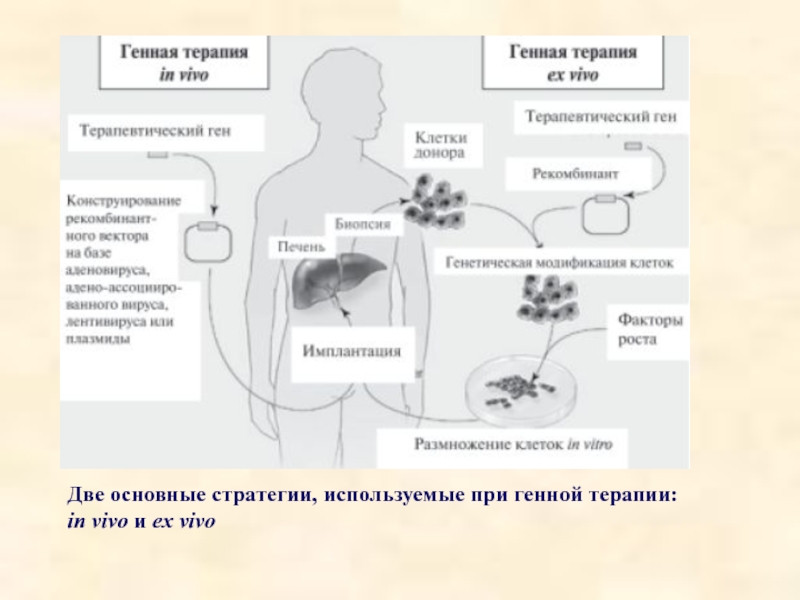
- 74. Две основные стратегии, используемые при генной терапии: in vivo и ex vivo
- 75. Генная терапия человека На людях технология генной
- 76. Работающая копия гена ADA была введена в
- 77. В настоящее время известно 4000 наследственных заболеваний,
- 78. Неблагоприятная экологическая обстановка и целый ряд других
- 79. Генно-инженерный метод лечения диабета Канадские исследователи
- 80. Одна из самых больших загадок диабета –
- 81. Почему некоторые опухоли не поддаются химио- и
- 82. Р53 – белок, вызывающий апоптоз (физиологическую
- 83. Управление экспрессией генов – будущее лекарственных препаратов?
- 84. В своих экспериментах профессор Анна К. Мапп
- 85. Будущее противораковой терапии: новые системы доставки РНК
- 86. «Малые интерферирующие РНК, осуществляющие процесс так называемой
- 87. Как довести рак до самоубийства? Специалисты
- 88. Обезьян вылечили от дальтонизма при помощи генной
Слайд 4Генная терапия -новая область современной биомедицины, основанная на введении в организм
Слайд 514 сентября 1990 г.
- введение ретровирусного вектора, экспрессирующего ген аденозиндеаминазы
(National Institute of Health (NIH), Bethesda, USA)
Слайд 81) по типу клеток-мишеней:
соматическая
фетальная
2) по цели воздействия:
позитивная
негативная (подавление функций гена)
3) по тактике введения генотерапевтического агента:
ex vivo
in vivo
in utero (введение конструкций в эмбрион)
in situ (локально)
Слайд 94) по типу векторной системы:
вирусные векторы
невирусные векторы
микроинъекция
“gene
5) по применяемым агентам:
нуклеиновые кислоты
белки
иммунотерапия
Слайд 12Смена парадигм генной терапии
от «генетической» к генной терапии
от «пересадки»
от вирусных к невирусным векторам
Слайд 14Нуклеиновые кислоты – генотерапевтические агенты
Антисенс ДНК и РНК
Рибозимы
Peptide – nucleic acids
РНК - ловушки
Слайд 15Антисенс ДНК и РНК
Преимущества:
относительная специфичность дуплекса возможность экспрессии в составе
Недостатки:
быстрая деградация (РНКазы, ДНКазы) в клетке
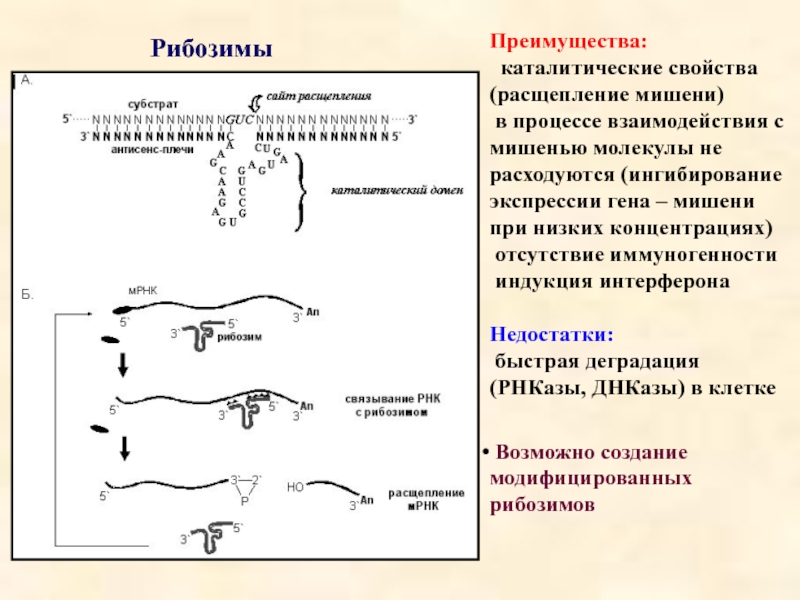
Слайд 16Рибозимы
Преимущества:
каталитические свойства (расщепление мишени)
в процессе взаимодействия с мишенью молекулы
отсутствие иммуногенности
индукция интерферона
Недостатки:
быстрая деградация (РНКазы, ДНКазы) в клетке
Возможно создание модифицированных рибозимов
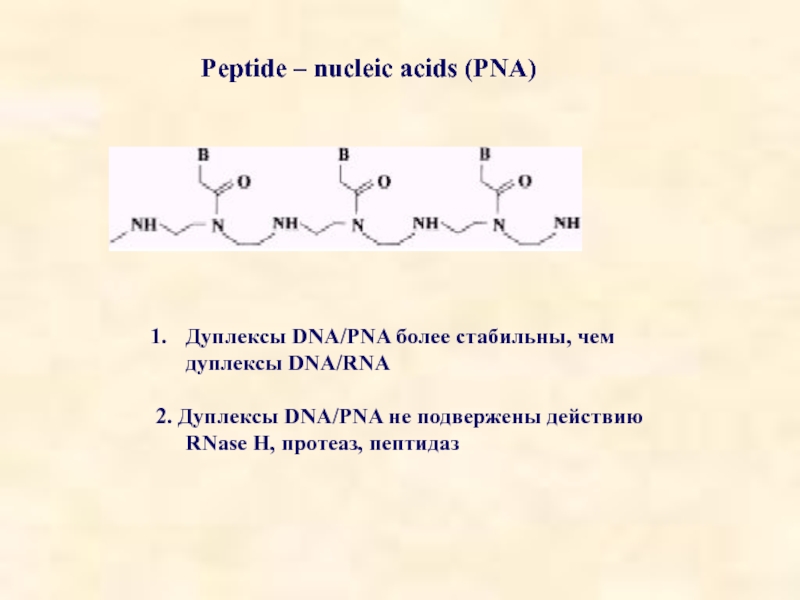
Слайд 17Peptide – nucleic acids (PNA)
Дуплексы DNA/PNA более стабильны, чем дуплексы DNA/RNA
2.
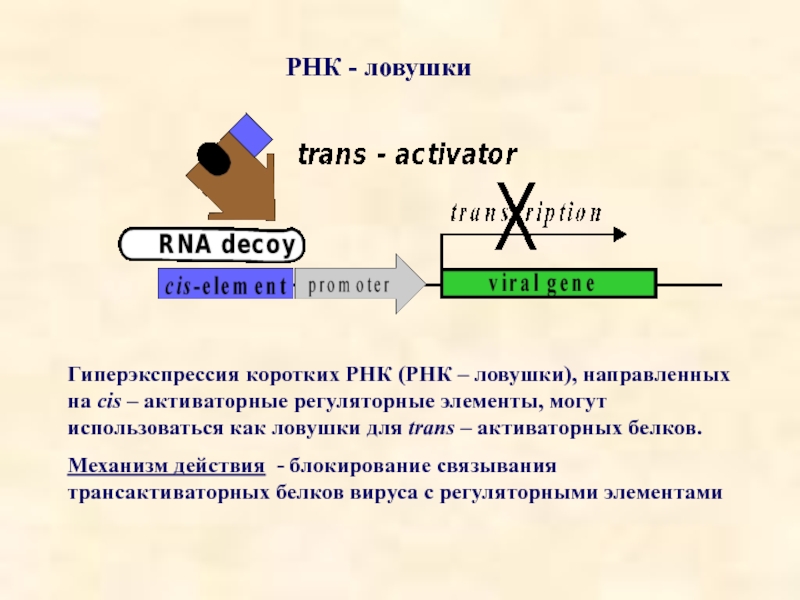
Слайд 18РНК - ловушки
Гиперэкспрессия коротких РНК (РНК – ловушки), направленных на cis
Механизм действия - блокирование связывания трансактиваторных белков вируса с регуляторными элементами
Слайд 19Белки – генотерапевтические агенты
Трансдоминантные негативные белки
Одноцепочечные антитела (intrabodies)
Суицидные гены
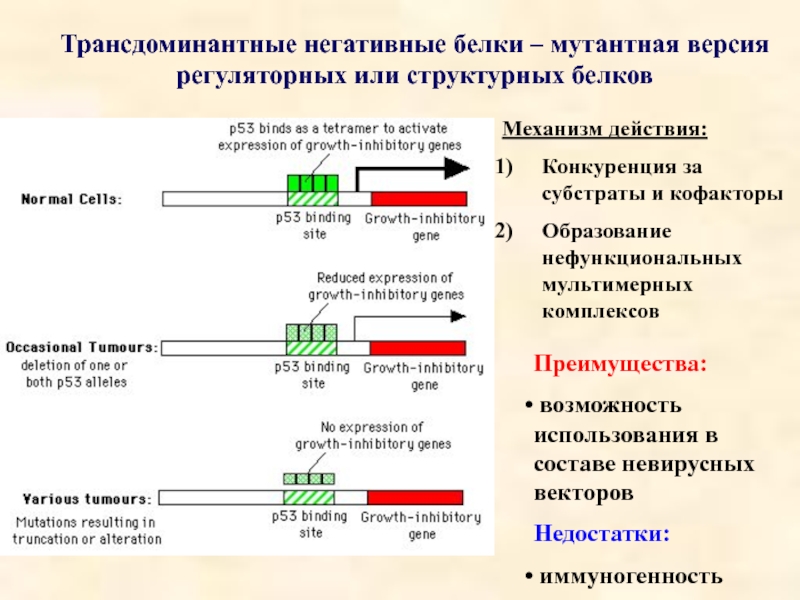
Слайд 20Трансдоминантные негативные белки – мутантная версия
регуляторных или структурных белков
Механизм действия:
Конкуренция
Образование нефункциональных мультимерных комплексов
Преимущества:
возможность использования в составе невирусных векторов
Недостатки:
иммуногенность
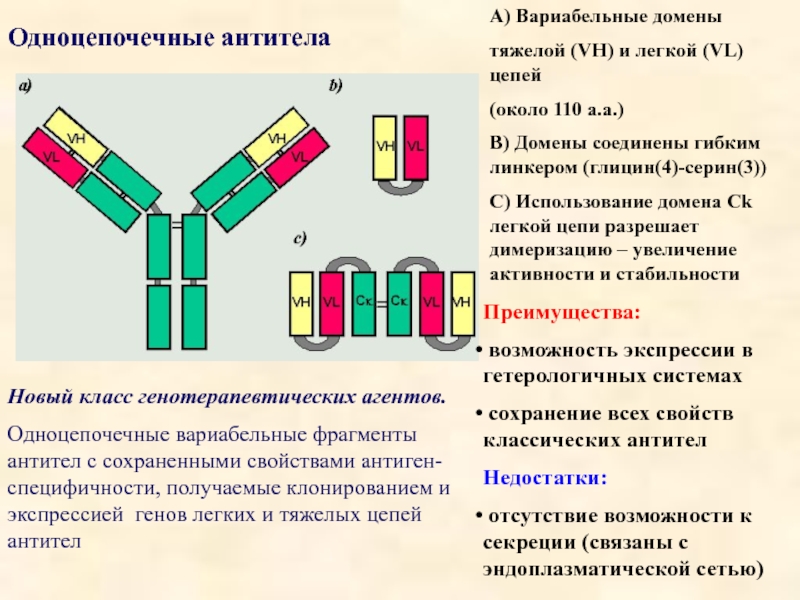
Слайд 21Одноцепочечные антитела
Новый класс генотерапевтических агентов.
Одноцепочечные вариабельные фрагменты антител с сохраненными
А) Вариабельные домены
тяжелой (VH) и легкой (VL) цепей
(около 110 а.а.)
B) Домены соединены гибким линкером (глицин(4)-серин(3))
C) Использование домена Ck легкой цепи разрешает димеризацию – увеличение активности и стабильности
Преимущества:
возможность экспрессии в гетерологичных системах
сохранение всех свойств классических антител
Недостатки:
отсутствие возможности к секреции (связаны с эндоплазматической сетью)
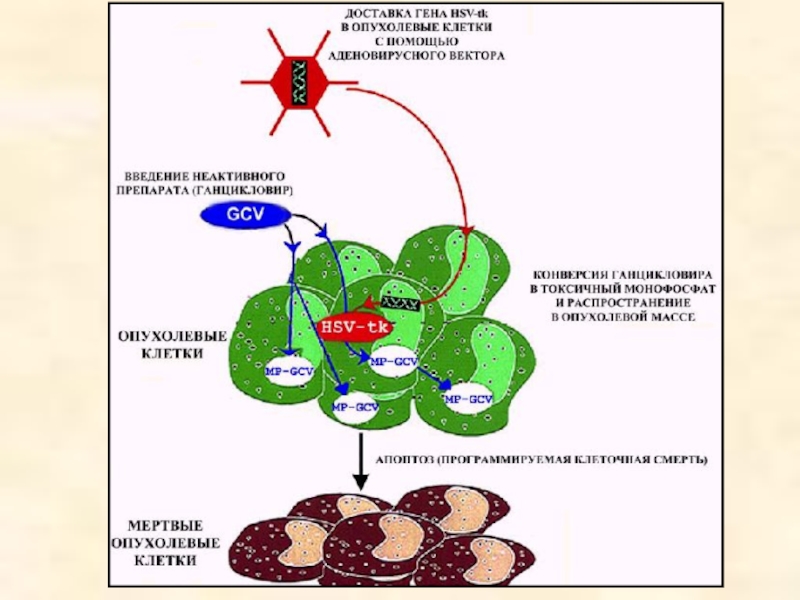
Слайд 22Суицидные гены
Вместо ингибирования (или компенсации) функции дефектного гена возможно использование суицидных
Примеры:
А-цепь дифтерийного токсина
ген цитозиндеаминазы
ген тимидинкиназы вируса простого герпеса (HSV tk)
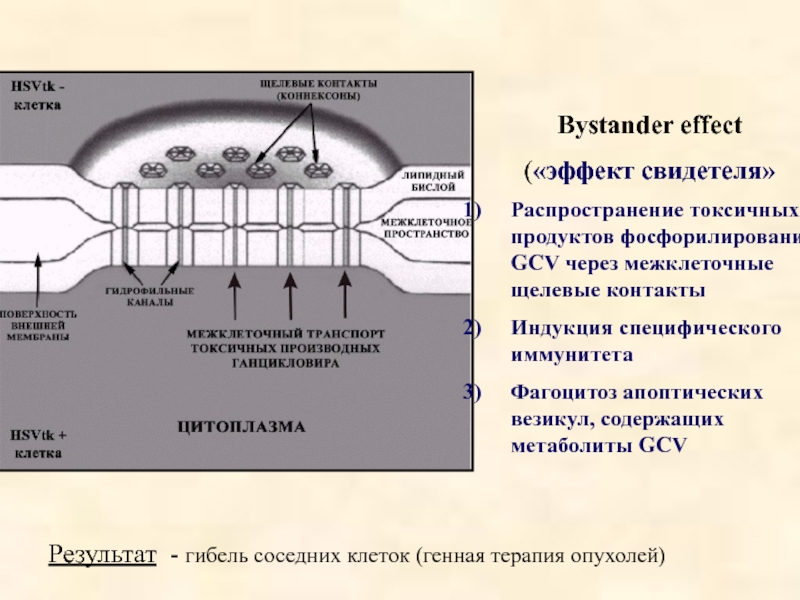
Слайд 24Bystander effect
(«эффект свидетеля»
Распространение токсичных продуктов фосфорилирования GCV через межклеточные щелевые контакты
Индукция
Фагоцитоз апоптических везикул, содержащих метаболиты GCV
Результат - гибель соседних клеток (генная терапия опухолей)
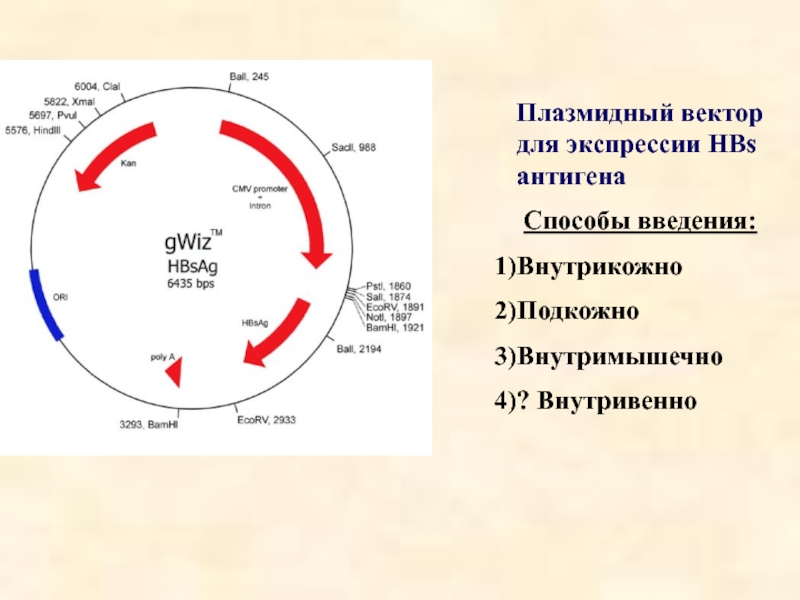
Слайд 26Плазмидный вектор для экспрессии HBs антигена
Способы введения:
Внутрикожно
Подкожно
Внутримышечно
? Внутривенно
Слайд 27Преимущества:
дешевизна производства
отсутствие иммуногенности (? Анти-ДНК антитела)
экспрессия продукта
индукция Т-клеточного иммунитета
Недостатки:
низкая эффективность доставки
низкая емкость векторов
высокая вероятность интеграции в геном клетки
Слайд 30Вирусные векторы:
ретровирусы
аденовирусы
аденоассоциированный вирус
герпесвирусы
лентивирусы
и др.
- достоинства:
тропизм
неспособность реплицироваться в клетке-хозяине
устойчивость к деградации лизосомами
- недостатки:
иммуногенность (аденовирусы, герпесвирусы)
потенциальная туморогенность (ретровирусы)
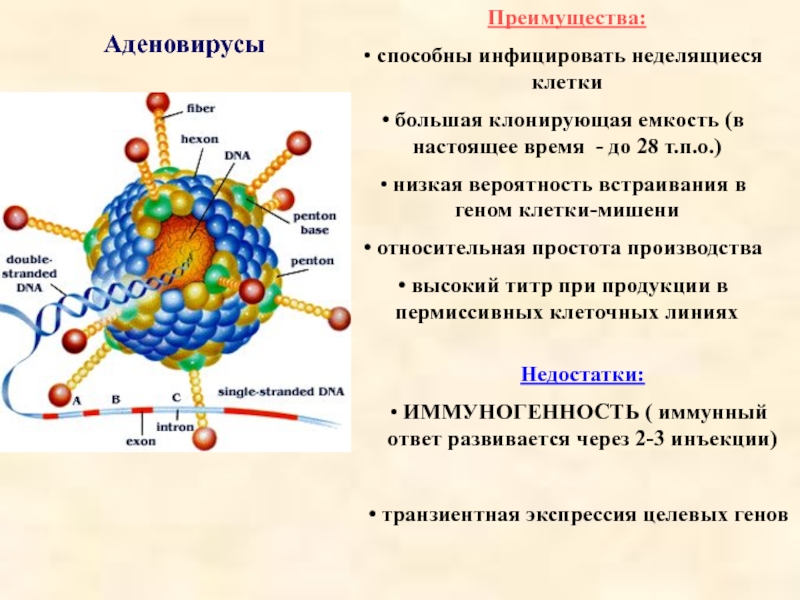
Слайд 31Аденовирусы
Преимущества:
способны инфицировать неделящиеся клетки
большая клонирующая емкость (в настоящее время
низкая вероятность встраивания в геном клетки-мишени
относительная простота производства
высокий титр при продукции в пермиссивных клеточных линиях
Недостатки:
ИММУНОГЕННОСТЬ ( иммунный ответ развивается через 2-3 инъекции)
транзиентная экспрессия целевых генов
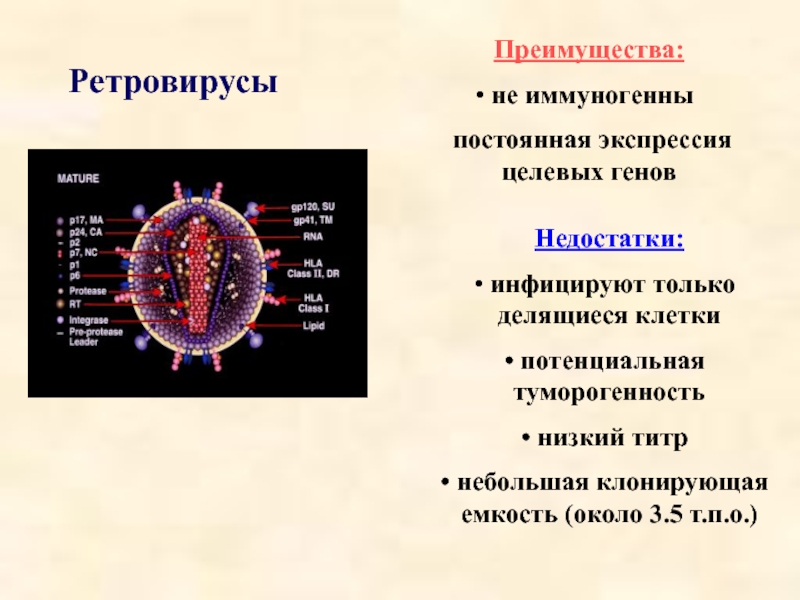
Слайд 33Ретровирусы
Преимущества:
не иммуногенны
постоянная экспрессия целевых генов
Недостатки:
инфицируют только делящиеся клетки
низкий титр
небольшая клонирующая емкость (около 3.5 т.п.о.)
Слайд 34Невирусные системы
прямая инъекция
рецепторо-опосредованный эндоцитоз
генное ружье
липофекция
электропорация
полимерные
Слайд 35Плазмидные векторы
- достоинства:
отсутствие токсичности и мутагенности
практически неограниченная емкость вектора
- недостатки:
трансфекция ограниченной популяции клеток
деградация ДНК лизосомами
отсутствие тропизма
( в настоящее время есть перспективные разработки)
Слайд 37Маркерные гены:
SEAP (secreted alkaline phosphatase)
β - galactosidase
G418 (neomycin)
Слайд 40Физические методы доставки рекомбинантных плазмидных векторов:
прямая инъекция «голого» гена в
электропорация
липофекция
кальций-фосфатная трансфекция
Невирусные системы доставки
Слайд 48Клинические испытания генотерапевтических препаратов.
I фаза. Оценка токсичности генной конструкции.
II
III фаза. Широкомасштабные мультицентровые клинические испытания.
Слайд 50 Зарегистрировано 636 клинических протоколов генной терапии
3496 пациента имеют в
63,4 % протоколов и 68,4 % пациентов - генная терапия злокачественных новообразований (цитокины и суицидные гены)
12,3 % и 8,8% - генная терапия моногенных наследственных болезней
6,4% и 11,7% - генная терапия инфекционных заболеваний
Слайд 51Из 636 генотерапевтических проектов:
420 проектов (66%) - I фаза клинических
134 проекта (21,1%) - между I и II фазами клинических испытаний
4 проекта (0,6%) - III фаза клинических испытаний
Слайд 60III фаза клинических испытаний
Генная терапия глиобластомы головного мозга.
После резекции в ложе
Через неделю больным вводится препарат ганцикловир, который после фосфорилирования in situ обрывает синтез ДНК в быстроделящихся клетках.
Genetic Therapy, Inc./Novartis
Слайд 61Реализуемые механизмы:
прямой эффект фосфорилированного ганцикловира
«bystander effect» - гибель соседних
локальное воспаление как результат введения мышиных клеток
системный иммунный ответ
Слайд 62Генная терапия остеосаркомы (ESCCHN)
(2 протокола)
Частота встречаемости - 40 000 случаев
Предпосылки - более 50% пациентов, имеют повышенный уровень экспрессии мутантной формы р53
Генотерапевтический агент - фактор супрессии опухоли (кДНК р53)
Вектор – аденовирус тип 5
Способ введения - прямая инъекция в опухоль
Увеличение выживаемости в 2 раза
Слайд 63Генная терапия метастатической меланомы
(иммунотерапия)
Генотерапевтический агент - HLA-B7/Beta-2 Microglobulin cDNA
Презентация антигенов MHC
Вектор - плазмидная ДНК в комплексе с катионными липосомами и DMRIE-DOPE
Способ введения – прямая инъекция в опухоль
31% пациентов не имели возврата опухоли в течение 6 лет
Слайд 64Первый трагический случай
Смерть в сентябре 1999 г. Джесси Гелзингера (США).
Страдал
Смерть наступила после третьей инъекции аденовирусного вектора последнего поколения, экспрессирующего ген ОКТ.
Вскрытие показало атрофию внутренних органов по механизму апоптоза.
Новое явление взаимодействия вирусного и человеческого генома?
Слайд 65ПРИМЕРЫ:
муковисцидоз (кистозный фиброз поджелудочной железы) - перенос гена МТР (муковисцидозный
мышечная дистрофия Дюшена - введение нормальных копий кДНК гена дистрофина с помощью ретровирусных векторов.
рестеноз (повторное сужение просвета артерии после ангиопластики) - введение в сосуд гена сосудистого эндотелиального фактора роста (VEGF) в виде плазмидной ДНК.
Слайд 71Новые подходы к коррекции генных дефектов:
Химеропластика (коррекция ДНК в клетке)
Химеропласты
В ядре клетки происходит гомологичная рекомбинация с исправлением дефекта последовательности.
Успешная конверсия в 25-40% клеток.
Слайд 72Выводы:
Генная терапия пригодна для лечения широкого спектра заболеваний.
Генная терапия имеет низкий
Эффективность генной терапии на сегодняшний день близка к нулю.
Слайд 73вопросы
Сможет ли генная терапия в будущем обеспечить полноценную генокоррекцию, которая не
В какой мере полезность и необходимость генотерапевтической процедуры для индивидуума перевесят риск такого вмешательства для всего человечества?
Сколь оправданы будут эти процедуры на фоне грядущего перенаселения планеты?
Как будут соотноситься генно-инженерные мероприятия на человеке с проблемами гомеостаза общества и биосферы?
Слайд 75Генная терапия человека
На людях технология генной инженерии была впервые применена для
Слайд 76Работающая копия гена ADA была введена в клетки крови Ашанти с
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения заболеваний. Сегодня мы знаем, что с помощью генной терапии можно лечить диабет, анемию, некоторые виды рака, болезнь Хантингтона и даже очищать артерии. Сейчас идёт более 500 клинических испытаний различных видов генной терапии.
Слайд 77В настоящее время известно 4000 наследственных заболеваний, для большинства из которых
Сегодня существует возможность диагностировать многие генетические заболевания ещё на стадии эмбриона или зародыша. Скоро станет возможным исправлять и оптимизировать генотип будущего ребёнка.
Свершения генной инженерии как в познании механизмов функционирования организмов, так и в прикладном плане весьма внушительны, а перспективы поистине фантастичны.
Слайд 78Неблагоприятная экологическая обстановка и целый ряд других подобных причин приводят к
Сегодня существует возможность диагностировать многие генетические заболевания ещё на стадии эмбриона или зародыша. Пока можно только прекратить беременность на самой ранней стадии в случае серьёзных генетических дефектов, но скоро станет возможным исправлять и оптимизировать генотип будущего ребёнка. Это позволит полностью избежать генетических болезней и улучшить физические, психические и умственные характеристики детей.
Сегодня мы можем отметить, что за тридцать лет своего существования генная инженерия не причинила никакого вреда самим исследователям, не принесла ущерба ни природе, ни человеку. Свершения генной инженерии как в познании механизмов функционирования организмов, так и в прикладном плане весьма внушительны, а перспективы поистине фантастичны.
Слайд 79Генно-инженерный метод лечения диабета
Канадские исследователи идентифицировали белок, ингибирующий выработку инсулина
Слайд 80Одна из самых больших загадок диабета – причина, по которой специализированные
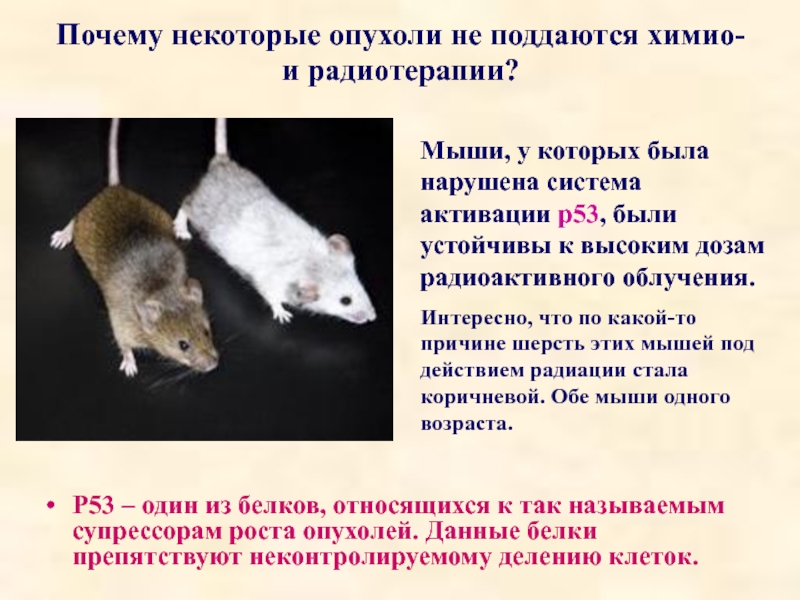
Слайд 81Почему некоторые опухоли не поддаются химио- и радиотерапии?
Р53 – один
Мыши, у которых была нарушена система активации р53, были устойчивы к высоким дозам радиоактивного облучения.
Интересно, что по какой-то причине шерсть этих мышей под действием радиации стала коричневой. Обе мыши одного возраста.
Слайд 82 Р53 – белок, вызывающий апоптоз (физиологическую гибель) аномальных быстро делящихся клеток.
В норме существует по крайней мере два негативных регулятора активности р53 – это белки Mdm2 и Mdmx, которые сдерживают р53, не позволяя ему вызывать гибель здоровых клеток. Однако даже небольшое повышение концентрации в клетке белка Mdmx приводит к полной инактивации р53, в результате чего опухолевые клетки не гибнут и становятся устойчивыми к любым повреждающим воздействиям.
В эксперименте на мышах исследователи показали, что инактивация р53 приводит к тому, что у животных начинают развиваться агрессивные лимфомы, не поддающиеся воздействию химиотерапии.
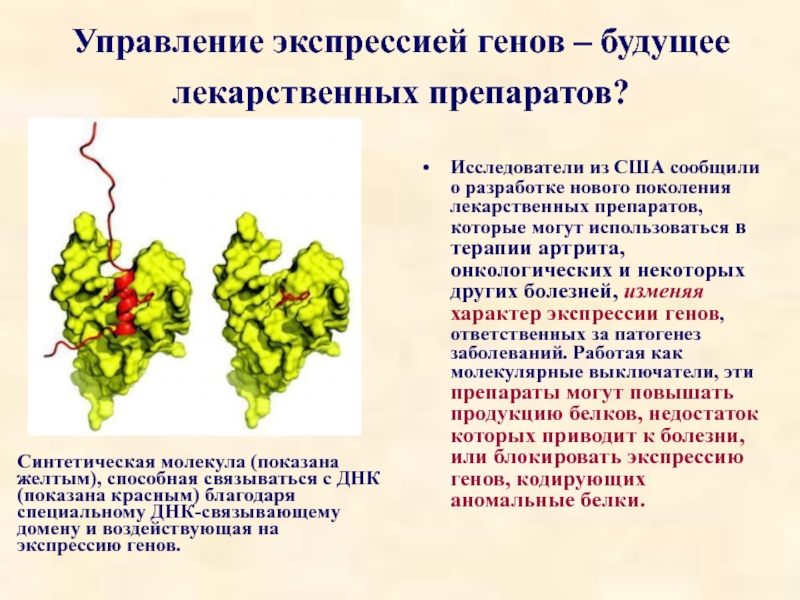
Слайд 83Управление экспрессией генов – будущее лекарственных препаратов?
Исследователи из США сообщили
Синтетическая молекула (показана желтым), способная связываться с ДНК (показана красным) благодаря специальному ДНК-связывающему домену и воздействующая на экспрессию генов.
Слайд 84В своих экспериментах профессор Анна К. Мапп и ее коллеги сосредоточились
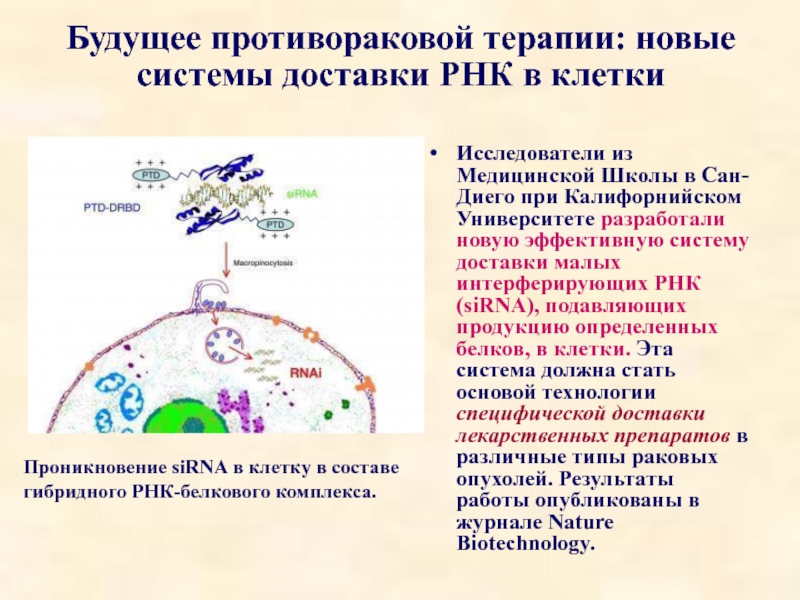
Слайд 85Будущее противораковой терапии: новые системы доставки РНК в клетки
Исследователи из
Проникновение siRNA в клетку в составе гибридного РНК-белкового комплекса.
Слайд 86«Малые интерферирующие РНК, осуществляющие процесс так называемой РНК-интерференции, обладают невероятным потенциалом
Слайд 87Как довести рак до самоубийства?
Специалисты из Казанского государственного университетаСпециалисты из
Исследователи считают, что необходимо как можно быстрее расширить банк «противоопухолевых ферментов». Причем бактериальные рибонуклеазы, три из которых они как раз и протестировали, удобнее в использовании, чем ферменты млекопитающих, так как способны действовать в присутствии других препаратов, и к тому же дешевле.
Слайд 88Обезьян вылечили от дальтонизма при помощи генной терапии
Самцы беличьей обезьяны Saimiri
Образцы картинок, на которых обезьяны должны были найти цветное пятно.