- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Вуглеводи. Класифікація вуглеводів презентация
Содержание
- 1. Вуглеводи. Класифікація вуглеводів
- 2. КЛАСИФІКАЦІЯ ВУГЛЕВОДІВ Вуглеводи діляться на дві
- 3. У природі найбільш поширені два види моноз:
- 4. Генетичний ряд альдоз D-ряду
- 5. Велике значення в природі мають D-глюкоза і
- 6. В молекулі глюкози є 4 асимметричних атоми
- 7. В молекулах як глюкози, та і фруктози
- 8. Причиною такої аномальної поведінки цих сполук є
- 11. Таким чином, циклічна і відкрита форми є
- 12. Утворений при циклізації напівацетальний гідроксил і є
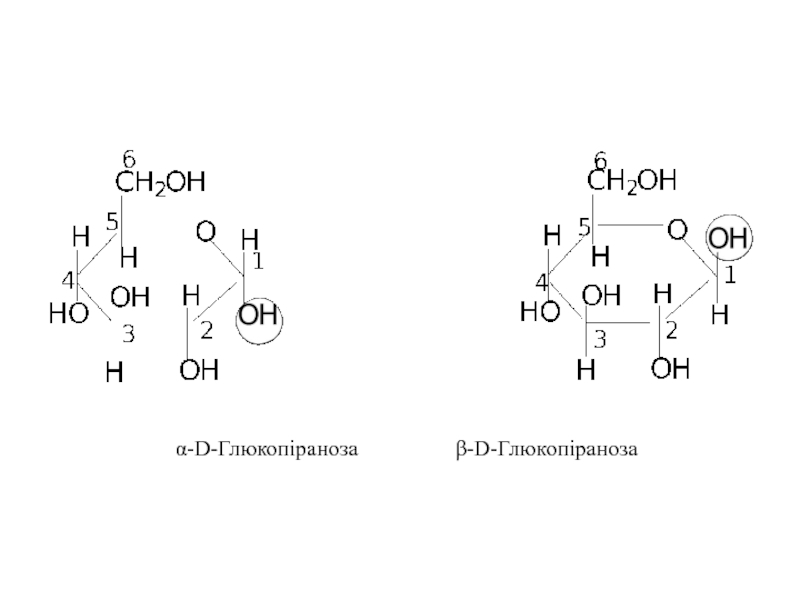
- 13. Просторову будову моносахаридів у циклічній формі зручно
- 14. α-D-Глюкопіраноза β-D-Глюкопіраноза
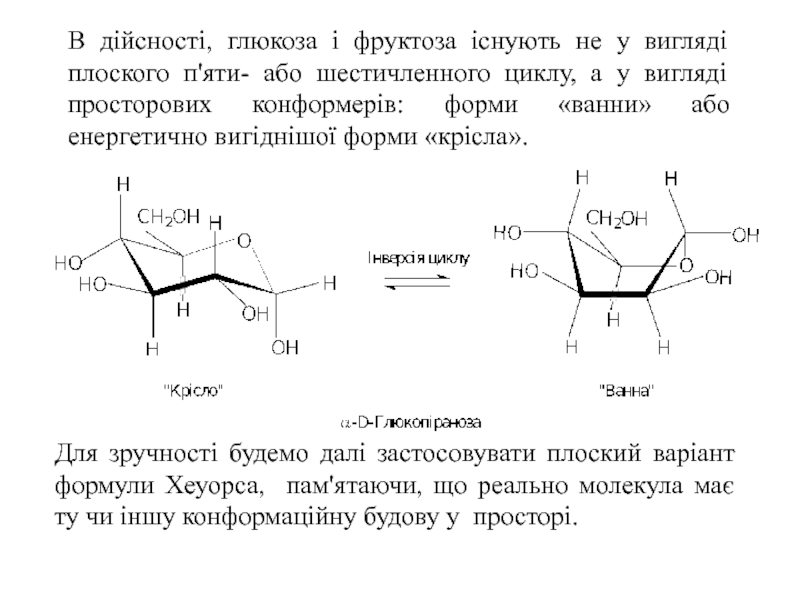
- 15. В дійсності, глюкоза і фруктоза існують не
- 16. Утворені напівацеталі можуть мати α- і β-форми,
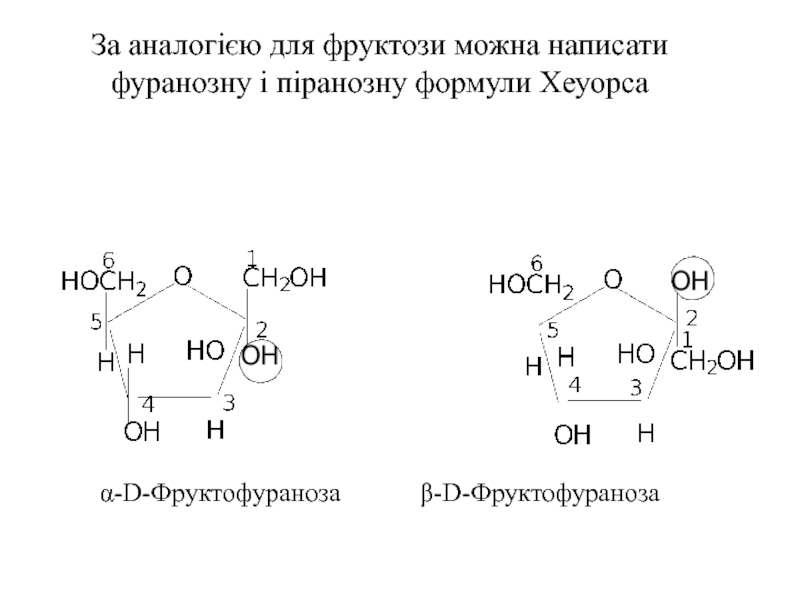
- 17. За аналогією для фруктози можна написати фуранозну
- 18. Для напівацетальних форм альдогексоз, число ізомерів зростає
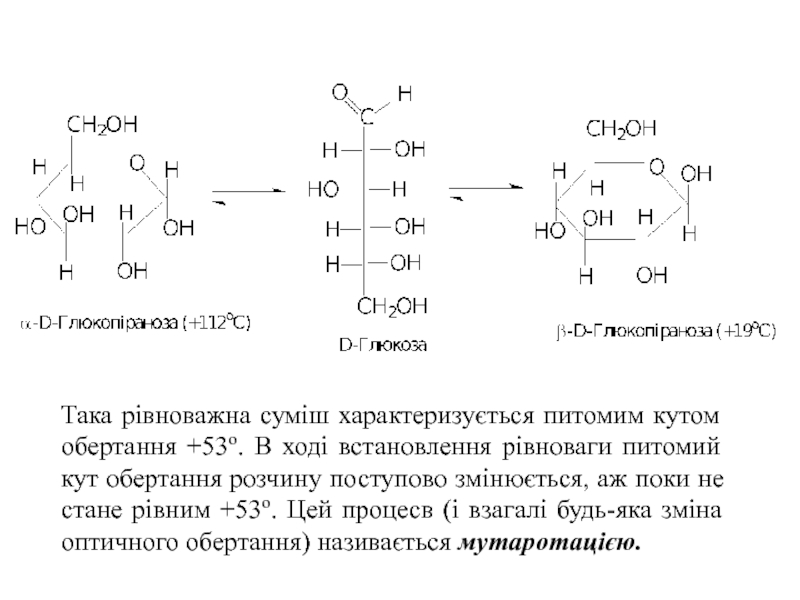
- 19. Така рівноважна суміш характеризується питомим кутом обертання
- 20. ОДЕРЖАННЯ МОНОСАХАРИДІВ Гідроліз дисахаридів і полісахаридів
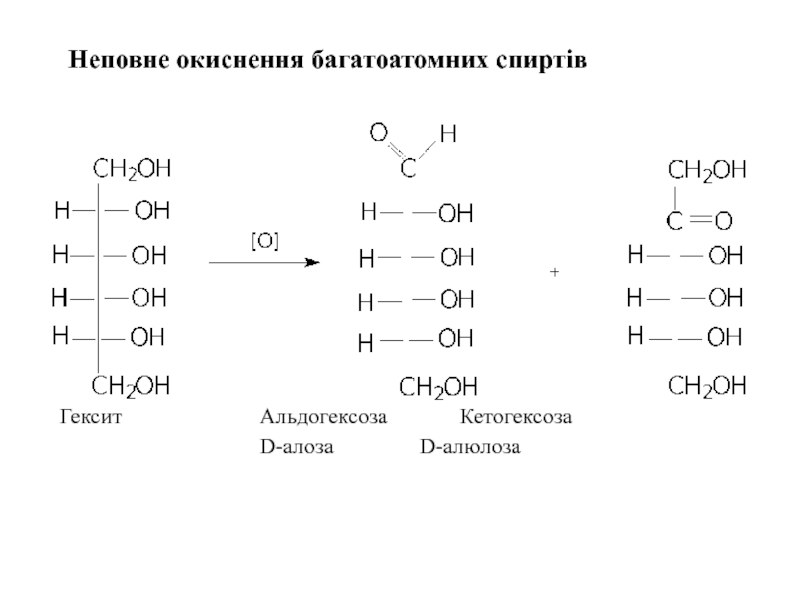
- 21. Неповне окиснення багатоатомних спиртів
- 22. Оксинітрильний (ціангідринний) синтез Г.Кіліані-Е.Фішера. Даним методом вдається збільшувати довжину вуглецевого ланцюга монози.
- 23. Фотосинтез. В природі моносахариди утворюються внаслідок фотосинтезу в зелених рослинах
- 24. ХІМІЧНІ ВЛАСТИВОСТІ Моносахариди виявляють властивості спиртів,
- 25. 2. Окиснення Залежно від характеру окиснювача
- 26. При дії сильніших окисників, наприклад, конц. HNO3
- 27. 3. Дія лугів на моносахариди
- 29. 4. Реакції алкілування одержання (повних і неповних
- 30. При взаємодії з більш активними алкілюючими агентами
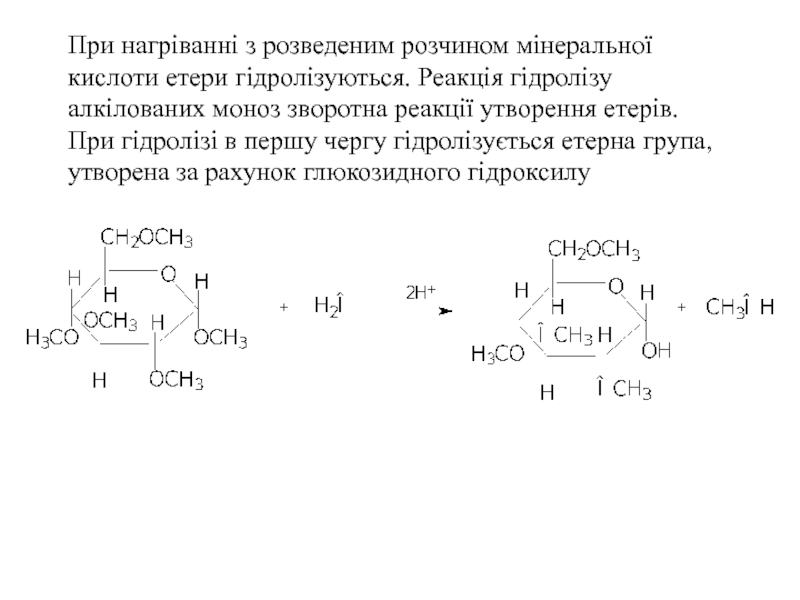
- 31. При нагріванні з розведеним розчином
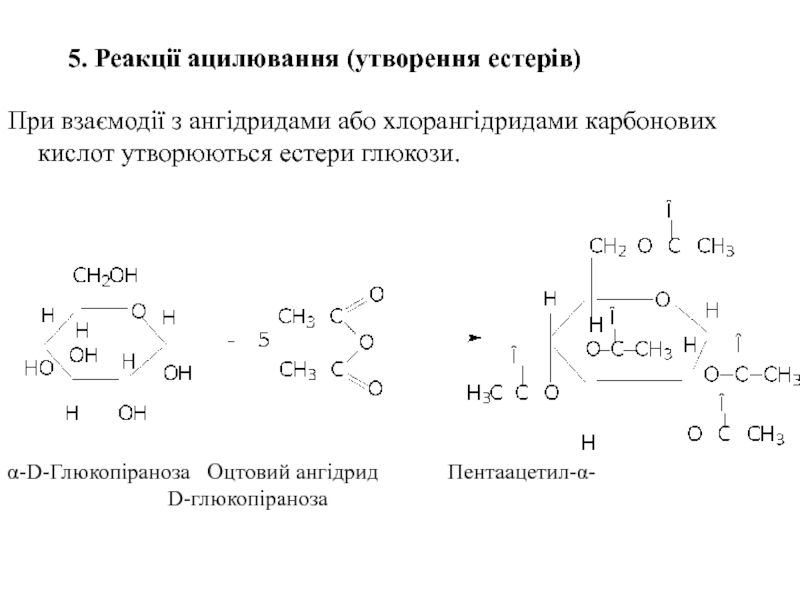
- 32. 5. Реакції ацилювання (утворення естерів) При
- 33. 6. Бродіння 6.1. Спиртове. Для деяких
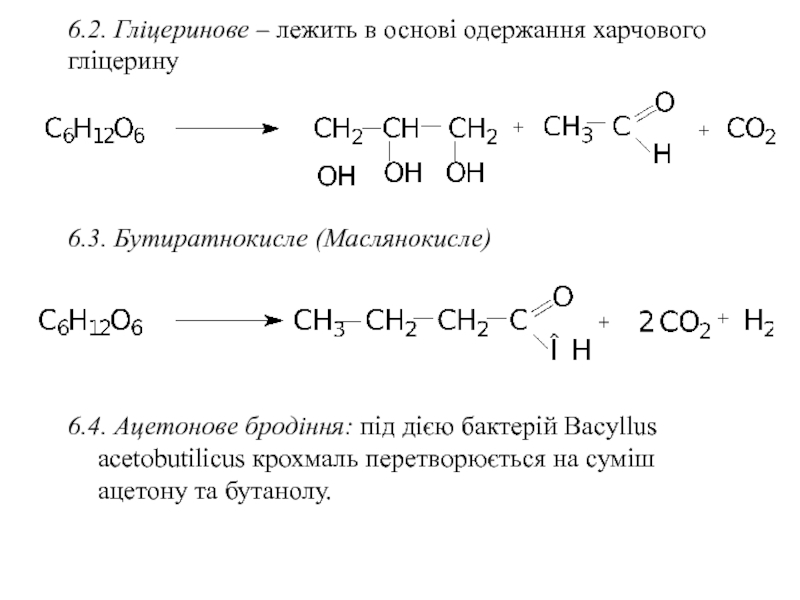
- 34. 6.2. Гліцеринове – лежить в основі одержання
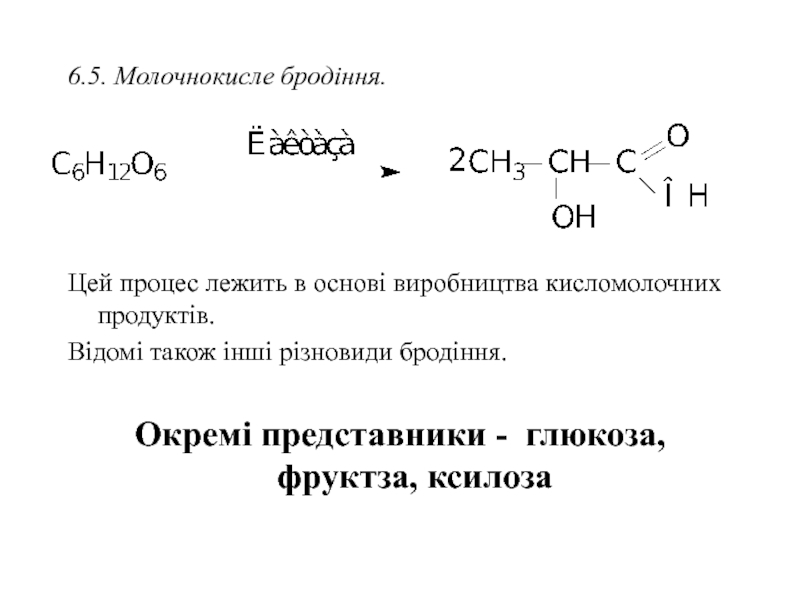
- 35. 6.5. Молочнокисле бродіння.
- 36. ДИСАХАРИДИ Сполуки, що складаються з
- 37. Молекула дисахариду може приєднувати молекулу води з
- 38. Дисахариди бувають відновлюючі і невідновлюючі.
- 39. Відновлюючі дисахариди Мальтоза (солодовий цукор) Глікозидний зв’язок
- 41. Целобіоза Целобіоза відрізняється від мальтози наявністю
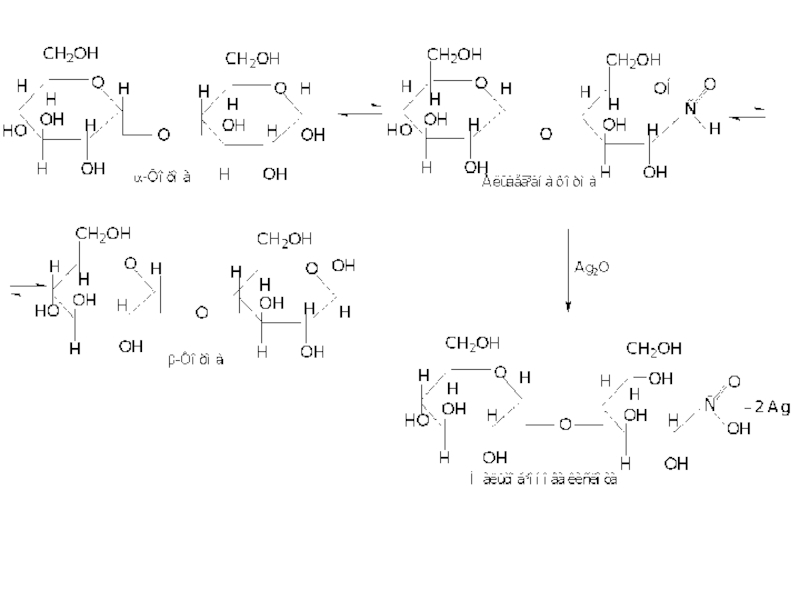
- 42. Невідновлюючі дисахариди Цукроза Цукроза є харчовим
- 43. Цукроза характеризується правим обертанням з питомим кутом
- 44. ПОЛІСАХАРИДИ Полісахариди - високомолекулярні нецукроподібні вуглеводи.
- 45. Крохмаль Міститься у зернах рослин, у
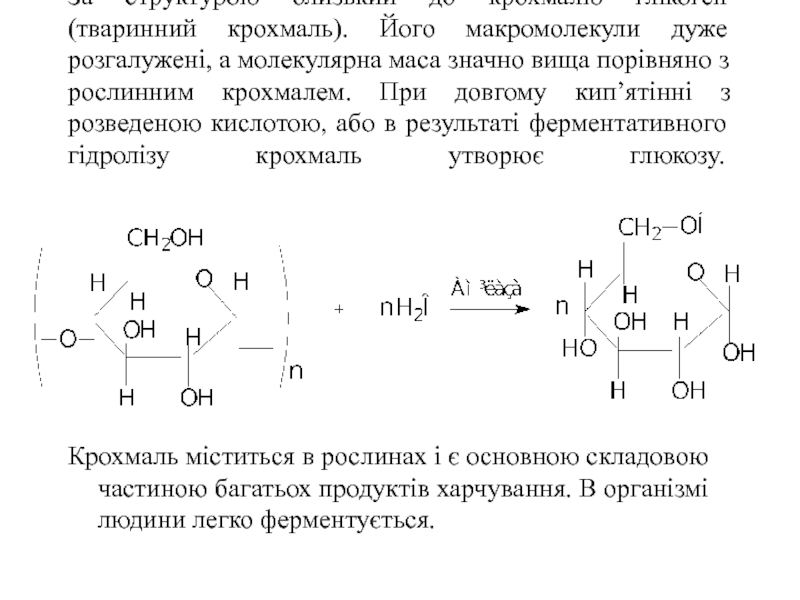
- 48. За структурою близький до крохмалю глікоген (тваринний
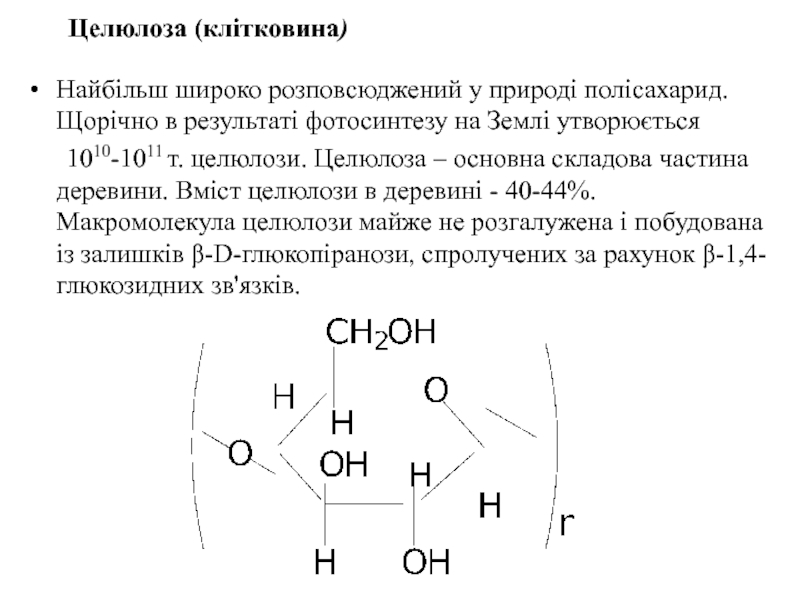
- 49. Целюлоза (клітковина) Найбільш широко розповсюджений у
- 50. Молекулярна маса целюлози 21000-50000. Особливості будови
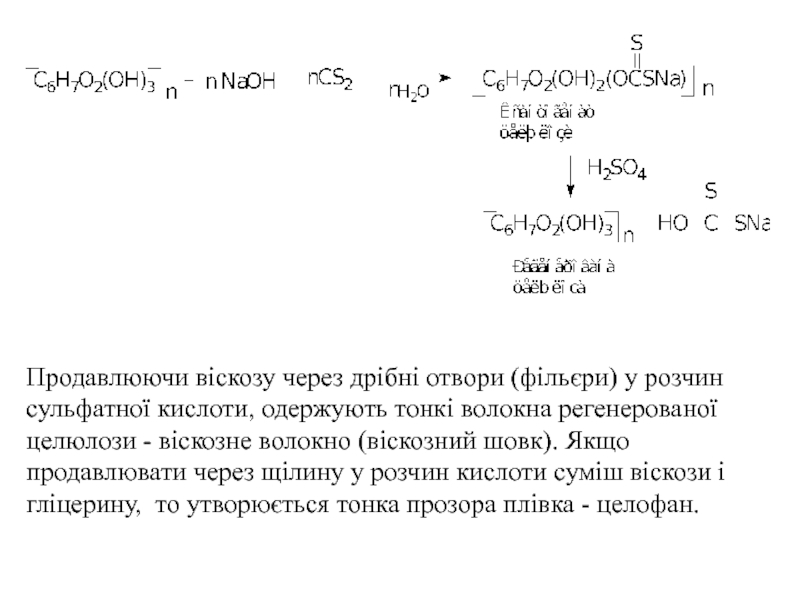
- 51. 1. Одержання віскозного волокна При обробці
- 52. 2. Нітрування Целюлоза нітрується конц. НNO3.
- 53. 3. Ацилювання Гідроксильні групи целюлози здатні
- 54. 4. Алкілування Целюлоза алкілується алкілгалогенідами або
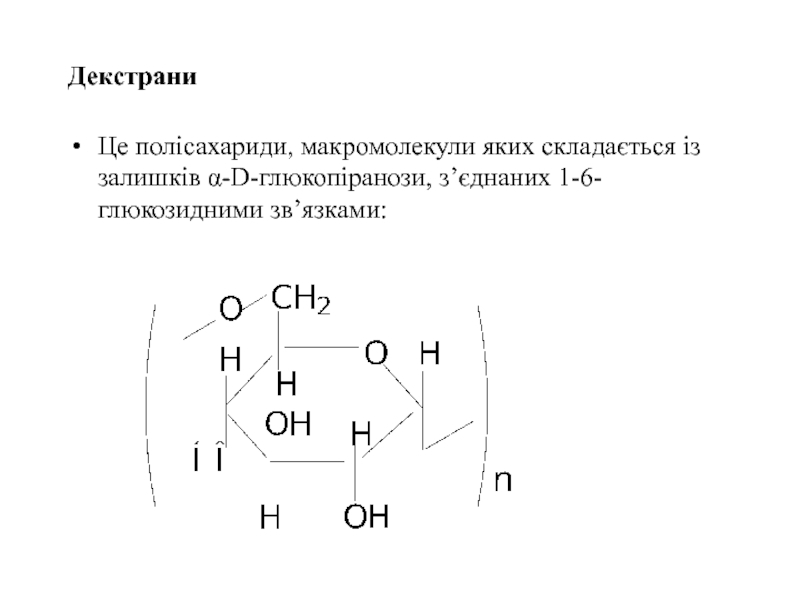
- 55. Декстрани Це полісахариди, макромолекули яких
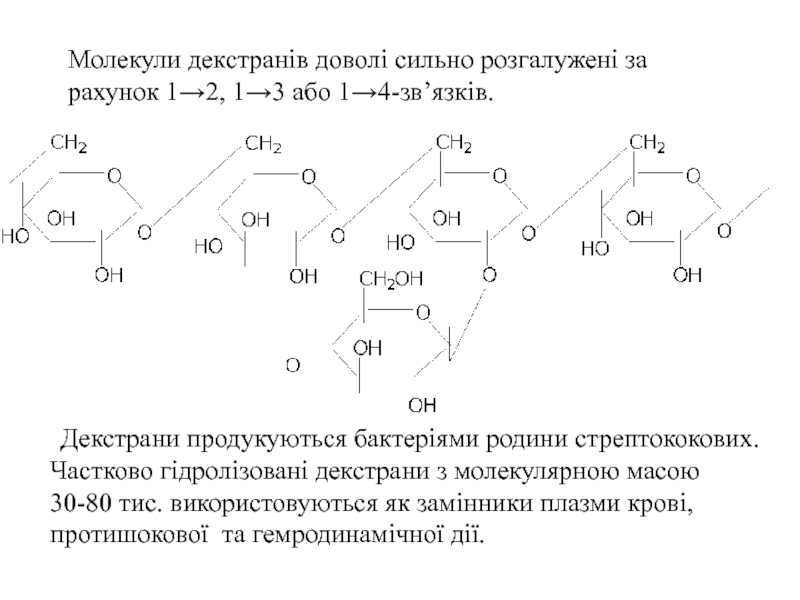
- 56. Молекули декстранів доволі сильно розгалужені за рахунок
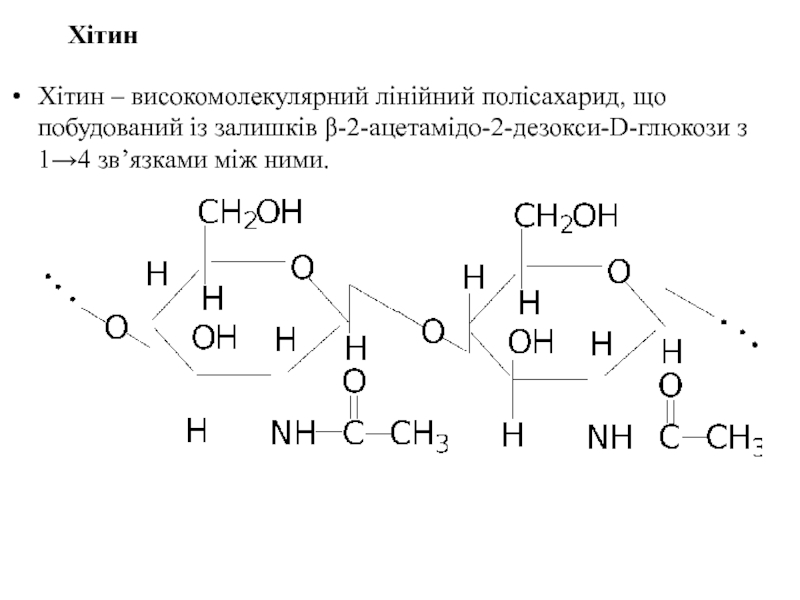
- 57. Хітин Хітин – високомолекулярний лінійний полісахарид,
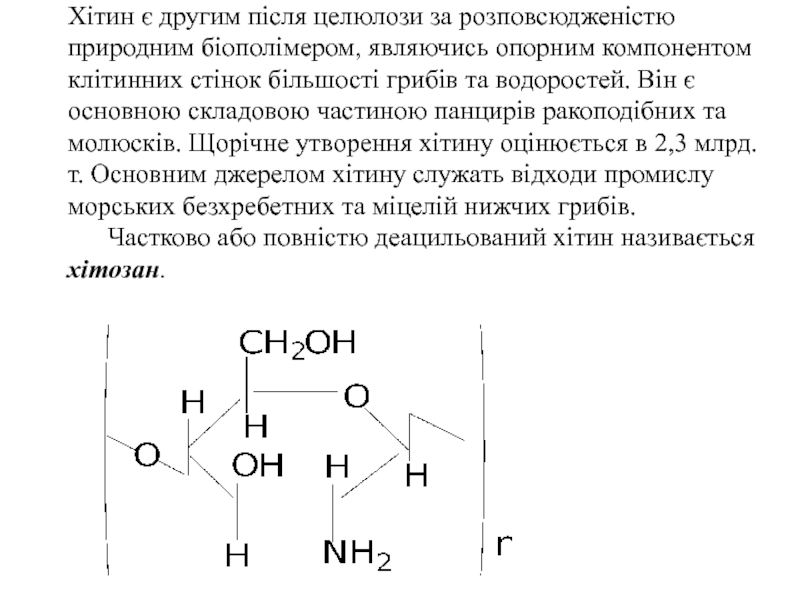
- 58. Хітин є другим після целюлози за розповсюдженістю
- 59. Продавлюючи віскозу через дрібні отвори (фільєри) у
Слайд 1ВУГЛЕВОДИ
Вуглеводами називаються сполуки з загальною формулою Сn(Н2О)m, з чим і
Слайд 2КЛАСИФІКАЦІЯ ВУГЛЕВОДІВ
Вуглеводи діляться на дві великі групи:
1 - Моносахариди (монози));
2 -
Моносахариди, у свою чергу класифікують за кількістю атомів вуглецю у молекулі – триози, тетрози, пентози, гексози, або за природою функціональних груп (альдози та кетози). Альдози містять альдегідну та гідросильні, а кетози – кетонну та гідроксильні функціональні групи.
Полісахариди, в свою чергу, бувають: цукроподібні або олігосахариди (дисахариди, трисахариди, пентасахариди тощо) і нецукроподібні (крохмаль, целюлоза, декстрани).
Слайд 3У природі найбільш поширені два види моноз: пентози С5Н10О5 та гексози
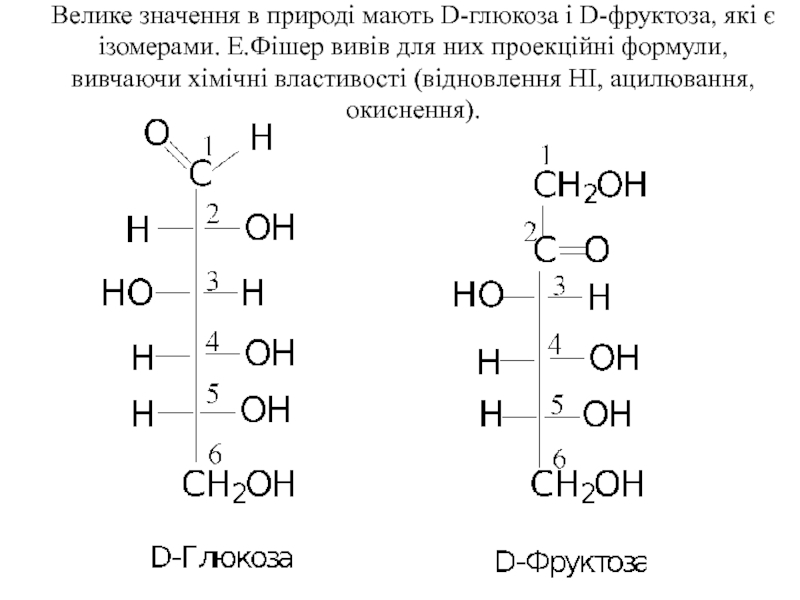
Слайд 5Велике значення в природі мають D-глюкоза і D-фруктоза, які є ізомерами.
Слайд 6В молекулі глюкози є 4 асимметричних атоми вуглецю, тому вона має
Слайд 7В молекулах як глюкози, та і фруктози є по 5 гідроксильних
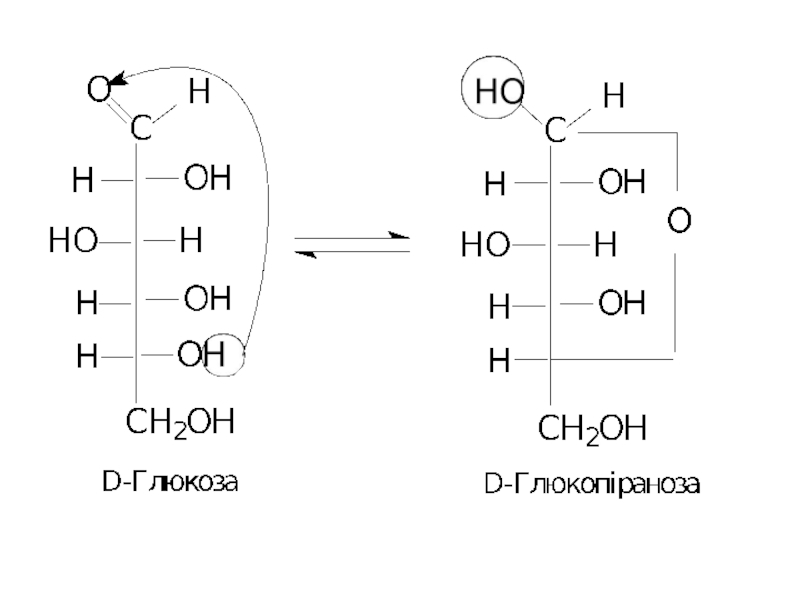
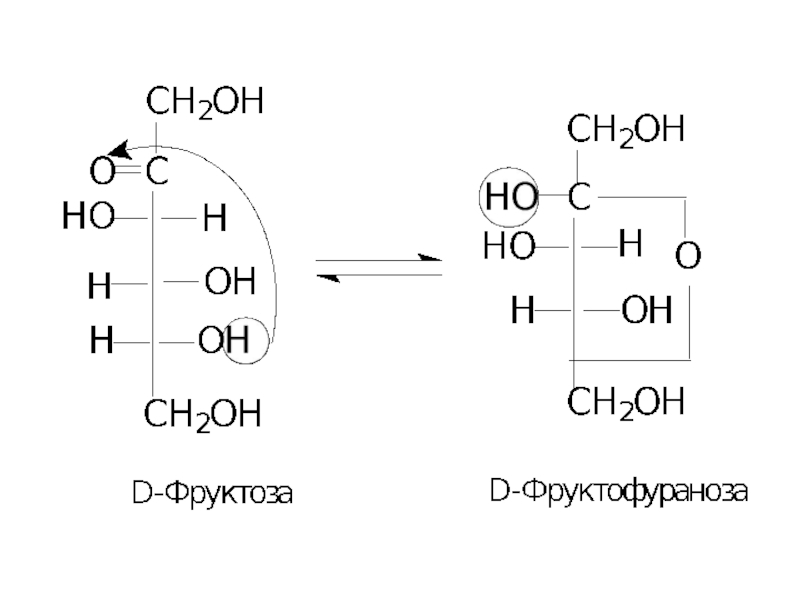
Слайд 8Причиною такої аномальної поведінки цих сполук є утворення циклічних або напівацетальних
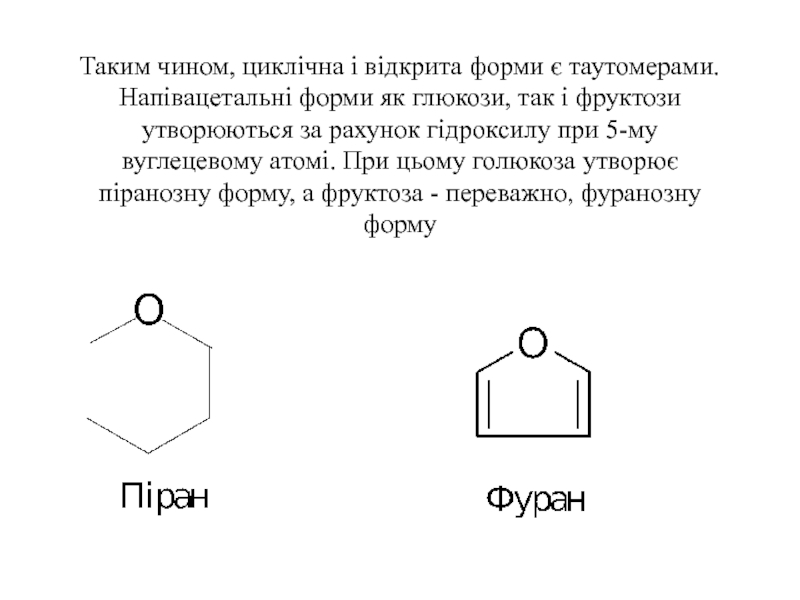
Слайд 11Таким чином, циклічна і відкрита форми є таутомерами. Напівацетальні форми як
Слайд 12Утворений при циклізації напівацетальний гідроксил і є тим, що відрізняється за
Слайд 13Просторову будову моносахаридів у циклічній формі зручно зображати перспективними формулами У.Хеуорса
Слайд 15В дійсності, глюкоза і фруктоза існують не у вигляді плоского п'яти-
Для зручності будемо далі застосовувати плоский варіант формули Хеуорса, пам'ятаючи, що реально молекула має ту чи іншу конформаційну будову у просторі.
Слайд 16Утворені напівацеталі можуть мати α- і β-форми, які відрізняються положенням напівацтального
Слайд 17За аналогією для фруктози можна написати фуранозну і піранозну формули Хеуорса
α-D-Фруктофураноза β-D-Фруктофураноза
Слайд 18Для напівацетальних форм альдогексоз, число ізомерів зростає у два рази до
Слайд 19Така рівноважна суміш характеризується питомим кутом обертання +53о. В ході встановлення
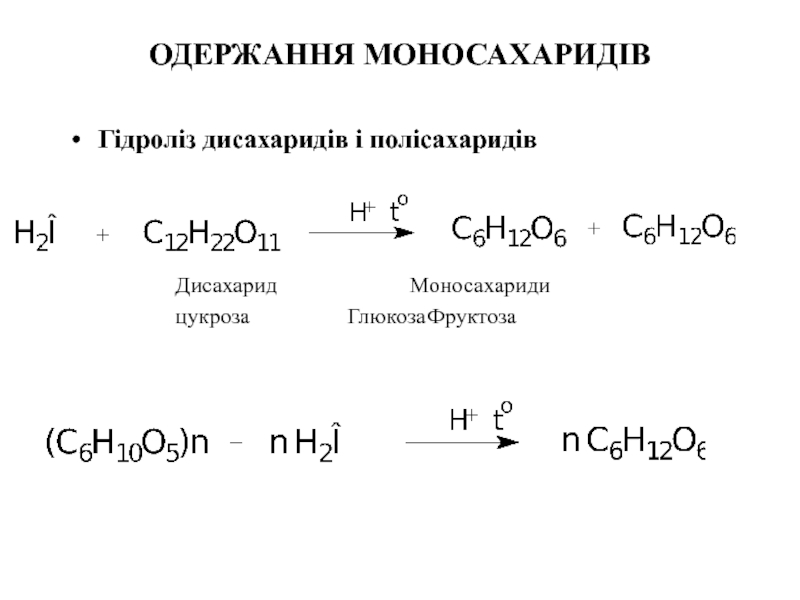
Слайд 20ОДЕРЖАННЯ МОНОСАХАРИДІВ
Гідроліз дисахаридів і полісахаридів
Дисахарид Моносахариди
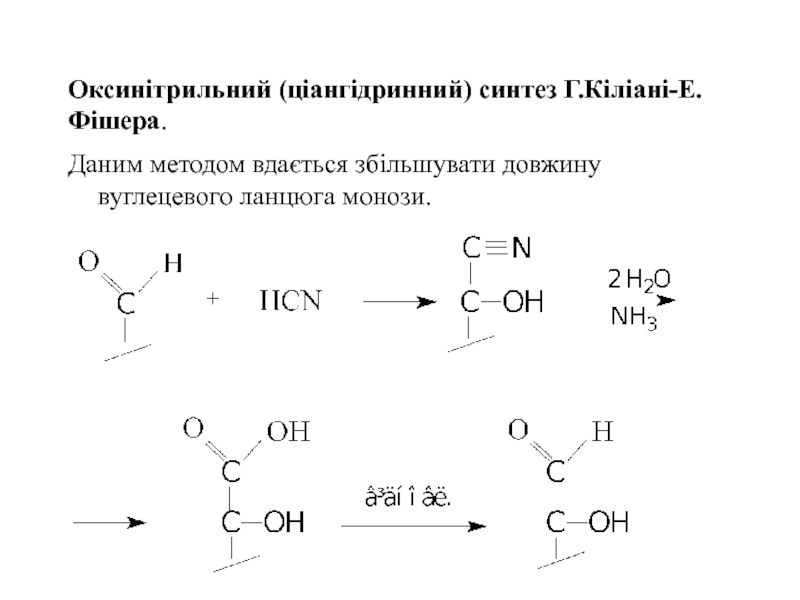
Слайд 22Оксинітрильний (ціангідринний) синтез Г.Кіліані-Е.Фішера.
Даним методом вдається збільшувати довжину вуглецевого ланцюга монози.
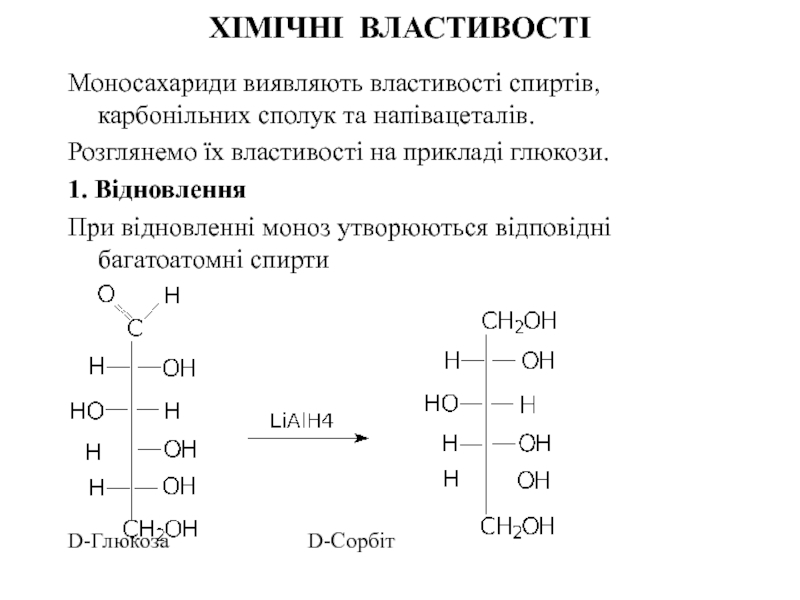
Слайд 24ХІМІЧНІ ВЛАСТИВОСТІ
Моносахариди виявляють властивості спиртів, карбонільних сполук та напівацеталів.
Розглянемо їх властивості
1. Відновлення
При відновленні моноз утворюються відповідні багатоатомні спирти
D-Глюкоза D-Сорбіт
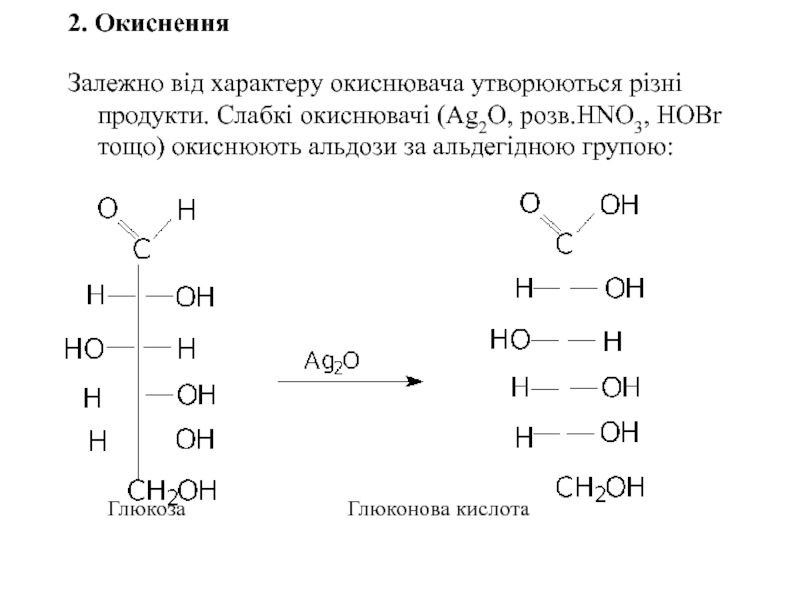
Слайд 252. Окиснення
Залежно від характеру окиснювача утворюються різні продукти. Слабкі окиснювачі (Ag2O,
Глюкоза Глюконова кислота
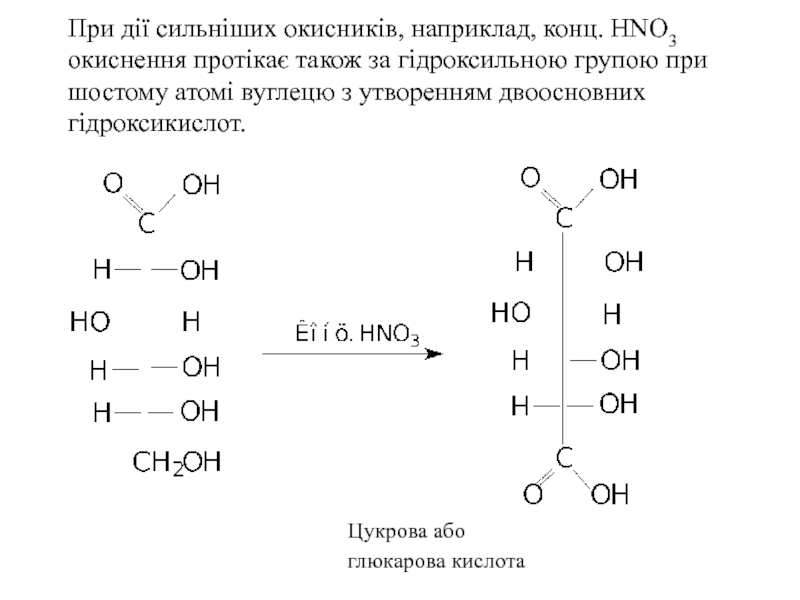
Слайд 26При дії сильніших окисників, наприклад, конц. HNO3 окиснення протікає також за
Цукрова або
глюкарова кислота
Слайд 27
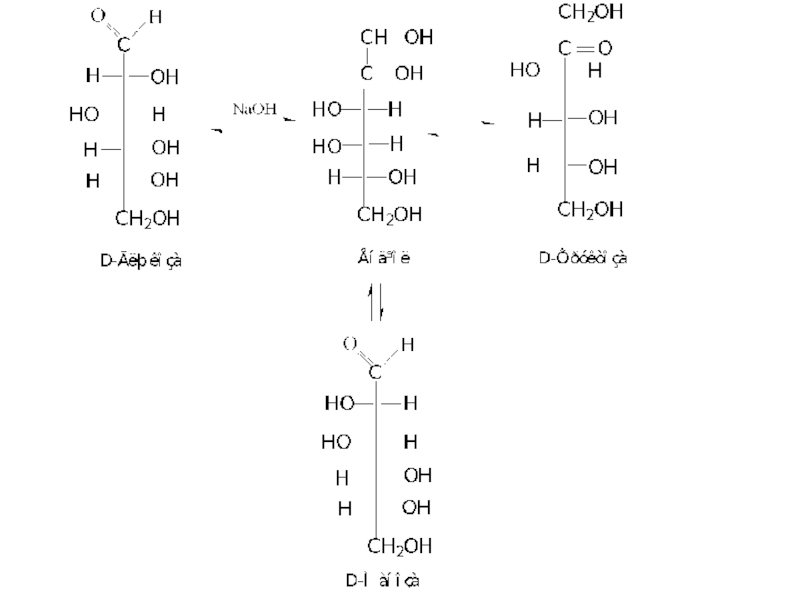
3. Дія лугів на моносахариди
Луги за нормальних умов викликають ізомерні перетворення
Нагадаємо, що епімерами називаються вуглеводи, що відрізняються когфігурацією лише одного асиметричного атома вуглецю.
Слайд 294. Реакції алкілування одержання (повних і неповних етерів)
Легко алкілується глікозидна НО-група
α-D-Глюкопіраноза О-Метил- α-D- глюкопіраноза
Одержана сполука відноситься до глікозидів. Глікозидами називаються похідні моносахаридів, у молекулах яких атоми водню глікозидного гідроксилу заміщено якимось замісником. Цей замісник називається агліконом. В даному випадку агліконом являється метил (СН3). Глікозиди досить поширені у природі. Під дією кислот або ферментів вони легко гідролізуються до вихідного моносахариду.
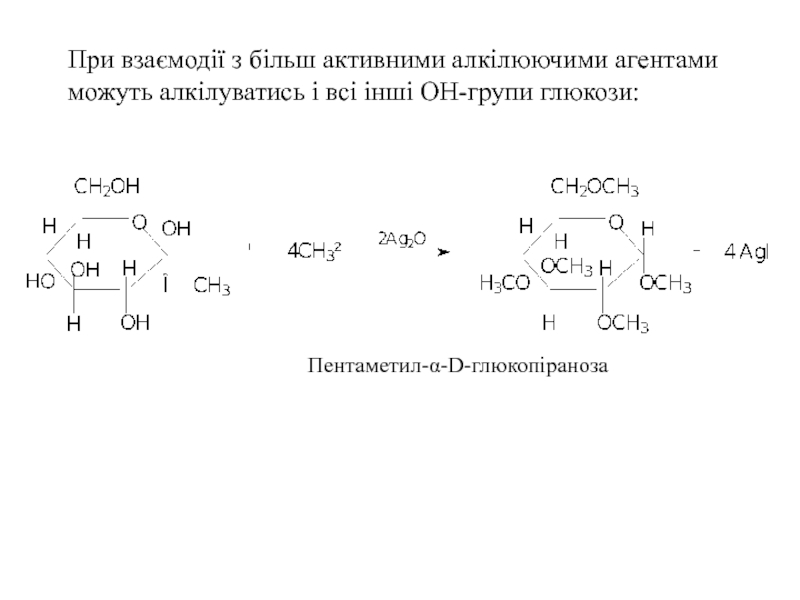
Слайд 30При взаємодії з більш активними алкілюючими агентами можуть алкілуватись і всі
Пентаметил-α-D-глюкопіраноза
Слайд 31 При нагріванні з розведеним розчином мінеральної кислоти етери гідролізуються. Реакція гідролізу
Слайд 325. Реакції ацилювання (утворення естерів)
При взаємодії з ангідридами або хлорангідридами карбонових
α-D-Глюкопіраноза Оцтовий ангідрид Пентаацетил-α- D-глюкопіраноза
Слайд 336. Бродіння
6.1. Спиртове. Для деяких гексоз характерне розщеплення молекул до спирту
Причому, етиловий спирт під дією ферментів утворюється лише з D-глюкози, D-фруктози та D-манози.
Слайд 346.2. Гліцеринове – лежить в основі одержання харчового гліцерину
6.3. Бутиратнокисле (Маслянокисле)
6.4.
Слайд 356.5. Молочнокисле бродіння.
Цей процес лежить в основі виробництва кисломолочних продуктів.
Відомі також
Окремі представники - глюкоза, фруктза, ксилоза
Слайд 36ДИСАХАРИДИ
Сполуки, що складаються з двох залишків моносахаридів, з'єднаних між собою
Глікозидний зв’язок утворюється за рахунок відщеплення молекули води від двох молекул моносахаридів, причому в утворенні цього зв’язку обов’язково приймає участь хоча б один глікозидний гідроксил, наприклад:
Слайд 37Молекула дисахариду може приєднувати молекулу води з утворенням двох молекул моносахариду.
За
Слайд 38Дисахариди бувають відновлюючі і невідновлюючі.
Якщо для утворення глікозидного зв’язку використовується
До них відноситься цукроза, трегалоза тощо.
Слайд 39Відновлюючі дисахариди
Мальтоза (солодовий цукор)
Глікозидний зв’язок в молекулі мальтози утворюється за участю
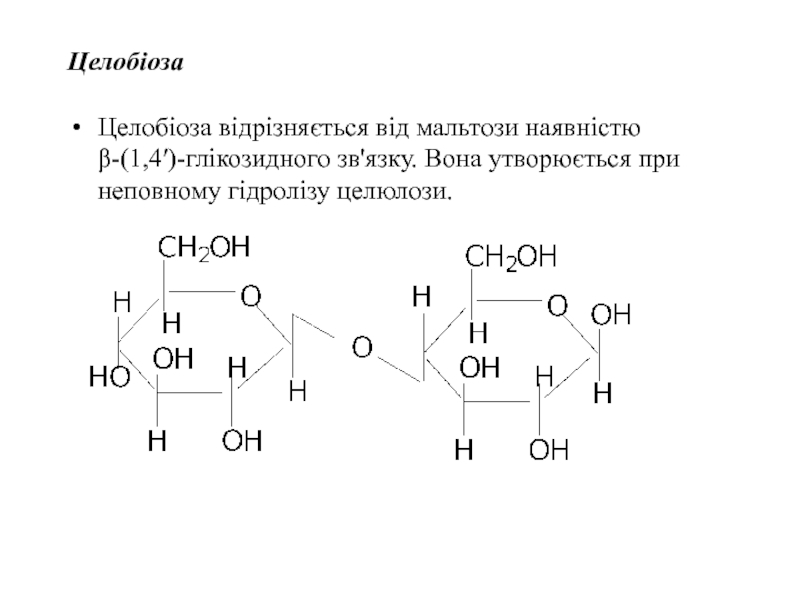
Слайд 41Целобіоза
Целобіоза відрізняється від мальтози наявністю β-(1,4′)-глікозидного зв'язку. Вона утворюється при неповному
Слайд 42Невідновлюючі дисахариди
Цукроза
Цукроза є харчовим продуктом, який виділяється з цукрової тростини або
Цукроза побудована із залишків α-D-глюкопіранози і β-D-фруктофуранози, за рахунок α-(1-2′ ) глікозидного зв'язку. Схематично її утворення можна показати наступною схемою:
При гідролізі відбувається зворотна реакція,
Слайд 43Цукроза характеризується правим обертанням з питомим кутом +66о. В результаті гідролізу
Слайд 44ПОЛІСАХАРИДИ
Полісахариди - високомолекулярні нецукроподібні вуглеводи. Вони являють собою продукти конденсації великого
Головні представники полісахаридів - крохмаль і целюлоза.
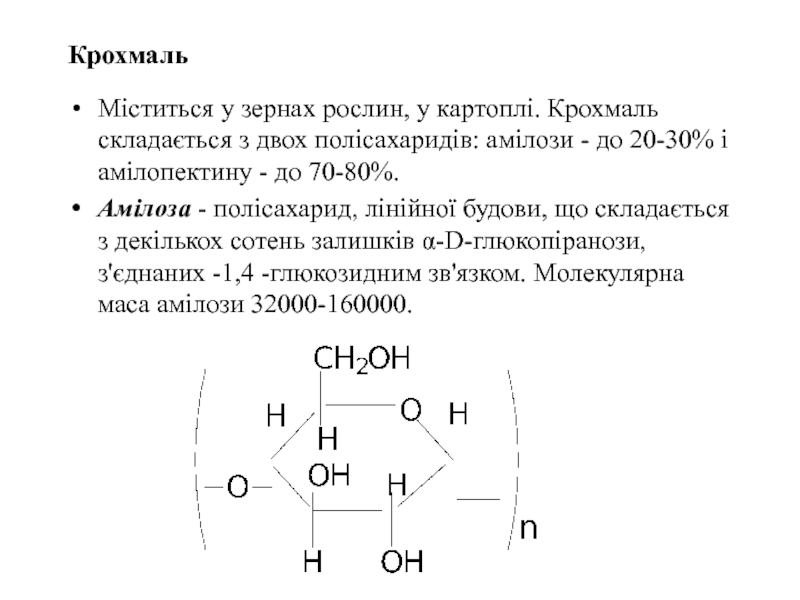
Слайд 45Крохмаль
Міститься у зернах рослин, у картоплі. Крохмаль складається з двох полісахаридів:
Амілоза - полісахарид, лінійної будови, що складається з декількох сотень залишків α-D-глюкопіранози, з'єднаних -1,4 -глюкозидним зв'язком. Молекулярна маса амілози 32000-160000.
Слайд 46 Амілопектин – більш високомолекулярний полісахарид з розгалуженою структурою, молекулярної маси 100000-1000000.
Слайд 48За структурою близький до крохмалю глікоген (тваринний крохмаль). Його макромолекули дуже
Крохмаль міститься в рослинах і є основною складовою частиною багатьох продуктів харчування. В організмі людини легко ферментується.
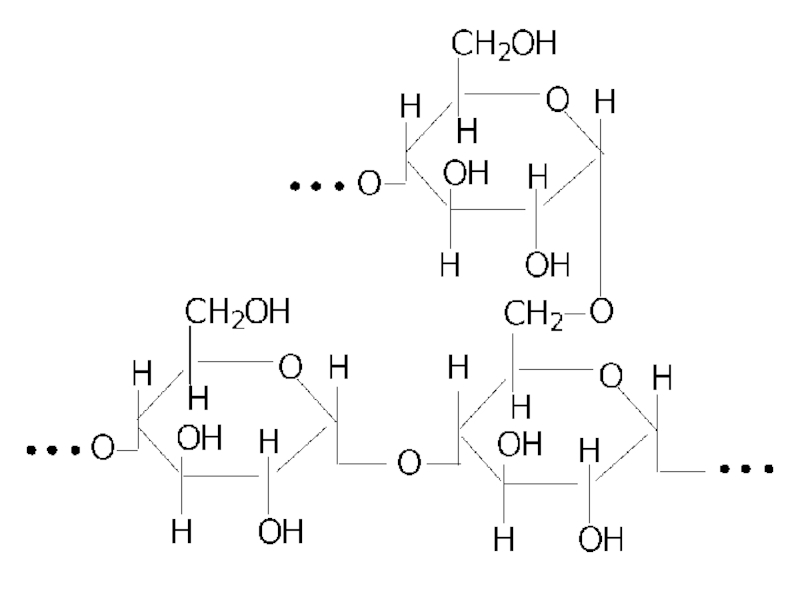
Слайд 49Целюлоза (клітковина)
Найбільш широко розповсюджений у природі полісахарид. Щорічно в результаті фотосинтезу
1010-1011 т. целюлози. Целюлоза – основна складова частина деревини. Вміст целюлози в деревині - 40-44%. Макромолекула целюлози майже не розгалужена і побудована із залишків β-D-глюкопіранози, спролучених за рахунок β-1,4-глюкозидних зв'язків.
Слайд 50
Молекулярна маса целюлози 21000-50000.
Особливості будови макромолекул целюлози є в тому, що
Целюлоза широко застосовується для виготовлення волокон, тканин, лаків, пластмас тощо. Подібно до крохмалю, целюлоза здатна піддаватися гідролізу до глюкози, яку потім переробляють в етиловий спирт (гідролізний).
Слайд 511. Одержання віскозного волокна
При обробці целюлози водним розчином лугу, а потім
Слайд 522. Нітрування
Целюлоза нітрується конц. НNO3. Реакція може протікати поступово із залученням
Суміш моно- і динітроцелюлози називається колоксилін, який використовують для виготовлення нітролаків, колодію, целулоїду (суміш колоксиліну з камфорою 1:3). Тринітроцелюлоза використовується для виготовлення бездимного пороху.
Слайд 533. Ацилювання
Гідроксильні групи целюлози здатні ацилюватись ангідридами або галогенангідридами кислот.
Фільєруванням ацетонового
Слайд 544. Алкілування
Целюлоза алкілується алкілгалогенідами або алкілсульфатами.
Найпоширеніші метил-, етил- і бензилцелюлоза використовуються
Слайд 55Декстрани
Це полісахариди, макромолекули яких складається із залишків α-D-глюкопіранози, з’єднаних 1-6-глюкозидними
Слайд 56Молекули декстранів доволі сильно розгалужені за рахунок 1→2, 1→3 або 1→4-зв’язків.
Декстрани
Слайд 57Хітин
Хітин – високомолекулярний лінійний полісахарид, що побудований із залишків β-2-ацетамідо-2-дезокси-D-глюкози з
Слайд 58Хітин є другим після целюлози за розповсюдженістю природним біополімером, являючись опорним