- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные соединения презентация
Содержание
- 1. Комплексные соединения
- 2. План лекции Общие понятия Строение комплексных соединений Характер химической связи Номенклатура Классификация
- 3. Диссоциация солей Наряду с соединениями обычного типа
- 4. Комплексные соединения Молекулярные соединения, содержащие в своем
- 5. Основные положения теории Центральное место в комплексном
- 6. Комплексообразователь Положительно заряженный ион (чаще всего металл)
- 7. Наибольшей способностью к комплексообразованию обладают атомы f
- 8. Лиганды Ионы противоположного знака CN-, NO2-, NO3-,
- 9. Характеристики лигандов Дентантность – количество мест, которые
- 10. Пример
- 11. Внутренняя сфера Заключается в квадратные скобки [
- 12. Внешняя сфера Состоит из: Положительно заряженных ионов,
- 13. Координационное число Количество лигандов (монодентантных), связанных с
- 14. Формулу комплексного соединения определяют Заряд (степень окисления)
- 15. Пространственное строение комплексного иона К.число = 2
- 16. Характер химической связи Образование комплексных соединений происходит
- 17. Пример При образовании комплексного иона аммония NH4+
- 18. Диссоциация КС Первичная – практически нацело на
- 19. Константа нестойкости (КН) Применяя закон действующих масс
- 20. Константы нестойкости некоторых комплексных ионов
- 21. Константа устойчивости В растворах имеет место ступенчатая
- 22. Номенклатура Вначале называют катион, затем анион Отрицательно
- 23. Перед названием лигандов ставится их число (греческие
- 24. Примеры K[Al(OH)4(H2O)2] – калия тетрагидроксодиакваалюминат (III) K3[Fe(CN)6]
- 25. Классификация А. По составу Ацидокомплексы: лигандами являются
- 26. Б. По строению Многоядерные: [(NH3)5Co – NH2
- 27. Внутрикомплексные соединения – одна из разновидностей циклических
- 28. Комплексоны Полидентантные лиганды, способные образовывать устойчивые хелатные
- 29. Применение комплексонов Трилон Б – в аналитической
- 30. В лакокрасочной и кинофотопромышленности Для разделения редкоземельных
- 31. Природные комплексные соединения Железо находится в центре
- 32. Кобальт как комплексообразователь содержится в витамине В12
- 33. Строение гема 2 +
- 35. Строение хлорофилла
Слайд 2План лекции
Общие понятия
Строение комплексных соединений
Характер химической связи
Номенклатура
Классификация
Слайд 3Диссоциация солей
Наряду с соединениями обычного типа (KCI, Al2(SO4)3), встречаются и более
сложные соединения – двойные, комплексные соли. Подобные соединения относят к соединениям высшего порядка
KCI ⇄ K+ + CI-
KAl(SO4)2 ⇄ K+ + Al3+ + 2SO42-
K3[Fe(CN)6] ⇄ 3K+ + [Fe(CN)6]3-
KCI ⇄ K+ + CI-
KAl(SO4)2 ⇄ K+ + Al3+ + 2SO42-
K3[Fe(CN)6] ⇄ 3K+ + [Fe(CN)6]3-
Слайд 4Комплексные соединения
Молекулярные соединения, содержащие в своем составе комплексные ионы, способные к
существованию как в растворе, так и в кристалле [Fe(CN)6]3-
Комплексообразование объясняет координационная теория, предложенная в 1893 году А. Вернером и развитая в 1906 году Л.А. Чугаевым
Комплексообразование объясняет координационная теория, предложенная в 1893 году А. Вернером и развитая в 1906 году Л.А. Чугаевым
Слайд 5Основные положения теории
Центральное место в комплексном соединении занимает комплексообразователь Fe3+
С комплексообразователем
координированы лиганды CN-
Комплексообразователь + лиганды – внутренняя сфера комплексного соединения [Fe(CN)6]3-
Обычно присутствует внешняя сфера (когда комплексный ион имеет заряд)
Комплексообразователь + лиганды – внутренняя сфера комплексного соединения [Fe(CN)6]3-
Обычно присутствует внешняя сфера (когда комплексный ион имеет заряд)
Слайд 6Комплексообразователь
Положительно заряженный ион (чаще всего металл)
Нейтральный атом
Неметалл (редко)
Является акцептором электронных
пар, предоставляя свободные атомные орбитали; занимает центральное положение в комплексном соединении
Слайд 7Наибольшей способностью к комплексообразованию обладают атомы f и d-элементов
f > d
> p >> s
Комплексообразователями могут быть также неметаллы в положительной степени окисления: Si4+, В3+, Р5+, S6+, I7+; реже – в отрицательной: I-, S2-, N3-
Комплексообразователями могут быть также неметаллы в положительной степени окисления: Si4+, В3+, Р5+, S6+, I7+; реже – в отрицательной: I-, S2-, N3-
Слайд 8Лиганды
Ионы противоположного знака
CN-, NO2-, NO3-, CI-, Br-, J-, OH-, CO32-
Нейтральные полярные
молекулы
NH3, H2O, NO, CO
Неполярные молекулы, которые могут поляризоваться в электрическом поле иона-комплексообразователя
Являются донорами электронных пар и непосредственно соединены с комплексообразователем
NH3, H2O, NO, CO
Неполярные молекулы, которые могут поляризоваться в электрическом поле иона-комплексообразователя
Являются донорами электронных пар и непосредственно соединены с комплексообразователем
Слайд 9Характеристики лигандов
Дентантность – количество мест, которые занимает лиганд вокруг центрального атома
Монодентантные
H2O, NH3, CO, CN-
Бидентантные
C2O42-, SO42-, NH2 – CH2 – CH2 – NH2
Полидентантные
Слайд 11Внутренняя сфера
Заключается в квадратные скобки [ ]. Остается стабильной при растворении
В
соответствии с зарядом внутренней сферы комплексные соединения подразделяются на:
Анионные
Катионные
Нейтральные комплексы
Анионные
Катионные
Нейтральные комплексы
Слайд 12Внешняя сфера
Состоит из:
Положительно заряженных ионов, если комплексный ион заряжен отрицательно
K31+[Fe3+(CN)6]3-
Отрицательно заряженных
ионов, если комплексный ион заряжен положительно
[Cu2+(NH3)4]2+SO42-
Может отсутствовать, если заряд комплекса равен 0
[Pt2+(NH3)4CI2] или [Fe(CO)5]
[Cu2+(NH3)4]2+SO42-
Может отсутствовать, если заряд комплекса равен 0
[Pt2+(NH3)4CI2] или [Fe(CO)5]
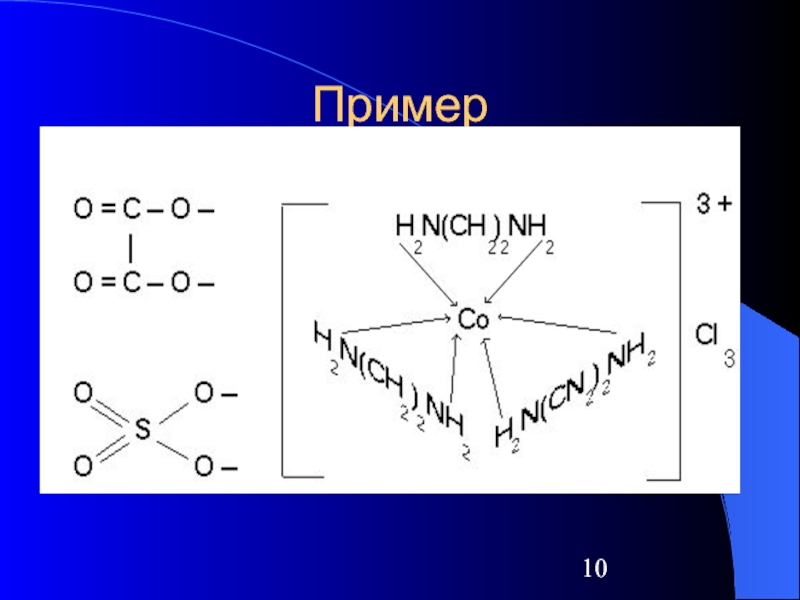
Слайд 13Координационное число
Количество лигандов (монодентантных), связанных с комплексообразователем
Заряд центрального иона – основной
фактор, влияющий на его координационное число
Слайд 14Формулу комплексного соединения определяют
Заряд (степень окисления) комплексообразователя
Заряд лигандов
Координационное число
Ионы внешней сферы
Заряд
комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов
[Au(CN)2]1-
[Cu(NH3)4]2+
[Fe(CN)6]3-
[Au(CN)2]1-
[Cu(NH3)4]2+
[Fe(CN)6]3-
Слайд 15Пространственное строение комплексного иона
К.число = 2 – линейное
К.число = 4 –
квадрат, тетраэдр
К.число = 6 – октаэдр
К.число = 6 – октаэдр
Слайд 16Характер химической связи
Образование комплексных соединений происходит в том случае, когда один
из компонентов представляет неподеленную пару электронов (донор), а другой – свободную орбиталь (акцептор). Такая связь – донорно-акцепторная или координационная
Комплексные соединения – соединения высшего порядка, характеризующиеся наличием хотя бы 1 донорно-акцепторной связи. Внутренняя и внешняя сферы соединены между собой ионной связью
Комплексные соединения – соединения высшего порядка, характеризующиеся наличием хотя бы 1 донорно-акцепторной связи. Внутренняя и внешняя сферы соединены между собой ионной связью
Слайд 17Пример
При образовании комплексного иона аммония NH4+ неподеленная электронная пара атома азота
в аммиаке перешла в общее владение с ионом водорода, а положительный заряд последнего стал общим для всего комплекса
Слайд 18Диссоциация КС
Первичная – практически нацело на комплексный ион и ионы внешней
сферы
[Ag(NH3)2]CI → [Ag(NH3)2]+ + CI-
Вторичная – частичная на центральный ион и лиганды
1 [Ag(NH3)2]+ ⇄ [Ag(NH3)]+ + NH3
2 [Ag(NH3)]+ ⇄ Ag+ + NH3
Суммарная
[Ag(NH3)2]+ ⇄ Ag+ + 2NH3
[Ag(NH3)2]CI → [Ag(NH3)2]+ + CI-
Вторичная – частичная на центральный ион и лиганды
1 [Ag(NH3)2]+ ⇄ [Ag(NH3)]+ + NH3
2 [Ag(NH3)]+ ⇄ Ag+ + NH3
Суммарная
[Ag(NH3)2]+ ⇄ Ag+ + 2NH3
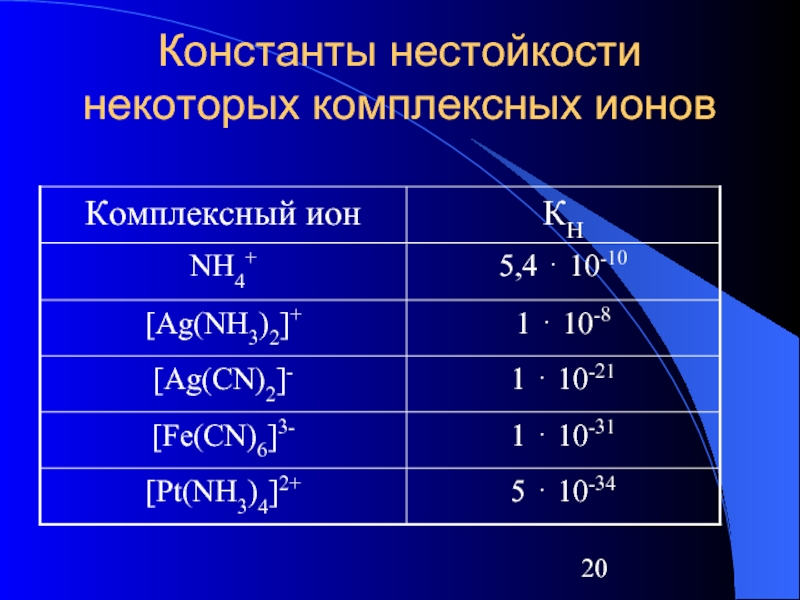
Слайд 19Константа нестойкости (КН)
Применяя закон действующих масс к обратимым процессам, можно получить
выражение КН комплексного иона:
[Ag+][NH3]2
КД = КН = ---------------
[Ag(NH3)2]+
КН могут служить мерой устойчивости комплекса. Чем больше величина КН, тем сильнее комплексный ион диссоциирует
[Ag+][NH3]2
КД = КН = ---------------
[Ag(NH3)2]+
КН могут служить мерой устойчивости комплекса. Чем больше величина КН, тем сильнее комплексный ион диссоциирует
Слайд 21Константа устойчивости
В растворах имеет место ступенчатая диссоциация комплексов; между КН имеется
соотношение
КН1 > КН2 > КН3 > КН4
так как затрудняется последовательный отрыв лиганд
КОБЩ = КН1 ⋅ КН2 … КНn
Величина, обратная константе нестойкости комплексного иона – КУ
1
КУ = ----------
КН
КН1 > КН2 > КН3 > КН4
так как затрудняется последовательный отрыв лиганд
КОБЩ = КН1 ⋅ КН2 … КНn
Величина, обратная константе нестойкости комплексного иона – КУ
1
КУ = ----------
КН
Слайд 22Номенклатура
Вначале называют катион, затем анион
Отрицательно заряженные ионы с окончанием «о»:
CN- –
циано
OH- – гидроксо
Нейтральные молекулы:
NH3 – аммин
CO – карбонил
H2O – аква
OH- – гидроксо
Нейтральные молекулы:
NH3 – аммин
CO – карбонил
H2O – аква
Слайд 23Перед названием лигандов ставится их число (греческие числительные би, тетра, пента,
гекса)
В комплексном анионе комплексообразователь имеет окончание «ат» (феррат, цинкат); в катионе он называется в родительном падеже, в нейтральном – в именительном
Степень окисления комплексообразователя указывается римской цифрой (исключение – нейтральное комплексное соединение)
В комплексном анионе комплексообразователь имеет окончание «ат» (феррат, цинкат); в катионе он называется в родительном падеже, в нейтральном – в именительном
Степень окисления комплексообразователя указывается римской цифрой (исключение – нейтральное комплексное соединение)
Слайд 24Примеры
K[Al(OH)4(H2O)2] – калия тетрагидроксодиакваалюминат (III)
K3[Fe(CN)6] – калия гексацианоферрат (III)
[Co(NH3)5CI]SO4 – хлоропентааминкобальта
(III) сульфат
[Co(NH3)3CI3] – трихлоротриамминкобальт
[Co(NH3)3CI3] – трихлоротриамминкобальт
Слайд 25Классификация
А. По составу
Ацидокомплексы: лигандами являются отрицательно заряженные анионы кислот
Гидроксокомплексы
Аммиакаты, аквакомплексы, карбонилы
– полярные молекулы различных веществ (H2O, CO, NH3)
[Fe(CN)6]3- [Al(OH)6]3-
[Cu(NH3)4]2+ [Fe(CO)5]
[Ca(H2O)6]2+
[Fe(CN)6]3- [Al(OH)6]3-
[Cu(NH3)4]2+ [Fe(CO)5]
[Ca(H2O)6]2+
Слайд 26Б. По строению
Многоядерные:
[(NH3)5Co – NH2 – Co(NH3)5]5+
цитохромоксидаза
Циклические (хелатные): устойчивые комплексные соединения
металлов с полидентантными лигандами, в которых центральный атом является компонентом циклической структуры
NaOOCCH2 CH2COONa
N – CH2 – CH2 – N
OOCCH2 CH2COO
Ca2+
NaOOCCH2 CH2COONa
N – CH2 – CH2 – N
OOCCH2 CH2COO
Ca2+
Слайд 27Внутрикомплексные соединения – одна из разновидностей циклических комплексных соединений, отличающаяся тем,
что один из концевых атомов полидентантного лиганда связан с центральным атомом-комплексообразователем ковалентной или ионной связью и донорно-акцепторной
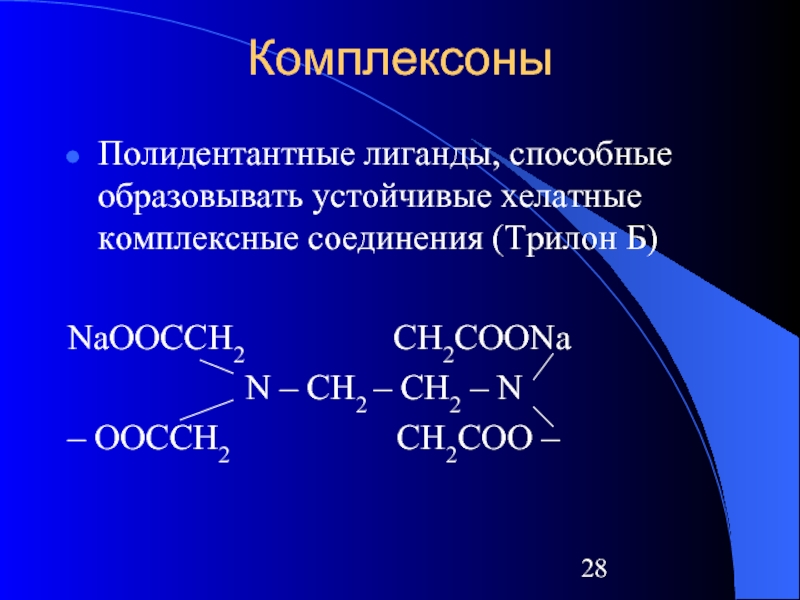
Слайд 28Комплексоны
Полидентантные лиганды, способные образовывать устойчивые хелатные комплексные соединения (Трилон Б)
NaOOCCH2 CH2COONa
N – CH2 – CH2 – N
– OOCCH2 CH2COO –
– OOCCH2 CH2COO –
Слайд 29Применение комплексонов
Трилон Б – в аналитической химии для титриметрического (количественного) определения
многих катионов и анионов (Ca2+, Mg2+, Co2+, Ni2+, Zn2+, Fe2+, Mn2+, Cu2+, SO42-, PO43-)
Комплексонометрическим методом определяют жесткость воды (содержание Ca2+, Mg2+), содержание металлов в различных фармацевтических препаратах и других материалах
Комплексонометрическим методом определяют жесткость воды (содержание Ca2+, Mg2+), содержание металлов в различных фармацевтических препаратах и других материалах
Слайд 30В лакокрасочной и кинофотопромышленности
Для разделения редкоземельных элементов
Для лечения болезней растений
В медицине
для лечения лучевой болезни
При отравлениях ртутью и свинцом
При заболеваниях, связанных с отложением в организме малорастворимых солей (камни в печени и почках)
При отравлениях ртутью и свинцом
При заболеваниях, связанных с отложением в организме малорастворимых солей (камни в печени и почках)
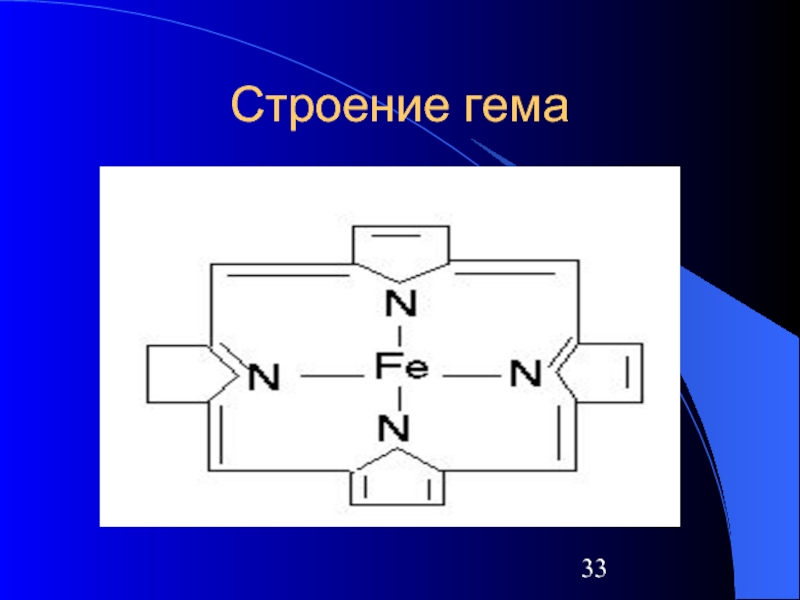
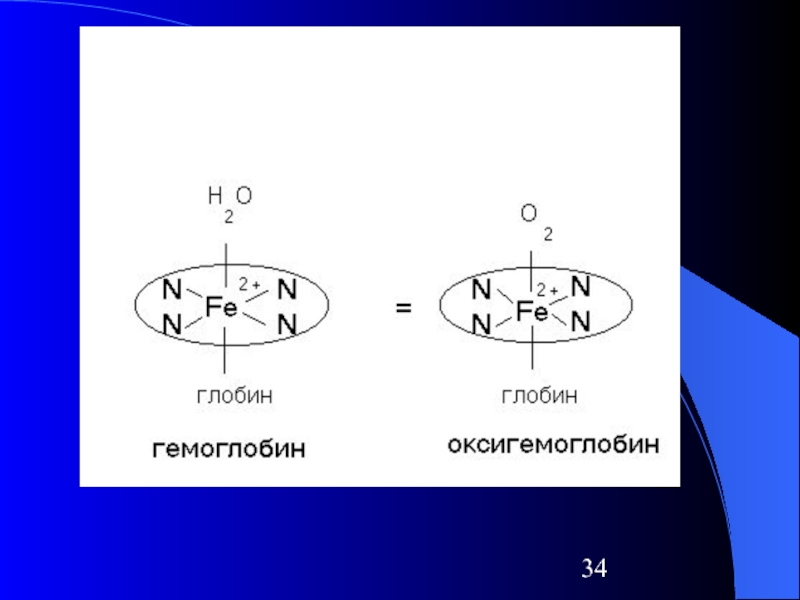
Слайд 31Природные комплексные соединения
Железо находится в центре плоской порфириновой системы в таких
белках, как:
Гемоглобин
Миоглобин
Трансферрин
в некоторых ферментах:
Цитохромы
Каталаза
Пероксидаза
Гемоглобин
Миоглобин
Трансферрин
в некоторых ферментах:
Цитохромы
Каталаза
Пероксидаза
Слайд 32Кобальт как комплексообразователь содержится в витамине В12
Цинк – в ферментах:
Карбоксипептидаза
Карбоангидраза
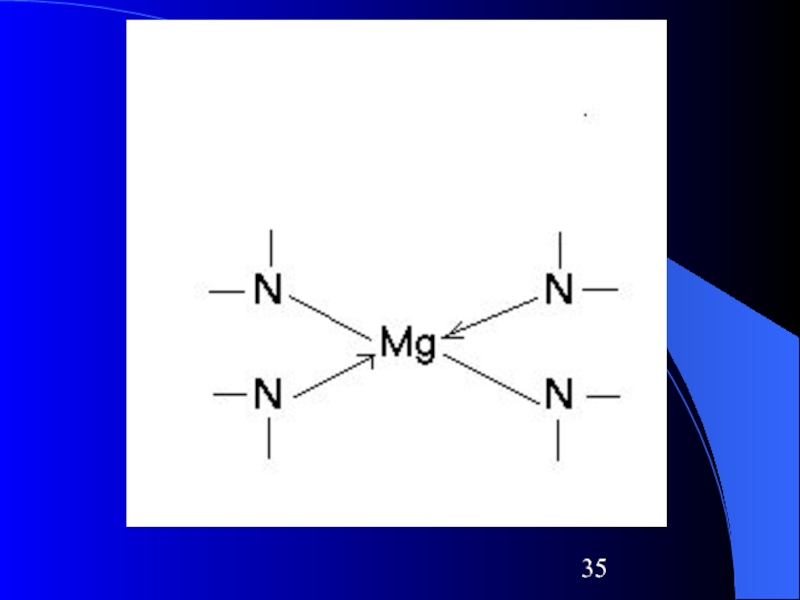
Магний –
в хлорофилле, участвующем в процессах фотосинтеза в растениях (построен аналогично гемоглобину)









![Внутренняя сфераЗаключается в квадратные скобки [ ]. Остается стабильной при растворенииВ соответствии с зарядом внутренней](/img/tmb/1/98712/40deada258f92bc9e66b1ba51cdfdee7-800x.jpg)
![Внешняя сфераСостоит из:Положительно заряженных ионов, если комплексный ион заряжен отрицательноK31+[Fe3+(CN)6]3-Отрицательно заряженных ионов, если комплексный ион](/img/tmb/1/98712/9dcdf5fb97a2e4693cfb76571b2c2a62-800x.jpg)




![Диссоциация КСПервичная – практически нацело на комплексный ион и ионы внешней сферы[Ag(NH3)2]CI → [Ag(NH3)2]+ +](/img/tmb/1/98712/85e037aae938aecd6e5f6681177969ed-800x.jpg)




![ПримерыK[Al(OH)4(H2O)2] – калия тетрагидроксодиакваалюминат (III)K3[Fe(CN)6] – калия гексацианоферрат (III)[Co(NH3)5CI]SO4 – хлоропентааминкобальта (III) сульфат[Co(NH3)3CI3] – трихлоротриамминкобальт](/img/tmb/1/98712/1d6e6430bbefa562d30bea1d6a190be7-800x.jpg)

![Б. По строениюМногоядерные:[(NH3)5Co – NH2 – Co(NH3)5]5+цитохромоксидазаЦиклические (хелатные): устойчивые комплексные соединения металлов с полидентантными лигандами,](/img/tmb/1/98712/a260951f3406fe03a89b3064290dce97-800x.jpg)