- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Chimia coordinativă презентация
Содержание
- 1. Chimia coordinativă
- 2. Configuraţia electronică a elementelor d
- 3. Caracteristici ale ionilor metalelor 3d
- 4. Din istoria descoperirilor în chimia compușilor coordinativi
- 5. Sinteza compușilor complecși
- 6. Unii din primii compuși coordinativi
- 7. Studierea compușilor coordinativi prin metode chimice
- 8. Compoziția
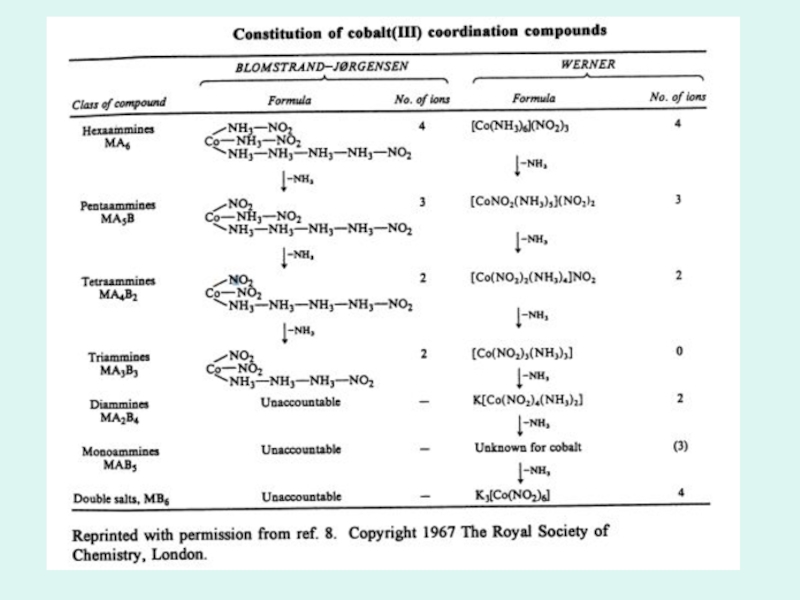
- 10. Dezvoltarea chimiei compușilor coordinativi pînă la Werner
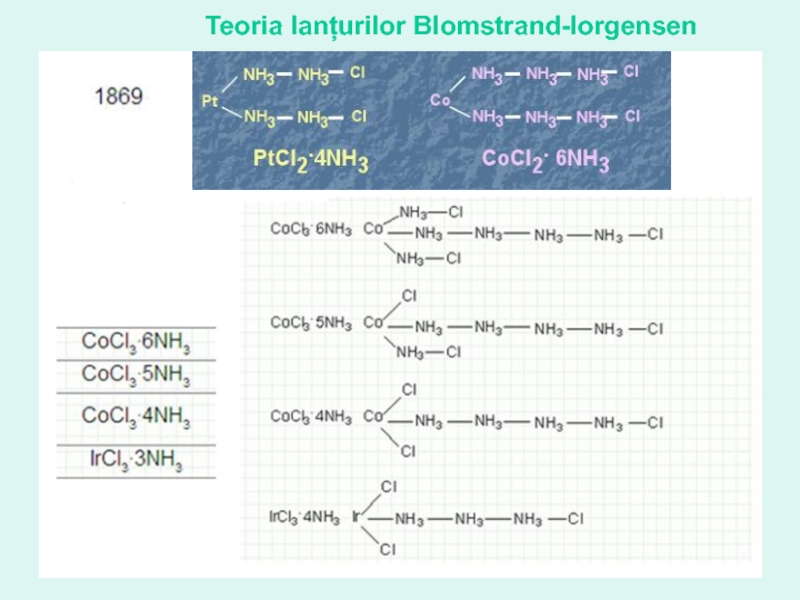
- 11. Teoria lanțurilor Blomstrand-Iorgensen
- 13. Teoria coordinativă a lui A.Werner
- 14. Ionii din soluție, conform lui A.Werner
- 17. Plan-patrat
- 18. Atom central Ligand Sferă interioară Sferă exterioară A.Werner: compus complex (coordinativ)
- 19. Teoria coordinativă a şui A.Werner 1893
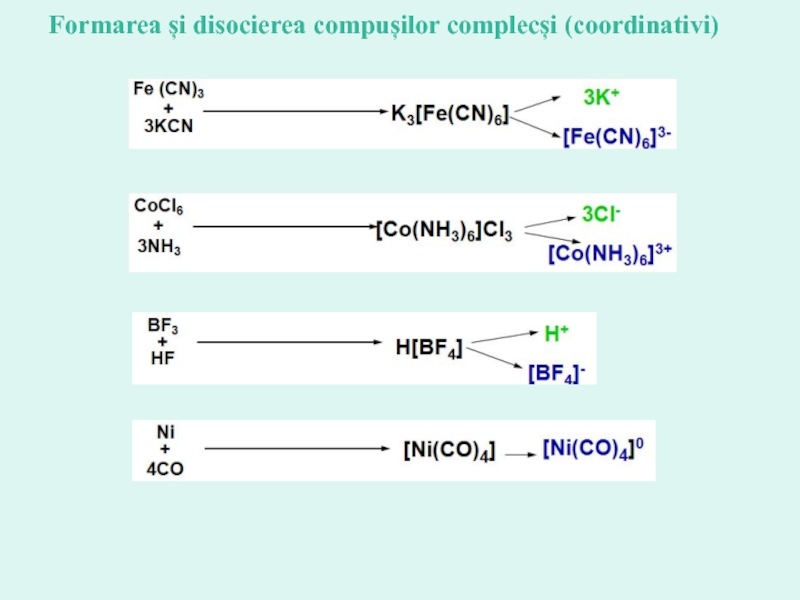
- 20. Formarea și disocierea compușilor complecși (coordinativi)
- 21. Ionii, care nu intră in sfera interioară
- 23. Conductibilitatea molară a soluțiilor apoase ale compușilor coordinativi
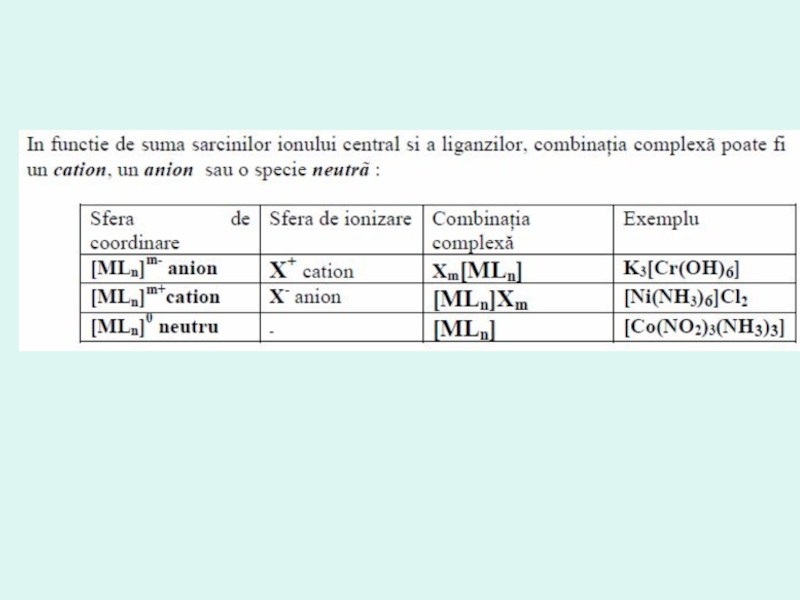
- 24. Compuşi coordinativi şi săruri duble A.Werner:
- 25. [Co(NH3)6]3+ - complex [Co(NH3)6]Cl3 – compus complex
- 26. Combinaţiile complexe (coordinative) sunt compuşi de ordin
- 28. Generatorul de coomplex, împreună cu liganzii formează
- 29. Atomul central Metal Nemetal
- 31. Într-un compus coordinativ se scrie în primul
- 32. [Cu(H2O)4](SO4)·H2O Atom central Liganzi Sfera interioară Sfera exterioară
- 33. Liganzi Sfera exterioară Sfera interioară
- 34. Generator de complex Liganzi
- 35. Atom central
- 36. Proprietăţile chimice 1.Disocierea [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +
- 37. 3. Reacţii cu participarea liganzilor
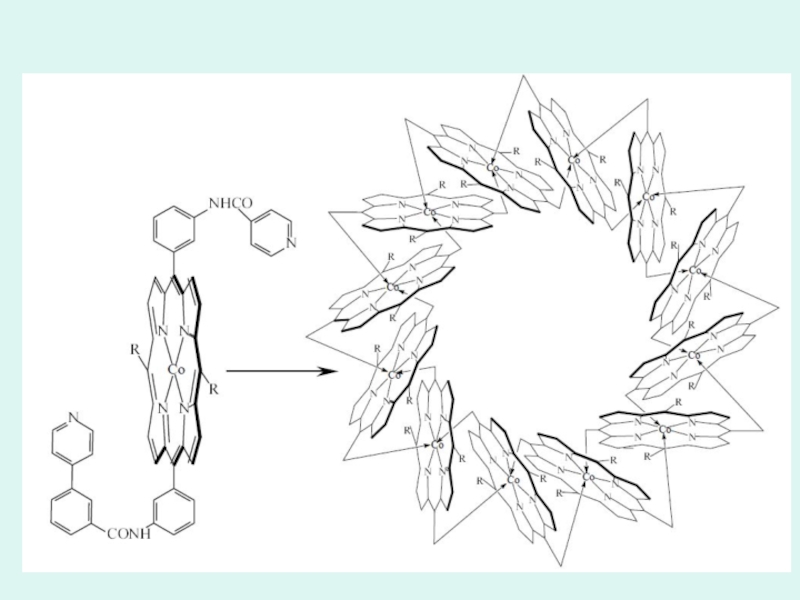
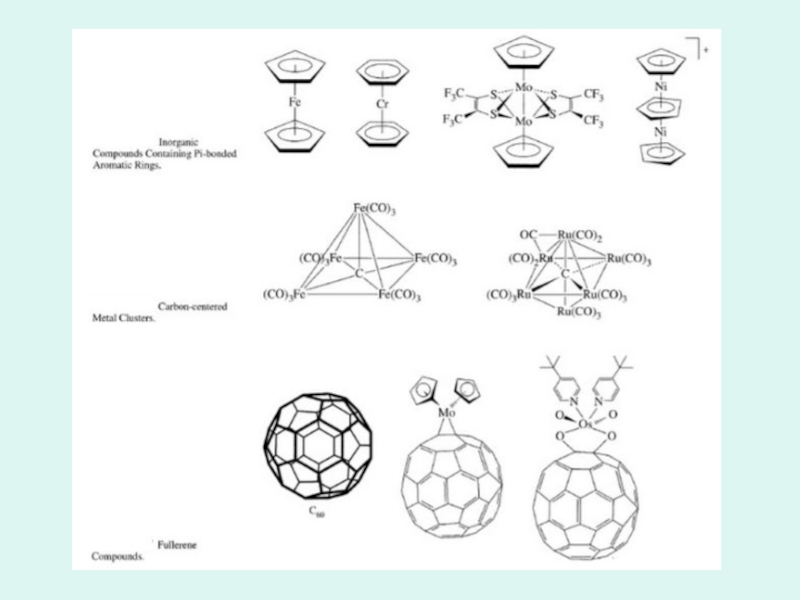
- 38. Realizări ale chimiei compușilor coordinativi
- 43. C.Turtă
- 45. Aplicații moderne ale chimiei compușilor coordinativi
Слайд 8Compoziția Culoarea
Oranj
Purpurie
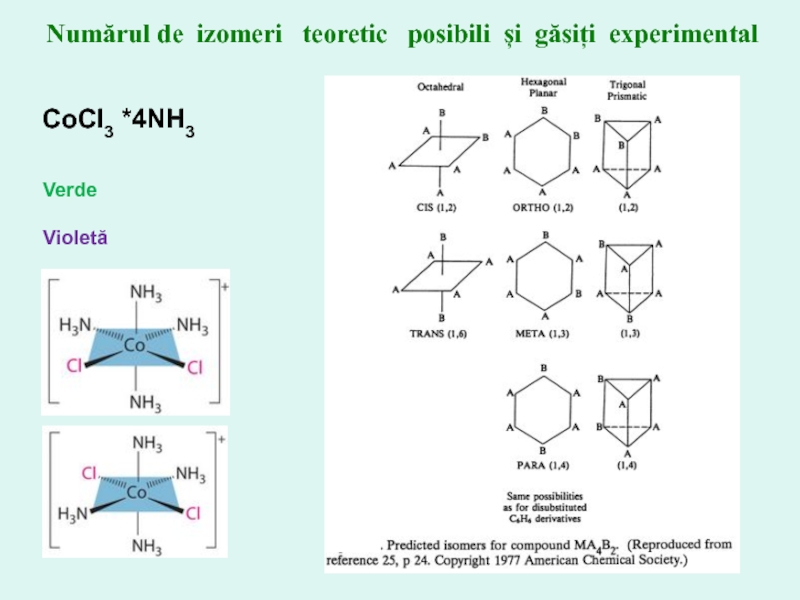
Verde
Violetă
Albastru
-verde
Studierea compușilor coordinativi
Luteo
Purpureo
Prazeo
Violeo
o
3
2
1
1
0
CoCl3 *6NH3
CoCl3 *5NH3
CoCl3 *4NH3
CoCl3 *4NH3
CoCl3 *3NH3
Слайд 9
?????
Cum pot interacționa două
De ce din substanțe inițiale identice se obțin substanțe finale cu compoziții diferite?
De ce din substanțe cu acelaș număr de ioni de clor, se precippită un număr diferit de clor? (De ce aceste substanțe au o conductibilitate molară diferită?)
De ce aceste substanțe au culori diferite?
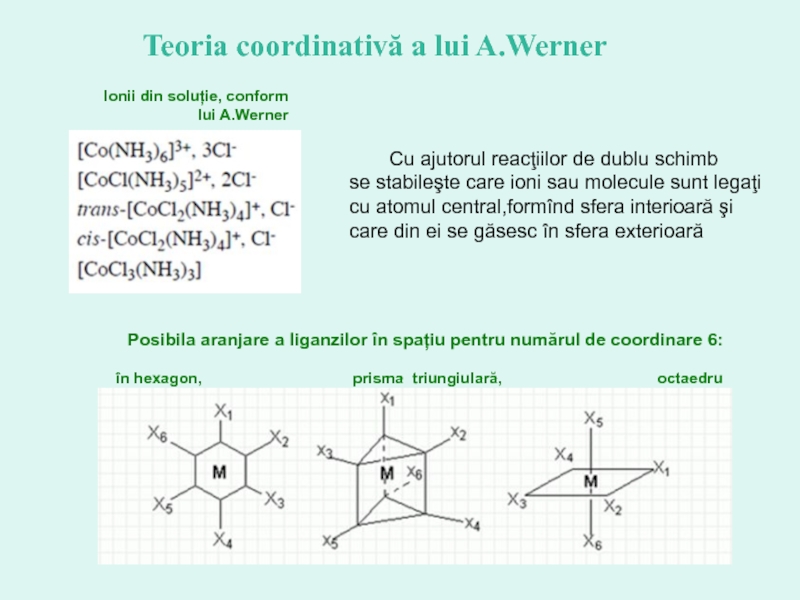
Слайд 14Ionii din soluție, conform
lui A.Werner
Teoria coordinativă a lui A.Werner
Posibila aranjare
în hexagon, prisma triungiulară, octaedru
Cu ajutorul reacţiilor de dublu schimb se stabileşte care ioni sau molecule sunt legaţi cu atomul central,formînd sfera interioară şi care din ei se găsesc în sfera exterioară
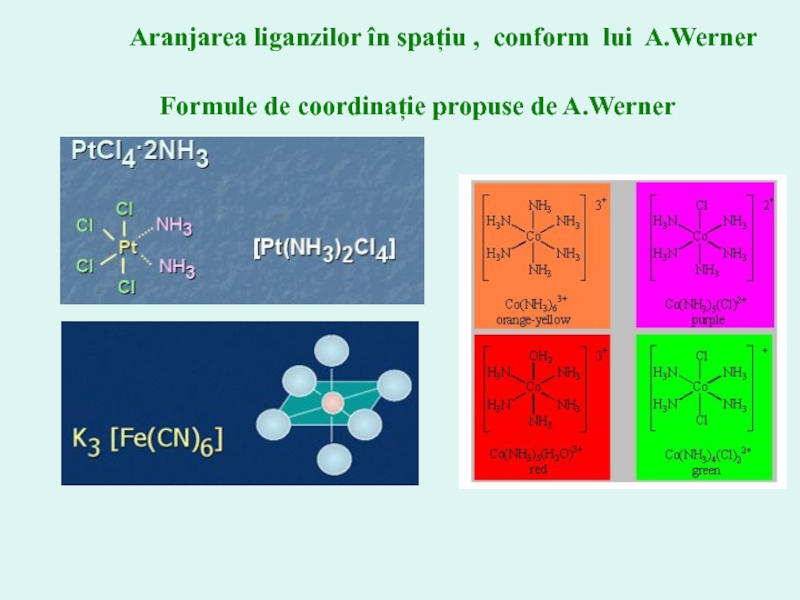
Слайд 16 Aranjarea liganzilor în spațiu
Formule de coordinație propuse de A.Werner
Слайд 19Teoria coordinativă a şui A.Werner
1893 - A.Werner propune teoria coordinativă cu
1. Majoritatea elementelor manifestă două tipuri de valenţă principală şi secundară.
2. Atomul elementului central tinde spre saturarea nu numai a valenţei principale, dar şi a celei secundare.
3. Valenţele secundare ale atomului sunt strict orientate în spaţiu şi determină geometria complexului şi proprietăţile lui.
În chimia contemporană:
valenţa principală = grad de oxidare valenţa secundară = număr de coordinare
Слайд 21 Ionii, care nu intră in sfera interioară de coordinaţie, la dizolvare
Disociaţia compuşilor coordinativi
nu disociază
Слайд 22 Studierea compuşilor coordinativi prin
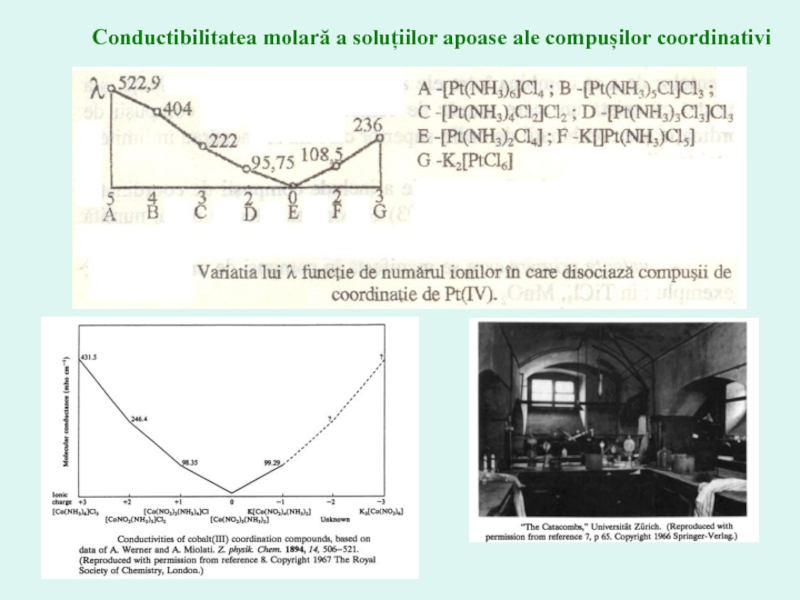
Compoziţia sferei interioare se poate stabili şi prin măsurarea conductibilităţii electrice a combinaţiei coordinative. Astfel, dacă se iau soluţii careconţin un mol de substanţă la 1000 l de apă la 25 C, atunci valorile conductibilităţii electrice moleculare (µ) vor fi:
A.Werner şi A.Miolati
Conductibilitatea molară a soluțiilor apoase ale compușilor coordinativi
Слайд 24Compuşi coordinativi şi săruri duble
A.Werner:
Compuşi coordinativi – substanţe de
Săruri duble – substanţe de ordinul superior, instabile în soluţii apoase.
Слайд 25[Co(NH3)6]3+ - complex
[Co(NH3)6]Cl3 – compus complex (coordinativ)
[Fe(CO)5] – complex şi compus
Complex - atomul sau ionul central de metal (generator de complex), inconjurat cu un set de liganzi
Слайд 26Combinaţiile complexe (coordinative) sunt compuşi de ordin superior cu dimensiuni moleculare.
1. Ele se formează prin unirea a cîtorva ioni (sau molecule) cu unul din ionii (sau atomii), numiţi centrali, alcătuind un agregat (complex) unic cu proprietăţi specifice, distincte de cele ale părţilor componente.
2. Compusul coordinativ reprezintă o particulă complexă, capabilă să existe independent în cristal sau soluţie şi constă din particule mai simple, la fel capabile să existe independent.
Слайд 28 Generatorul de coomplex, împreună cu liganzii formează aşa numita sferă interioară
Ionii, care nu sunt legaţi direct cu generatorul de complex formează sfera exterioară a complexului.
Слайд 31 Într-un compus coordinativ se scrie în primul rînd atomul metalic central,
Se pot folosi şi notaţii prescurtate ale liganzilor, în locul formulelor complete (en - pentru H2NC2H4NH2).
Formula unui complex se scrie între paranteze patrate, indiferent dacă are sau nu sarcină electrică. De exemplu, complexul neutru al ionului Co(III) cu N.C. = 6 şi cu 3 liganzi anionici (ionul Cl-) şi 3 liganzi neutri (moleculele NH3) se scrie [Co(NH3)6]Cl 3.
[M(L1)+(L2)0(L3)- ] X
Слайд 33Liganzi
Sfera
exterioară
Sfera
interioară
Număr de coordinaţie
Generator de complex
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-
Слайд 34
Generator
de complex
Liganzi
Sfera
exterioară
Sfera
interioară
Număr de
coordinaţie
H[AuCl4] → H+ + [AuCl4]-
Слайд 35
Atom
central
Liganzi
Număr de
coordinaţie
Sfera interioară
Sfera
exterioară
[Ag(NH3)2]OH → [Ag(NH3)2]+ + OH-
Слайд 36Proprietăţile chimice
1.Disocierea
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-
2. Reacţii cu participarea sferei
FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl
[Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓
Слайд 373. Reacţii cu participarea liganzilor
[Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4
4. Reacţii cu participarea generatorului de complex
de schimb:
[Ag(NH3)2]Cl + KI → AgI↓ + KCl + 2NH3
redox:
2[Ag(NH3)2]OH + R-CH=O →2Ag↓+RCOONH4+H2O+3NH3
Proprietăţile chimice

















![[Co(NH3)6]3+ - complex[Co(NH3)6]Cl3 – compus complex (coordinativ)[Fe(CO)5] – complex şi compus complex (coordinativ)Complex - atomul](/img/tmb/3/263487/52dccd30d82aedb666f216146bb49add-800x.jpg)





·H2OAtom centralLiganziSfera interioarăSfera exterioară](/img/tmb/3/263487/943dde003081fae8a6a2ced4a7ddc1b0-800x.jpg)
![LiganziSfera exterioarăSfera interioarăNumăr de coordinaţieGenerator de complexK4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-](/img/tmb/3/263487/b7d1ee6f838527f64eae8e28cf203543-800x.jpg)
![Generator de complexLiganziSfera exterioarăSfera interioarăNumăr de coordinaţieH[AuCl4] → H+ + [AuCl4]-](/img/tmb/3/263487/655f4d191912dc41ca6e0e7535dc1a43-800x.jpg)
![Atom centralLiganziNumăr de coordinaţieSfera interioarăSfera exterioară[Ag(NH3)2]OH → [Ag(NH3)2]+ + OH-](/img/tmb/3/263487/f3fd4fd6653e490b3519f040a51a7bf0-800x.jpg)
![Proprietăţile chimice1.Disocierea[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42- 2. Reacţii cu participarea sferei exterioare](/img/tmb/3/263487/ad0db57f65563c7e084b3a75de1d2bb2-800x.jpg)