Дисциплина: Химия
Лектор: к.б.н., доцент Клокова Вера Михайловна
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Учение о растворах презентация
Содержание
- 1. Учение о растворах
- 2. Учение о растворах Якоб Хендрик
- 3. Раствор - гомогенная (однородная), устойчивая система переменного
- 4. Различают растворы: газообразные, жидкие и твердые
- 5. Растворение – физико-химический процесс, где происходит взаимодействие между частицами, образующими раствор, и равномерное распределение частиц.
- 6. Стадии растворения кристаллических веществ в воде: Разрушение
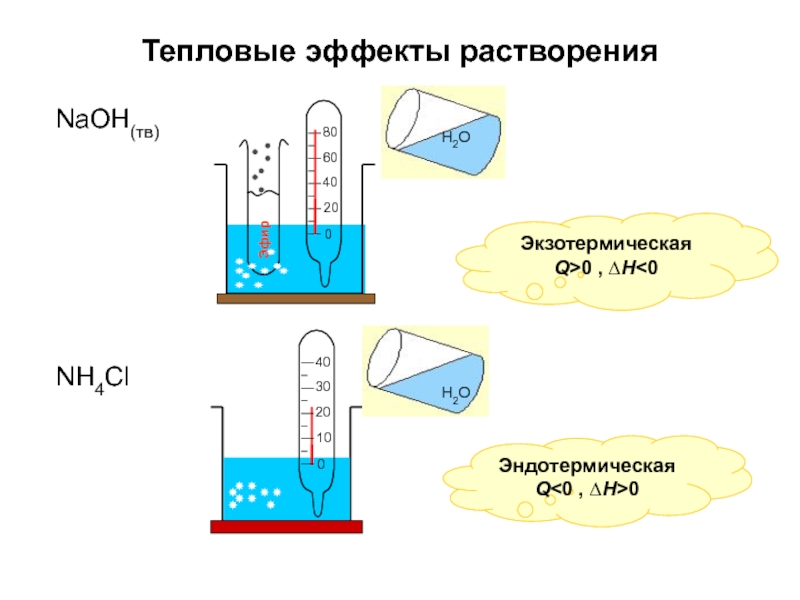
- 7. Экзотермическая Q>0 , ∆H
- 8. «Подобное растворяется в подобном» Вещества с ионным
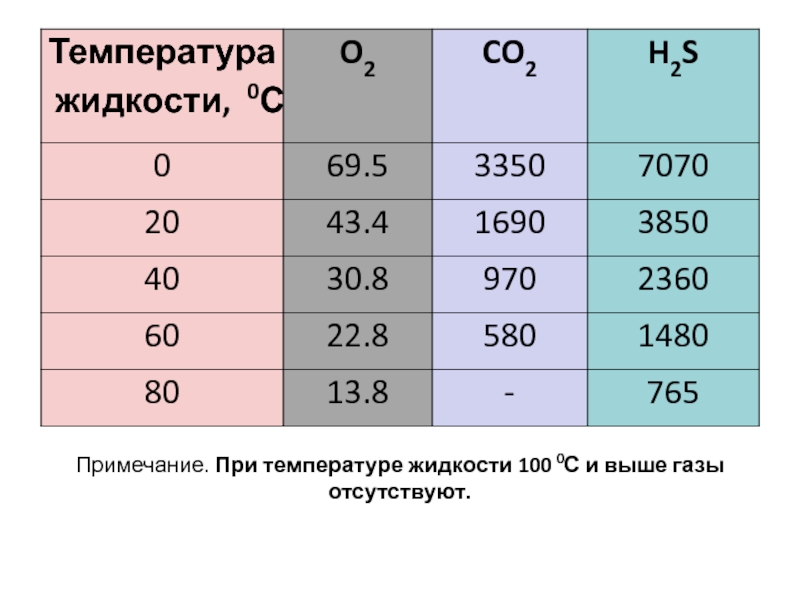
- 9. Примечание. При температуре жидкости 100 0С и выше газы отсутствуют.
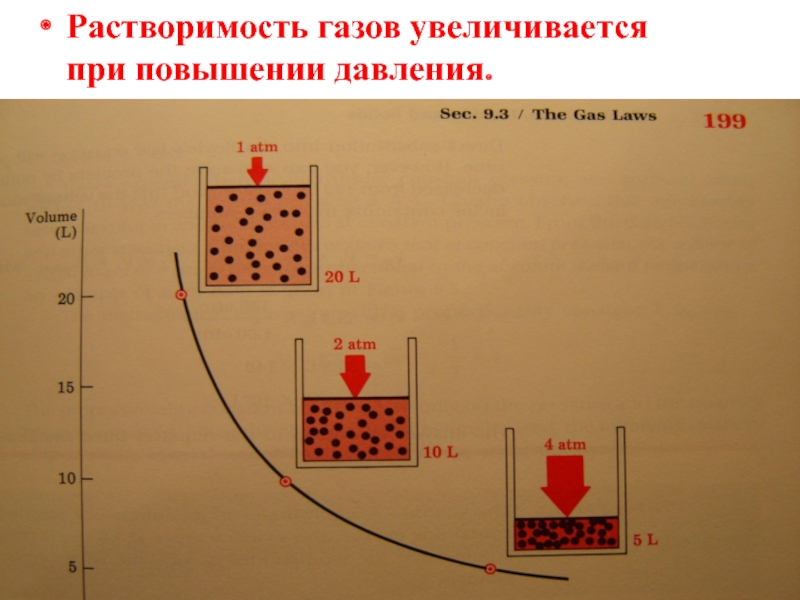
- 10. Растворимость газов увеличивается при повышении давления.
- 12. Закон Дальтона: Растворимость каждого из компонентов газовой
- 13. Закон Генри и Дальтона позволяет объяснить причины кессонной болезни
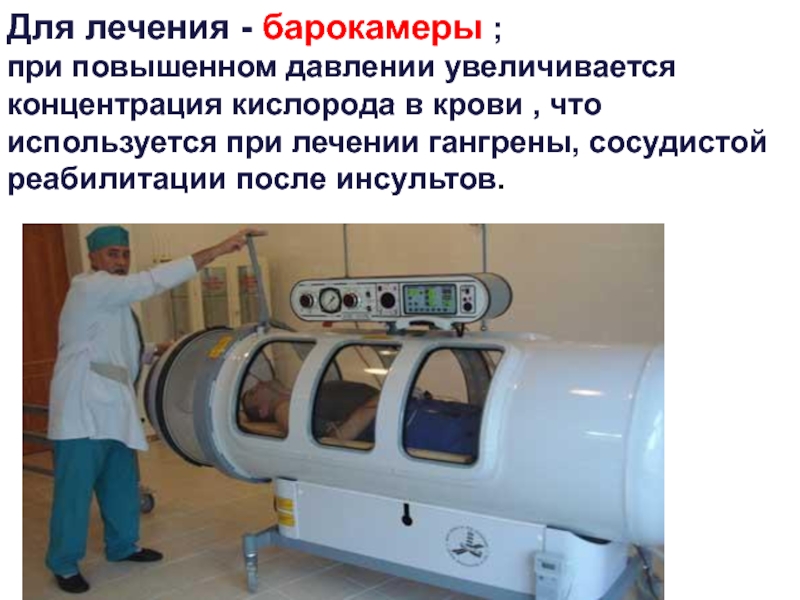
- 18. Для лечения - барокамеры ;
- 19. где S и S0 – растворимость
- 20. Электролитами называются вещества, расплавы и растворы которых
- 21. Степень диссоциации (α) - отношение
- 23. Факторы, влияющие на α: природа электролита и
- 24. Электролитическая диссоциация слабых электролитов, является обратимой реакцией,
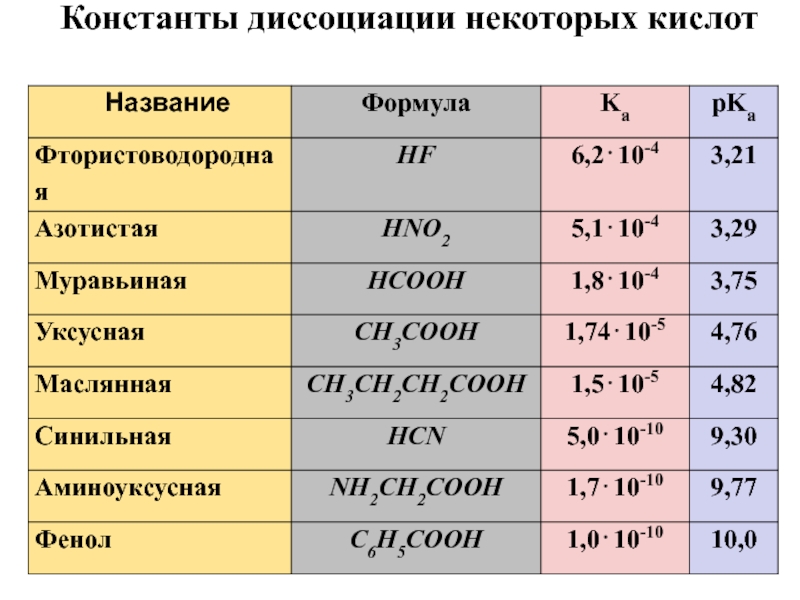
- 25. Константы диссоциации некоторых кислот
- 26. Связь константы диссоциации и степени диссоциации (закон
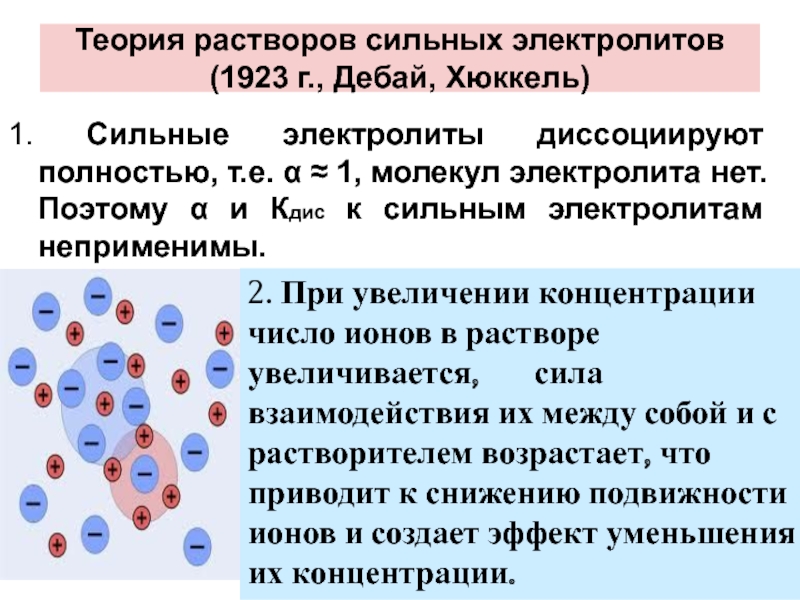
- 27. Теория растворов сильных электролитов (1923 г., Дебай,
- 29. В разбавленных растворах γ = 1, тогда
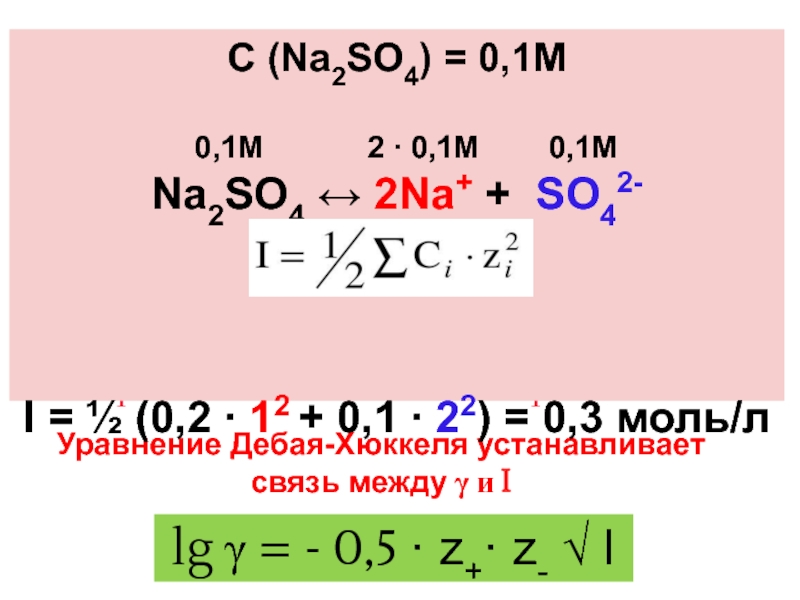
- 30. Ионная сила раствора — мера интенсивности электрического поля—
- 31. Ионная сила раствора (I) -
- 33. Давление насыщенного пара (ДНП) над раствором
- 34. Вторая формулировка закона Рауля: относительное
- 35. КС – линия испарения (ж → п)
- 36. Растворы кипят
- 37. Понижение Тзам и повышение Ткип растворов пропорционально
- 38. В растворах электролитов число частиц больше из-за
- 39. Осмос. Осмотическое давление Осмос –
- 40. Закон Вант-Гоффа: – для растворов неэлектролитов
- 41. В организме осмотическое давление должно
- 42. При приготовлении физиологических растворов необходимо учитывать их
- 43. Растворы, у которых π больше,
- 44. Растворы, у которых π меньше,
- 46. Значение осмоса ⮚ упругость, тургор
- 47. Методы, основанные на изучении коллигативных свойств растворов
- 48. Применяются для определения :
- 49. Криоскопическому методу исследования отдается предпочтение, поскольку температуру
Слайд 1Воронежский государственный медицинский университет им. Н.Н.Бурденко кафедра Химии Зав. кафедрой д.х.н., профессор Пономарева
Слайд 2Учение о растворах
Якоб Хендрик
Вант-Гофф
1852-1911
Сванте Август
Аррениус
1859-1927
Фридрих Вильгельм
Оствальд
1853-1932
Рихард Адольф
Зигмонди
1865-1929
Слайд 3Раствор - гомогенная (однородная), устойчивая система переменного состава, состоящая из двух
Компоненты раствора
Растворитель
Растворенное вещество
Компонент, агрегатное состояние которого не изменяется при образовании раствора, а при одинаковом агрегатном состоянии компонентов находится в избытке.
вещество, равномерно распределенное в растворителе в виде молекул или ионов
Слайд 4Различают растворы:
газообразные, жидкие и твердые
молекулярные растворы
(неэлектролитов) и растворы электролитов.
разбавленные
Слайд 5Растворение – физико-химический процесс, где происходит взаимодействие между частицами, образующими раствор,
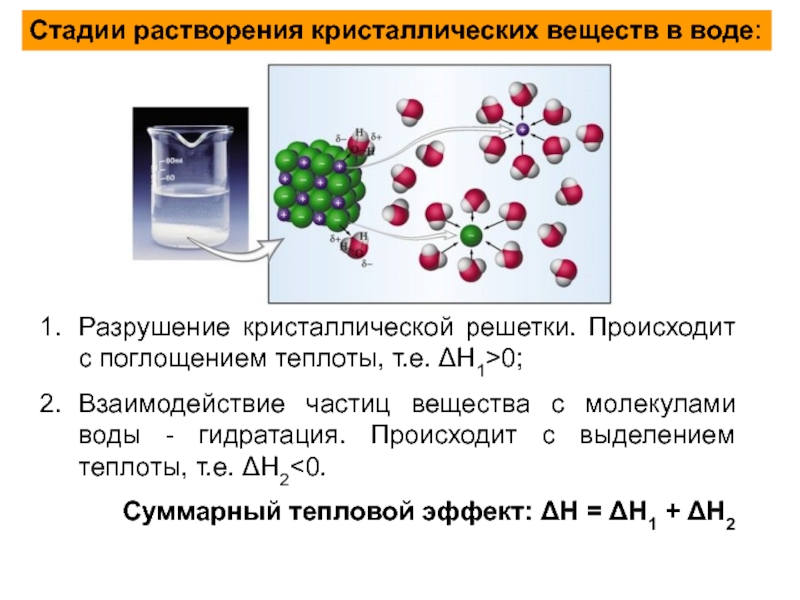
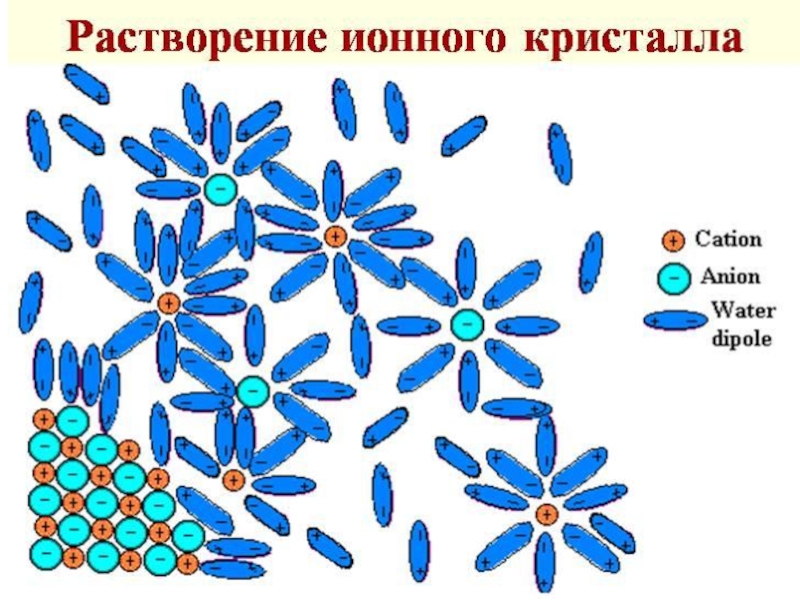
Слайд 6Стадии растворения кристаллических веществ в воде:
Разрушение кристаллической решетки. Происходит с поглощением
Взаимодействие частиц вещества с молекулами воды - гидратация. Происходит с выделением теплоты, т.е. ΔН2<0.
Суммарный тепловой эффект: ΔН = ΔН1 + ΔН2
Слайд 8«Подобное растворяется в подобном»
Вещества с ионным типом хим. связи лучше растворяются
неполярные вещества – в неполярных.
Растворимость твердых веществ (как правило) увеличивается при повышении температуры, а у газов падает.
Факторы, влияющие на растворимость
2. Температура
1. Природа веществ
Слайд 11
Закон Генри:
Растворимость (концентрация) газа в жидкости пропорциональна парциальному давлению этого газа над раствором:
S – растворимость (г/л),
k – константа растворимости,
р0 - парциальное давление газа.
Джозеф Генри
(1797-1878)
Слайд 12Закон Дальтона:
Растворимость каждого из компонентов газовой смеси при Т = const
Для воздуха: Ратм = 760 мм.рт.ст.; С(О2) = 20,9%;
Р(О2) = 159 мм.рт.ст.
Джон Дальтон
(1766-1844)
Слайд 18Для лечения - барокамеры ;
Слайд 19 где S и S0 – растворимость газа в растворе электролита
k – константа Сеченова,
С – концентрация раствора электролита.
Закон Сеченова
Растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов:
Сеченов И.М.
(1829-1905)
4. Электролиты (для газов)
Слайд 20Электролитами называются вещества, расплавы и растворы которых содержат подвижные ионы и
Явление распада вещества на составляющие их ионы называется электролитической диссоциацией.
Полнота распада (сила электролита) характеризуется 2 количественными величинами – степенью и константой диссоциации.
Растворы электролитов
Слайд 21 Степень диссоциации (α) - отношение числа молекул, распавшихся на
Слайд 23Факторы, влияющие на α:
природа электролита и растворителя: чем полярнее хим. связь
концентрация электролита
(↑С,α↓(з-н Оствальда)
температура (↑t, α↑)
наличие одноименных ионов
CH3COOН↔CH3COO͞ + H+
Теория электролитической диссоциации электролитов Аррениуса – это теория растворов слабых электролитов
Слайд 24Электролитическая диссоциация слабых электролитов, является обратимой реакцией, например:
Константу равновесия такой реакции можно
выразить уравнением:
Константу равновесия применительно к реакции диссоциации называют константой диссоциации (Кд).
.
На практике используют показатель константы диссоциации (рК):
Чем больше рК, тем слабее электролит.
Слайд 26Связь константы диссоциации и степени диссоциации
(закон разведения Оствальда)
для слабых электролитов α
Слайд 27Теория растворов сильных электролитов
(1923 г., Дебай, Хюккель)
1. Сильные электролиты диссоциируют полностью,
Слайд 29В разбавленных растворах γ = 1, тогда а = С.
Коэффициент активности
температуры;
общей концентрации всех ионов в растворе (ионной силы раствора – ввел Г.Льюис)
а = С ·γ
Количественно влияние межионного взаимодействия характеризуют:
Активность иона (а) – эффективная концентрация иона;
Коэффициент активности (γ) - мера отклонения активности иона от его истинной концентрации.
Слайд 30Ионная сила раствора — мера интенсивности электрического поля— мера интенсивности электрического поля,
Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом
где ci — молярные концентрации отдельных ионов (моль/л), zi - заряды ионов
Слайд 31 Ионная сила раствора (I) - величина, характеризующая силу электростатического
Ионная сила плазмы равна 0,167;
все кровезаменители готовят с I равной плазме
Уравнение Дебая-Хюккеля устанавливает связь между γ и I
I = ½ ∑Ci·zi2
lg γ = - 0,5 · z+· z- √ I
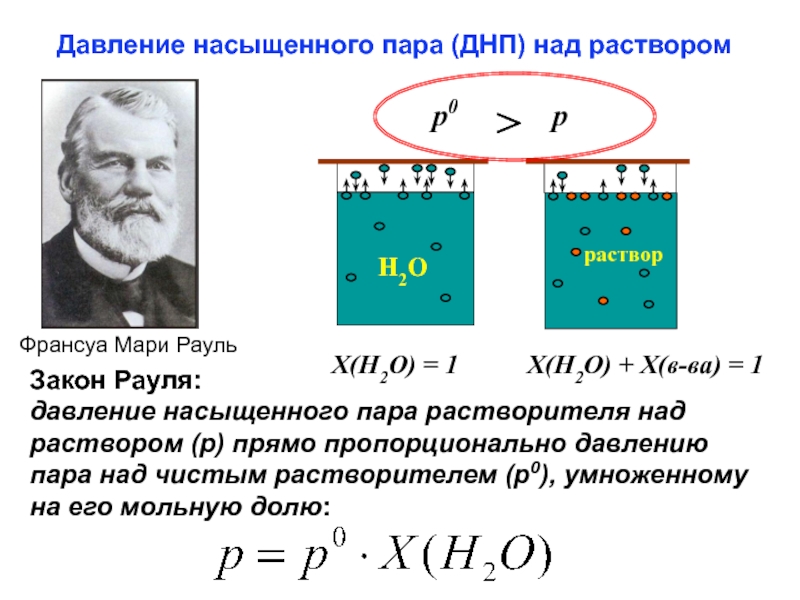
Слайд 33Давление насыщенного пара (ДНП) над раствором
Франсуа Мари Рауль
p0
>
p
Х(Н2О)
Х(Н2О) + Х(в-ва) = 1
Закон Рауля:
давление насыщенного пара растворителя над раствором (р) прямо пропорционально давлению пара над чистым растворителем (p0), умноженному на его мольную долю:
Слайд 34Вторая формулировка закона Рауля:
относительное понижение давления насыщенного пара растворителя
Слайд 35КС – линия испарения
(ж → п)
КВ – линия кристаллизации
(ж → тв)
КА
(тв → п)
К – тройная точка
(+0,01 0С; 0,006 атм)
Диаграмма состояния воды
К
С
В
А
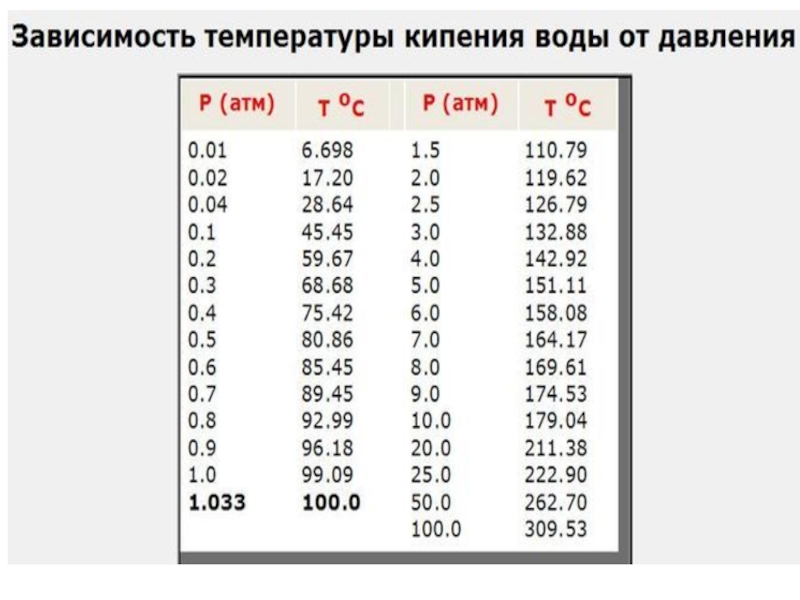
Слайд 36 Растворы
кипят при более высоких температурах по
ΔТкип = Ткип(р-ра) - Ткип(р-ля),
замерзают при более низких
ΔТзам = Тзам(р-ля) - Тзам(р-ра)
Слайд 37Понижение Тзам и повышение Ткип растворов пропорционально моляльности раствора:
ΔТзам = Ккр
Ккр – криоскопическая постоянная,
Кэб - эбулиоскопическая постоянная,
Cm –моляльность раствора (моль/кг).
константы зависят от природы растворителя
при Сm = 1 моль/кг; Ккр = ΔТзам; Кэб = ΔТкип.
Для Н2О: Ккр = 1,86 кг∙К/моль,
Кэб = 0,52 кг∙К/моль.
ΔТкип = Кэб • Cm,
Слайд 38В растворах электролитов число частиц больше из-за диссоциации.
Вант-Гофф ввел поправочный
изотонический коэффициент (i),
который учитывает диссоциацию электролитов.
степень число частиц
диссоциации из 1 молекулы
Изменение температуры кипения и замерзания для
растворов электролитов рассчитывается с учетом
изотонического коэффициента (i) по уравнениям:
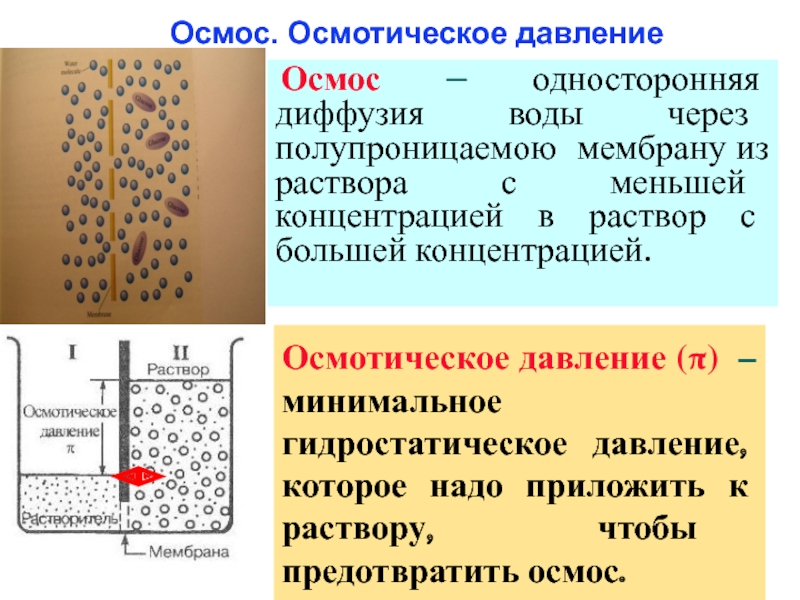
Слайд 39 Осмос. Осмотическое давление
Осмос – односторонняя диффузия воды через полупроницаемою
Осмотическое давление (π) – минимальное гидростатическое давление, которое надо приложить к раствору, чтобы предотвратить осмос.
Слайд 40Закон Вант-Гоффа:
– для растворов неэлектролитов
– для растворов электролитов
СМ- молярная концентрация (моль/л),
R
T – температура (К),
i - изотонический коэффициент.
Слайд 41 В организме осмотическое давление должно быть постоянным (изоосмия):
π
В медицинской практике изотоническими растворами называются растворы, осмотическое давление которых равно
- осмотическому давлению крови = 7,7 атм.
0,9% раствор хлорида натрия и
4,5-5,0% раствор глюкозы называемые изотоническим растворами
πр-ра = πплазмы
Слайд 42При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому их
Сосм = СM [Осм/л] – для неэлектролитов
Сосм = СM · i, [Осм/л] – для электролитов
Осмолярная концентрация - суммарное молярное количество всех кинетически активных, т. е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
Осмотическому давлению крови человека соответствует осмолярная концентрация частиц от 275 до 300 мОсм/л.
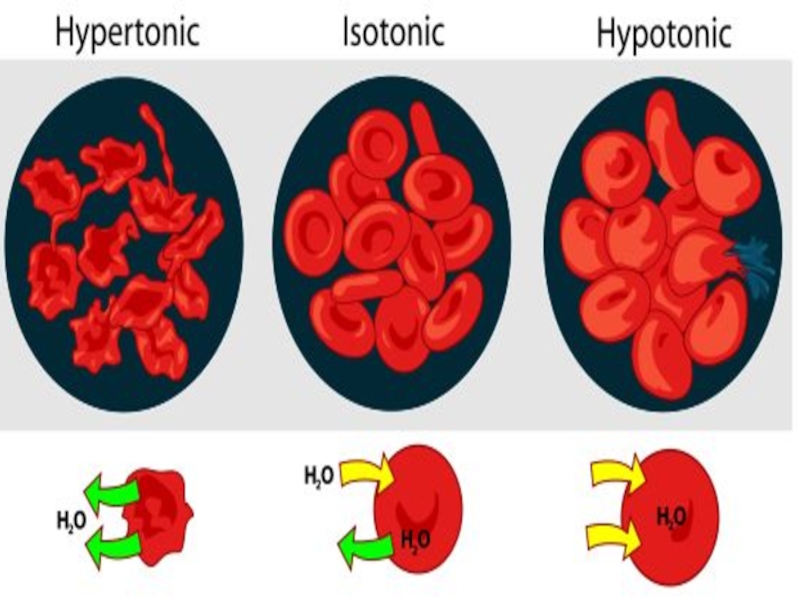
Слайд 43 Растворы, у которых π больше, чем у π (плазмы)
В медицине они применяются для очистки ран от гноя (10 % NaCl), для удаления аллергических отеков (до 25% CaCl2, 20 % – глюкоза), в качестве слабительных лекарств (Na2SO4∙10H2O, MgSO4∙7H2O).
Экзоосмос (движение воды из клетки в плазму) приводит к сморщиванию оболочки клетки вызывая плазмолиз
πр-ра > πплазмы
Слайд 44 Растворы, у которых π меньше, чем у π (плазмы)
Эндоосмос (движение воды в клетку из плазмы) приводит к набуханию оболочки клетки с появлением напряженного состояния – тургора.
При большой разнице концентраций происходит разрушение клеточной мембраны и лизис клетки, что является причиной гемолиза.
Слайд 46Значение осмоса
⮚ упругость, тургор клеток
⮚ эластичность тканей, форма
⮚ усвоение пищи, образование лимфы, мочи, кала
⮚действие лекарств
⮚За счет осмоса вода в организме распределяется между кровью, тканями, клетками.
Слайд 47Методы, основанные на изучении коллигативных свойств растворов
осмометрия – измерение π,
криоскопия
эбулиоскопия – измерение ΔТкип (р-ра).
Слайд 48Применяются для определения :
молекулярных масс различных
биополимеров (белков);
суммарной концентрации всех
растворенных частиц;
изотонического коэффициента, степени и
константы диссоциации.
Слайд 49Криоскопическому методу исследования отдается предпочтение, поскольку температуру замерзания можно измерить с
При выборе растворителя предпочтение следует отдавать растворителю с большей криоскопической константой.