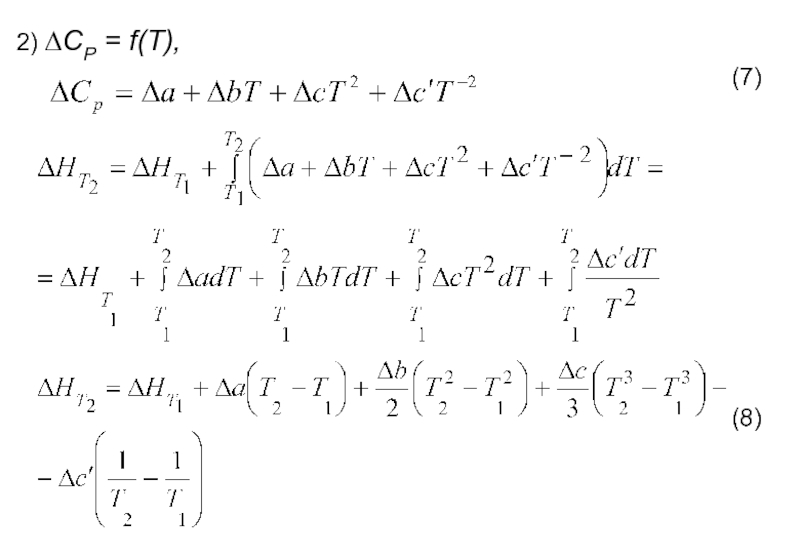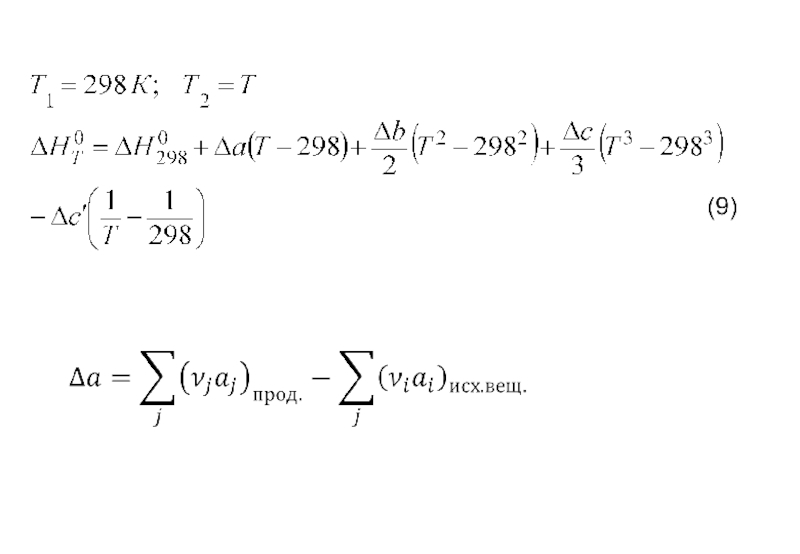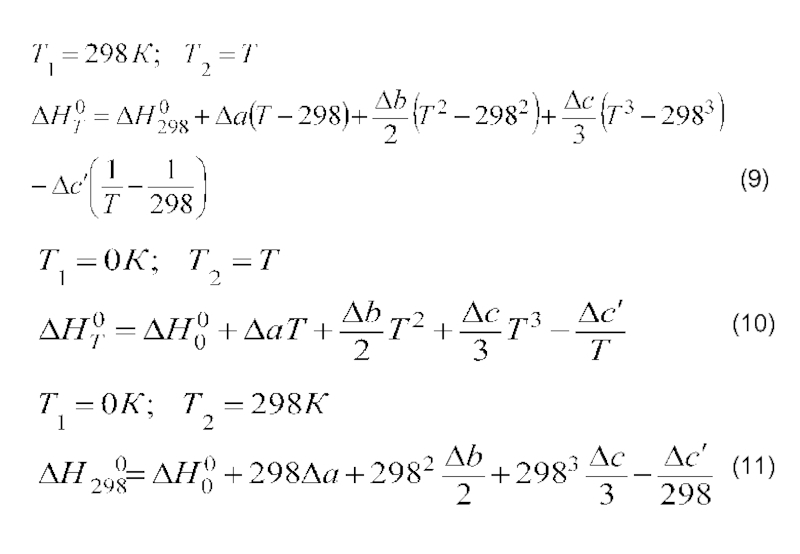- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термохимия. Расчет тепловых эффектов химических реакций презентация
Содержание
- 1. Термохимия. Расчет тепловых эффектов химических реакций
- 2. Закон Гесса.
- 3. Применение закона Гесса Метод термохимических уравнений Метод термохимических схем Метод термохимических уравнений
- 4. Метод термохимических схем
- 5. Следствия из закона Гесса.
- 7. Зависимость тепловых эффектов химических реакций от температуры. Теплоемкость. Уравнение Кирхгофа.
- 8. Расчеты тепловых эффектов реакций на основе
- 9. Средние теплоемкости измеряются на определенном интервале
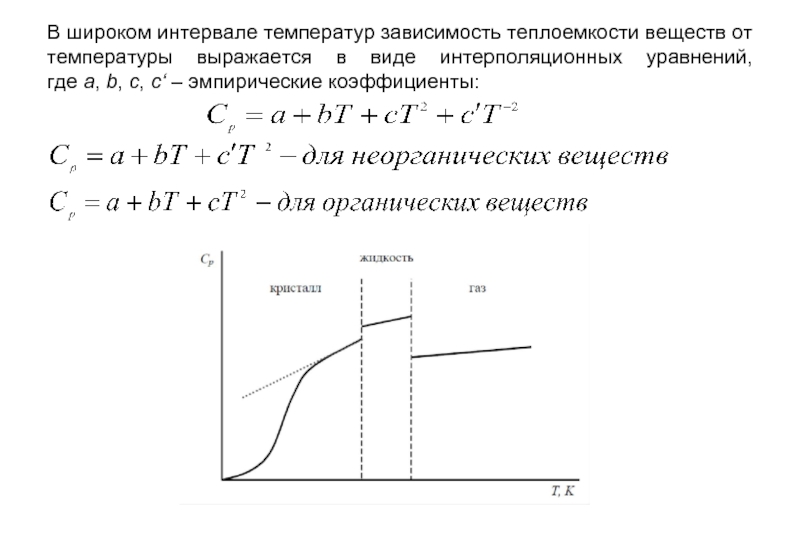
- 10. В широком интервале температур зависимость теплоемкости веществ
- 11. Уравнение Кирхгофа и его интегрирование
- 12. На практике интегрирование обычно проводят от стандартной
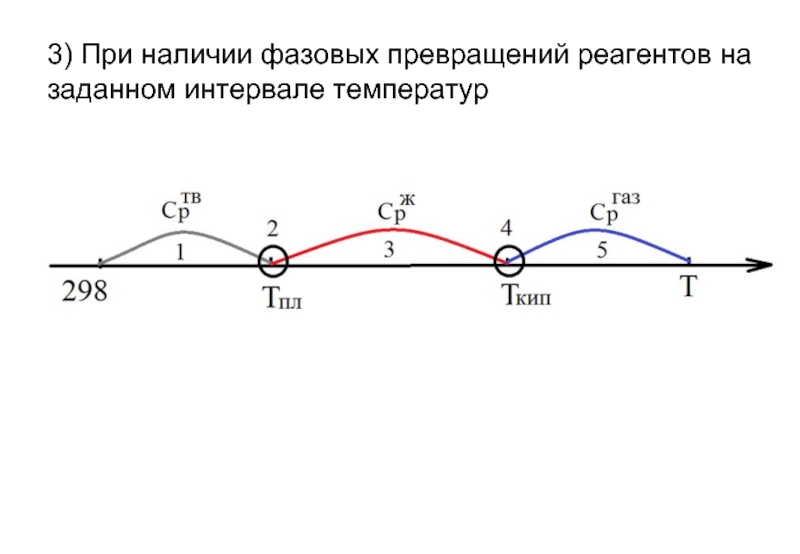
- 17. 3) При наличии фазовых превращений реагентов на заданном интервале температур
- 18. Процессы: изобарное нагревание твердого вещества от 298К
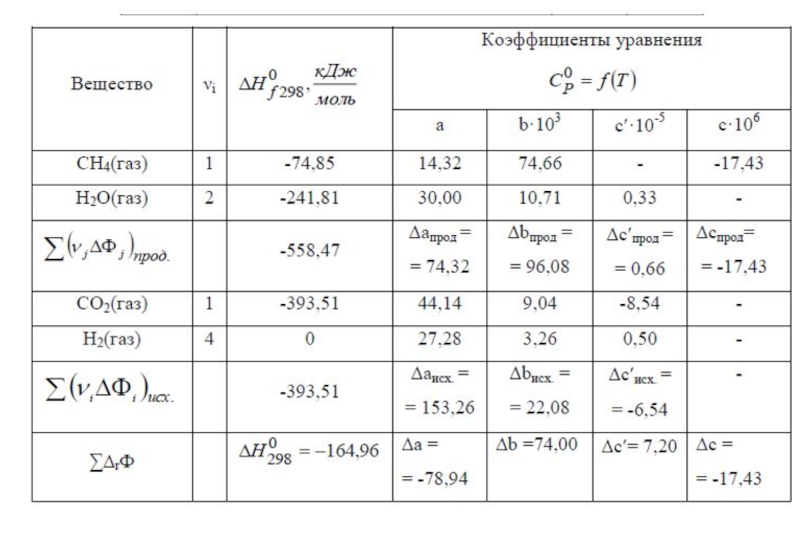
- 19. МВЗ № 4 , гл. «Первое начало термодинамики»
- 22. В задаче рассматриваются три метода расчета изменения
Слайд 3
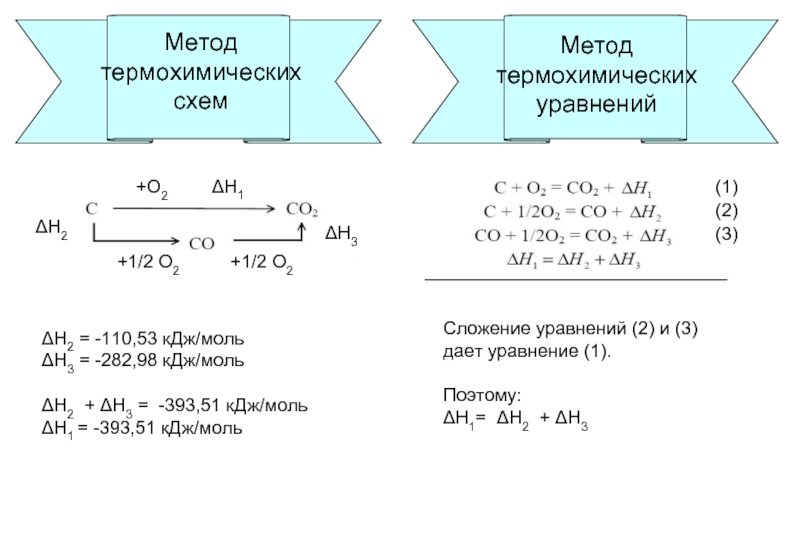
Применение закона Гесса
Метод
термохимических
уравнений
Метод термохимических схем
Метод термохимических уравнений
Слайд 4
Метод
термохимических
схем
ΔН1
ΔН2
ΔН3
+О2
+1/2 О2
+1/2 О2
ΔН2 = -110,53 кДж/моль
ΔН3 = -282,98 кДж/моль
ΔН2
ΔН1 = -393,51 кДж/моль
Метод
термохимических
уравнений
Сложение уравнений (2) и (3)
дает уравнение (1).
Поэтому:
ΔН1= ΔН2 + ΔН3
(1)
(2)
(3)
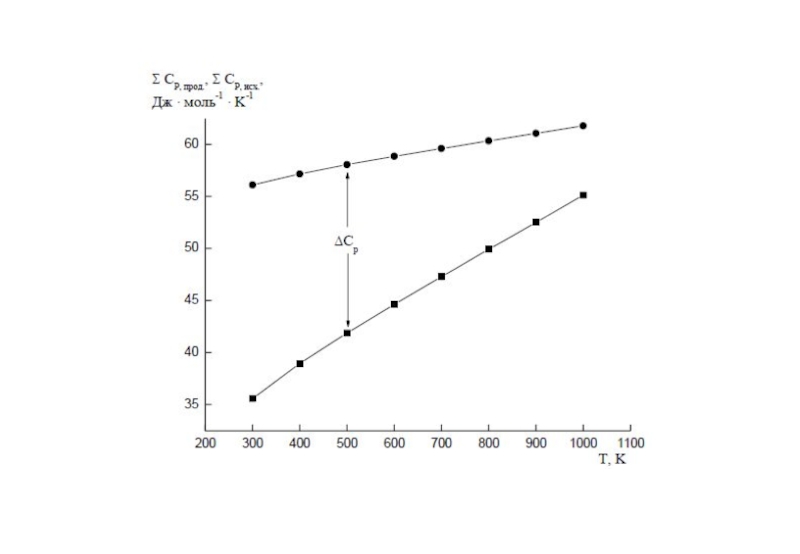
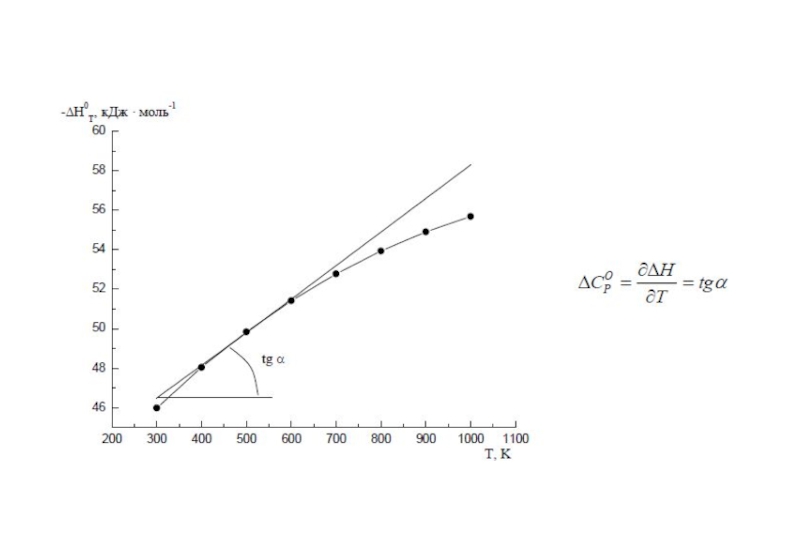
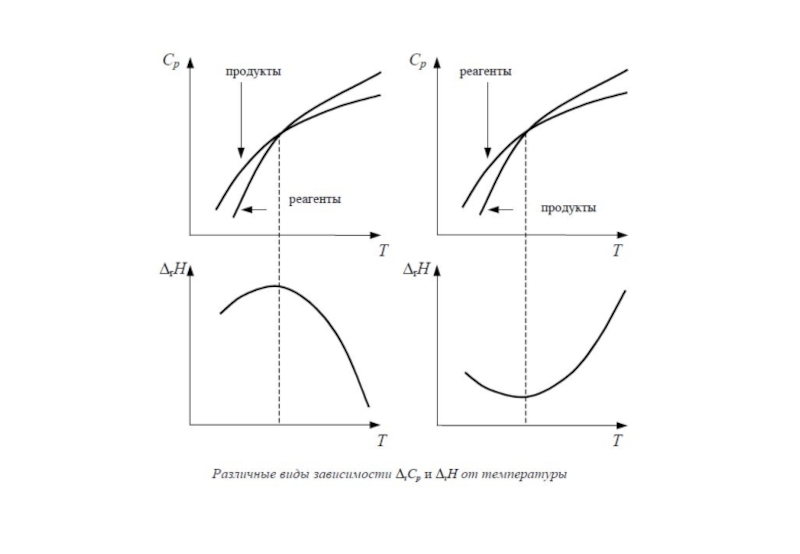
Слайд 7Зависимость тепловых эффектов химических реакций от температуры.
Теплоемкость.
Уравнение Кирхгофа.
Слайд 8
Расчеты тепловых эффектов реакций на основе следствий из закона Гесса с
Тепловые эффекты химических реакций зависят от температуры, т.к. при изменении температуры изменяются теплоемкости веществ – участников реакции.
Теплоемкость – количество теплоты, необходимое для нагревания 1 моля или 1 грамма (1 кг) вещества на один градус.
С – молярная теплоемкость, Дж/(моль•К)
СУД – удельная теплоемкость, Дж/(г•К) или Дж/(кг•К)
По условиям измерения:
СP – изобарная теплоемкость,
СV – изохорная теплоемкость,
Слайд 9
Средние теплоемкости измеряются на определенном интервале температур
Истинные теплоемкости соответствуют бесконечно малому
Изобарная теплоемкость
Изохорная теплоемкость
Слайд 10В широком интервале температур зависимость теплоемкости веществ от температуры выражается в
Слайд 12На практике интегрирование обычно проводят от стандартной температуры 298 К до
Слайд 18Процессы:
изобарное нагревание твердого вещества от 298К до ТПЛ
плавление твердого вещества при
изобарное нагревание жидкости от ТПЛ до ТКИП
испарение жидкости при ТКИП
изобарное нагревание газообразного вещества до Т