- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Природа и типы химических связей презентация
Содержание
- 1. Природа и типы химических связей
- 2. Природа и типы химических связей
- 3. Природа и типы химических связей Химическая связь
- 4. Природа и типы химических связей
- 5. r,нм Изменение потенциальной энергии в системе из
- 6. Природа и типы химических связей
- 7. Природа и типы химических связей Важнейшими характеристиками
- 8. Природа и типы химических связей б)
- 9. Природа и типы химических связей в) валентный
- 10. Природа и типы химических связей Химическая
- 11. Природа и типы химических связей Существует 2
- 12. Природа и типы химических связей
- 13. Природа и типы химических связей
- 14. Природа и типы химических связей КС характеризуется:
- 15. Природа и типы химических связей
- 16. Природа и типы химических связей Насыщаемость ковалентной связи: атомы образуют ограниченное число связей, равное их валентности.
- 17. Природа и типы химических связей
- 18. Природа и типы химических связей σ-связь а)
- 19. Природа и типы химических связей π -
- 20. Природа и типы химических связей г) π
- 21. Направленность ковалентной связи-… Природа и типы химических связей
- 22. Природа и типы химических связей
- 23. Природа и типы химических связей
- 24. Природа и типы химических связей
- 25. Природа и типы химических связей При этом
- 26. Природа и типы химических связей
- 27. Неполярные молекулы Молекула неполярна, если суммарный μ
- 28. Полярные молекулы Природа и типы химических связей
- 29. Дипольный момент молекулы зависит: ∙от полярности
- 30. Поляризуемость Поляризуемость ковалентной связи – это …
- 31. HCl HBr
- 32. Природа и типы химических связей
- 33. Природа и типы химических связей
- 34. Природа и типы химических связей
- 35. Природа и типы химических связей sp2
- 36. Природа и типы химических связей sp гибридизацию
- 37. Природа и типы химических связей Химическая связь
- 38. Природа и типы химических связей Механизм образования
- 39. Природа и типы химических связей Ионные соединения
- 40. Природа и типы химических связей
- 41. Природа и типы химических связей Для металлов
- 42. Природа и типы химических связей Водородная связь
- 43. Взаимодействие между молекулами НХ: сильно ЭО элемент:
- 44. Механизм образования Н-связи: - Электростатическое взаимодействие
- 45. Есвязи, кДж/моль ковалентная 100-400 водородная 4-50 межмолекулярная
- 46. Природа и типы химических связей Энергия трех
- 47. Природа и типы химических связей
- 48. Природа и типы химических связей - внутримолекулярные
- 49. Природа и типы химических связей
Слайд 2Природа и типы химических связей
Установление строения атома (модели
Слайд 3Природа и типы химических связей
Химическая связь – это сложное электростатическое взаимодействие
Слайд 4Природа и типы химических связей
Химическая связь образуется в
Слайд 5r,нм
Изменение потенциальной энергии в системе из двух атомов водорода в зависимости
0,074
Fпр.= Fотт.
Fпр. >Fотт.
Fпр.< Fотт.
Природа и типы химических связей
Слайд 6Природа и типы химических связей
В зависимости от характера
ковалентную;
ионную;
металлическую.
Отдельно выделяют водородную связь и межмолекулярное взаимодействие (вандер-ваальсовые силы).
Слайд 7Природа и типы химических связей
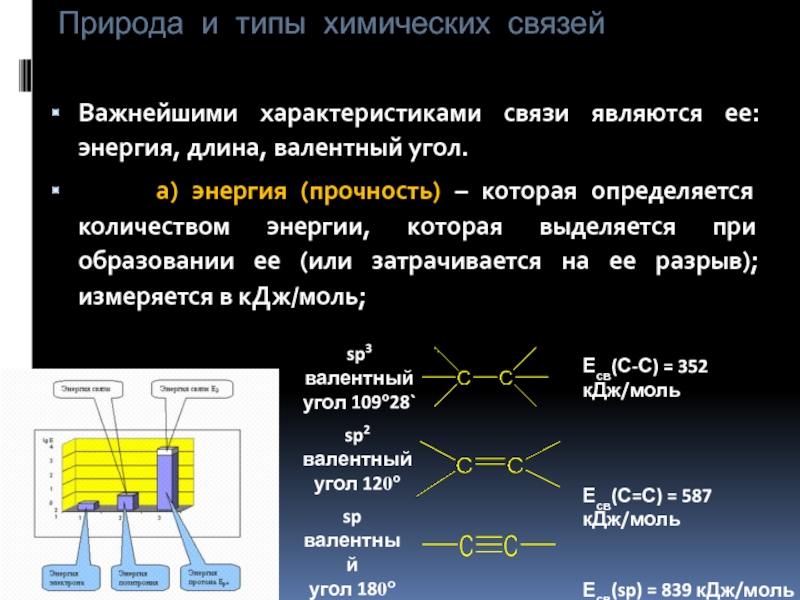
Важнейшими характеристиками связи являются ее: энергия, длина,
а) энергия (прочность) – которая определяется количеством энергии, которая выделяется при образовании ее (или затрачивается на ее разрыв); измеряется в кДж/моль;
sp3
валентный
угол 109о28`
sp2
валентный
угол 120о
sp
валентный
угол 180о
Есв(С-С) = 352 кДж/моль
Есв(С=С) = 587 кДж/моль
Есв(sp) = 839 кДж/моль
Слайд 8Природа и типы химических связей
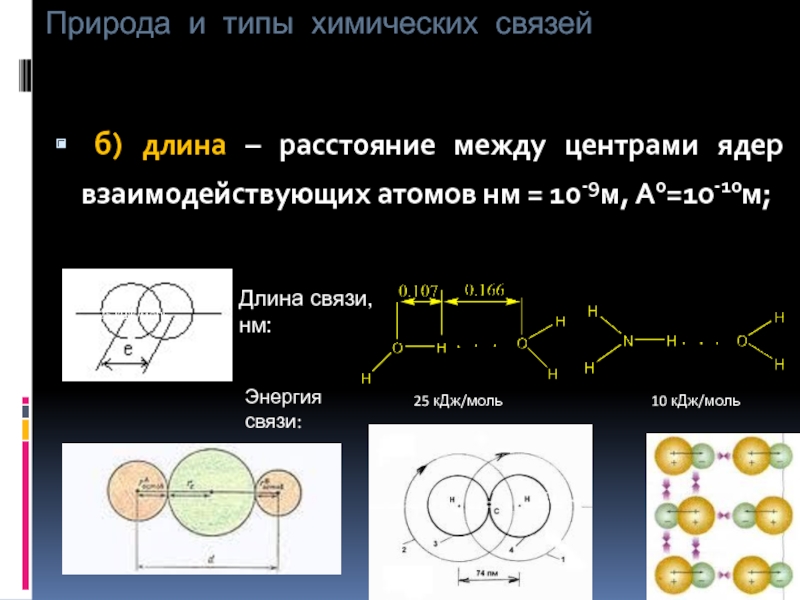
б) длина – расстояние между центрами
Длина связи, нм:
Энергия связи:
25 кДж/моль
25 кДж/моль
10 кДж/моль
Слайд 9Природа и типы химических связей
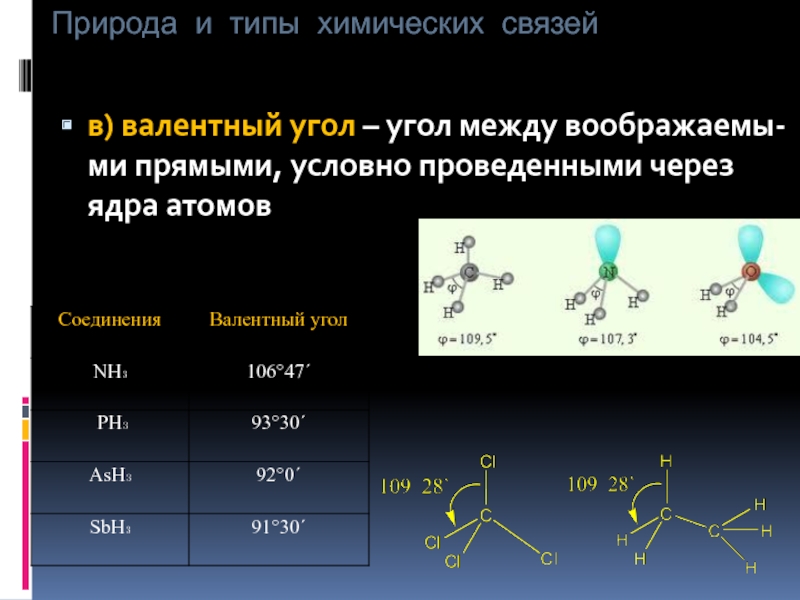
в) валентный угол – угол между воображаемы-ми
Слайд 10Природа и типы химических связей
Химическая связь между атомами, возникающая за
1. В образовании общей электронной пары могут участвовать только электроны с антипараллельными спинами (подтверждается кривой Гейтлера-Лондона).
2. Ковалентная связь тем прочнее, чем больше область перерывания электронных облаков (подтверждается гибридизацией атомных орбиталей).
Слайд 11Природа и типы химических связей
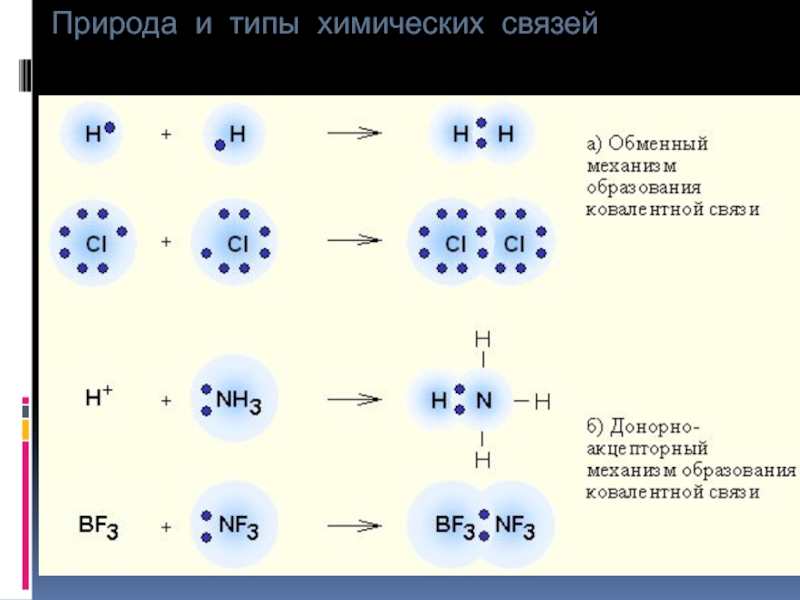
Существует 2 способа образования ковалентной связи (КС):
H∙ + H∙
H:H
Слайд 12Природа и типы химических связей
б) донорно-акцепторный – заключается
Н:–+Н+
Н:Н
гидрид-ион донор протон акцептор
Неподеленная пара электронов
Донорно-акцепторная связь
Донор
Акцептор
Метиламин
Хлорид
метиламмония
Слайд 14Природа и типы химических связей
КС характеризуется:
а) насыщенностью;
б) направленностью;
в) поляризуемостью.
Слайд 15Природа и типы химических связей
Под насыщенностью КС
а) неспареных валентных электронов (нормальное или возбужденное состояние) С (карбон)
б) валентных орбиталей В (бор)
в) свободных электронных пар N (нитроген)
Слайд 16Природа и типы химических связей
Насыщаемость ковалентной связи: атомы образуют ограниченное число связей,
Слайд 17Природа и типы химических связей
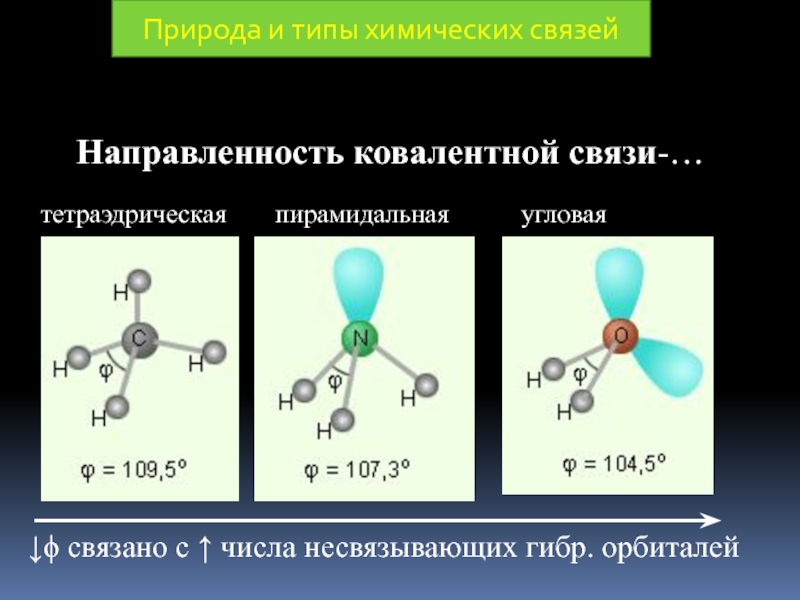
Под направленностью КС понимают,
а) на линии связывающей ядра атомов (σ - связь)
б) по обе стороны от линии, связывающей ядра атомов (π - связь)
Слайд 18Природа и типы химических связей
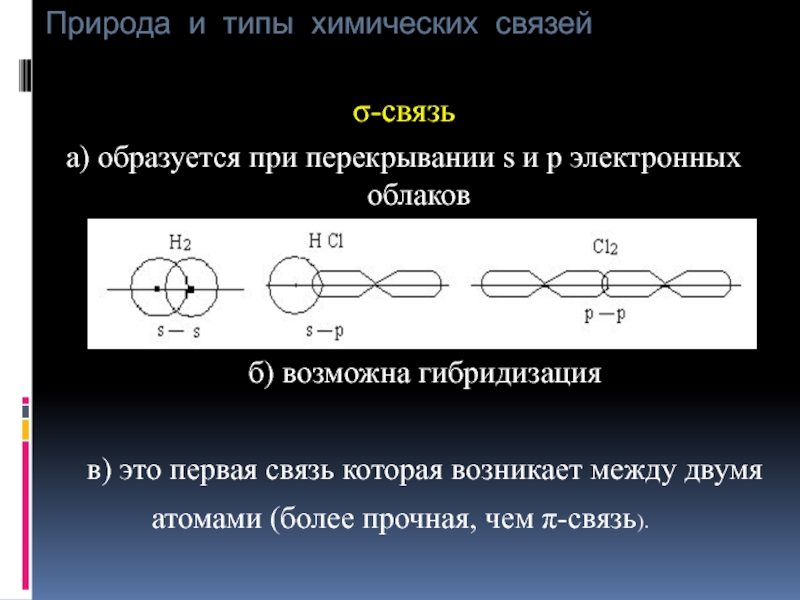
σ-связь
а) образуется при перекрывании s и p
б) возможна гибридизация
в) это первая связь которая возникает между двумя атомами (более прочная, чем π-связь).
Слайд 19Природа и типы химических связей
π - связь:
а) образуется при перекрывании р–р
б) гибридизация невозможна
в) образуется после σ-связи в плоскости (-ях) перпендикулярной оси
Слайд 23Природа и типы химических связей
КС может быть неполярной и
Неполярная КС образуется между атомами одного и того же элемента (H2, N2, O2, и т. д.), т.к. считается, что общее электронное облако расположено симметрично в пространстве между ядрами. Однако под действием постоянного движения электронов в очень малый промежуток времени происходит смещение общей электронной плоскости к одному из атомов, который через мгновение меняет свое направление
Слайд 24Природа и типы химических связей
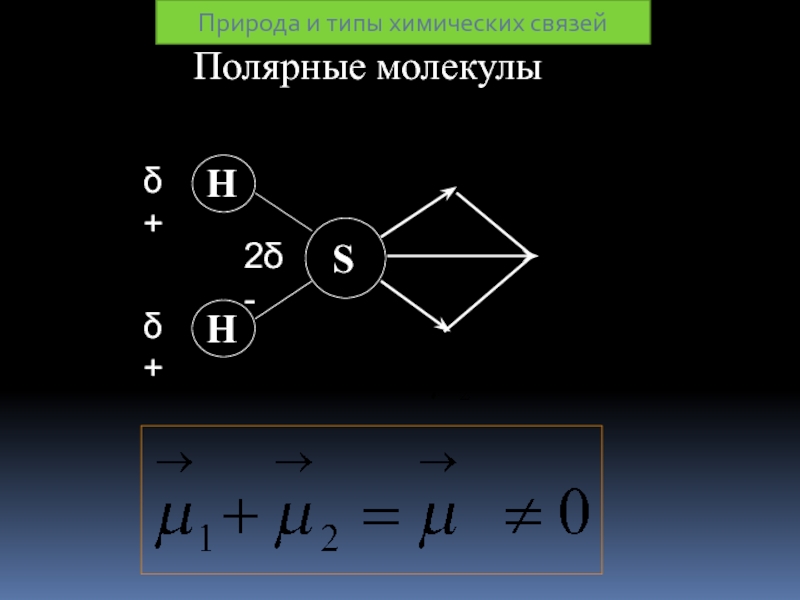
Полярная КС образуется между атомами
Слайд 25Природа и типы химических связей
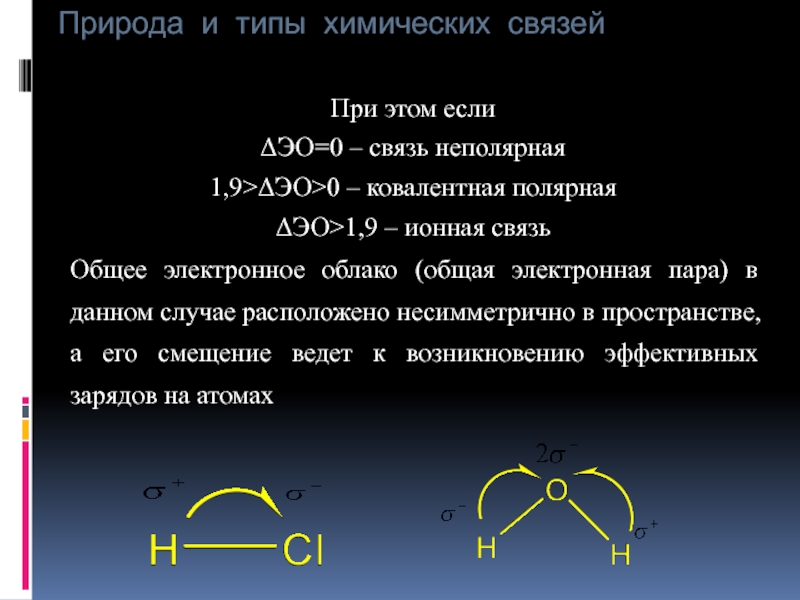
При этом если
ΔЭО=0 – связь неполярная
1,9>ΔЭО>0 –
ΔЭО>1,9 – ионная связь
Общее электронное облако (общая электронная пара) в данном случае расположено несимметрично в пространстве, а его смещение ведет к возникновению эффективных зарядов на атомах
Слайд 26Природа и типы химических связей
Такая молекула представляет собой диполь
Длина связи
Эффективный заряд
Слайд 27Неполярные молекулы
Молекула неполярна, если суммарный μ всех связей = 0.
Природа и
Слайд 29Дипольный момент молекулы зависит:
∙от полярности связей;
∙от геометрии молекулы;
∙от
Природа и типы химических связей
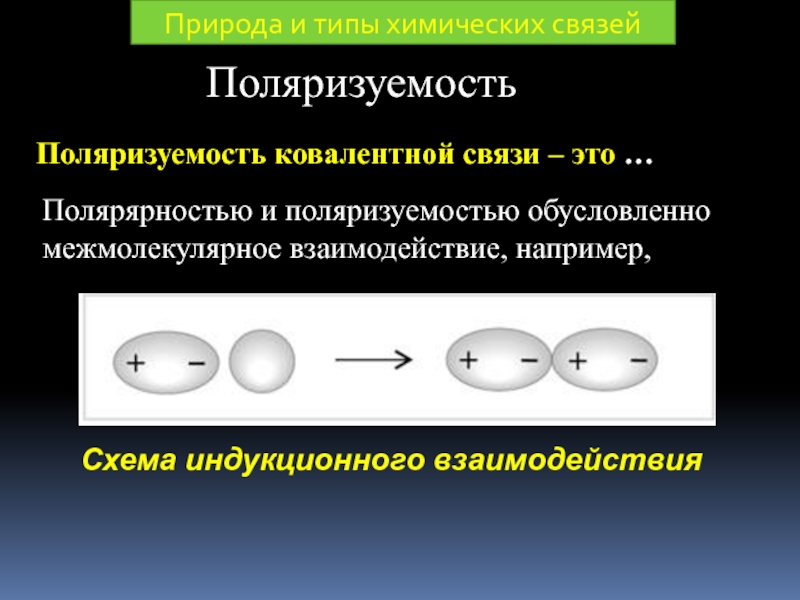
Слайд 30Поляризуемость
Поляризуемость ковалентной связи – это …
Полярярностью и поляризуемостью обусловленно межмолекулярное взаимодействие,
Природа и типы химических связей
Слайд 31HCl HBr HI
ΔЭО:
Полярность связи уменьшается
Поляризуемость увеличивается
Природа и типы химических связей
Слайд 32Природа и типы химических связей
При устранении внешнего воздействия диполь
а) ионов (гетеролитический разрыв)
б) радикалов (гомолитический разрыв)
Слайд 33Природа и типы химических связей
Теория гибридизации была предложена в
Гибридизацией называется изменение формы и энергии различных орбиталей одного атома приводящее к образованию одинаковых гибридных орбиталей
Слайд 34Природа и типы химических связей
sp3-гибридизация на примере СН4 (именно
Слайд 35Природа и типы химических связей
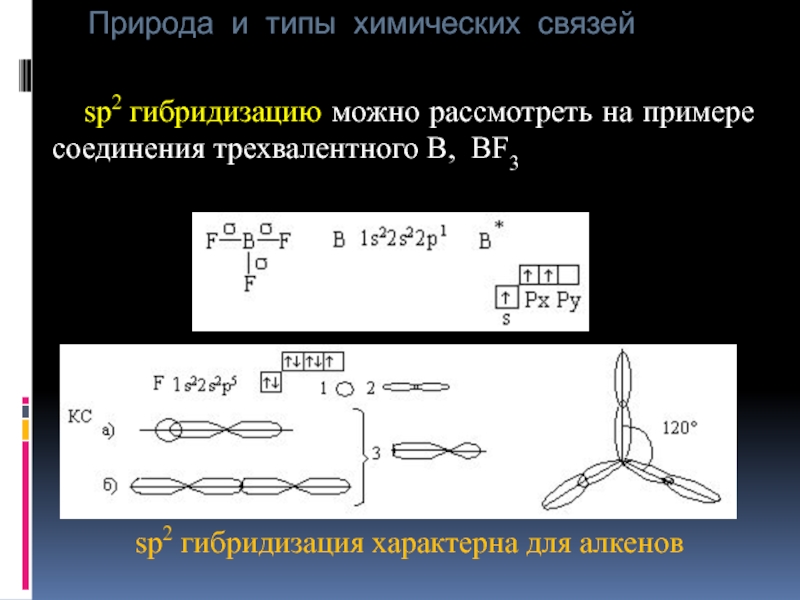
sp2 гибридизацию можно рассмотреть на примере
sp2 гибридизация характерна для алкенов
Слайд 36Природа и типы химических связей
sp гибридизацию можно рассмотреть на примере молекулы
sp гибридизация характерна для алкинов
Слайд 37Природа и типы химических связей
Химическая связь образованная за счет электростатического взаимодействия
Способность элементов образовывать простые ионы обусловлена электронной структурой их атомов и может быть оценена величиной энергии ионизации и сродства к электрону.
Слайд 38Природа и типы химических связей
Механизм образования
Na 1s22s2p63s1 – e Na+←2s22p6
Cl 1s22s2p63s2p5+e Cl–←3s23p6 или ионная связь
Слайд 39Природа и типы химических связей
Ионные соединения в целом представляет собой гигантскую
В обычных условиях ионные соединения являются кристаллическими веществами, но только в идеальном кристалле вокруг каждого иона расположено определенное число противоионов, что сопровождается компенсацией зарядов.
Слайд 40Природа и типы химических связей
Все металлы (за исключением
Слайд 41Природа и типы химических связей
Для металлов характерно наличие:
а) небольшого числа валентных
б) большого числа свободных валентных орбиталей;
в) слабой связи между валентными и ядром (что подтверждается низкими значениями Еион);
Слайд 42Природа и типы химических связей
Водородная связь
это связь между молекулами или частями
H–Fσ–···Hσ+–Fσ–···Hσ+–Fσ+
Слайд 43Взаимодействие между молекулами НХ:
сильно ЭО элемент: F, O, N, (Cl, S
Природа и типы химических связей
Слайд 44Механизм образования Н-связи:
- Электростатическое взаимодействие (диполь-дипольное)
-Донорно-акцепторное взаимодействие:
-направленность
-насыщаемость
Природа и типы химических
Слайд 45Есвязи, кДж/моль
ковалентная
100-400
водородная
4-50
межмолекулярная
0,1 -5
Энергия Н-связи
Природа и типы химических связей
Слайд 46Природа и типы химических связей
Энергия трех типов связи.
Видно, что энергия водородной
Слайд 47Природа и типы химических связей
Водородная связь может быть 2
- межмолекулярная. H2O, HF, NH3 спирты, карбоновые кислоты и т. д.
Слайд 48Природа и типы химических связей
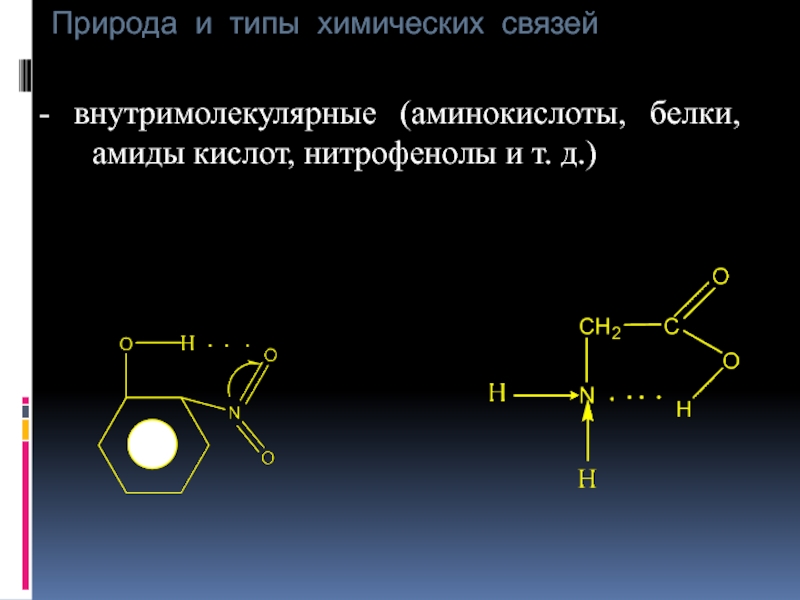
- внутримолекулярные (аминокислоты, белки, амиды кислот, нитрофенолы