Валерьевич
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
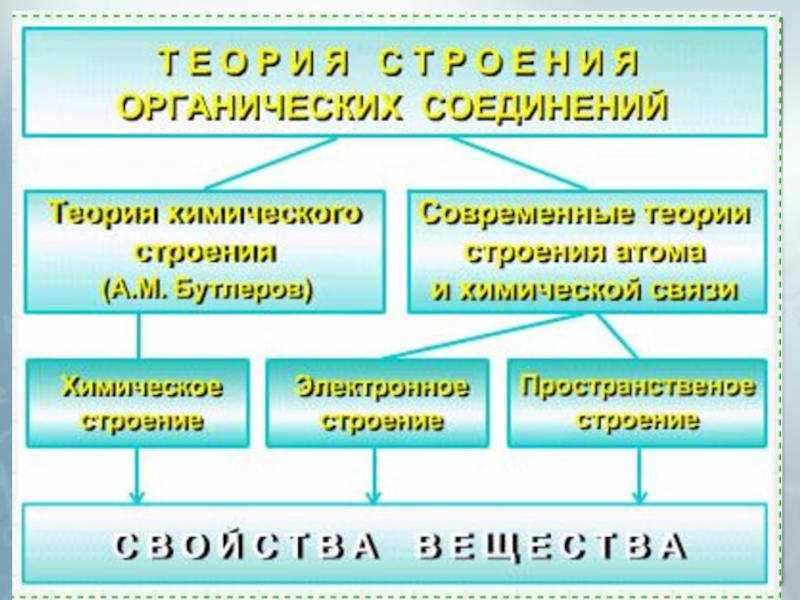
Теория строения органических соединений презентация
Содержание
- 1. Теория строения органических соединений
- 2. 19.02.2016
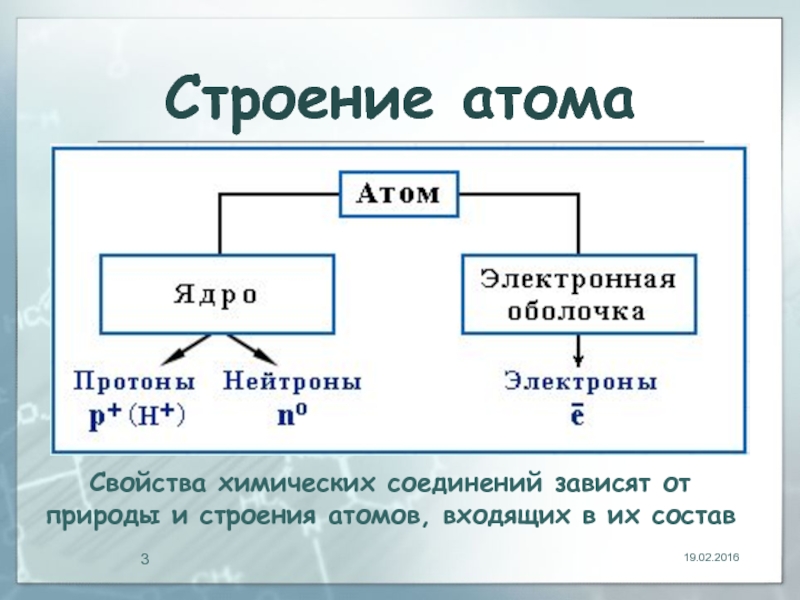
- 3. Строение атома 19.02.2016 Свойства химических соединений зависят
- 4. Свойства электрона 19.02.2016 Часть пространства, в котором вероятность нахождения максимальна, называют орбиталью или электронным облаком
- 5. 19.02.2016 Атомная орбиталь (АО) – область наиболее вероятного пребывания электрона в электрическом поле ядра атома
- 6. Форма и энергия АО 19.02.2016 Первый уровень – 1s, второй – 2s
- 7. Форма и энергия АО 19.02.2016 Второй уровень – 2s, 2px,2py, 2pz
- 8. Заполнение атомных орбиталей электронами Принцип устойчивости.
- 9. Принцип устойчивости 19.02.2016
- 10. Заполнение атомных орбиталей электронами Принцип Паули.
- 11. Заполнение атомных орбиталей электронами Правило Хунда.
- 13. Контрольная работа 19.02.2016
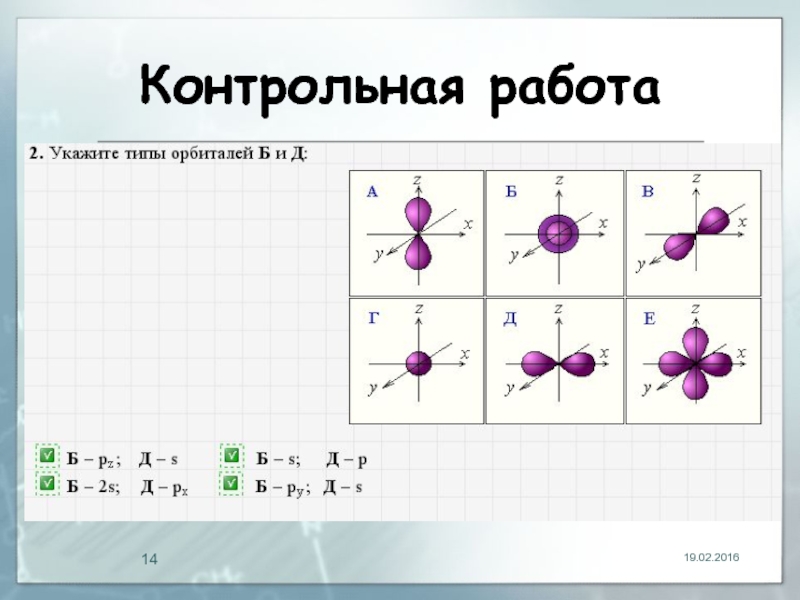
- 14. Контрольная работа 19.02.2016
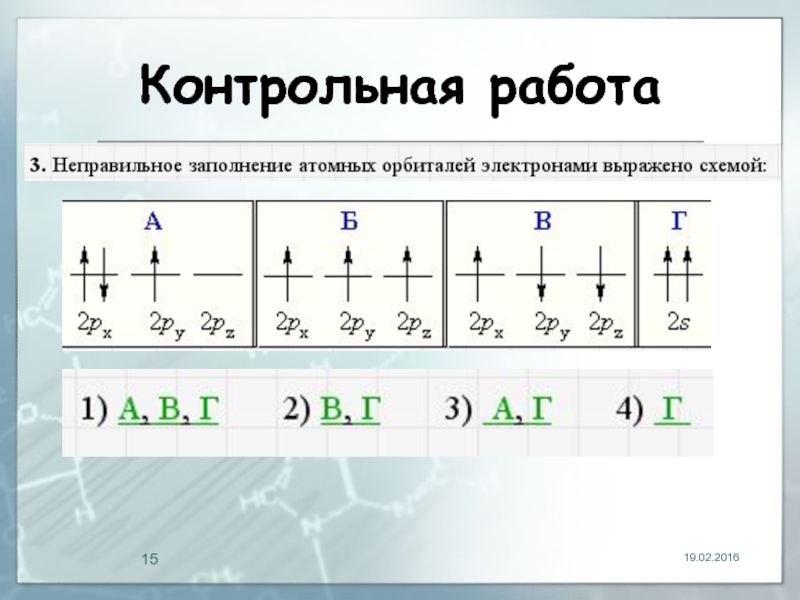
- 15. Контрольная работа 19.02.2016
- 16. Контрольная работа 19.02.2016
- 17. Контрольная работа 19.02.2016
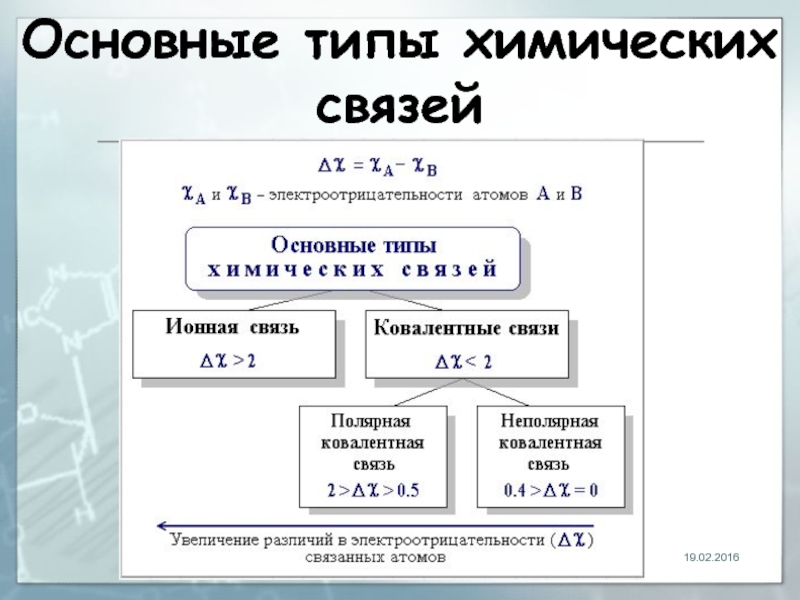
- 18. Основные типы химических связей 19.02.2016
- 19. 19.02.2016 Ионная связь химическая связь, основанная
- 20. 19.02.2016 Электроотрицательность Способность атома удерживать внешние
- 21. Ковалентная связь 19.02.2016 Связь, образованная путём обобществления пары электронов связываемых атомов
- 22. 19.02.2016 Свойства ковалентной связи Направленность Насыщаемость Полярность Поляризуемость
- 23. Направленность 19.02.2016 Молекулярное строение органических молекул имеет
- 24. Насыщаемость 19.02.2016 Способность атомов образовывать ограниченное
- 25. Полярность 19.02.2016 Обусловлена неравномерным распределением электронной
- 26. Полярность 19.02.2016 Ковалентные связи делятся на
- 27. Полярность 19.02.2016 Полярные связи между двумя атомами с разной электроотрицательностью: Н—F, С—Сl.
- 28. Поляризуемость 19.02.2016 Смещение электронов под воздействием внешнего электрического поля другой частицы.
- 29. Длина связи 19.02.2016 Расстояние между центрами
- 30. Энергия связи 19.02.2016 Энергия, выделяемая при
- 31. Дипольный момент (μ или D) 19.02.2016
- 32. 19.02.2016
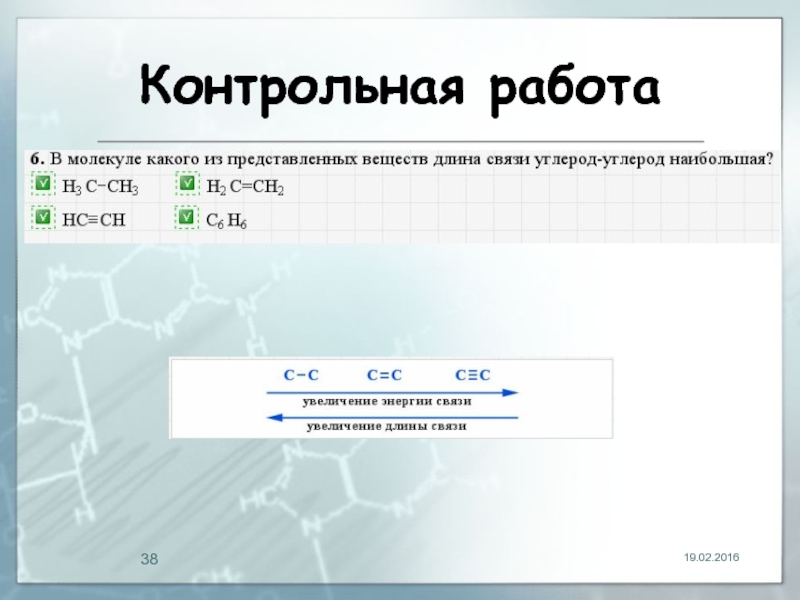
- 33. Контрольная работа 19.02.2016
- 34. Контрольная работа 19.02.2016
- 35. Контрольная работа 19.02.2016
- 36. Контрольная работа 19.02.2016
- 37. Контрольная работа 19.02.2016
- 38. Контрольная работа 19.02.2016
Слайд 1Основы органической химии
Семинар-3. Теория строения органических соединений
E-mail: irkrav66@gmail.com
лектор:
проф. Рохин Александр
Слайд 3Строение атома
19.02.2016
Свойства химических соединений зависят от природы и строения атомов, входящих
в их состав
Слайд 4Свойства электрона
19.02.2016
Часть пространства, в котором вероятность нахождения максимальна, называют орбиталью или
электронным облаком
Слайд 519.02.2016
Атомная орбиталь (АО) – область наиболее вероятного пребывания электрона в электрическом
поле ядра атома
Слайд 8Заполнение атомных орбиталей электронами
Принцип устойчивости.
АО заполняются электронами в порядке повышения
их энергетических уровней:
1s < 2s < 2p < 3s < 3p < 4s < 3d …
1s < 2s < 2p < 3s < 3p < 4s < 3d …
Слайд 10Заполнение атомных орбиталей электронами
Принцип Паули.
На одной АО могут находиться не
более двух электронов с противоположными спинами.
Слайд 11Заполнение атомных орбиталей электронами
Правило Хунда.
На АО с одинаковой энергией, так
называемых вырожденных орбиталях, электроны стремятся расположиться по одному с параллельными спинами.
Слайд 1919.02.2016
Ионная связь
химическая связь, основанная на электростатическом притяжении ионов
В органических соединениях
встречается редко, например, в органических солях: RCOO-Na+
Слайд 2019.02.2016
Электроотрицательность
Способность атома удерживать внешние валентные электроны
Подчиняется периодическому закону: растет слева
направо в периодах и снизу вверх в главных подгруппах в таблице Д.И. Менделеева
Слайд 21Ковалентная связь
19.02.2016
Связь, образованная путём обобществления пары электронов связываемых атомов
Слайд 23Направленность
19.02.2016
Молекулярное строение органических молекул имеет геометрическую форму.
Количественной мерой направленности является угол
между двумя связями (валентный угол)
Слайд 24Насыщаемость
19.02.2016
Способность атомов образовывать ограниченное число ковалентных связей.
Количество связей определяется числом
внешних атомных орбиталей атома.
Слайд 25Полярность
19.02.2016
Обусловлена неравномерным распределением электронной плотности вследствии различной электро-отрицательности атомов по
шкале Л.Полинга:
Слайд 26Полярность
19.02.2016
Ковалентные связи делятся на полярные и неполярные.
Неполярные связи между
двумя одинаковыми атомами:
Н—Н, С—С.
Н—Н, С—С.
Слайд 27Полярность
19.02.2016
Полярные связи между двумя атомами с разной электроотрицательностью:
Н—F, С—Сl.
Слайд 28Поляризуемость
19.02.2016
Смещение электронов под воздействием внешнего электрического поля другой частицы.
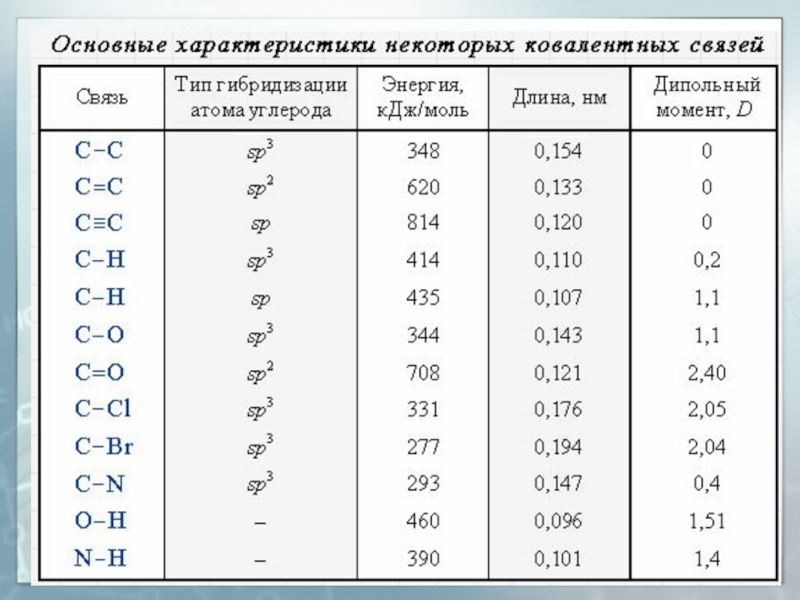
Слайд 29Длина связи
19.02.2016
Расстояние между центрами двух связанных атомов.
На характеристики связей влияет
их кратность
Слайд 30Энергия связи
19.02.2016
Энергия, выделяемая при образовании связи или необходимая для разъединения
двух связанных атомов
Слайд 31Дипольный момент (μ или D)
19.02.2016
Величина, характеризующая полярность связи:
l – длина
связи
q – эффективный заряд
q – эффективный заряд