- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая характеристика элементов IVA-группы. Углерод и кремний презентация
Содержание
- 1. Общая характеристика элементов IVA-группы. Углерод и кремний
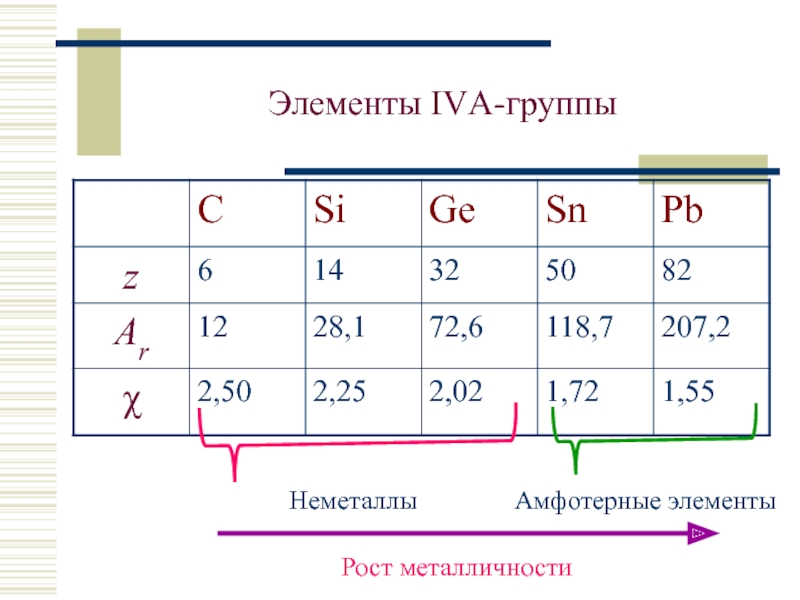
- 2. +6С )2)4 +14Si )2)8)4 +32Ge )2)8)18)4
- 3. Изменение свойств в группе
- 4. Элементы IVА-группы Неметаллы Амфотерные элементы
- 5. Общая электронная формула: […] ns 2 (n–1)d
- 6. Оксиды элементов IVА-группы +IV CO2(г)
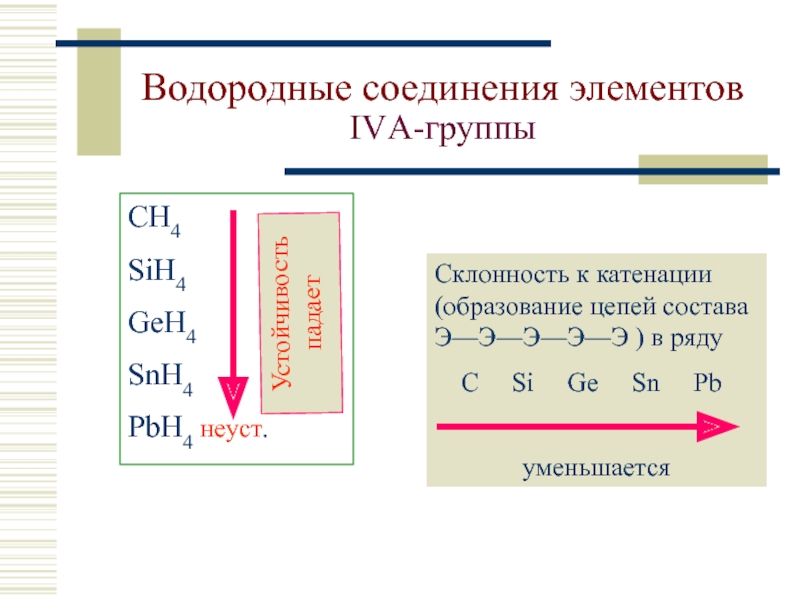
- 7. Водородные соединения элементов IVА-группы СH4 SiH4 GeH4
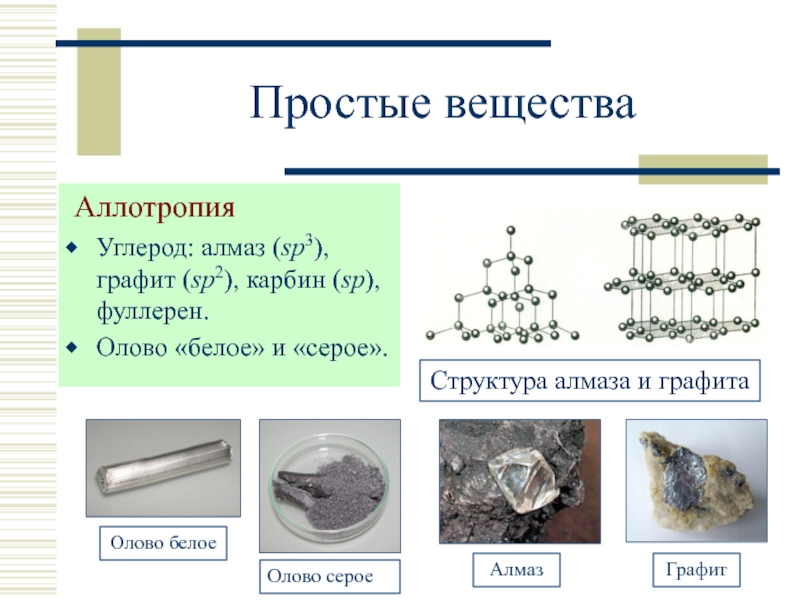
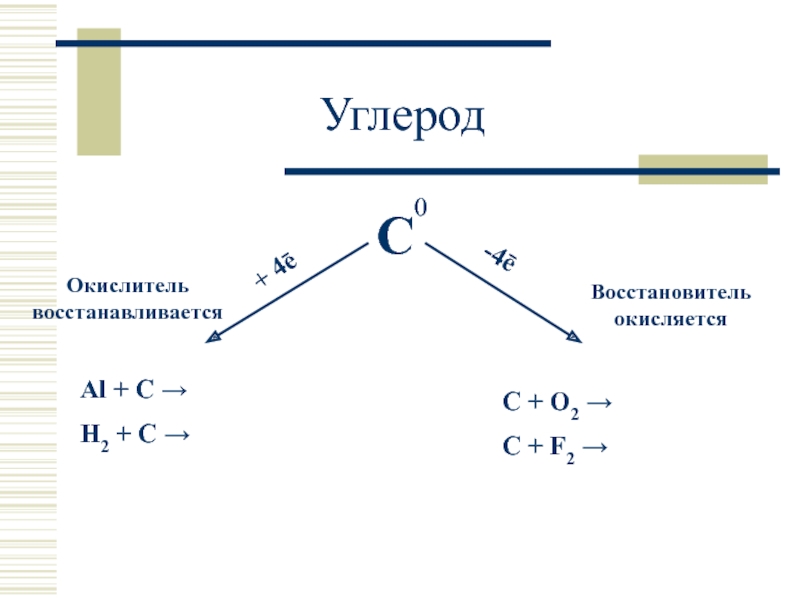
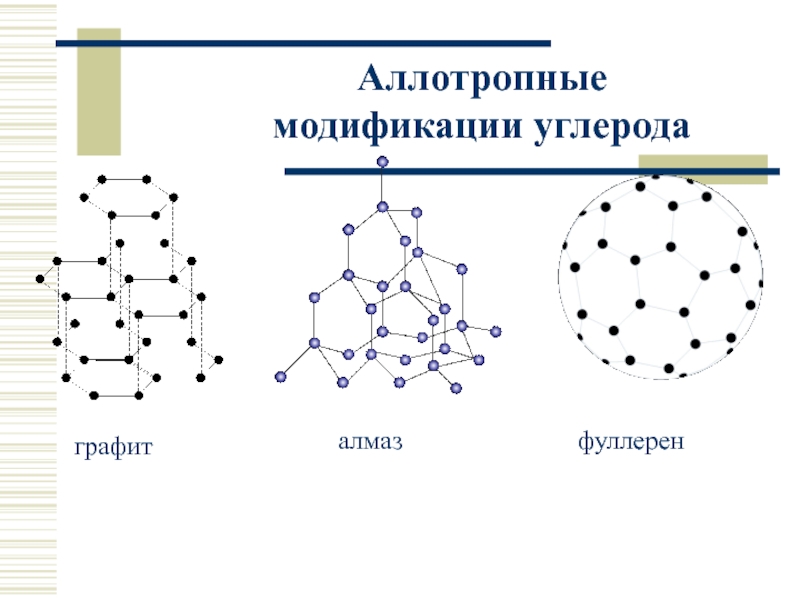
- 8. Простые вещества Аллотропия Углерод: алмаз (sp3),
- 9. Химические свойства При комн. темп. С, Si,
- 10. Химические свойства С(т) + KOH ≠ Si + 4NaOH = Na4SiO4 + 2H2↑
- 11. Распространение в природе и важнейшие минералы
- 12. Углерод: графит, алмаз, каменный уголь, нефть, природный газ, орг. в-ва, карбонаты
- 13. Германий, олово и свинец
- 14. Шкала степеней окисления углерода CO2, CO32−,
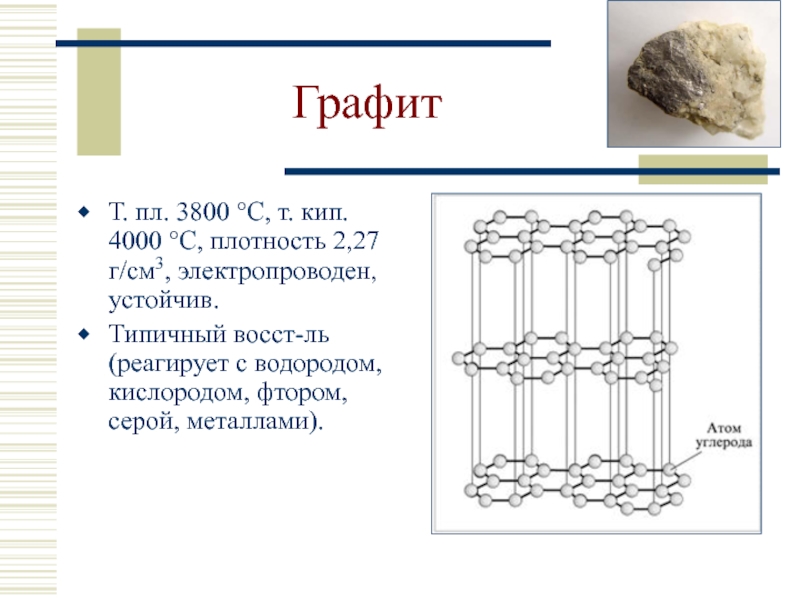
- 15. Графит Т. пл. 3800 °С, т. кип.
- 16. 0 Углерод
- 17. Аллотропные модификации углерода графит алмаз фуллерен
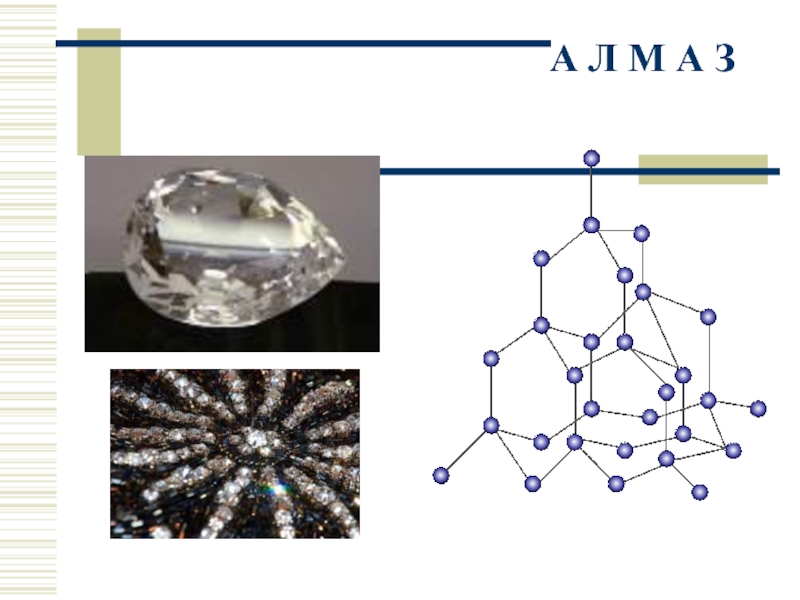
- 18. А Л М А З
- 19. Звезда ордена Св. Андрея Первозванного Алмаз «Шах» Скипетр императорский
- 20. Большая императорская корона Малая императорская корона
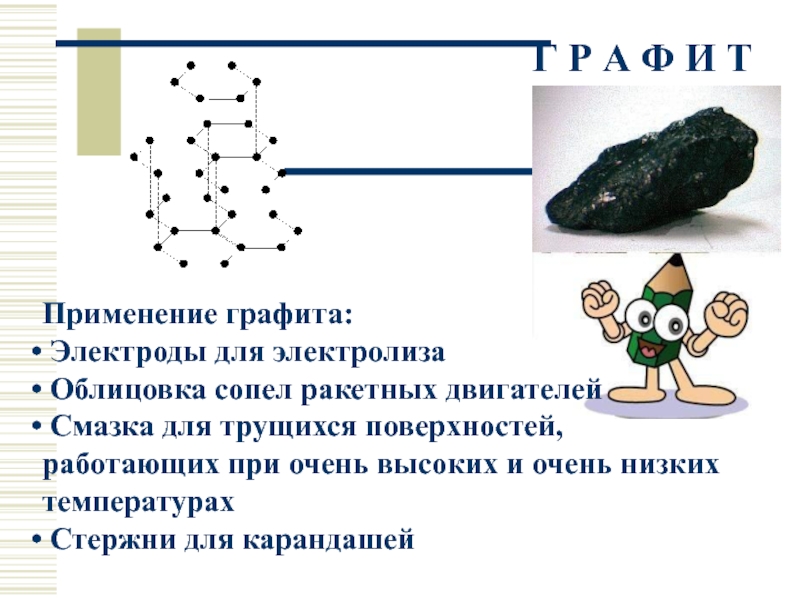
- 21. Г Р А Ф И Т Применение
- 22. П О Ч Е М У А
- 23. Угольные фильтры В бытовых фильтрах, в промышленном
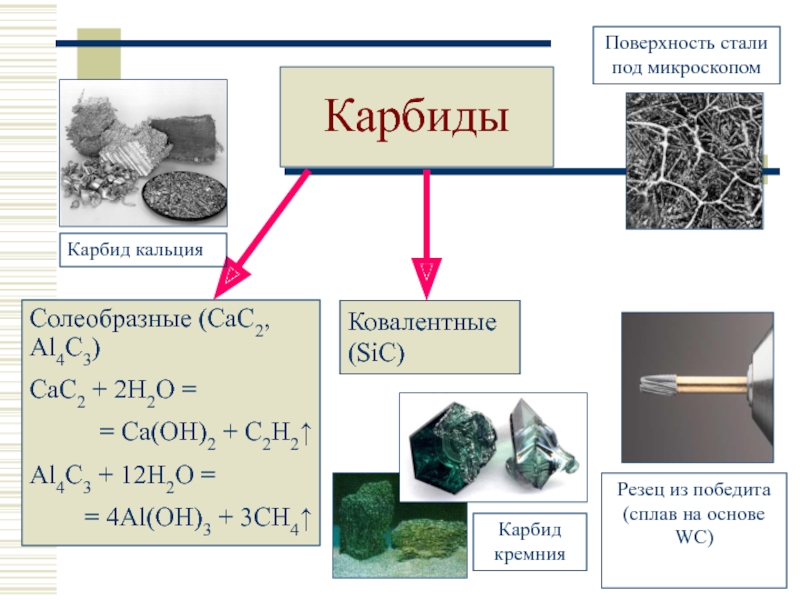
- 24. Карбиды
- 25. Водородные соединения. Метан CH4 СН4 –
- 26. Монооксид углерода CO – несолеобразующий оксид
- 27. Диоксид углерода CO2 (кислотный оксид) Бесцветный газ,
- 28. Моногидрат CO2 . H2O и угольная кислота
- 29. Псевдогалогениды Циановодород HCN
- 30. Псевдогалогениды Тиоцианат водорода HNCS («родановодород») не
- 32. аллотропия КРЕМНИЯ Кристаллический кремний Аморфный кремний
- 33. Нахождение в природе SiO2 кремнезём (песок)
- 34. ПРИМЕНЕНИЕ КРЕМНИЯ Кремнистые стали Силиконовый каучук Фотоэлементы Силиконовый герметик
- 36. Получение кремния SiO2 + 2C = Si
- 37. Водородные соединения SinH2n+2 (силаны) Моносилан SiH4:
- 38. СОЕДИНЕНИЯ КРЕМНИЯ
- 39. ОКСИД КРЕМНИЯ - SiO2 песок горный хрусталь (кварц) аметист
- 40. Взаимодействие кремния с кислородом Si + O2 = SiO2
- 41. Кислородные соединения -SiO2 оксид кремния SiO2
- 42. Травление стекла SiO2 + 6HF (изб.)
- 43. КРЕМНЕВАЯ КИСЛОТА H2SIO3 Na2SiO3
- 44. Получение кремниевой кислоты https://www.youtube.com/watch?v=hB6GOzNFEaA
- 45. СОЛИ КРЕМНЕВОЙ КИСЛОТЫ Растворимые силикаты натрия и калия называют жидким стеклом
Слайд 2 +6С )2)4
+14Si )2)8)4
+32Ge )2)8)18)4
+50Sn )2)8)18)18)4
+82Pb )2)8)18)32)18)4
S2 P2
Р
Общая электронная формула внешнего слоя
Слайд 5Общая электронная формула:
[…] ns 2 (n–1)d 10np2
Валентные возможности:
Степени окисления: –IV, 0, +II, +IV
Устойчивые ст.ок.: С, Si, Ge, Sn: +IV
(PbIV – сильн.окисл.). Уст. ст.ок.: Pb: +II
Слайд 6Оксиды элементов IVА-группы
+IV
CO2(г) уст.
SiO2(т) уст.
GeO2(т) уст.
SnO2(т)
PbO2(т) с.окисл.
+II
CO
SiO
GeO
SnO
PbO уст.
Слайд 7Водородные соединения элементов IVА-группы
СH4
SiH4
GeH4
SnH4
PbH4 неуст.
Склонность к катенации (образование цепей состава Э—Э—Э—Э—Э
C Si Ge Sn Pb
Слайд 8Простые вещества
Аллотропия
Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен.
Олово «белое»
Структура алмаза и графита
Слайд 11Распространение в природе и важнейшие минералы
2. Si 25,80%
(27,72%
13. C 0,087%
(0,032% в литосфере)
31. Sn 0,0035%
35. Pb 0,0018%
46. Ge 6 ·10–4% (РРЭ)
Кремний: кварц, яшма, агат, опал, силикаты, алюмосиликаты
Слайд 14Шкала степеней окисления углерода
CO2, CO32−, H2CO3, Na2CO3, CS2, CF4, CCl2O,
CO, HCN, C2F4
C (графит, алмаз, карбин, фуллерен)
СH4, Be2C, Al4C3, SiC
Слайд 15Графит
Т. пл. 3800 °С, т. кип. 4000 °С, плотность 2,27 г/см3,
Типичный восст-ль (реагирует с водородом, кислородом, фтором, серой, металлами).
Слайд 21Г Р А Ф И Т
Применение графита:
Электроды для электролиза
Облицовка
Смазка для трущихся поверхностей, работающих при очень высоких и очень низких температурах
Стержни для карандашей
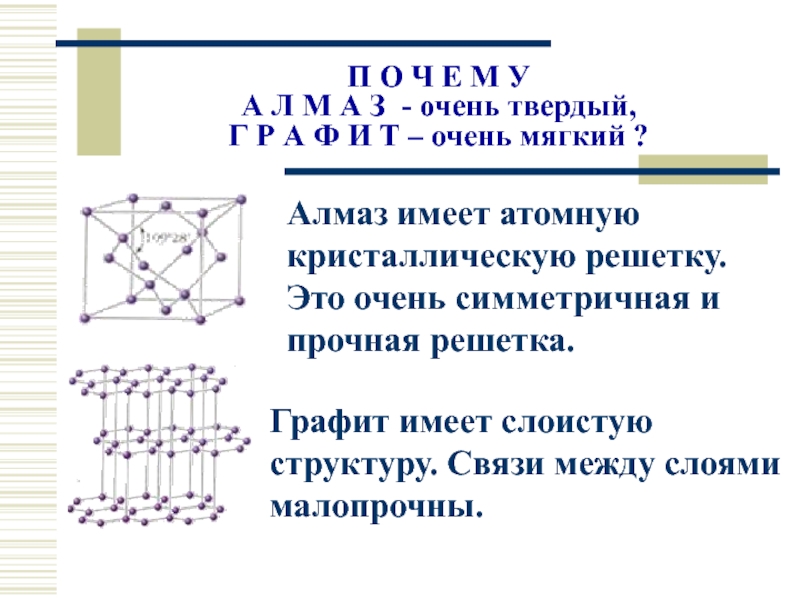
Слайд 22П О Ч Е М У
А Л М А З -
Г Р А Ф И Т – очень мягкий ?
Алмаз имеет атомную кристаллическую решетку. Это очень симметричная и прочная решетка.
Графит имеет слоистую структуру. Связи между слоями малопрочны.
Слайд 23Угольные фильтры
В бытовых фильтрах, в промышленном производстве, на очистных сооружениях –
Слайд 25Водородные соединения. Метан CH4
СН4 – газ без цвета и запаха,
Получение в лаборатории:
CH3COONa + NaOH (+t) =
= Na2CO3 + CH4↑
Горение:
CH4 + O2 = С + 2H2O
CH4 + 2O2 (изб.) =
= СO2 + 2H2O
sp3
Слайд 26Монооксид углерода CO – несолеобразующий оксид
Бесцветный газ, без запаха, легче
ядовит («угарный газ»).
Восстановительные свойства (t):
4CO + Fe3O4 = 3Fe + 4CO2
(пирометаллургия)
Слайд 27Диоксид углерода CO2 (кислотный оксид)
Бесцветный газ, без запаха, тяжелее воздуха, умеренно
В тв. Сост. «сухой лёд»
Слайд 28Моногидрат CO2 . H2O и угольная кислота H2CO3
В водном растворе:
CO2
H2CO3 – слабая двухосновная кислота:
H2CO3 + H2O ⮀ HCO3– + H3O+ ;
HCO3– + H2O ⮀ CO32– + H3O+ ;
Соли – карбонаты и гидрокарбонаты M2CO3 и MHCO3 подвергаются гидролизу (рН > 7).
Термическое разложение гидрокарбонатов:
2NaHCO3 = Na2CO3 + CO2↑ + H2O
Слайд 29Псевдогалогениды
Циановодород HCN
В водн. р-ре – слабая «синильная
HCN + H2O ⮀ CN– + H3O+;
Цианид-ион CN− : донорные св-ва, образует прочные комплексы, ядовит.
: C:::N–
Слайд 30Псевдогалогениды
Тиоцианат водорода HNCS («родановодород») не ядовит.
В водном растворе
Ион NCS− : слабые донорные свойства
HNCS
Слайд 33Нахождение в природе
SiO2 кремнезём
(песок)
Al2O3∙ 2SiO2∙2H2O
каолинит
(глина)
По распространенности занимает второе место
Слайд 37Водородные соединения SinH2n+2 (силаны)
Моносилан SiH4:
SiH4 + 2O2 = SiO2
Получение силанов:
SiO2 + 4Mg(изб) = Mg2Si + 2MgO
(силицид магния)
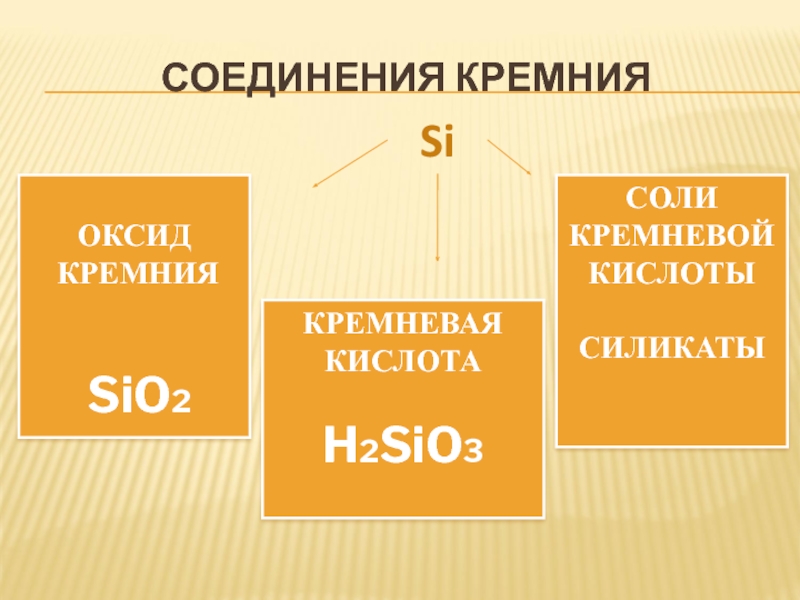
Слайд 38СОЕДИНЕНИЯ КРЕМНИЯ
ОКСИД
КРЕМНИЯ
SiO2
КРЕМНЕВАЯ
КИСЛОТА
H2SiO3
СОЛИ
КРЕМНЕВОЙ
КИСЛОТЫ
СИЛИКАТЫ
Si
Слайд 42Травление стекла
SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат
Травление — в технике, растворение поверхности твёрдых тел с практической целью
Слайд 43КРЕМНЕВАЯ КИСЛОТА H2SIO3
Na2SiO3 + 2HCl = 2NaCl + H2SiO3 ↓
Получение:
Кремниевая кислота — это слабая двухосновная кислота, которая в реакциях выпадает в осадок в виде студенистого вещества, которое иногда заполняет весь объём раствора, превращая его в массу похожую на студень, желе.



![Общая электронная формула: […] ns 2 (n–1)d 10np2Валентные возможности:](/img/tmb/4/396396/cefb26da3a5f7fdf809e6cf32011268f-800x.jpg)


























![Травление стекла SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода)Травление — в технике,](/img/tmb/4/396396/c34915568dd6d85e60ad913075e9af77-800x.jpg)








